İyonlar, yüklü atomlar ve atom gruplarıdır. İyonik reaksiyonlar kavramı ve iyonların yükü
Talimat
Herhangi bir maddenin atomu bir elektron kabuğu ve bir çekirdekten oluşur. Çekirdek iki tür parçacıktan oluşur - nötronlar ve protonlar. Nötronların elektriği yoktur şarj evet, elektrik şarj nötronlar sıfırdır. Protonlar pozitif yüklü parçacıklardır ve elektriksel şarj+1'e eşittir. Proton sayısı, belirli bir atomun atom numarasını karakterize eder.
Bir atomun elektron kabuğu, farklı sayıda elektron içeren elektron orbitallerinden oluşur. Elektron - negatif yüklü temel parçacık. onun elektrik şarj-1'e eşittir.
Atomlar ayrıca bağlar yoluyla moleküllere bağlanabilir.
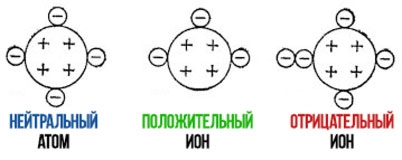
Nötr bir atomda proton sayısı elektron sayısına eşittir. Bu nedenle şarj sıfıra eşittir.
Belirlemek, birsey belirlemek şarj ve o, yapısını, yani çekirdekteki proton sayısını ve elektron orbitallerindeki elektron sayısını bilmek gerekir.
Toplam şarj ve o cebirsel toplamının bir sonucu olarak elde edilen şarjİçinde bulunan proton ve elektronların s'si. Bir iyondaki elektron sayısı proton sayısını geçebilir ve o zaman iyon negatif olur. Elektron sayısı proton sayısından az ise iyon pozitif olacaktır.
Bir kimyasal elementi bilmek, periyodik tabloyu kullanarak, bu elementin bir atomunun çekirdeğindeki proton sayısına eşit olan atom numarasını belirleyebiliriz (örneğin, sodyum için 11). Elektronlardan biri sodyum atomunu terk ederse, sodyum atomunun artık 11 değil 10 elektronu olacaktır. Sodyum atomu pozitif yüklü bir iyon haline gelir. şarj ohm Z = 11+(-10) = +1.
Böyle bir iyon, bu durumda, Na sembolü ile üstte bir artı ile gösterilecektir. şarj ve +2 - iki artı vb. Buna göre, negatif için ve o eksi işareti kullanılır.
Atom kimyasal element içerir çekirdek ve elektronik kabuk. Çekirdek, neredeyse tüm kütlesinin yoğunlaştığı atomun merkezi kısmıdır. Elektron kabuğundan farklı olarak, çekirdeğin pozitif bir şarj.
İhtiyacın olacak
- Bir kimyasal elementin atom numarası, Moseley yasası
Talimat
Bir atomun çekirdeği iki tür parçacıktan oluşur - protonlar ve nötronlar. Nötronlar elektriksel olarak nötr parçacıklardır, yani elektriksel şarj sıfıra eşittir. Protonlar pozitif yüklü parçacıklardır ve elektriksel şarj+1'dir.
Böylece, şarj çekirdek proton sayısına eşittir. Buna karşılık, çekirdekteki proton sayısı, kimyasal elementin atom numarasına eşittir. Örneğin, hidrojenin atom numarası 1'dir, yani hidrojenin çekirdeği bir protondan oluşur. şarj+1. Sodyumun atom numarası 11'dir, şarj onun çekirdek+11'e eşittir.
alfa bozunmasında çekirdek atom numarası bir alfa parçacığının emisyonu ile iki azalır ( çekirdek helyum atomu). Böylece alfa bozunmasına uğramış bir çekirdekteki proton sayısı da iki azalır.
Beta bozunması üç şekilde gerçekleşebilir. çeşitli tipler. Beta-eksi bozunma durumunda, nötron bir elektron ve bir antinötrino yayarak bir protona dönüşür. O zamanlar şarj çekirdek bir artar.
Beta artı bozunma durumunda proton bir nötron, bir pozitron ve bir nötrinoya dönüşür, şarj çekirdek bir azalır.
Elektronik yakalama durumunda şarj çekirdek da bir azalır.
Şarj çekirdek frekans tarafından da belirlenebilir spektral çizgiler Bir atomun karakteristik radyasyonu. Moseley yasasına göre: sqrt(v/R) = (Z-S)/n, burada v karakteristik radyasyonun spektral frekansıdır, R Rydberg sabitidir, S tarama sabitidir, n ana kuantum sayısıdır.
Böylece Z = n*sqrt(v/r)+s.
İlgili videolar
Kaynaklar:
- Nükleer yük nasıl değişir?
ilerde laboratuvar işi ve kimyasalları tanımak için gerekli beceri ve yetenekler geliştirilmemiştir. ya da belki içinde kimyasal laboratuvar bileşiklerin isimlerini içeren etiketler yanlışlıkla soyuldu. Spesifiklikleri nedeniyle kimyasalları doğru bir şekilde tanımlama yeteneği, mezuniyetten sonra artık gerekli olmayabilir. Eğitim Kurumları. Ancak diğer yandan, bu bilgiye yardım için gelecek olan kendi çocuğunuz tarafından ihtiyaç duyulabilir. O zaman ona ne cevap verecek?

İhtiyacın olacak
- Test tüplü raf, maddelerin belirlenmesi için reaktifler, ispirto lambası, halkalı tel, göstergeler
Talimat
Kimyasal maddeler pozitif ve negatif yüklü iyonlardan oluşur ve genellikle elektriksel olarak nötr bir bileşik oluşturur. Bir maddenin bileşimini belirlemek için, çeşitli durumlara kalitatif reaksiyonlarla yönlendirilmek gerekir. iyonlar. Ve onları ezbere öğrenmek gerekli değildir, ancak hemen hemen her kimyasal bileşiği belirleyebileceğiniz bu tür reaktiflerin olduğunu bilmek yeterlidir.
Asitler. Tüm asitlerin ortak özelliği, bir hidrojen iyonu içermeleridir. Asidik özellikleri belirleyen onun varlığıdır. Göstergeler, bu madde grubuna kalitatif bir reaksiyon olarak kabul edilebilir, yani asidik bir ortamda turnusol kırmızıya döner ve metil turuncu pembeye döner.
Vakıflar. Bu grubun maddeleri de bir gösterge kullanılarak belirlenebilir. Alkali bir ortamda kıpkırmızı hale gelen fenolftalein tarafından karakteristik bir reaksiyon verilir. Bu, hidroksit iyonlarının varlığından kaynaklanmaktadır.
Metaller. Belirlemek, birsey belirlemek iyonlar metaller, bunun için bir alkol lambası veya brülör kullanmanız gerekir. Bir bakır tel alın, bir ucundan 6-10 mm çapında bir halka yapın ve aleve getirin. Hemen hemen güzel bir yeşil renk aldığını göreceksiniz. Bu sadece bakır iyonları nedeniyle olur. Aynı sonuç, tel önce bakır tuzlarına (bakır klorür, bakır nitrat, bakır sülfat) daldırılır ve ardından aleve alınırsa gözlemlenecektir.
İyonların varlığını belirlemek için alkali metaller(sodyum ve potasyum) ve alkali toprak (kalsiyum ve baryum), ayrıca ispirto lambasının alevine uygun tuz çözeltilerini de eklemelisiniz. Sodyum iyonları alevi parlak sarıya boyar, iyonlar kalsiyum - tuğla kırmızısı. Maddelerin bir parçası olan baryum iyonları sarı-yeşil bir renk verecek ve iyonlar potasyum - mor.
Asit kalıntılarının iyonlarını belirlemek için bir dizi vardır. kalitatif reaksiyonlar. Sülfat iyonu, beyaz bir çökelti ile sonuçlanacak olan reaktif klor iyonu seçilerek belirlenebilir. Bir test tüpünde karbonat iyonu olduğunu bulmak için herhangi bir seyreltik asit alın ve sonunda bir köpürme göreceksiniz. Ek olarak, bulanıklığı gözlemlerken ortaya çıkan karbondioksiti kireçli sudan geçirin.
Atomların elektronegatifliğindeki (0.4-2.0) küçük bir farktan dolayı elektron çiftinin aralarında eşit olarak dağılmadığını kısaca ele aldık. Unutanlar için hatırlatırım elektronegatiflik atomların elektronları kendilerine çekme yeteneğidir.

Ancak elektronegatiflik tablosuna göre atomların elektronegatiflikleri 2'den fazla farklılık gösteriyorsa elektron çifti tamamen elektronegatifliği daha yüksek olan atoma geçer ve sonuç olarak, iyonik kimyasal bağ. İyonik bir kimyasal bağ, yalnızca tipik metallerin atomları (dış elektronları kolayca kaybettikleri için) ve metal olmayanlar (yüksek elektronegatifliğe sahip oldukları için) arasında oluşur.

pozitif ve negatif iyonlar
İyonik kimyasal bağa iyi bir örnek, her mutfakta bulunan yaygın sofra tuzu NaCl'dir. Sodyum atomları (ve genel olarak tüm metaller) dış elektronları zayıf bir şekilde tutarken, klor atomları aksine elektronları kendilerine çekme konusunda çok yüksek bir yeteneğe sahiptir, yani. yüksek elektronegatifliğe sahiptirler.
Bu nedenle NaCl molekülünün oluşumu sırasında her Na atomu bir elektron (e -) kaybederek pozitif iyon sodyum Na + ve her Cl atomu, aksine, bu kayıp sodyum elektronunu alarak negatif iyon klor Cl - . Bu iki reaksiyon olarak yazılır:
- Na → Na + + e - ve ½Cl 2 + e - → Cl -
½Cl 2'yi yazmak gerekliydi, çünkü doğada gaz halindeki klor, serbest moleküllerden değil, iki atomlu moleküllerden oluşur. tek atomlar klor.
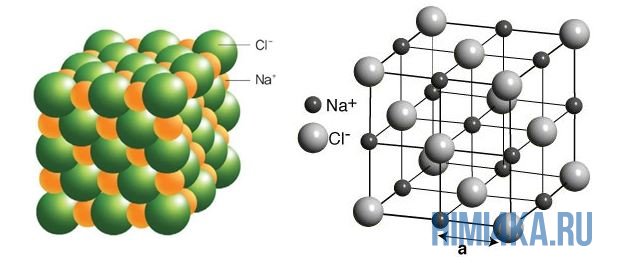
Yukarıdaki şekilde, her klorür iyonu Cl -'nin komşu pozitif sodyum iyonları Na + tarafından her taraftan çevrelendiği NaCl kristal kafesi gösterilmiştir; sodyum iyonları Na + da aynı şekilde en yakın klorür iyonları Cl - ile çevrilidir. Bu iyon dizilimi oldukça kararlıdır.
Pozitif yüklü iyonlara denir katyonlar. Bunlar, bir ila üç elektronu kolayca bağışladıkları için esas olarak metallerdir. Aşağıdakiler katyon örnekleridir:

anyonlar metal değildirler, çünkü elektronları seve seve kendilerine bağlayarak negatif yüklü iyonlara dönüşürler. Anyon örnekleri:

Mg2+ veya F2 gibi basit, tek atomlu bir iyonun yüküne oksidasyon durumu denir. Paslanma durumu- bu, nötr bir atoma dönüşmesi için iyona eklenmesi (indirgenmesi) veya ondan alınması (oksitlenmesi) gereken elektron sayısıdır.
- Geri kazanım reaksiyonu: Mg 2+ + 2e - → Mg
- Oksidasyon reaksiyonu: F 2- → F + 2e -
Elektronların bir atoma bağlanması veya basitçe belirli bir atoma doğru kaydırılması işlemine ne ad verilir? toparlanma reaksiyonu, ve bir atomdan elektronların çekilmesi veya tamamen çıkarılması denir. oksidasyon reaksiyonu. İşte basit iyonların oksidasyon durumlarını içeren harika bir hile sayfası:

Örnek 12.
Klor iyonu oluştuğunda klor oksitlenir mi yoksa indirgenir mi? Bu iyonun oksidasyon durumu nedir?
Çözüm: Klor indirgenir, çünkü bir klorür iyonu oluşturmak için her bir klor atomuna bir elektron bağlanması gerekir. Klorür iyonu, Cl - , -1 oksidasyon durumuna sahiptir.
Örnek 13
Metaller iyon oluşturduklarında oksitlenir mi yoksa indirgenir mi? Alüminyum iyonunun oksidasyon durumu nedir?
Çözüm: Metal iyonları oluştuğunda, ikincisi oksitlenir, çünkü bu durumda elektronlar metal atomlarından çıkarılır. Alüminyum iyonu, Al 3+, +3 oksidasyon durumuna sahiptir.
Kimyasal elementlerin değerliliği
değerlik belirli bir atomun bir moleküldeki diğer atomlarla oluşturduğu kimyasal bağların sayısı olarak adlandırılır. Ancak konuşursa basit kelimelerle, o zaman değerlik aynı oksidasyon durumu olarak anlaşılır, ancak bunun aksine değerlik işareti yoktur ve sıfıra eşit değildir.
iyonların adı
Farklı (değişken) oksidasyon durumlarına sahip metal iyonları aşağıdaki gibi yazılır:
- Fe 2+ demir(II) veya demir iyonu
- Fe 3+ demir(III) veya demir iyonu
- Cu + bakır(I) veya tek değerli bakır iyonu
- Cu 2+ bakır (II) veya iki değerli bakır iyonu
- Sn 2+ kalay(II) veya iki değerli kalay
- Sn 4+ kalay (IV) veya dört değerli kalay iyonu
Örnek 2: Bir demir iyonu bir demir iyonuna dönüştürüldüğünde oksidasyon veya indirgeme meydana gelir? Bu işlemin denklemini yazınız.
Çözüm: Reaksiyon denklemi aşağıdaki forma sahiptir: Fe 3+ + e - → Fe 2+. Orijinal iyona bir elektron eklendiğinden, bu bir indirgeme işlemidir.
Umarım 6 "" dersi sizin için anlaşılır ve faydalı olmuştur. Herhangi bir sorunuz varsa, bunları yorumlara yazın. Soru yoksa, ders 7 "" ye gidin.
Konuyla ilgili bilgilendirici video
"İyon" terimi ilk olarak 1834'te Michael Faraday'a atfedilerek tanıtıldı. Elektrik akımının tuz, alkali ve asit çözeltileri üzerindeki etkisini inceledikten sonra, belirli bir yüke sahip parçacıklar içerdikleri sonucuna vardı. Faraday, bir elektrik alanında negatif yüklü katoda hareket eden katyon iyonlarını çağırdı. Anyonlar, bir elektrik alanında artı anoda doğru hareket eden negatif yüklü, temel olmayan iyonik parçacıklardır.
Bu terminoloji bugün hala kullanılmaktadır ve parçacıklar daha fazla çalışılmaktadır, bu da elektrostatik bir etkileşimin sonucu olarak bir kimyasal reaksiyonu düşünmemize izin vermektedir. Pek çok reaksiyon bu prensibe göre ilerler, bu da onların gidişatını anlamayı ve seyrini hızlandırmak ve sentezi engellemek için katalizörleri ve inhibitörleri seçmeyi mümkün kılar. Ayrıca birçok maddenin özellikle çözeltilerde her zaman iyon halinde olduğu da bilinir hale geldi.
İyonların isimlendirilmesi ve sınıflandırılması
İyonlar, yüklü atomlar veya bir atom grubudur. Kimyasal reaksiyon Kaybolan veya kazanılan elektronlar. Atomun dış katmanlarını oluştururlar ve çekirdeğin düşük çekici kuvveti nedeniyle kaybolabilirler. O zaman bir elektronun ayrılmasının sonucu pozitif bir iyondur. Ayrıca, bir atomun güçlü bir nükleer yükü ve dar bir elektron kabuğu varsa, çekirdek ek elektronların alıcısıdır. Sonuç olarak, negatif bir iyonik parçacık oluşur.
İyonların kendileri sadece fazla veya yetersiz atomlar değildir. elektron kabuğu. Aynı zamanda bir atom grubu da olabilir. Doğada, çözeltilerde, organizmaların vücutlarının biyolojik sıvılarında ve sıvılarda en sık bulunan grup iyonlarıdır. deniz suyu. İsimleri oldukça geleneksel olan çok sayıda iyon türü vardır. Katyonlar pozitif yüklü iyonlardır ve negatif yüklü iyonlar anyonlardır. Kompozisyona bağlı olarak, farklı şekilde adlandırılırlar. Örneğin, sodyum katyonu, sezyum katyonu ve diğerleri. Anyonlar, çoğu zaman birçok atomdan oluştuğu için farklı olarak adlandırılır: sülfat anyonu, ortofosfat anyonu ve diğerleri.
İyon oluşum mekanizması
Bileşiklerdeki kimyasal elementler nadiren elektriksel olarak nötrdür. Yani, neredeyse hiçbir zaman atom halinde değildirler. En yaygın olarak kabul edilen bir kovalent bağın oluşumunda, atomların da belirli bir yükü vardır ve elektron yoğunluğu molekül içindeki bağlar boyunca kayar. Ancak iyonun yükü burada oluşmaz, çünkü enerji kovalent bağ iyonlaşma enerjisinden daha azdır. Bu nedenle, farklı elektronegatifliğe rağmen, bazı atomlar diğerlerinin dış katmanındaki elektronları tamamen çekemez.
Atomlar arasındaki elektronegatiflik farkının yeterince büyük olduğu iyonik reaksiyonlarda, bir atom diğer atomdan dış katmandan elektron alabilir. Daha sonra oluşturulan bağlantı güçlü bir şekilde polarize olur ve kopar. Bunun için harcanan ve iyonun yükünü oluşturan enerjiye iyonlaşma enerjisi denir. Her atom için farklıdır ve standart tablolarda belirtilmiştir.

İyonizasyon, ancak bir atom veya bir atom grubu, elektron verme veya elektron alma yeteneğine sahip olduğunda mümkündür. Bu en çok çözelti ve tuz kristallerinde gözlenir. Kristal kafes ayrıca kinetik enerjiden yoksun, neredeyse hareketsiz yüklü parçacıklar içerir. Ve kristalde hareket imkanı olmadığından iyonların reaksiyonu çoğunlukla çözeltilerde gerçekleşir.
Fizik ve kimyada iyonlar
Fizikçiler ve kimyagerler, çeşitli nedenlerle aktif olarak iyonları inceliyorlar. İlk olarak, bu parçacıklar maddenin bilinen tüm toplu hallerinde bulunur. İkinci olarak, pratik faaliyetlerde kullanmak için bir atomdan elektron koparma enerjisi ölçülebilir. Üçüncüsü, iyonlar kristallerde ve çözeltilerde farklı davranırlar. Dördüncüsü, iyonlar iletmeyi mümkün kılar. elektrik, ve çözeltilerin fizikokimyasal özellikleri iyonların konsantrasyonuna bağlı olarak değişir.
Çözeltideki iyonik reaksiyonlar
Çözümler ve kristallerin kendileri daha ayrıntılı olarak düşünülmelidir. Tuz kristallerinde ayrı olarak bulunur pozitif iyonlarörneğin, sodyum katyonları ve negatif, klor anyonları. Kristalin yapısı şaşırtıcıdır: elektrostatik çekim ve itme kuvvetleri nedeniyle iyonlar özel bir şekilde yönlendirilir. Sodyum klorür durumunda, sözde elmas kristal kafesini oluştururlar. Burada, her bir sodyum katyonu 6 klorür anyonu ile çevrilidir. Sırayla, her klorür anyonu 6 klorür anyonu çevreler. Bu nedenle hem soğukta hem de soğukta basit sofra tuzu sıcak su hemen hemen aynı oranda çözülür.

Çözeltide ayrıca tam bir sodyum klorür molekülü yoktur. İyonların her biri su dipolleri ile çevrilidir ve kalınlığında rastgele hareket eder. Yüklerin ve elektrostatik etkileşimlerin varlığı, tuzlu su çözeltilerinin sıfırdan biraz daha düşük bir sıcaklıkta donmasına ve 100 derecenin üzerindeki bir sıcaklıkta kaynamasına neden olur. Ayrıca, çözeltide içine girebilecek başka maddeler varsa, Kimyasal bağ, o zaman reaksiyon moleküllerin değil iyonların katılımıyla ilerler. Bu, bir kimyasal reaksiyonun evrelenmesi doktrinini yarattı.
Sonunda elde edilen ürünler, etkileşim sırasında hemen oluşmaz, ara ürünlerden kademeli olarak sentezlenir. İyonların incelenmesi, reaksiyonun tam olarak elektrostatik etkileşimlerin ilkelerine göre ilerlediğini anlamayı mümkün kıldı. Sonuçları, diğer iyonlarla elektrostatik olarak etkileşime giren ve nihai denge reaksiyon ürününü yaratan iyonların sentezidir.
Özet
İyon gibi bir parçacık, elektron kaybı veya kazanımı sırasında elde edilen elektrik yüklü bir atom veya atom grubudur. En basit iyon hidrojendir: eğer bir elektron kaybederse, o zaman sadece +1 yüklü bir çekirdektir. Biyolojik sistemlerin ve organizmaların işleyişi için önemli olan çözeltilerin ve ortamların asidik ortamına neden olur.
İyonlar pozitif veya negatif masraflar. Bu nedenle, çözeltilerde, her parçacık su dipolleri ile elektrostatik etkileşime girer, bu da yaşam ve hücreler tarafından sinyal iletimi için koşullar yaratır. Dahası, iyonik teknolojiler daha da gelişiyor. Örneğin, zaten 7 NASA uzay görevi ile donatılmış iyon motorları oluşturuldu.






