G mol nimani anglatadi. Mol - moddaning miqdor birligi. Molyar massa
8-sinfda kimyo fanidan “Modda miqdori. kuya"
Dars maqsadlari:
- talabalarni yangi fizik miqdor - moddaning miqdori, uning o'lchov birligi - mol bilan tanishtirish; materiya miqdori va moldan foydalanishni o'rganing.
Molyar massa tushunchasini bering, moddaning miqdori haqidagi tushunchani shakllantirishni davom ettiring, bu qiymatdan foydalanish qobiliyati, mazmunini boyitish. kimyoviy formula.
Vazifalar:
Dars davomida “modda miqdori”, “Avogadro soni” tushunchalarini shakllantirish.
“modda miqdori”, “Avogadro soni” tushunchalaridan foydalangan holda masalalar yechish qobiliyatini shakllantirish.
Moddalar bilan ishlashda eksperimental ko'nikmalarni, kuzatish, tahlil qilish, xulosa chiqarish, kerakli ma'lumotlarni ajratib ko'rsatish qobiliyatini rivojlantirishni davom eting.
Rejalashtirilgan natija:
Talabalar “modda miqdori”, “Avogadro soni” tushunchalarini biladilar, shu tushunchalar yordamida hisoblash masalalarini yecha oladilar.
Dars turi: kombinatsiyalangan AKT - interfaol o'qitish usullaridan foydalangan holda dars.
Dars rejasi.
I bosqich. Tashkiliy vaqt
Salomlashish, ijobiy hissiy kayfiyatni yaratish.
Talabalarni sinfga tekshirish.
Xayrli kun yigitlar!(yo'qligini belgilang)
Sizni ko'rganimdan xursandman. Oldimda aqlli, mehribon chehralarni ko'raman. Bugun qanday ishlashimizni tushunish uchun siz qanday kayfiyatda ekanligingizni bilmoqchiman. Agar kayfiyatingiz yaxshi bo'lsa, menga tabassum qiling. Bir-biringizga qarang, tabassum!
Ishonchim komilki, bugungi dars bizni mamnun qiladi va samarali bo'ladi va sizning kayfiyatingiz dars oxirigacha yomonlashmaydi.
II bosqich. Kerakli bilim va ko'nikmalarni yangilash, shu jumladan tekshirish Uy ishi(2-slayd)
Davriy sistemaning qayerida tegishli elementlar joylashgan oddiy moddalar metallar?
Nometallar davriy sistemada qayerda joylashgan?
Generallar nima jismoniy xususiyatlar metallar?
Allotropiya nima?
Allotropiyaga misollar keltiring?
Gaplarni to'ldiring: (3-slayd)
Ma'lum 22 metall bo'lmagan
Yod kristallari siyohrang ranglar
suyuq metall bo'lmagan brom
Uglerod shakllari olmos va grafit
Havoda momaqaldiroqdan keyin hosil bo'ladi ozon
Quyidagi jumlalardan metallarga mos keladigan raqamlarni bitta ustunga, metall bo'lmaganlarga mos keladigan raqamlarni boshqa ustunga yozing. (slayd 4)
1. Agregat holati: qattiq.
2. Metall yorqinlikka ega bo'ling.
3.Metalik porlashi yo'q.
5. Elektr tokini o'tkazuvchi.
6. Gazsimon.
7. Qattiq holatda - mo'rt.
8. Plastmassa.
9. Issiqlik o'tkazmang.
Metalllar
1,2,4,5,8
metall bo'lmaganlar
1,3, 6,7, 9
(5-slayd) Yangi mavzudan oldingi holatingizni baholang.
III bosqich. Yangi materialni tushuntirish. (6-slayd)
Yelim to'kildi - so'zlar bir-biriga yopishib qoldi. So'zlarni bir-biridan tire bilan ajrating.
shakar|mol|suv|miqdori|bir|modda|
O'qituvchi darsning maqsad va vazifalarini aytadi.
Dars mavzusini yozib olish (7-slayd)
O'qituvchi o'quvchilarga kimyo moddalar va ularning o'zgarishi haqidagi fan ekanligini eslatib turadi. Muayyan miqdordagi mahsulotni olish uchun (in kimyoviy laboratoriya yoki zavodda) qat'iy belgilangan qabul qilish kerak miqdori boshlang'ich moddalar.
Kimyogarlar tajriba o'tkazar ekan, ba'zi reaktsiyalar mahsulotlarining tarkibi reaktivlar olingan nisbatlarga bog'liqligini payqashdi.
(slayd 8) Masalan, agar ko'mir kisloroddan ortiqcha yondirilsa, karbonat angidrid hosil bo'ladi:
C + O 2 → CO 2
Va agar siz 2 baravar kamroq qabul qilsangiz, uglerod oksidi olasiz:
C + 0,5O 2 → CO 2
Birinchi holda 1 ta kislorod molekulasi 1 ta uglerod atomi bilan, ikkinchi holatda esa bitta kislorod molekulasi ikkita uglerod atomi bilan reaksiyaga kirishdi.
Savol tug'iladi: ma'lum miqdordagi atomlar yoki molekulalarni qanday o'lchash mumkin?
Moddaning massasini (tarozi yordamida) yoki gaz yoki suyuqlik hajmini (o'lchash asboblari yordamida) o'lchash oson. Demak, kerak jismoniy miqdor, bu sizga atomlar yoki molekulalar sonini massa yoki hajmga aylantirish imkonini beradi.
Oddiy hisob-kitoblarni amalga oshiramiz: eng engil atom - vodorodning massasi 1,66 10 -24 g, bu massa nisbiy atom massasi birligi sifatida olinadi: Ar(H) = 1. Endi bizda 1 g vodorod atomi bor deb faraz qilaylik. Bu massada nechta atom bo'ladi? Hisoblash uchun vodorodning bir qismining massasini 1 vodorod atomining massasiga bo'lish kerak: 1 g: 1,66 11 -24 g ≈ 6,02 10 23 atom.
Har qanday elementning massasida (grammda), son jihatdan nisbiyga teng atom massasi, bu elementning bir xil miqdordagi atomlarini o'z ichiga oladi.
Har qanday moddaning nisbiy molekulyar og'irligiga teng bo'lgan massasi (grammda) bir xil miqdordagi molekulalarni o'z ichiga oladi. Bu doimiy qiymat bo'lib, u Avogadro raqami deb ataladi, N A bilan belgilanadi.
(9-slayd)
(slayd 10)Chizma qanday assotsiatsiyalarni uyg'otadi? (mol). Moddaning miqdorini o'lchash birligi "deb nomlangan. mol"
Tarkibida 6,02 10 23 moddaning struktura birliklari bo'lgan moddaning miqdori deyiladi. molem .(slayd 11)
Ko'rib chiqilgan misollarga asoslanib, o'qituvchi boshqa zarralar soni ham mollarda o'lchanishini qo'shimcha qiladi: atomlar, ionlar, elektronlar va boshqalar.
(slayd 12/1)Har qanday moddaning 1 mol agregatsiya holati o'z ichiga oladi N A = 6∙10 23 uning molekulalari.
mol - birlik moddaning miqdori .
Moddaning miqdori - bu moddaning tarkibiy birliklari soni va uning massasi yoki hajmini bog'lash uchun kiritilgan fizik miqdor.
(slayd 12/2) Moddaning miqdori belgilanadi n(uz) yoki (nu) (eskirgan), mol bilan o'lchanadi.
n[mol]
(slayd 13)Moddalar miqdorining umumiy slaydlari.
(slayd 14-15) Har qanday moddaning 1 mol massasi son jihatdan nisbiy molekulyar massaga teng, ammo g / mol birligiga ega.
Bu massa deyiladi molar , M tomonidan belgilangan.
Mr = M [g/mol]
1 mol moddani qanday ko'rish mumkin?
Bir osh qoshiq oling, uni suv bilan to'ldiring va stakanga quying. Bu taxminan 1 mol suv bo'ladi. Bir stakan ichiga yana bir qoshiq suv quying. Endi stakanda bu moddaning 2 mol bor. Yana bir qoshiq qo'shamiz. Suv miqdori 3 molga teng bo'ladi.
(slayd 16)Sinfga 1 mol miqdoridagi ba'zi moddalarni ko'rsating: 56 g temir kukuni ( Fe ), 58 g tuz ( NaCl ), 342 g shakar ( C 12 H 22 O 11 )
(slayd 17-18)Ayrim moddalarning molyar massasini aniqlash
(19-slayd) Moddaning miqdori va massasi quyidagi bog'liqlik bilan bog'liq:
m = n M
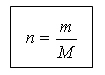
Moddaning miqdori va strukturaviy birliklar soni N quyidagi munosabat bilan bog'liq:
N = N A n
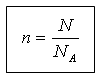
- Xo'sh, uch mol suv tarkibidagi zarrachalar sonini qanday hisoblaymiz? (slayd 20)
Qabul qilingan moddaning miqdorini (bu holda suv) Avogadro doimiysiga ko'paytirish kerak:
N(H 2 O) \u003d 3 mol 6 10 23 molekula \u003d 18 10 23
(slayd 22) Darsdagi holatingizni baholang
IV bosqich. Mustahkamlash. Muammoni hal qilish.
10 mol azotning massasini toping? (23-slayd)
Yechim:
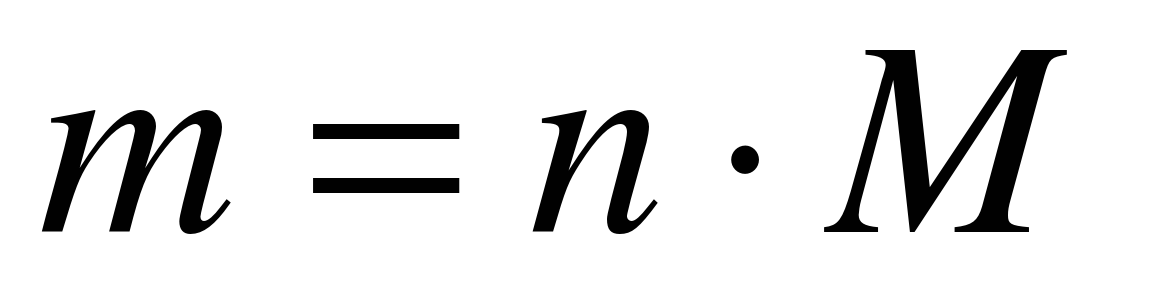
M (N 2) \u003d 28 g / mol
m (N 2) \u003d 10 mol * 28 g / mol
Javob: m (N 2) \u003d 280 g
Berilgan:
n (N 2) \u003d 10 mol
Toping:
m (N 2) - ?
(24-slayd)V bosqich.Uy vazifasi
§15, masalan. 1-3
Savolga javob:
Tozalangan shakarning massasi 1,3 g ekanligini bilgan holda, uning tarkibida qancha shakar molekulasi bor?
Mol, molyar massa
DA kimyoviy jarayonlar eng kichik zarralar - molekulalar, atomlar, ionlar, elektronlar ishtirok etadi. Bunday zarrachalar soni, hatto materiyaning kichik qismida ham, juda ko'p. Shuning uchun, bilan matematik operatsiyalarni oldini olish uchun katta raqamlar, ishtirok etgan moddaning miqdorini tavsiflash kimyoviy reaksiya, maxsus birlik ishlatiladi - mol.
Mol - bu Avogadro doimiysiga teng bo'lgan ma'lum miqdordagi zarrachalarni (molekulalar, atomlar, ionlar) o'z ichiga olgan moddaning shunday miqdori.
Avogadro doimiysi NA 12 g izotop tarkibidagi atomlar soni sifatida aniqlanadi. 12
FROM:
Shunday qilib, 1 mol moddada 6,02 10 mavjud23
ushbu moddaning zarralari.
Shunga asoslanib, moddaning har qanday miqdorini ma'lum miqdordagi mol n (nu) bilan ifodalash mumkin. Masalan, moddaning namunasi 12,04 10 ni o'z ichiga oladi23
molekulalar. Shunday qilib, ushbu namunadagi moddaning miqdori:
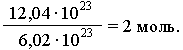
Umuman:
bu erda N - berilgan moddaning zarralari soni;
N A- 1 mol moddani o'z ichiga olgan zarrachalar soni (Avogadro doimiysi).
Molyar massa moddalar (M)
berilgan moddaning 1 moliga ega bo'lgan massa.
Moddaning m massasining n moddaning miqdoriga nisbatiga teng bo'lgan bu qiymat kg/mol yoki g/mol o'lchamiga ega. G/molda ifodalangan molyar massa son jihatdan nisbiy molekulyar massa Mr ga teng (moddalar uchun) atom tuzilishi Ar ning nisbiy atom massasi).
Masalan, metan CH ning molyar massasi 4
quyidagicha aniqlanadi:
Janob (CH 4
) = Ar(C) + 4 Ar(H) = 12+4 =16
M(CH 4 )=16 g/mol, ya'ni. 16 g CH4 6.02 10 ni o'z ichiga oladi23 molekulalar.
Moddaning molyar massasini, agar uning massasi m va miqdori (mollar soni) n ma'lum bo'lsa, formuladan foydalanib hisoblash mumkin:
Shunga ko'ra, moddaning massasi va molyar massasini bilib, biz uning mollari sonini hisoblashimiz mumkin:
yoki mollar soni va molyar massasi bo'yicha moddaning massasini toping:
m = nM
Shuni ta'kidlash kerakki, moddaning molyar massasining qiymati uning sifat va miqdoriy tarkibi bilan belgilanadi, ya'ni. janob va Arga bog'liq. Shuning uchun bir xil miqdordagi molga ega bo'lgan turli xil moddalar mavjud turli xil massalar m.

Misol
Metan CH ning massalarini hisoblang4
va etan C2
H6
har biri n = 2 mol miqdorida olinadi.
Yechim
Metanning molyar massasi M(CH 4
) 16 g/mol ga teng;
etanning molyar massasi M(C2
H6
) = 2 12+6=30 g/mol.
Bu yerdan:
M(CH 4
) = 2 mol 16 g/mol = 32 g;
m (C2
H6
) \u003d 2 mol 30 g / mol \u003d 60 g.
Shunday qilib, mol bir xil miqdordagi zarrachalarni o'z ichiga olgan, ammo turli moddalar uchun har xil massaga ega bo'lgan moddaning bir qismidir, chunki moddaning zarralari (atom va molekulalar) massasi bir xil emas.
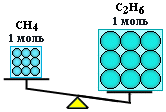
n (CH4 ) = n (S2 H6 ), lekin m (CH4 ) < m(С 2 H6 )
n ni hisoblash deyarli barcha hisoblash masalalarida qo'llaniladi.






