Zbulimi i protonit. Modeli protono-elektronik i bërthamës
Fig.131
Njësia e normës së dozës së ekspozimit në SI kulon për kilogram në sekondë.
Njësia jashtë sistemit - rreze x në orë. 1 R ç
h = 7,17 C ç
kg s. Norma e dozës së ekspozimit 1 Р ç
h korrespondon me shpejtësinë e dozës së absorbuar 8,77 10 -3 Gy ç
3600 s \u003d 2,44 10 - -6 Gy ç
Me.
9. Efekti biologjik i rrezatimit radioaktiv u zbulua dhe filloi të studiohej tashmë në vitet e para pas zbulimit të radioaktivitetit. Me fillimin e përdorimit të armëve atomike në vitin 1945 dhe më pas përdorimin paqësor të energjisë atomike, këto studime u bënë veçanërisht intensive. Karakteristikat kryesore të veprimit biologjik të rrezatimit janë si më poshtë:
a.Çrregullimet e thella në aktivitetin jetësor shkaktohen nga sasi të papërfillshme të energjisë. Pra, energjia e përthithur nga trupi i një gjitari ose personi kur rrezatohet me një dozë vdekjeprurëse, nëse do të shndërrohej në nxehtësi, do të çonte në ngrohjen e trupit me vetëm 0,001 ° C.
b.Rrezatimi dëmton aparatin trashëgues, efekti i tij prek jo vetëm individin e rrezatuar, por edhe pasardhësit e tij të mëvonshëm.
në. Dëmtimi i rrezatimit ka natyrë latente (të fshehur). . Nuk shfaqet menjëherë, por pas disa kohësh.
Ndërveprimi i rrezatimit me një objekt biologjik karakterizohet nga dozë ekuivalente
D e = kD, ku D- doza e absorbuar k- të ashtuquajturat faktor cilësor. Vlera k aq më e rrezikshme kjo specie rrezatimi për një organizëm të gjallë. Për β
- dhe
g-rrezet k= 1, për neutronet e ngadalta k= 3, për neutronet dhe protonet e shpejta k= 10, për fragmente të ndarjes bërthamore k = 20.
Njësia e dozës ekuivalente në SI sievert(Sv), 1 Sv = 1 J ç kg.
Deri kohët e fundit, doza ekuivalente matej në terma të rems. Baer është një shkurtim i frazës ekuivalenti biologjik i rad. 1 rem = 0,01 Sv, 1 Sv = 100 rem.
§tetëmbëdhjetë. Problemi i strukturës së bërthamës atomike
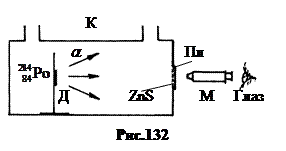 1. Zbulimi i protonit .
Në vitin 1919 Ernst Rutherford ishte pionier i shndërrimit artificial të bërthamave të azotit. Diagrami i instalimit është paraqitur në Fig.132. Përgatitja e poloniumit alfa-aktive u aplikua në mbajtësen D brenda kuvetës K. Scintilacionet a-grimcat mund të vërehen në një pllakë qelqi Pl me pluhur ZnS përmes një mikroskopi M. Grimcat alfa kanë një energji prej 7,58 MeV dhe një rrugë të lirë në ajër me presion normal prej rreth 7 cm presion gazi në qelizë a-grimcat mund të arrijnë në pllakën Pl dhe të shkaktojnë djegie në të. Në presion normal dhe të ngritur a-grimcat nuk arritën në pllakën Pl.
1. Zbulimi i protonit .
Në vitin 1919 Ernst Rutherford ishte pionier i shndërrimit artificial të bërthamave të azotit. Diagrami i instalimit është paraqitur në Fig.132. Përgatitja e poloniumit alfa-aktive u aplikua në mbajtësen D brenda kuvetës K. Scintilacionet a-grimcat mund të vërehen në një pllakë qelqi Pl me pluhur ZnS përmes një mikroskopi M. Grimcat alfa kanë një energji prej 7,58 MeV dhe një rrugë të lirë në ajër me presion normal prej rreth 7 cm presion gazi në qelizë a-grimcat mund të arrijnë në pllakën Pl dhe të shkaktojnë djegie në të. Në presion normal dhe të ngritur a-grimcat nuk arritën në pllakën Pl.
Kuveta u mbush me gazra të ndryshëm, pas së cilës u vunë re shkrepje a-grimcat në presione të ulëta dhe zhdukja e tyre me rritjen e presionit.
Kur kuveta u mbush me nitrogjen N 2, në pllakën Pl u vunë re shkrepje edhe në presione më të larta se ajo kufizuese. Sepse a-grimcat nuk mund të arrinin fosforin, mbeti të supozohej se në procesin e ndërveprimit a-grimca me bërthama azoti ishte lindur disa grimca të tjera jonizuese.
Mbivendosja e fushave elektrike dhe magnetike bëri të mundur që të përcaktohet se një grimcë e re që lind ka ngarkesë pozitive, e barabartë në vlerë absolute me ngarkesën e elektronit dhe një masë afërsisht e barabartë me masën e hidrogjenit. Natyrisht, kjo është bërthama e një atomi hidrogjeni, si a-grimca - bërthama e një atomi heliumi.
Në vitet 1910, u parashtrua ideja që bërthamat e të gjithë elementëve kimikë përbëhen nga bërthama hidrogjeni - domethënë bërthamat e elementit më të thjeshtë, të parë në tabelë. Prandaj, Rutherford e quajti grimcën e re "proton", nga greqishtja. protos- i pari. (Edhe më herët, në 1815, një ide e ngjashme në lidhje me përbërjen e elementeve kimike u shpreh nga kimisti William Prout).
Patrick Blackett vazhdoi në 1925 eksperimentet me azotin duke përdorur një dhomë reje të përmirësuar prej tij (shih f. 132). Ai automatizoi xhirimin e gjurmëve të mjegullta të grimcave jonizuese me dy kamera njëkohësisht nga drejtime të ndryshme. Kjo bëri të mundur rindërtimin e formës hapësinore të trajektoreve të grimcave. Pasi shqyrtoi 23,000 fotografi, ai e përcaktoi këtë a-grimca në përplasje absorbohet nga bërthama e azotit, pas së cilës kjo bërthamë e re nxjerr një proton. Duke marrë parasysh ruajtjen e ngarkesës dhe masës, një reaksion bërthamor mund të shkruhet si më poshtë: ![]() Rutherford, 1919 Zbulimi i protonit (18.1)
Rutherford, 1919 Zbulimi i protonit (18.1)
Energjia e protonit në eksperimentet e Rutherford ishte rreth 6 MeV dhe gjatësia e rrugës ishte 28 cm.
2. Vetitë e protonit. Protoni në gjendje të lirë - të qëndrueshme grimcë elementare , bërthama e një atomi hidrogjeni. Në reaksionet bërthamore, shpesh shënohet me simbolin . masë protonike m fq pothuajse 2000 herë masa e një elektroni mua, m fq = 1836mua\u003d 1,67239 10 -27 kg.
Rrotullimi, domethënë vrulli i vet këndor një proton është i njëjtë me një elektron. Projeksioni i tij në boshtin fizik mund të marrë vetëm dy vlera, L sz =±ћ/ 2. Rrotullimi numër kuantik s një proton, si një elektron, është një gjysmë numër i plotë, . Prandaj, përshkruhet sistemi i protoneve, si sistemi i elektroneve Statistikat e Fermi-Dirac.
Momenti i rrotullimit magnetik të protonit. Siç është përmendur tashmë në §2, në teorinë e Bohr-it për atomin e hidrogjenit, momenti magnetik orbital i një elektroni në gjendjen më të ulët të energjisë ( n= 1) është e barabartë me J ç Tl (shih f. 2.18). Në një nivel më të lartë energjie, momenti magnetik në n herë më shumë ku n- numri i nivelit, M n = n M një. Vlera minimale e momentit magnetik quhet Bohr magneton. Ky është momenti minimal magnetik në fizikën e predhave elektronike të atomeve. Prandaj, magnetoni Bohr përdoret si njësi matëse për momentet magnetike të elektroneve.
Nga eksperimentet e Stern dhe Gerlach mbi ndarjen e rrezeve atomike në një fushë magnetike johomogjene, rezultoi se momenti magnetik spin i një elektroni është i barabartë me magnetonin Bohr. Prandaj, pas zbulimit të protonit, ishte e natyrshme të supozohej se momenti magnetik spin i protonit përcaktohet nga formula e magnetonit Bohr, në të cilën në vend të masës elektronike mua duhet të qëndrojë masë protonike m fq. ![]() J ç
Tl. (18.2)
J ç
Tl. (18.2)
vlera M unë thërras magnetoni bërthamor. Është 1836 herë më i vogël se magnetoni Bohr dhe përdoret si njësi matëse për momentet magnetike në fizikën bërthamore.
Por matjet treguan se momenti magnetik i rrotullimit të protonit është 2,79 herë më i madh se magnetoni bërthamor dhe është ![]() J ç
Tl. (18.3)
J ç
Tl. (18.3)
3. Reaksionet bërthamore me emetim proton u vërejt më vonë gjatë granatimeve a-grimcat e borit, fluorit, natriumit, aluminit dhe fosforit.
vini re, se a-grimcat mund të ndërveprojnë në mënyrë efektive vetëm me bërthamat e lehta. Për të kapërcyer zmbrapsjen elektrike të bërthamës, a-grimca duhet të ketë energji kinetike E, jo më pak se energjia potenciale e nevojshme për reagimin e afrimit me bërthamën. ![]() (18.4)
(18.4)
Nga këtu mund të gjeni numrin maksimal Z element kerneli i të cilit është i disponueshëm
a-grimca me energji E. ![]() . (18.5)
. (18.5)
Rrezja e bërthamës m. Për a-grimca me energji E≈ 10 MeV, marrim
Ky është një numër i mbivlerësuar. Siç tregojnë eksperimentet, ndërveprim efektiv
a-grimcat me bërthama është reale vetëm për elementet me Z≤ 20, pra deri në kalcium.
4. Zbulimi i neutronit. Deri në vitin 1930, doli që disa elementë, për shembull, Be, Li, O 2, kur u qëlluan a-grimcat nuk lëshojnë protone. Prandaj, lindi pyetja: çfarë ndodh kur granatohet a-grimca bërthama nuk lëshon një proton?
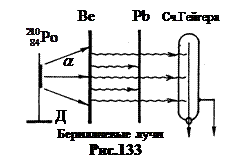 Në vitin 1930 Walter Bothe dhe Hans Becker vendosni një eksperiment, skema e të cilit është paraqitur në Fig. 133. Mbi mbajtësen D u vendos a- ilaç aktiv. E veçanta e saj është se ka përjetuar a- zbërthimi i bërthamës së poloniumit -210 kthehet në bërthamë të një izotopi të qëndrueshëm të plumbit. Prandaj, përgatitja e polonium-210 nuk jep ndonjë rrezatim tjetër. Energjisë a-grimca y është më e vogël se y, është 5.25 MeV. Por për të depërtuar në bërthamat e beriliumit të lehtë të zgjedhur për eksperimentet, i cili ka Z= 4, kjo ishte e mjaftueshme.
Në vitin 1930 Walter Bothe dhe Hans Becker vendosni një eksperiment, skema e të cilit është paraqitur në Fig. 133. Mbi mbajtësen D u vendos a- ilaç aktiv. E veçanta e saj është se ka përjetuar a- zbërthimi i bërthamës së poloniumit -210 kthehet në bërthamë të një izotopi të qëndrueshëm të plumbit. Prandaj, përgatitja e polonium-210 nuk jep ndonjë rrezatim tjetër. Energjisë a-grimca y është më e vogël se y, është 5.25 MeV. Por për të depërtuar në bërthamat e beriliumit të lehtë të zgjedhur për eksperimentet, i cili ka Z= 4, kjo ishte e mjaftueshme.
Kishte frikë se bërthamat që nuk lëshonin protone lëshonin rrezatime të tjera që nuk japin ndezje në sulfid zinku ZnS. Prandaj, ekrani i sulfurit të zinkut u zëvendësua nga një numërues Geiger. Veprimi i tij bazohet në faktin se një grimcë bërthamore që fluturon në banak jonizon gazin në të. Si rezultat, një impuls aktual shfaqet në qarkun e numëruesit (për më shumë detaje mbi numëruesin Geiger, shih f. 130).
Kur rrezatohet a-grimcat e pllakave nga beriliumi, bori, litiumi, siç ka treguar përvoja, lind një lloj rrezatimi, duke shkaktuar shkarkime të dobëta të numëruesit Geiger. Beriliumi dha rrezatim veçanërisht të fortë. Këto berilium rrezet kishin një efekt të jashtëzakonshëm depërtues: një pllakë plumbi 2 cm e trashë uli intensitetin e tyre vetëm me 14%.
Bothe dhe Becker sugjeruan se rrezet e beriliumit janë shumë të forta g- kuantë. Nga përthithja në plumb, u zbulua se energjia e tyre është 7 MeV. Por energjia a-grimcat ishin 5.25 MeV. Nga erdhi rritja e energjisë?
Në vitin 1931, Irene dhe Frederic Joliot-Curie. Duke vendosur fletë parafine në vend të pllakave të plumbit, ata zbuluan se nga parafina lëshoheshin protone nën veprimin e rrezeve të beriliumit, diapazoni maksimal në ajrin e të cilave ishte 26 cm. Ky diapazon korrespondonte me një energji protonike prej 4,5 MeV.
Parafinat janë hidrokarbure të ngopura me formulë e përgjithshme C n H 2 n+2 . Në to numër i madh atomet e hidrogjenit. Shfaqja e protoneve gjatë rrezatimit të parafinës me rrezet e beriliumit u interpretua nga Curies si rezultat i Shpërndarja e komptonit g-kuantet mbi protonet - bërthamat e atomeve të hidrogjenit. Protoni i kthimit lëviz përpara kur shpërndahet g kuanti reflektohet prapa, θ
= π
. Nga këtu ![]() ku m fqështë masa e protonit, λ
0 është gjatësia e valës së beriliumit g- kuantë. Energjisë E i protonit të rrëzuar duhet të jetë i barabartë me humbjen e energjisë g-kuantike, (18.6)
ku m fqështë masa e protonit, λ
0 është gjatësia e valës së beriliumit g- kuantë. Energjisë E i protonit të rrëzuar duhet të jetë i barabartë me humbjen e energjisë g-kuantike, (18.6)
Le të supozojmë se 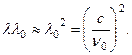 Pastaj
Pastaj 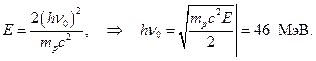
Pra, energjia e beriliumit g-kuanta, e llogaritur nga përthithja në plumb, 7 MeV, nga energjia e protoneve të nxjerra nga parafina - 46-48 MeV. Për më tepër, rezulton se α - grimcat me energji 5.25 MeV trokasin g-kuantike me energji 46-48 MeV!
Në vitin 1932, ai u përfshi në studimin e natyrës së rrezeve të beriliumit. James Chadwick. Skema e instalimit të saj praktikisht nuk ishte e ndryshme nga skema e Bothe dhe Becker, vetëm në vend të banakut Geiger, ai, si Curie, përdori një dhomë jonizimi. Chadwick hetoi shpërndarjen e rrezeve të beriliumit jo vetëm nga parafina, por edhe nga substanca të tjera. Energjisë g-kuantet e matura nga energjia e bërthamave të kthimit të azotit rezultuan të jenë të barabarta me hν= 150 MeV.
Pra, hipoteza sipas së cilës janë rrezet e beriliumit g-kuanta, çoi në rezultate kontradiktore. Në varësi të metodës së matjes, energjia g-kuantat ishin të ndryshme dhe arrinin në 7, 48, 150 MeV. Kjo vërtetoi pasaktësinë e kësaj hipoteze.
Në të njëjtin 1932, Chadwick arriti në përfundimin se rrezatimi i beriliumit është fluksi i grimcave neutrale të cilin e emërtoi neutronet. Simboli për neutronet është . Reaksioni bërthamor i prodhimit të neutronit mund të shkruhet si më poshtë:
![]() Reaksioni i zbulimit të neutronit, 1930-32 .
(18.7)
Reaksioni i zbulimit të neutronit, 1930-32 .
(18.7)
Chadwick bëri gjithashtu matjet e para të masës së neutronit. Doli se masa e neutronit është afër masës së protonit. Vlera e saktë e masës së neutronit është marrë nga bilanci i masës së reaksioneve të ndryshme bërthamore që përfshijnë neutronet.
5. Vetitë e neutronit. neutron i lirë - grimcë elementare e paqëndrueshme, i cili zbërthehet në një proton, një elektron dhe një antineutrino elektronike. ![]() (18.8)
(18.8)
Jetëgjatësia mesatare e neutronit τ ≈ 16 minuta. Masa e një neutroni është disi më e madhe se masa e një protoni dhe është m n = 1838 mua\u003d 1,6760 10 -27 kg. Rrotullimi i neutronit është ħç 2. Prandaj, përshkruhen neutronet, si elektronet dhe protonet Statistikat e Fermi-Dirac.
Raporti i momenteve magnetike të rrotullimit të protonit dhe neutronit është
M p cM n = - 3ç
2. "Minus" do të thotë se drejtimet e momenteve të brendshme mekanike dhe magnetike të neutronit janë të kundërta.
Fuqia e lartë depërtuese e neutroneve është për shkak të mungesës së ngarkesës elektrike të tyre. Neutronet praktikisht nuk ndërveprojnë me predha elektronike të atomeve dhe, ndryshe nga a-grimcat dhe protonet nuk zmbrapsen nga bërthamat. Prandaj, edhe në energji të ulëta, neutronet mund t'u afrohen bërthamave atomike dhe të kapen prej tyre.
Për të regjistruar neutronet e shpejta, përdoren përplasjet e tyre elastike me bërthamat e hidrogjenit. Për shkak të barazisë praktike të masave të protonit dhe neutronit, gjatë ndikimit elastik të një neutroni me një proton të palëvizshëm, pjesa më e madhe e energjisë kinetike të neutronit transferohet tek ky i fundit. Si rezultat, neutroni praktikisht ndalon, dhe protoni lëviz në të njëjtin drejtim me një energji afër energjisë fillestare të neutronit. Gjatë rrugës, protoni prodhon jonizimin intensiv dhe për këtë arsye mund të regjistrohet nga një dhomë jonizimi, një numërues Geiger ose një dhomë reje.
Pas disa përplasjeve të njëpasnjëshme me bërthamat atomike, neutronet e shpejta heqin dorë nga energjia e tyre e tepërt dhe më pas kryejnë një lëvizje kaotike me shpejtësi termike. Për neutrone të tilla termike, metoda e regjistrimit e përshkruar më sipër duke shpërndarë në bërthamat e atomeve të hidrogjenit është e papërshtatshme. Në këtë rast, përdoren reaksionet bërthamore, në të cilat një neutron, duke depërtuar në bërthamë, çon në një arratisje nga kjo e fundit. a grimca me energji të lartë. Për shembull, ![]() (18.10)
(18.10)
6. Problemi i strukturës së bërthamës. Nga fillimi i viteve 30 të shekullit XX. U zbuluan elementët e mëposhtëm strukturorë të atomit: elektron, 1897, Thomson; proton, 1919 Rutherford;
neutron, 1932 Chadwick. Zbulimi i radioaktivitetit dhe vëzhgimi i reaksioneve të para bërthamore e bënë pyetjen urgjente: si është rregulluar bërthama atomike?
Para së gjithash, u bë e qartë se bërthama e një atomi nuk mund të përfaqësohet si një top i bërë nga disa tulla bërthamore të palëvizshme. Bërthama e një atomi është shumë një vëllim i vogël hapësire në të cilën lëvizin elementët bërthamorë. Kjo do të thotë, është një sistem i objekteve bërthamore që lëvizin dhe ndërveprojnë sipas disa ligjeve ende të panjohura.
Para së gjithash, ishte e nevojshme t'i përgjigjemi pyetjes: nga cilat grimca përbëhet bërthama. Historikisht, dy opsione janë konsideruar: bërthamat proton-elektron dhe proton-neutron.
a.Bërthama proton-elektron. Para zbulimit të neutronit në vitin 1930 Paul Dirac analizoi idenë e Prout se të gjithë elementët kimikë përbëhen nga hidrogjeni. Siç u zbatua në problemin e strukturës së bërthamës, kjo ide u zhyt në faktin se të gjitha bërthamat e elementeve përbëhen nga bërthamat e atomit të hidrogjenit, domethënë nga protonet. (Izotopi i hidrogjenit deuterium u zbulua vetëm 2 vjet më vonë). Por kjo do të thotë që numri serial i elementit në tabelën periodike duhet të jetë i barabartë me numrin masiv të tij. Por nuk ka elementë të tillë në tabelë. Heliumi tashmë ka një numër serial Z= 2, dhe numri masiv POR= 4. Sikur nga 4 protone në bërthamë, 2 janë neutralizuar. Mund të supozohet se bërthama e heliumit përmban 4 protone dhe 2 elektrone. Por në këtë rast, ka kontradikta me parimin e pasigurisë së Heisenberg. Në të vërtetë, pasiguria e momentit në bërthamë, e shprehur nga lidhja e pasigurisë për koordinatën-moment është: (18.11)
Por pasiguria e koordinatës Δ X nuk mund të jetë më i madh se rrezja e bërthamës, të paktën Δ X≈ r 0 . Nga eksperimentet e Rutherford në 1909 r 0 ≈ 10 -15 m Momenti i një elektroni në bërthamë nuk mund të jetë më i vogël se pasiguria e momentit, ![]() dhe shpejtësia minimale e saj nga formula relativiste (18.12)
dhe shpejtësia minimale e saj nga formula relativiste (18.12)
Këtu muaështë masa e mbetur e elektronit. Pas llogaritjeve, marrim v = 0,99998c, ku Meështë shpejtësia e dritës. Llogaritur me formulën relativiste energjia kinetike elektroni në bërthamë është 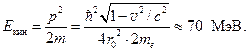
Por elektronet e emetuara nga bërthama në β -kalbje, kanë një energji brenda 10 MeV. Një mospërputhje e tillë e habitshme është shumë e vështirë për të gjetur një shpjegim bindës.
Vështirësia e dytë e modelit proton-elektron të bërthamës quhet katastrofa e azotit. Thelbi i saj është si më poshtë.
Nga ndarja hiperfine e spektrave atomike, ishte e mundur të llogaritet momenti magnetik bërthamat atomike. Doli të ishte rreth 1000 herë më pak se momenti magnetik i rrotullimit të elektronit. Nëse ka një numër çift elektronesh në bërthamë, atëherë një moment kaq i vogël magnetik i bërthamës mund të shpjegohet me faktin se elektronet në bërthamë formojnë çifte me rrotullime të kundërta, kështu që momenti magnetik i bërthamës përbëhet nga momentet e protoneve. Dhe momenti magnetik i protonit është 658 herë më i vogël se momenti i elektronit.
Por në bërthamën e një atomi të azotit duhet të ketë 14 protone dhe 7 elektrone. Nëse 6 elektrone formojnë çifte me rrotullime të kundërta, atëherë një elektron mbetet i paçiftuar. Ky elektron i paçiftuar duhet t'i sigurojë bërthamës së azotit të njëjtin moment magnetik siç ka, domethënë 1000 herë më shumë se bërthamat me numër çift elektronesh. Por kjo nuk është. Momenti magnetik i bërthamës së azotit është i të njëjtit rend si ai i bërthamave të tjera.
b.Bërthama proton-neutron. Më pak se gjashtë muaj pas zbulimit të neutronit, pothuajse njëkohësisht dhe në mënyrë të pavarur nga njëri-tjetri Dmitry Ivanenko dhe Werner Heisenberg sugjeruar proton-neutron përbërjen e bërthamës. Modeli proton-neutron i bërthamës i zhvilluar më vonë është në përputhje të shkëlqyer me eksperimentin dhe tani është i pranuar përgjithësisht. Sipas këtij modeli, bërthama e një atomi përmban Z protonet dhe A-Z neutronet. Këtu Z- numri serial i elementit në tabelën periodike. Ngarkesa kryesore q= Ze +, pra numri Z thirret shpesh numri i tarifës. vlera POR thirrur numri masiv. Ky është një numër i plotë i barabartë me masën atomike të elementit të shprehur në njësi karboni dhe i rrumbullakosur në numrin e plotë më të afërt. Protonet dhe neutronet në bërthamë quhen nukleonet(nga lat. bërthama- bërthama). Kjo thekson se protoni dhe neutroni në përbërjen e bërthamës janë një grimcë e njëjtë në gjendje të ndryshme. Numri masiv PORështë numri i nukleoneve në bërthamë. Në varësi të raportit midis numrit të protoneve dhe neutroneve në bërthama, ekzistojnë izotopet, izobaret dhe izotoneve.
izotopet(nga greqishtja isos - e barabartë, topos - vend) - bërthama që përmbajnë të njëjtin numër protonesh, domethënë që kanë të njëjtin numër Z, dhe një numër të ndryshëm neutronesh. Të gjithë izotopët vendosen në një qelizë të tabelës periodike dhe janë varietetet e njërës element kimik. Izotopet ndryshojnë në numër N neutronet në bërthamë. Për shembull, izotopet e hidrogjenit:
Protium, , bërthama-proton, Z = 1, A = 1, N = A–Z= 0, nuk ka neutrone.
Deuterium, , bërthama-deuteron, Z = 1, A = 2, N= 1, një neutron.
Tritium, , bërthama e tritonit, Z = 1, A = 3, N= 2, dy neutrone.
Izotopet e heliumit:
, Z= 2 (dy protone), A = 3, N= 1 (një neutron), i qëndrueshëm.
, Z = 2, A = 4, N= 2 (dy neutrone), të qëndrueshme.
, Z = 2, A = 6, N= 4 (katër neutrone), të paqëndrueshme.
, Z = 2, A = 8, N= 6 (gjashtë neutrone), e paqëndrueshme.
Elementet e njohura aktualisht kanë një numër Z arrin afërsisht 105. Ky numër elementësh përbën afërsisht 1500 izotope të njohur. Mesatarja për artikull
14 izotope. Nga të cilat 1 ç
5 - e qëndrueshme dhe 4 ç
5 - e paqëndrueshme.
Izotopet e të njëjtit element kimik kanë të njëjtin kimik dhe pothuajse identik vetitë fizike. Prandaj, ndarja e izotopeve është një problem kompleks fiziko-kimik. Izotopet e hidrogjenit ndryshojnë më së shumti.
izobaret(nga isos- dhe greke baros- graviteti) - bërthama me të njëjtin numër masiv POR. Për shembull, tritium dhe helium. Ata kanë 3 nukleone, por raporti midis protoneve dhe neutroneve është i ndryshëm. tritium Z = 1, N= 2, për heliumin Z = 2, N = 1.
izotoneve janë bërthama me të njëjtin numër neutronesh. Ashtu si izobaret, izotonet janë bërthama të elementeve të ndryshme kimike. Për shembull, bërthamat dhe përmbajnë 3 neutrone.
Fjalët izobaret dhe izotoneve përdoret shumë më rrallë se fjala izotopet.
1. Madhësitë e kernelit përcaktohet në tre mënyra: me shpërndarje në bërthamat e elektroneve të shpejta, duke studiuar spektrat mezoatomeve dhe difraksioni nga bërthamat e neutroneve.
a. Shpërndarja në bërthamat e elektroneve të shpejta ju lejon të përcaktoni rrezja elektrike e bërthamës R email Elektronet, energjia e të cilave duhet të jetë së paku 100 MeV, përjetojnë ndërveprim elektromagnetik, por jo bërthamor me bërthamën. Prandaj, bazuar në shpërndarjen e tyre, mund të gjykohet në të vërtetë vetëm shpërndarja e protoneve në bërthamë.
b. Spektrat e mezoatomeve , pra atomet në të cilët zëvendësohet njëri prej elektroneve muon. Muon µ - grimca elementare, ngarkesa e saj e barabartë me ngarkesën elektron, dhe masa është 207 herë më e madhe, m= 207mua. Ashtu si elektroni, muoni nuk merr pjesë në ndërveprimet bërthamore. Spektrat e mezoatomeve japin më shumë informacion për strukturën e bërthamës sesa spektret e atomeve të zakonshme, pasi muoni, për shkak të masës së tij më të madhe, lëviz 207 herë më afër bërthamës sesa elektroni. Muoni kalon një kohë relativisht të dukshme edhe brenda bërthamës.
në. Difraksioni nga bërthamat e neutronit me energji të rendit 20 MeV ka përparësinë që përjetojnë neutronet bërthamore ndërveprimi me thelbin. Rrezja e këtij ndërveprimi është shumë e vogël. Prandaj, neutronet shpërndahen dukshëm në bërthamë, domethënë ato devijojnë nga lëvizja drejtvizore, duke fluturuar vetëm shumë afër bërthamës dhe brenda vetë bërthamës. Nga gjerësia e maksimumit të difraksionit, e cila formohet nga neutronet që kanë kaluar si jashtë dhe brenda bërthamës, mund të vlerësohet si madhësia ashtu edhe shkalla e transparencës së bërthamës për neutronet.
Difraksioni i neutroneve nga bërthamat bën të mundur përcaktimin e rrezes së rajonit në të cilin veprojnë forcat bërthamore të tërheqjes. Në fakt, kjo është zona në të cilën janë përqendruar nukleonet e bërthamës. Nga eksperimentet rezulton se rrezja e bërthamës është proporcionale me rrënjën kubike të numrit A të nukleoneve që përmbahen në të, ![]() m. (19.1)
m. (19.1)
Le të llogarisim përqendrimin e nukleoneve në bërthamë. Për këtë, numri masiv A duhet të ndahet me vëllimin e bërthamës. .
Duke shumëzuar me masën e një nukleoni m fq= 1,67·10 -27 kg, marrim dendësinë mesatare ρ të substancës bërthamore. .
Dendësia e lëndës bërthamore nuk varet nga numri i nukleoneve në bërthamë. Është i njëjtë në të gjitha bërthamat dhe është një vlerë gjigante. Një milimetër kub i një lënde të tillë do të kishte një masë prej 200,000 tonësh. Se dendësia ρ e lëndës bërthamore është konstante, tregon se nukleonet në bërthamë në kuptimin e paketimit janë të ngjashëm me molekulat e lëngëta. Vëllimi mesatar për nukleon në një bërthamë nuk varet nga madhësia e bërthamës, ashtu si vëllimi mesatar për molekulë në një lëng nuk varet nga madhësia e pikës.
2. Forcat bërthamore. Eksperimentet e Rutherford në 1909. me dispersion a-grimcat kanë treguar se ligji i Kulombit përmbushet në mikrokozmos deri në madhësinë e bërthamave. Por kjo do të thotë se forca të mëdha refuzuese duhet të veprojnë midis protoneve në bërthamë. Le të gjejmë madhësinë e këtyre forcave për dy protone në një bërthamë heliumi. Numri i nukleoneve në një bërthamë heliumi. Nga formula (19.1) rrezja e bërthamës së heliumit R\u003d 1,25 10 -15 4 1/3 \u003d 2 10 -15 m. Supozojmë se protonet janë në skajet e diametrit të bërthamës 2 R= 4 10 -15 m. Atëherë forca refuzuese ndërmjet tyre është:
Pse bërthama, pavarësisht nga një zmbrapsje kaq e madhe e ndërsjellë e protoneve, nuk shpërndahet në pjesët përbërëse të saj?
Stabiliteti i vëzhguar eksperimentalisht i bërthamave do të thotë se përveç forcat elektrike zmbrapsja midis grimcave bërthamore, ka edhe forca tërheqëse. Nuk mund të jetë forcë tërheqje gravitacionale. Ata energji potenciale
– Gmp/2R= – 6,7 10 -11 (1,7 10 -27) 2 /4 10 -15 = – 5 10 -50 J, ndërsa energjia potenciale e zmbrapsjes së protonit është (1/4 πε
0)/(e 2 /2R) ≈ 6 10 -14 J! Kjo është 36 urdhra magnitudë më e lartë.
Rrjedhimisht, në rastin e bërthamave atomike, ne përballemi me një lloj të ri, të veçantë ndërveprimi. Ky ndërveprim quhet të fortë dhe forcat që i përgjigjen asaj - bërthamore. Teori e plotë forcat bërthamore ende nuk është ndërtuar, megjithëse ka arritur sukses të madh në shpjegimin dhe parashikimin e shumë fakteve eksperimentale. Idetë kryesore moderne rreth forcave bërthamore janë si më poshtë:
a. Ekzistenca e një fushe bërthamore . Ashtu si forcat elektrike kushtëzohen nga ekzistenca e materialit fushë elektromagnetike, forcat bërthamore janë për shkak të ekzistencës së një fushe bërthamore materiale. Burimet e fushës EM janë çdo grimcë e materies me ngarkesë elektrike - elektronet, protonet, etj. Burimet e fushës bërthamore janë nukleonet - protonet dhe neutronet. Nukleonet kanë një specifikë ngarkesë bërthamore.
b. Ngarkoni pavarësinë e forcave bërthamore . ngarkesë bërthamore nukleonet janë të njëjta në madhësi dhe shenjë. Nuk varet nëse nukleoni ka ngarkesë elektrike (proton) apo jo (neutron). Me ndihmën e forcave bërthamore, një neutron me një neutron, një neutron me një proton dhe dy protone bashkëveprojnë në të njëjtën mënyrë.
në. Forcat bërthamore me rreze të shkurtër. Krahasuar me forcat Kulomb dhe gravitacionale, të cilat zvogëlohen në proporcion me katrorin e distancës midis burimeve pika (ngarkesat, masat), forcat bërthamore zvogëlohen shumë më shpejt. Ato janë shumë të mëdha në distanca të rendit të diametrit të bërthamës, por tashmë në një distancë prej tre diametrash ato janë praktikisht të padukshme. Kur nukleonet i afrohen njëri-tjetrit, tërheqja zëvendësohet nga zmbrapsja.
G. Forcat bërthamore nuk janë qendrore. fushë elektrike përreth tarifë pikë dhe fusha gravitacionale rreth masave pika janë simetrike qendrore. Fusha bërthamore e një nukleoni individual nuk ka simetri qendrore. Kjo është për shkak të pranisë së momenteve mekanike dhe magnetike të rrotullimit në nukleone. Ndërveprimi ndërmjet nukleoneve varet nga orientimi i rrotullimeve të tyre. Për shembull, një neutron dhe një proton mbahen së bashku në bërthamën e hidrogjenit të rëndë - deuteron - vetëm nëse rrotullimet e tyre mekanike janë paralele me njëri-tjetrin.
d. Vetia e ngopjes së forcave bërthamore. Siç dihet, energjia e ndërveprimit të dy ngarkesave elektrike nuk varet nga prania e një të tretës ( parimi i mbivendosjes). Me futjen e çdo ngarkese pasuese, energjia e sistemit rritet në proporcion me sasinë e ngarkesës së futur. Çdo ngarkesë elektrike mund të ndërveprojë me një numër të pakufizuar ngarkesash të tjera. Nuk ka ngopje të forcave elektrike.
Ngopja e forcave bërthamore është se çdo nukleon në bërthamë mund të ndërveprojë me një numër të kufizuar nukleonesh. Kjo është disi e ngjashme me valencën kimike të elementeve. Për shembull, një atom karboni C mund të kombinohet me katër atome hidrogjeni H për të formuar një molekulë metani CH 4 , me dy atome oksigjeni (CO 2 ) dhe kështu me radhë. Nuk ka një diversitet të tillë midis nukleoneve si midis elementeve kimike. Prandaj, ngopja e forcave bërthamore manifestohet në faktin se energji specifike lidhëse(energjia për nukleon) në bërthamë nuk rritet me rritjen e numrit të nukleoneve në bërthamë, por mbetet afërsisht konstante.
3. Masa bërthamore ndryshon nga masa e një atomi të elementeve kimike vetëm nga vlera e masës së shtresës elektronike. Në tabelën periodike, masat e atomeve shprehen në njësi të masës atomike a.m.u. Një e mëngjesit është e barabartë me 1 ç 12 masa të një atomi karboni, 1 amu = 1,66 10 -27 kg. Meqenëse ka 12 nukleone në bërthamën e izotopit kryesor të karbonit (99% në tokë), është e qartë se a.m.u. afër masës së një nukleoni.
Masa e një elektroni mua= 5,5 10 -4 amu Raporti i masës së shtresës elektronike Zme në masën e një atomi është për hidrogjen mua/m() = 5,5 10 -4 ç 1,008 = 0,0005, pra 0,05%. Për atomet e tjera, ky raport është edhe më i vogël, pasi numri i nukleoneve në bërthamë rritet më shpejt se numri i elektroneve në atom. në atomin e uraniumit Zme/m() = 0,0002 (0,02%). Prandaj, në rastet kur llogaritjet kërkojnë një saktësi prej jo më shumë se katër shifra, masa e një atomi të një elementi kimik nga tabela periodike mund të merret si masa e bërthamës.
Si fizika bërthamore Izotopët e panjohur më parë, duke përfshirë ato që nuk ekzistonin në natyrë, u zbuluan dhe u sintetizuan përmes reaksioneve bërthamore.
Metodat e matjes kimike masat atomike izotopet artificiale rezultuan pak efektive. Në vitin 1919 Francis Aston konstrukton spektrograf masiv- një pajisje e aftë për të ndarë jonet sipas masës së tyre me saktësi të lartë.
 Çdo spektrograf masiv përfshin tre pjesë kryesore: burimi i joneve, analizuesi dhe marrësi. Jonet formohen në burimin e joneve dhe formohet një rreze e dobët divergjente. Në analizues, rrezja ndahet në disa rreze, të cilat ndryshojnë në masa jonike dhe janë të përqendruara në sipërfaqen e pajisjes marrëse - një pllakë fotografike. Figura 134 tregon një diagram të njërit prej këtyre spektrografëve të masës. Avulli i avullit i elementit në studim hyn në vrimën 1 të burimit të joneve dhe jonizohet nga tufa elektronike që kalon nëpër të. Jonet që rezultojnë përshpejtohen dhe kolimohen nga diafragmat 2.
Çdo spektrograf masiv përfshin tre pjesë kryesore: burimi i joneve, analizuesi dhe marrësi. Jonet formohen në burimin e joneve dhe formohet një rreze e dobët divergjente. Në analizues, rrezja ndahet në disa rreze, të cilat ndryshojnë në masa jonike dhe janë të përqendruara në sipërfaqen e pajisjes marrëse - një pllakë fotografike. Figura 134 tregon një diagram të njërit prej këtyre spektrografëve të masës. Avulli i avullit i elementit në studim hyn në vrimën 1 të burimit të joneve dhe jonizohet nga tufa elektronike që kalon nëpër të. Jonet që rezultojnë përshpejtohen dhe kolimohen nga diafragmat 2.
Analizuesi është një fushë magnetike sektoriale AT drejtuar pingul me rrafshin e figurës. Në këtë fushë magnetike, jonet e emetuara nga burimi në kënde paksa të ndryshme devijohen dhe fokusohen. Rrezja e rrethit përgjatë të cilit lëviz joni në sektor është sa më i madh, aq më i vogël ngarkesa specifike e tij, ![]() . (19.2)
. (19.2)
(Shih Elektriciteti, §14). Këtu vështë shpejtësia e jonit, e/mështë ngarkesa e tij specifike.
Si rezultat, jonet e të njëjtit izotop bien në të njëjtin vend në pllakën fotografike Фп, duke formuar një vijë të ngushtë mbi të, pingul me rrafshin e figurës. Spektrografët e masës bëjnë të mundur matjen e masave të izotopeve me një gabim relativ prej 10 -5 ¸10 -6.
Nëse e zëvendësojmë pllakën fotografike me një filxhan Faraday dhe matim rrymën e joneve, mund të përcaktojmë intensitetin e rrezeve të joneve dhe të gjejmë bollëkun relativ të izotopeve në përzierjen e joneve. Një pajisje e tillë quhet spektrometri i masës.
4 . Defekti masiv dhe energjia lidhëse bërthamore. Masa bërthamë m i është gjithmonë më pak se masat e nukleoneve përbërëse të tij Zm fq+ (A-Z)m n Vlera .D m = Zm p + (A-Z)m n –m i (19.3)
 thirrur defekt masiv. Këtu m fq,m n,m dhe unë janë masat e mbetura të protonit, neutronit dhe bërthamës.
thirrur defekt masiv. Këtu m fq,m n,m dhe unë janë masat e mbetura të protonit, neutronit dhe bërthamës.
Fakti është se kur nukleonet e lira kombinohen, energjia lëshohet në formën e kuanteve të rrezatimit EM, të cilat mbartin masën Δ m. Energjia e lidhjes E numri i nukleoneve në një bërthamë llogaritet me formulë E sv = D mc 2 , (19.4)
ku cështë shpejtësia e dritës në vakum. Për të shkatërruar bërthamën, domethënë për ta ndarë atë në nukleone, është e nevojshme të jepet energji E, jo më pak se energjia lidhëse, E≥ E St.
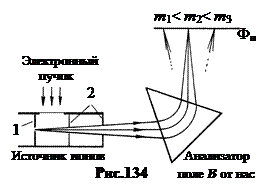
Indikative për vlerësimin e qëndrueshmërisë së bërthamave energji specifike lidhëse E St. cA, pra energjia për 1 nukleon. Figura 135 tregon varësinë eksperimentale të modulit të tij nga numri i masës A bërthama të qëndrueshme në MeV/nukleon. Pikat e zeza i referohen bërthamave çift, në të cilat numri i protoneve Z dhe numri i neutroneve A-Z- numra çift. Kryqe të drejta - te bërthamat me një tek A. Kryqet e zhdrejtë i referohen bërthamave tek-tek.
Fusha tregon energjinë specifike të lidhjes për bërthamat e lehta, duke filluar me deuterium ( A= 2) dhe duke përfunduar me neon ( A = 20).
Në përafrimin e parë, energjia specifike e lidhjes varion nga 7.4 MeV ç nukleon në deuterium deri në 8.8 MeV ç nukleon në hekur, domethënë brenda rreth 1.4 MeV ê nukleon. Por natyra e ndryshimit është tregues. Nga deuteriumi te hekuri, madhësia E St. cA rritet, duke arritur maksimumin në A= 56, domethënë në rajonin e bërthamave të hekurit. Pas hekurit me rritje A Energjia specifike e lidhjes bie në 7.5 MeV ç nukleon në fund të tabelës periodike.
Maksimumi i kurbës korrespondon me bërthamat më të qëndrueshme. Këto përfshijnë bërthamat E St. cA> 8.6 MeV ç nukleon duke filluar me kalcium çift-bar dhe duke përfunduar me plumb çift-bar me E St. cA= 7,9 MeV ç nukleon. Bërthamat më të lehta me A < 20 энергетически выгодно сливаться друг с другом в более тяжёлые с выделением energjia e shkrirjes. Për bërthamat më të rënda me A> 207, përkundrazi, procesi i ndarjes në fragmente është i dobishëm, i cili vazhdon me çlirimin e energjisë, që quhet atomike.
Është interesante se bërthamat e disa elementeve në figurën 135 janë pak më të larta se rrjedha e kurbës. Këto janë bërthama në të cilat numri i protoneve Z ose numri i neutroneve N=A-Z barabartë me të ashtuquajturat numra magjik: 2, 8, 20, 28, 50, 82, 126. Këto bërthama kanë rritur forcën në krahasim me fqinjët e tyre. Bërthamat magjike të dyfishta janë veçanërisht të forta. Nga këto, bërthama është aq e fortë sa që edhe gjatë kalbjes së bërthamave të rënda fluturon e paprekur ( a-grimca).
5 . Rrotullimet e bërthamave. Siç u përmend tashmë në §18, protonet dhe neutronet kanë momente mekanike rrotulluese, të njëjta me ato të elektroneve. Në projeksionin në boshtin fizik, momentet mekanike të rrotullimit të protonit, neutronit dhe elektronit mund të marrin vlerat L sz = ± ћç 2.
Të gjitha metodat për përcaktimin eksperimental të momenteve të rrotullimit Ls protonet, neutronet dhe bërthamat bazohen në lidhjen e momenteve mekanike të rrotullimit Ls me momente rrotullimi magnetike Znj. Njohja e marrëdhënies ndërmjet Ls dhe Znj për këto grimca, sipas madhësisë dhe veçorive të momentit magnetik M s, është e mundur të përcaktohet mekanika Ls.
Më e hershme metodat eksperimentale përcaktimi i momenteve të rrotullimit magnetik M s u bazuan në studimin e strukturës hiperfine të spektrit optik të hidrogjenit (spini i protonit), deuteriumi (proton spin bërthamor + neutron → spin neutron) dhe atome të tjera. Më vonë, ata filluan të studiojnë sjelljen e bërthamave në një fushë magnetike me radiospektroskopi. Rrotullimet e bërthamave të izotopeve jetëshkurtër përcaktohen nga reaksionet bërthamore në bazë të ligjeve të ruajtjes, rrotullimet e bërthamave të ngacmuara - sipas emetimit prej tyre g- rrezatimi.
Eksperimentet tregojnë se momentet e rrotullimit të bërthamës (përkatësisht mekanike dhe magnetike) janë të barabarta me shumat gjeometrike të momenteve të nukleoneve që përbëjnë bërthamën. Duhet të kihet parasysh se momenti total i secilit nukleon është shuma e momenteve të rrotullimit dhe orbitalit (d.m.th., i lidhur me lëvizjen e nukleonit përgjatë një "orbite" të caktuar në bërthamë). Momenti mekanik orbital i një nukleoni në një bërthamë, ndryshe nga momenti i rrotullimit, mund të marrë vetëm vlera të plota. Nese nje L sz= ± ћç 2, atëherë L lz =± nћ, ku nështë një numër i plotë. Le të rendisim faktet kryesore eksperimentale mbi rrotullimet bërthamore.
a. Rrotulloni momentet mekanike të bërthamave me çift A është gjithmonë numër i plotë, me A tek - gjysmë numër i plotë . Për shembull, rrotullimi i deuteronit L sz = ± ( ћç 2+ћç 2) = ± ћ . Rrotullimet e një neutroni dhe një protoni në një bërthamë deuteriumi janë paralele.
b. Momentet mekanike të rrotullimit të të gjitha bërthamave çift në gjendjet bazë janë të barabarta me zero . Meqenëse rrotullimet në çiftin proton - neutron të deuteriumit janë paralele, mbetet të konkludohet se rrotullimet antiparalele mund të jenë vetëm në çifte me të njëjtin emër, pra për proton-proton dhe neutron-neutron.
në. Momentet mekanike të rrotullimit të bërthamave të qëndrueshme të mbetura nuk kalojnë 9ћç 2, domethënë, ato janë shumë të vogla në krahasim me shumën e vlerave absolute të rrotullimit dhe momenteve orbitale të të gjitha grimcave që hyjnë në bërthamë. Kjo sugjeron që shumica e nukleoneve janë të lidhur fort në predha të mbyllura që kanë momentin total zero dhe nuk marrin pjesë në krijimin e rrotullimit bërthamor.
6. Momentet magnetike të bërthamave.Çdo bërthamë me rrotullim jo zero ka një moment magnetik M që karakterizon bashkëveprimin e bërthamës me një fushë magnetike të jashtme uniforme B . Drejtimi i momentit magnetik M mikrogrimcat përkojnë me drejtimin e momentit mekanik të rrotullimit Ls deri për të nënshkruar. M s = g Ls (19.5)
Këtu g – raporti xhiromagnetik. Është pozitiv për protonin (vektorët Znj dhe Ls përkojnë, për neutronin është negativ (vektorë Znj dhe Ls janë të kundërta). Ka shumë metoda për përcaktimin e momenteve magnetike të bërthamave dhe nukleoneve. Le të shqyrtojmë tre prej tyre.
a. Studimi i strukturës hiperfine të spektrit optik. Kjo metodë është përmendur tashmë në paragrafin e mëparshëm. Ne vetëm shtojmë se në këtë mënyrë ishte e mundur të vërtetohej se momentet magnetike bërthamore janë tre rend të madhësisë më të vogla se momenti magnetik spin i elektronit dhe kanë rendin magnetoni bërthamor M i = eћç 2m fq= 5,05 10 -27 J ç Tl. Kjo është arsyeja pse ndarje hiperfine vijat spektrale tre rend të madhësisë më pak strukturë e imët, për shkak të bashkëveprimit të momentit spin të elektronit me atë orbital.
 b. Metoda e rezonancës magnetike bërthamore
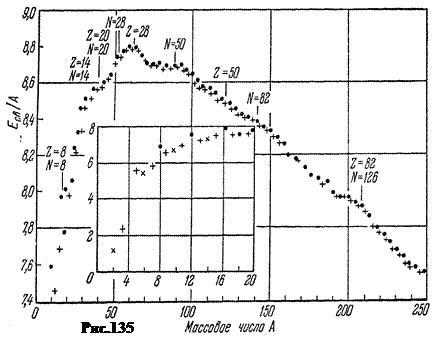
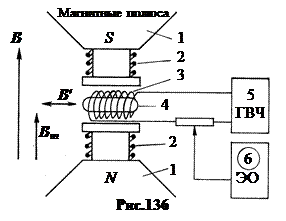
qëndron në faktin se rrotullimi i një bërthame të vendosur në një fushë magnetike të fortë konstante mund të "përmbyset" nën veprimin e një fushe të dobët me frekuencë të lartë të një frekuence të caktuar rezonante. Diagrami i instalimit është paraqitur në Fig.136.
b. Metoda e rezonancës magnetike bërthamore
qëndron në faktin se rrotullimi i një bërthame të vendosur në një fushë magnetike të fortë konstante mund të "përmbyset" nën veprimin e një fushe të dobët me frekuencë të lartë të një frekuence të caktuar rezonante. Diagrami i instalimit është paraqitur në Fig.136.
 Tre fusha magnetike. Së pari, një fushë magnetike e fortë e përhershme B≈ 1 T krijuar nga magnetet 1. Qëllimi i fushës magnetike B
është prishja e lidhjes ndërmjet momentit magnetik bërthamor dhe shtresë elektronike, krijimi i ndarjes hiperfine Zeeman të niveleve bërthamore. Së dyti, fusha me frekuencë të lartë e krijuar nga spiralja 3 nga gjeneratori 5 B
"
, i drejtuar pingul B
. Frekuenca e fushës B
"
mund të ndryshojë. Qëllimi i kësaj fushe është thyerja rezonante e rrotullimit bërthamor. Së treti, fusha e ndryshores moduluese e krijuar nga mbështjelljet 2 B
m, drejtuar paralelisht B
dhe ka një frekuencë të ulët konstante prej 50 Hz. Qëllimi i kësaj fushe është të përsërisë kthimin e rrotullimit bërthamor 50 herë në sekondë në mënyrë që të merret një pamje e palëvizshme në oshiloskopin 6 në rezonancë. Duke matur energjinë e absorbuar në rezonancë nga kampioni, induksioni i një fushe të fortë magnetike B
dhe frekuencën e gjeneratorit, është e mundur të përcaktohet momenti magnetik i bërthamave në instalimet moderne me një saktësi prej 6 shifrash dhjetore.
Tre fusha magnetike. Së pari, një fushë magnetike e fortë e përhershme B≈ 1 T krijuar nga magnetet 1. Qëllimi i fushës magnetike B
është prishja e lidhjes ndërmjet momentit magnetik bërthamor dhe shtresë elektronike, krijimi i ndarjes hiperfine Zeeman të niveleve bërthamore. Së dyti, fusha me frekuencë të lartë e krijuar nga spiralja 3 nga gjeneratori 5 B
"
, i drejtuar pingul B
. Frekuenca e fushës B
"
mund të ndryshojë. Qëllimi i kësaj fushe është thyerja rezonante e rrotullimit bërthamor. Së treti, fusha e ndryshores moduluese e krijuar nga mbështjelljet 2 B
m, drejtuar paralelisht B
dhe ka një frekuencë të ulët konstante prej 50 Hz. Qëllimi i kësaj fushe është të përsërisë kthimin e rrotullimit bërthamor 50 herë në sekondë në mënyrë që të merret një pamje e palëvizshme në oshiloskopin 6 në rezonancë. Duke matur energjinë e absorbuar në rezonancë nga kampioni, induksioni i një fushe të fortë magnetike B
dhe frekuencën e gjeneratorit, është e mundur të përcaktohet momenti magnetik i bërthamave në instalimet moderne me një saktësi prej 6 shifrash dhjetore.
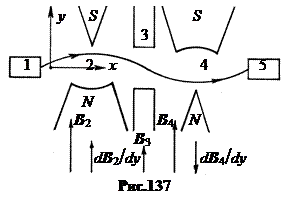
në. Metoda Isidor Rabi, 1937 Metoda e rezonancës magnetike bërthamore nuk mund të masë momentin magnetik të një neutroni, pasi neutronet nuk mbahen në një ampulë, ato ekzistojnë vetëm në rreze. Skema e metodës Rabi është paraqitur në Fig. 137. Rrezja e neutronit nga burimi 1 kalon në mënyrë të njëpasnjëshme nëpër dy fusha magnetike shumë johomogjene 2 dhe 4 me gradient të drejtuar në mënyrë të kundërt dBcdy. Në një fushë magnetike johomogjene, trajektorja e një grimce me një moment magnetik spin është e lakuar përgjatë ose kundër gradientit, në varësi të orientimit të momentit magnetik. Fusha e parë magnetike 2 përkul trajektoren e neutroneve, fusha e dytë 4 i fokuson ato në detektorin 5. Nëse tani, në hendekun 3 midis fushave, përfshijmë një kombinim të fushave magnetike konstante të forta homogjene dhe të dobëta me frekuencë të lartë nga skema e mëparshme, atëherë rrotullimi i neutronit do të kthehet në rezonancë. Si rezultat, këto neutrone nuk do të fokusohen nga fusha e dytë johomogjene 4 dhe nuk do të bien në detektorin 5. Prandaj, do të ketë një rënie të mprehtë në grafikun e intensitetit të numërimit në detektor në varësi të frekuencës së -fusha e frekuencës në rezonancë. Pozicioni i tij do të përcaktojë madhësinë e momentit magnetik të neutronit.
Metoda Rabi gjithashtu mund të përdorë rreze molekulare dhe të përcaktojë momentet magnetike të bërthamave.
Le të rendisim faktet kryesore eksperimentale mbi momentet magnetike të nukleoneve dhe bërthamave atomike.
a. Momentet e rrotullimit magnetik të protonit Mp dhe neutron M n janë: Mp= 2,79 M i, M n = –1,91 M i. Këtu M i = ehç 2m fq= 5,05 10 -27 J ç Tl është magnetoni bërthamor.
b . Momentet magnetike të bërthamave me rrotullim zero janë zero.
në . Momentet magnetike të bërthamave me rrotullim jozero janë të rendit të magnetonit bërthamor.
G. Momentet magnetike spin të nukleoneve nuk janë shtesë. Për shembull, deutroni përbëhet nga një proton dhe një neutron me rrotullime paralele. Momenti total magnetik i deuteronit duhet të jetë M d = M p + M n= 2,79 M i – 1,91 M i = 0,88 M i. Por përvoja jep M d = 0,86 M i. Ky mosaditivitet lidhet me joqendrueshmërinë e forcave që veprojnë ndërmjet nukleoneve.
7 . Modelet e bërthamës atomike. Një teori konsistente e bërthamës nuk është ndërtuar ende për shkak të dy vështirësive kryesore: njohjes së pamjaftueshme të forcave që veprojnë midis nukleoneve dhe rëndimit. problem kuantik shumë trupa. Në fund të fundit, një bërthamë me një numër masiv A duhet të përshkruhet nga një sistem i përbërë nga të paktën A ekuacionet. Këto vështirësi mund të kapërcehen pjesërisht duke krijuar modele bërthamore që bëjnë të mundur përshkrimin me ndihmën e ekuacioneve të thjeshta të një grupi të caktuar të vetive të bërthamës.
Janë zhvilluar rreth një duzinë modele, secila prej të cilave përshkruan grupin e vet të vetive bërthamore dhe gamën e saj të fenomeneve. Le të shqyrtojmë dy prej tyre.
a. model pikoj. Ajo u ofrua Yakov Frenkel në vitin 1937. Bërthama në këtë model krahasohet me një pikë lëngu, bërthama e ngacmuar krahasohet me një pikë të nxehtë. Nëse E është energjia e një bërthame të ngacmuar me numrin e nukleoneve A, atëherë, pasi u kemi caktuar 3 shkallë lirie nukleoneve, marrim:
![]() . (19.6)
. (19.6)
Në E = 10 MeV T≈ 10 9 K. Emetimi i neutroneve, protoneve dhe a-grimcat në një model të tillë mund të interpretohen si avullimi i bërthamës së rënies.
Baza për modelin e rënies ishte veprimi me rreze të shkurtër të forcave bërthamore dhe pavarësia e densitetit nga numri i masës A. Modeli i rënies bëri të mundur nxjerrjen e një formule gjysmë empirike për energjinë e lidhjes së grimcave në një bërthamë dhe përshkrimin procesi i ndarjes së bërthamave të rënda.
b. Modeli i guaskës. Ajo u propozua në vitin 1951. Maria Goeppert-Mayer. Baza për modelin e guaskës ishte fakti i ekzistencës së bërthamave veçanërisht të qëndrueshme, të ashtuquajturat magjike dhe dyfish magjike.
Në këtë model, nukleonet konsiderohet se lëvizin në mënyrë të pavarur nga njëri-tjetri brenda fushë simetrike mesatare qendrore. Supozohet se, si në atom, bërthama ka nivele diskrete, e mbushur me nukleone, duke marrë parasysh parimin Pauli. Këto nivele janë të grupuara në predha, secila prej të cilave mund të përmbajë një numër të caktuar nukleonesh. Një guaskë e mbushur plotësisht formon një bërthamë të qëndrueshme.
Nga fakti eksperimental i ekzistencës së bërthamave magjike dhe dyfishtë magjike, rezulton se guaskat e mbushura përmbajnë numrin magjik të nukleoneve 2, 8, 20, 28, 50, 82, 126. Shumë bërthama magjike janë më të zakonshme në Univers sesa fqinjët e tyre jo magjikë. Përveç dyfishit magjik (me përjashtim të), kjo përfshin
Modeli i guaskës është zhvilluar mirë matematikisht dhe lejon që dikush të shpjegojë vetitë e bërthamave magjike dhe bërthamave fqinje që ndryshojnë me 1 nukleon (mungon ose tepër). Në këtë model, forcat reale që veprojnë midis nukleoneve zëvendësohen nga një fushë e qëndrueshme në të cilën nukleonet lëvizin në mënyrë të pavarur nga njëri-tjetri. Skema e predhave të ndërtimit të kujton disi plotësimin e tabelës periodike, por inferiore ndaj saj në ashpërsi.
Eksperimentet e Rutherford-it vërtetuan se atomi përbëhet nga një bërthamë e vogël e ngarkuar pozitivisht dhe elektrone që rrotullohen rreth tij. Doli se në krahasim me madhësinë e vetë atomit, bërthama është jashtëzakonisht e vogël. Bërthama është 100,000 herë më e vogël se një atom.
Nëse bërthama atomike rritet në madhësinë e një bizele, atëherë diametri i atomit do të jetë i barabartë me lartësinë e kullës Ostankino.
Studimet e mëtejshme kanë treguar se ngarkesa e bërthamës atomike është e barabartë me prodhimin e numrit serik Z të elementit në tabelën periodike të D.I. Mendeleev më ngarkesë elementare. Kjo eshte numri atomik Z përcakton numrin e elektroneve në një atom, numrin e protoneve në bërthamë.

Nëse bërthama përbëhej vetëm nga protone, atëherë masa e bërthamës së çdo elementi kimik do të ishte e barabartë me masën Z të protoneve. Por në fakt, masa e bërthamave të të gjithë elementëve është shumë më e madhe. Prandaj, në vitin 1920, Rutherford sugjeroi ekzistencën e një grimce elektrike neutrale. Kjo grimcë u zbulua më vonë në mënyrë eksperimentale. Ata e thirrën atë neutron.
Në vitin 1932 ata propozuan modeli proton-neutron bërthama atomike. Protonet dhe neutronet quhen nukleonet.
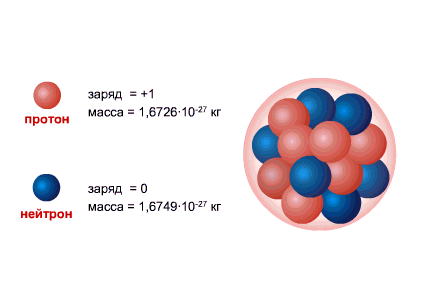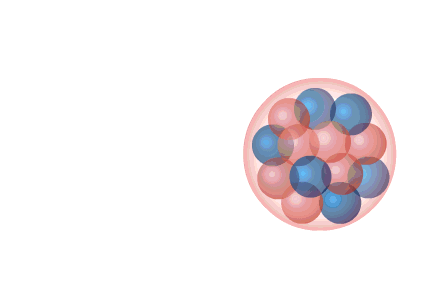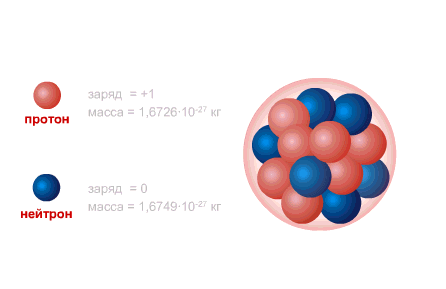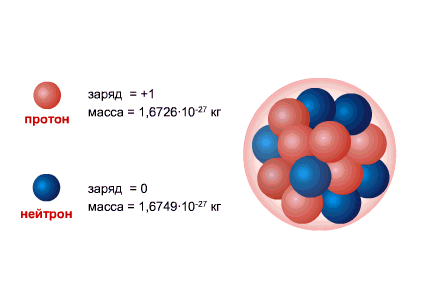
Numri i përgjithshëm i nukleoneve (protone + neutrone) quhet numri masiv A. Aktualisht, përcaktimet e mëposhtme pranohen për atomet e elementeve kimike:
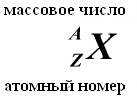

Stabiliteti i Bërthamës
Pse bërthama është e qëndrueshme? Forcat refuzuese të Kulonit me përmasa të mëdha, rreth 230 N, veprojnë midis protoneve brenda bërthamës. Por bërthama nuk shpërbëhet! Arsyeja e stabilitetit është prania e forcave të një natyre të ndryshme, ato quhen ndërveprime të forta.
Këto forca janë 100 herë më të mëdha se forcat repulsive të Kulombit. Ato shfaqen vetëm në distanca të rendit 10 -15 m Janë vetëm forca tërheqëse.
Masa bërthamë
Masat e të gjitha bërthamave (përveç hidrogjenit) janë më të vogla se masat e protoneve dhe neutroneve të lira që i formojnë ato. Diferenca në masë quhet defekt masiv.
Zbulimi i neutronit çoi menjëherë në një ndryshim në idenë e strukturës së bërthamës atomike. Hipoteza se bërthama përmban protone dhe elektrone, të cilat ekzistonin përpara zbulimit të neutronit, nuk u mbështet nga shumica e shkencëtarëve. Në vitin 1932, çuditërisht pjellor për zbulime të jashtëzakonshme, shkencëtari rus Dmitry Dmitrievich Ivanenko parashtroi një hipotezë në lidhje me modelin proton-neutron të bërthamës, elektronet në modelin e tij nuk ishin pjesë e bërthamës. Disi më vonë, Heisenberg shprehu një model të ngjashëm të bërthamës. Duhet thënë se ky model u pranua në mënyrë skeptike nga shumë shkencëtarë. Atyre iu duk se binte në kundërshtim me emetimin e elektroneve gjatë zbërthimit P. Heisenberg kujtoi se "ai u kritikua shumë nga fizikanët më të shquar". Ivanenko shpenzoi shumë përpjekje si për të bindur shkencëtarët për korrektësinë e zbulimit të tij dhe për të mbrojtur përparësinë e tij. Së shpejti modeli proton-neutron i bërthamës u njoh dhe u pranua përgjithësisht, megjithëse bërthama e atomit ende përmban shumë sekrete. Le të themi disa fjalë për grimcat që përbëjnë bërthamën e një atomi. (Duhet të mbahet mend se si protonet ashtu edhe neutronet, sipas mekanikës kuantike, kanë gjithashtu veti valore).
PROTONI është bërthama e atomit të hidrogjenit, ngarkesa e tij është e barabartë me ngarkesën e elektronit në madhësi dhe e kundërta në shenjë (+e = 1,6 x 10-19 C.), dhe masa (mp = 1,6726485 ± 0,0000086) x 10- 27 kg.
NEUTRONI ka një ngarkesë të barabartë me zero dhe një masë praktikisht të barabartë me masën e një protoni (mm = 1,674954 ± 0,000009) x 10-27 kg. 1, Neutronet dhe protonet e marra emer i perbashket nukleonet. Numri i përgjithshëm i nukleoneve në bërthamë, d.m.th. numri i protoneve dhe neutroneve në bërthamë, quhet numër masiv dhe shënohet me shkronjën A. Numri i protoneve në bërthamë shënohet me Z. Quhet numër atomik dhe është gjithashtu i barabartë me numrin e elektroneve në shtresën e jashtme të atomit. Numri i neutroneve në bërthamën N = A - Z.
Elementet kimike, me sugjerimin e bashkëshortëve Joliot-Curie, caktohen me dy indekse në të majtë të përcaktimit të elementit: Indeksi i sipërm tregon numrin e masës, indeksi i poshtëm tregon numrin e protoneve, për shembull, 13 Al, 11 H. Në bërthamat e të njëjtit element kimik, numri i neutroneve mund të jetë i ndryshëm, dhe numri i protoneve është i njëjtë. Bërthamat e tilla, të cilat kanë të njëjtin numër protonesh, por një numër të ndryshëm neutronesh, quhen izotope. Disa izotope nuk ndodhin në natyrë, por mund të merren në laboratorët e shkencëtarëve si rezultat i reaksioneve bërthamore.
Bërthama atomike- pjesa qendrore atom, në të cilën është kryesore peshë(mbi 99.9%). Bërthama është e ngarkuar pozitivisht, ngarkesa e bërthamës përcakton element kimik të cilit i përket atomi. Madhësitë e bërthamave të atomeve të ndryshme janë disa femtometra, e cila është më shumë se 10 mijë herë më e vogël se madhësia e vetë atomit.
Studimet e bërthamave atomike fizika bërthamore.
Bërthama atomike përbëhet nga nukleonet- i ngarkuar pozitivisht protonet dhe neutrale neutronet, të cilat janë të ndërlidhura me anë të ndërveprim i fortë. Protoni dhe neutroni kanë momentin e tyre këndor ( mbrapa), e barabartë me [sn 1] dhe të lidhura moment magnetik. I vetmi atom që nuk përmban një neutron në bërthamë është hidrogjeni i lehtë ( protium).
Bërthama atomike, e konsideruar si një klasë grimcash me një numër të caktuar protonesh dhe neutronesh, zakonisht quhet nukleide .
Numri i protoneve në një bërthamë quhet i tij numri i tarifës- ky numër është i barabartë me numrin serial element të cilit i përket atomi Tabela (Sistemi periodik i elementeve) Mendelejevi. Numri i protoneve në bërthamë përcakton strukturën shtresë elektronike atom neutral dhe kështu Vetitë kimike elementin përkatës. Numri i neutroneve në një bërthamë quhet i tij numri izotopik. Bërthamat me numër të njëjtë të protoneve dhe numër të ndryshëm neutronesh quhen izotopet. Bërthamat me të njëjtin numër neutronesh, por me numër të ndryshëm protonesh quhen izotoneve. Termat izotop dhe izoton përdoren gjithashtu në lidhje me atomet që përmbajnë bërthamat e treguara, si dhe për të karakterizuar varietetet jo kimike të një elementi kimik. Numri i përgjithshëm i nukleoneve në një bërthamë quhet i tij numri masiv() dhe është afërsisht e barabartë me masën mesatare të një atomi, të treguar në tabelën periodike. Quhen nukklide me numër masiv të njëjtë, por me përbërje të ndryshme proton-neutron izobaret.
Ashtu si çdo sistem kuantik, bërthamat mund të jenë në një gjendje të ngacmuar metastabile, dhe në disa raste jetëgjatësi kjo gjendje llogaritet në vite. Gjendje të tilla të ngacmuara të bërthamave quhen izomere bërthamore .
Eksperimentet e Rutherford-it vërtetuan se atomi përbëhet nga një bërthamë e vogël e ngarkuar pozitivisht dhe elektrone që rrotullohen rreth tij. Doli se në krahasim me madhësinë e vetë atomit, bërthama është jashtëzakonisht e vogël. Bërthama është 100,000 herë më e vogël se një atom.
Nëse bërthama atomike rritet në madhësinë e një bizele, atëherë diametri i atomit do të jetë i barabartë me lartësinë e kullës Ostankino.
Studimet e mëtejshme kanë treguar se ngarkesa e bërthamës atomike është e barabartë me prodhimin e numrit serik Z të elementit në tabelën periodike të D.I. Mendeleev në akuzën elementare. Kjo eshte numri atomik Z përcakton numrin e elektroneve në një atom, numrin e protoneve në bërthamë.

Nëse bërthama përbëhej vetëm nga protone, atëherë masa e bërthamës së çdo elementi kimik do të ishte e barabartë me masën Z të protoneve. Por në fakt, masa e bërthamave të të gjithë elementëve është shumë më e madhe. Prandaj, në vitin 1920, Rutherford sugjeroi ekzistencën e një grimce elektrike neutrale. Kjo grimcë u zbulua më vonë në mënyrë eksperimentale. Ata e thirrën atë neutron.
Në vitin 1932 ata propozuan modeli proton-neutron bërthama atomike. Protonet dhe neutronet quhen nukleonet.

Numri i përgjithshëm i nukleoneve (protone + neutrone) quhet numri masiv A. Aktualisht, përcaktimet e mëposhtme pranohen për atomet e elementeve kimike:
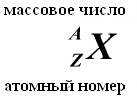

Stabiliteti i Bërthamës
Pse bërthama është e qëndrueshme? Forcat refuzuese të Kulonit me përmasa të mëdha, rreth 230 N, veprojnë midis protoneve brenda bërthamës. Por bërthama nuk shpërbëhet! Arsyeja e stabilitetit është prania e forcave të një natyre të ndryshme, ato quhen ndërveprime të forta.
Këto forca janë 100 herë më të mëdha se forcat repulsive të Kulombit. Ato shfaqen vetëm në distanca të rendit 10 -15 m Janë vetëm forca tërheqëse.
"Struktura e bërthamës atomike" - Ernest Rutherford (struktura e atomit). Mund të vdesësh nga e padukshmja. Becquerel Antoine Henri - 1897 “Hero me krahë të shkurtër” Defekt masiv?m ENERGJI!!! Igor Vasilievich Kurchatov. Struktura e atomit. efekt biologjik në trup. Struktura e bërthamës atomike. Radioaktiviteti - rrezatim spontan (veprimi i kripërave të uraniumit në një pllakë fotografike).
"Struktura e bërthamës së atomit" - Reaktor bërthamor. Transformimi radioaktiv i bërthamave atomike. Numrat masiv elementet kimike. Struktura e atomit. Bërthamat e uraniumit bombardohen me neutrone. Modeli i atomit të Radhërfordit. Petë nga metali i hetuar. Përbërja e bërthamës atomike. Eksperimentet e Radhërfordit 1. Një kokërr radiumi u vendos në një enë plumbi me mure të trasha.
"Struktura e bërthamës" e fizikës" - Proactinius. Modeli proton-neutron i bërthamës atomike. Gjysem jete. Mësoni rreth historisë së zbulimit të neutronit. Numri i tarifës. rrezatimi. Sa nukleone përmbajnë bërthamat. Struktura e bërthamës atomike. Produkt i panjohur. Pajisja. Izotopet. Grimca. Neutron. Rrezatimi. Struktura e atomit. Bërthama e heliumit. Element i ri.
"Struktura e atomit dhe bërthama atomike" - Niveli i energjisë(shtresa elektronike). Shkruani një formulë elektronike. Shpërndarja e elektroneve mbi nënnivele. Përbërja e atomit. Shembuj të formulave elektronike të atomeve. Golat. Diagrama grafike elektronike e atomit të azotit. Gjetja e një elektroni në një atom. Hapja e bërthamës. Imazhi i orbitaleve të elektroneve. Rregullat për shpërndarjen e elektroneve në nivelin e energjisë.
"Përbërja e bërthamës atomike" - FORCAT BËRTHAMORE - forcat tërheqëse që lidhin protonet dhe neutronet në bërthamë. Numri i ngarkesës është i barabartë me ngarkesën e bërthamës, i shprehur në elementare ngarkesat elektrike. Numri i ngarkesës është i barabartë me numrin rendor të elementit kimik. Detyrat. Nuk varet nga prania e një ngarkese. Plani i mësimit. Forma e përgjithshme emërtimet thelbësore. Përbërja e bërthamës atomike.
"Përbërja e bërthamës së atomit" - Dimensionet e bërthamave atomike. Përbërja e bërthamës së një atomi. Ngarkesa kryesore. Modeli proton-neutron i bërthamës. Bërthama e një atomi të një elementi kimik. Proton dhe neutron. Bërthama e një atomi. Radioaktiviteti. Grafiku i lidhjes specifike të nukleoneve në bërthamë. Skema e eksperimenteve të Rutherford. Numri i tarifës. Karakteristikat e forcave bërthamore. Numri i neutroneve në bërthamën e një atomi. Zbulimi i neutronit.
Gjithsej janë 7 prezantime në temë






