Ce înseamnă g mole. Un mol este o unitate de cantitate a unei substanțe. Masă molară
Lecție de chimie în clasa a VIII-a pe tema „Cantitatea de substanță. Molie"
Obiectivele lecției:
- pentru a familiariza elevii cu o nouă mărime fizică - cantitatea unei substanțe, cu unitatea de măsură a acesteia - o mol; învață să folosești cantitatea de materie și alunița.
Dați conceptul de masă molară, continuați formarea conceptului de cantitate de substanță, capacitatea de a utiliza această valoare, îmbogățiți conținutul formula chimica.
Sarcini:
Să formeze în timpul lecției conceptele de „cantitate de substanță”, „numărul lui Avogadro”.
Pentru a forma capacitatea de a rezolva probleme folosind conceptele de „cantitate de substanță”, „numărul lui Avogadro”.
Continuați să dezvoltați abilități experimentale în lucrul cu substanțe, capacitatea de a observa, analiza, trage concluzii, evidenția informațiile necesare.
Rezultat planificat:
Elevii cunosc conceptele de „cantitate de substanță”, „număr Avogadro”, pot rezolva probleme de calcul folosind aceste concepte
Tipul de lecție: TIC combinate - o lecție folosind metode de predare interactive.
Planul lecției.
eu etapă. Organizarea timpului
Salutare, crearea unei dispoziții emoționale pozitive.
Verificarea elevilor pentru clasă.
Buna ziua prieteni!(marca lipsă)
Mă bucur să te văd. Văd chipuri inteligente și amabile în fața mea. Pentru a înțelege cum vom lucra astăzi, vreau să știu în ce dispoziție ești. Dacă ești într-o dispoziție bună, zâmbește-mi. Uitați-vă unii la alții, zâmbiți!
Sunt sigur că lecția de astăzi ne va aduce satisfacții și va fi fructuoasă, iar dispoziția voastră nu se va înrăutăți până la sfârșitul lecției.
II etapă. Actualizarea cunoștințelor și abilităților necesare, inclusiv verificarea teme pentru acasă(diapozitivul 2)
Unde în Tabelul Periodic sunt elementele corespunzătoare substanțe simple metale?
Unde se găsesc nemetale în Tabelul Periodic?
Care sunt generalii proprietăți fizice metale?
Ce este alotropia?
Dați exemple de alotropie?
Completați propozițiile: (diapozitivul 3)
Cunoscut 22 metaloid
Cristale de iod Violet culorile
nemetal lichid brom
Forme de carbon diamant si grafit
După ce se formează o furtună în aer ozon
Din propozițiile de mai jos, scrieți numerele corespunzătoare metalelor într-o coloană și numerele corespunzătoare nemetalelor într-o altă coloană. (diapozitivul 4)
1. Stare agregată: solid.
2. Au un luciu metalic.
3. Nu au un luciu metalic.
5. Conductiv electric.
6. Gazos.
7. În stare solidă - fragilă.
8.Plastic.
9. Nu conduce căldura.
Metalele
1,2,4,5,8
nemetale
1,3, 6,7, 9
(diapozitivul 5) Evaluează-ți starea înainte de un subiect nou.
III etapă. Explicarea noului material. (diapozitivul 6)
Lipiciul s-a vărsat - cuvintele s-au lipit împreună. Separați cuvintele unul de celălalt cu liniuțe.
zahăr|aluniță|apă|cantitate|una|substanță|
Profesorul comunică scopurile și obiectivele lecției.
Înregistrarea subiectului lecției (diapozitivul 7)
Profesorul le reamintește elevilor că chimia este știința substanțelor și a transformărilor lor. Pentru a obține o anumită cantitate de produs (în laborator chimic sau la fabrică) este necesar să se ia strict definite cantitate iniţială substante.
Chimiștii, efectuând experimente, au observat că compoziția produselor unor reacții depinde de rapoartele în care au fost luați reactanții.
(diapozitivul 8) De exemplu, dacă cărbunele este ars în exces de oxigen, se produce dioxid de carbon:
C + O 2 → CO 2
Și dacă luați de 2 ori mai puțin, obțineți monoxid de carbon:
C + 0,5O 2 → CO 2
În primul caz, 1 moleculă de oxigen a reacționat cu 1 atom de carbon, iar în al doilea caz, o moleculă de oxigen a reacționat cu doi atomi de carbon.
Se pune întrebarea: cum se măsoară un anumit număr de atomi sau molecule?
Este ușor de măsurat masa unei substanțe (folosind cântare) sau volumul unui gaz sau lichid (folosind ustensile de măsurat). Deci ai nevoie cantitate fizica, care vă permite să convertiți numărul de atomi sau molecule în masă sau volum.
Să efectuăm calcule simple: masa celui mai ușor atom - hidrogen este de 1,66 10 -24 g, această masă este luată ca unitate de masă atomică relativă: Ar(H) = 1. Să presupunem acum că avem 1 g de atomi de hidrogen. Câți atomi vor fi în această masă? Pentru a calcula, trebuie să împărțiți masa unei porțiuni de hidrogen la masa unui atom de hidrogen: 1 g: 1,66 11 -24 g ≈ 6,02 10 23 atomi.
În masa (în grame) a oricărui element, numeric egală cu relativul masă atomică, va conține același număr de atomi ai acestui element.
Masa (în grame) a oricărei substanțe, numeric egală cu greutatea sa moleculară relativă, va conține același număr de molecule. Aceasta este o valoare constantă, se numește numărul lui Avogadro, notat cu N A .
(diapozitivul 9)
(diapozitivul 10)Ce asociații evocă desenul? (mol). Unitatea de măsurare a cantității de substanță se numea „ cârtiță"
Cantitatea de substanță care conține 6,02 10 23 unități structurale ale unei substanțe se numește molem .(diapozitivul 11)
Pe baza exemplelor luate în considerare, profesorul adaugă că numărul altor particule se măsoară și în moli: atomi, ioni, electroni etc.
(diapozitivul 12/1)1 mol de orice substanță în orice starea de agregare conţine N A = 6∙10 23 moleculele sale.
cârtiță - unitate cantitate de substanță .
Cantitatea de substanță este o mărime fizică introdusă pentru a lega numărul de unități structurale ale unei substanțe și masa sau volumul acesteia.
(diapozitivul 12/2) Se notează cantitatea de substanță n(ro) sau (nu) (învechit), măsurat în alunițe.
n[mol]
(diapozitivul 13)Slide generală a cantității de substanță.
(diapozitivul 14-15) 1 mol din orice substanță are o masă egală numeric cu masa moleculară relativă, dar având o unitate de g/mol
Această masă se numește molar , notat cu M.
Mr = M [g/mol]
Cum poți vedea 1 mol dintr-o substanță?
Luați o lingură, umpleți-o cu apă și turnați-o într-un pahar. Acesta va fi aproximativ 1 mol de apă. Se toarnă încă o lingură de apă într-un pahar. Acum există 2 moli din această substanță în sticlă. Să mai adăugăm o lingură. Cantitatea de apă va deveni egală cu 3 mol.
(diapozitivul 16)Demonstrați clasei câteva substanțe cantitatea de 1 mol: 56 g pulbere de fier ( Fe ), 58 g sare ( NaCl ), 342 g zahăr ( C 12 H 22 O 11 )
(diapozitivul 17-18)Determinarea masei molare a anumitor substante
(diapozitivul 19) Cantitatea de substanță și masa sunt legate prin următoarea relație:
m = n M
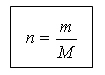
Cantitatea de substanță și numărul de unități structurale N sunt legate prin următoarea relație:
N = N A n
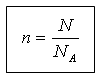
- Deci, cum calculăm numărul de particule conținute în trei moli de apă? (diapozitivul 20)
Este necesar să înmulțiți cantitatea de substanță luată (în acest caz, apă) cu constanta Avogadro:
N(H 2 O) \u003d 3 mol 6 10 23 molecule \u003d 18 10 23
(diapozitivul 22) Evaluează-ți starea în lecție
IV etapă. Consolidare. Rezolvarea problemelor.
Aflați masa a 10 moli de azot? (diapozitivul 23)
Soluţie:
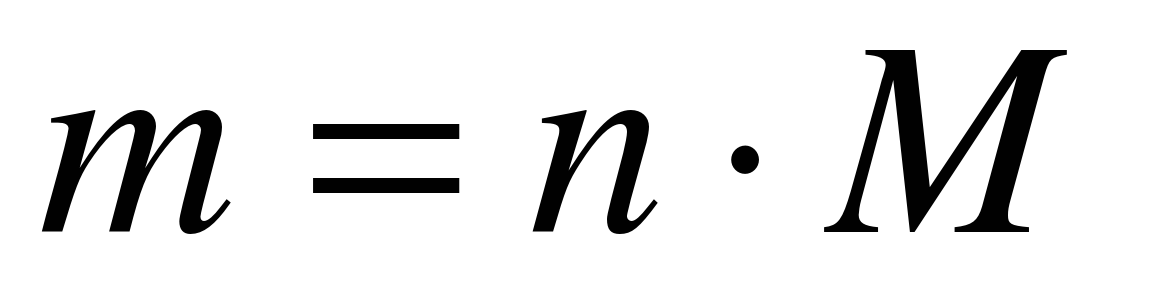
M (N 2) \u003d 28 g / mol
m (N 2) \u003d 10 mol * 28 g / mol
Răspuns: m (N 2) \u003d 280 g
Dat:
n (N 2) \u003d 10 mol
Găsi:
m (N2) - ?
(diapozitivul 24)V etapă.Teme pentru acasă
§15, ex. 1-3
Răspunde la întrebare:
Câte molecule de zahăr sunt conținute într-o bucată de zahăr rafinat știind că masa unei bucăți este de 1,3 g?
Aluniță, masă molară
LA procese chimice sunt implicate cele mai mici particule - molecule, atomi, ioni, electroni. Numărul de astfel de particule, chiar și într-o mică parte de materie, este foarte mare. Prin urmare, pentru a evita operațiile matematice cu numere mari, pentru a caracteriza cantitatea de substanță implicată în reactie chimica, se folosește o unitate specială - aluniță.
Un mol este o astfel de cantitate dintr-o substanță care conține un anumit număr de particule (molecule, atomi, ioni) egal cu constanta Avogadro.
Constanta Avogadro NA este definita ca numarul de atomi continuti in 12 g dintr-un izotop 12
DIN:
Astfel, 1 mol dintr-o substanță conține 6,02 1023
particule din această substanță.
Pe baza acestui fapt, orice cantitate de substanță poate fi exprimată printr-un anumit număr de moli ν (nu). De exemplu, o probă dintr-o substanță conține 12,04 1023
molecule. Prin urmare, cantitatea de substanță din această probă este:
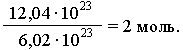
În general:
unde N este numărul de particule dintr-o substanță dată;
N / A- numărul de particule care conţine 1 mol de substanţă (constanta lui Avogadro).
Masă molară substanțe (M)
este masa pe care o are 1 mol dintr-o substanță dată.
Această valoare, egală cu raportul dintre masa m a unei substanțe și cantitatea de substanță ν, are dimensiunea kg/mol sau g/mol. Masa molară, exprimată în g/mol, este numeric egală cu masa moleculară relativă Mr (pentru substanțe structura atomica este masa atomică relativă a lui Ar).
De exemplu, masa molară a metanului CH 4
este definită după cum urmează:
Domnul (CH 4
) = Ar(C) + 4 Ar(H) = 12+4 =16
M(CH 4 )=16 g/mol, adică 16 g CH4 conţine 6,02 1023 molecule.
Masa molară a unei substanțe poate fi calculată dacă se cunosc masa m și cantitatea (numărul de moli) ν, folosind formula:
În consecință, cunoscând masa și masa molară a unei substanțe, putem calcula numărul de moli ai acesteia:
sau găsiți masa unei substanțe după numărul de moli și masa molară:
m = ν M
Trebuie remarcat faptul că valoarea masei molare a unei substanțe este determinată de compoziția sa calitativă și cantitativă, adică. depinde de Mr si Ar. Prin urmare, substanțe diferite cu același număr de moli au diverse mase m.

Exemplu
Calculați mase de metan CH4
și etan C2
H6
luate în cantitate de ν = 2 mol fiecare.
Soluţie
Masa molară a metanului M(CH 4
) este egal cu 16 g/mol;
masa molară a etanului M(C2
H6
) = 2 12+6=30 g/mol.
De aici:
M(CH 4
) = 2 mol 16 g/mol = 32 g;
m(C2
H6
) \u003d 2 mol 30 g / mol \u003d 60 g.
Astfel, o mol este o porțiune dintr-o substanță care conține același număr de particule, dar având o masă diferită pentru substanțe diferite, deoarece particulele de materie (atomi și molecule) nu au aceeași masă.
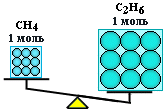
n(CH4 ) = n(С2 H6 ), dar m(CH4 ) < m(С 2 H6 )
Calculul lui ν este utilizat în aproape orice problemă de calcul.