Otkriće protona. Protonsko-elektronski model jezgra
Fig.131
Jedinica brzine doze ekspozicije u SI kulona po kilogramu u sekundi.
Vansistemska jedinica - rendgenski snimak na sat. 1 R ç
h = 7,17 C ç
kg s. Brzina doze ekspozicije 1 R ç
h odgovara brzini apsorbovane doze 8,77 10 -3 Gy ç
3600 s \u003d 2,44 10 - -6 Gy ç
With.
9. Biološki efekat radioaktivnog zračenja je otkriven i počeo se proučavati već u prvim godinama nakon otkrića radioaktivnosti. S početkom upotrebe atomskog oružja 1945. godine, a potom i mirnom upotrebom atomske energije, ova istraživanja postaju posebno intenzivna. Glavne karakteristike biološkog djelovanja zračenja su sljedeće:
a.Duboke smetnje u vitalnoj aktivnosti uzrokovane su zanemarivim količinama energije. Dakle, energija koju apsorbira tijelo sisara ili čovjeka kada je ozračena smrtonosnom dozom, ako se pretvori u toplinu, dovela bi do zagrijavanja tijela za samo 0,001°C.
b.Zračenje oštećuje nasljedni aparat, njegov efekat ne utiče samo na ozračenog pojedinca, već i na njegovo potomstvo.
in. Oštećenja od zračenja su latentne (skrivene) prirode . Ne pojavljuje se odmah, već nakon nekog vremena.
Interakciju zračenja sa biološkim objektom karakteriše ekvivalentna doza
D e = kD, gdje D- apsorbovana doza k- takozvani faktor kvaliteta. Vrijednost k opasnije ovu vrstu zračenje za živi organizam. Za β
- i
g-zraci k= 1, za spore neutrone k= 3, za brze neutrone i protone k= 10, za fragmente nuklearne fisije k = 20.
Jedinica ekvivalentne doze u SI sivert(Sv), 1 Sv = 1 J ç kg.
Do nedavno, ekvivalentna doza se mjerila u smislu rems. Baer je skraćenica za frazu biološki ekvivalent rad. 1 rem = 0,01 Sv, 1 Sv = 100 rem.
§osamnaest. Problem strukture atomskog jezgra
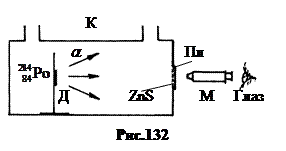 1. Otkriće protona .
Godine 1919 Ernst Rutherford bio pionir u umjetnoj konverziji jezgri dušika. Instalacioni dijagram je prikazan na sl.132. Alfa-aktivni preparat polonijuma apliciran je na držač D unutar kivete K. Scintilacije a-čestice se mogu posmatrati na staklenoj ploči Pl sa prahom ZnS kroz mikroskop M. Alfa čestice imaju energiju od 7,58 MeV i slobodni put u vazduhu pri normalnom pritisku od oko 7 cm pritisak gasa u ćeliji a-čestice bi mogle doći do Pl ploče i izazvati scintilacije na njoj. Pri normalnom i povišenom pritisku a-čestice nisu došle do Pl ploče.
1. Otkriće protona .
Godine 1919 Ernst Rutherford bio pionir u umjetnoj konverziji jezgri dušika. Instalacioni dijagram je prikazan na sl.132. Alfa-aktivni preparat polonijuma apliciran je na držač D unutar kivete K. Scintilacije a-čestice se mogu posmatrati na staklenoj ploči Pl sa prahom ZnS kroz mikroskop M. Alfa čestice imaju energiju od 7,58 MeV i slobodni put u vazduhu pri normalnom pritisku od oko 7 cm pritisak gasa u ćeliji a-čestice bi mogle doći do Pl ploče i izazvati scintilacije na njoj. Pri normalnom i povišenom pritisku a-čestice nisu došle do Pl ploče.
Kiveta je punjena različitim gasovima, nakon čega su uočene scintilacije a-čestice pri niskim pritiscima i njihov nestanak sa porastom pritiska.
Kada je kiveta napunjena dušikom N 2, scintilacije su uočene na Pl ploči čak i pri pritiscima većim od graničnog. Zbog a-čestice nisu mogle doći do fosfora, preostalo je pretpostaviti da u procesu interakcije a-čestice sa jezgrom azota su rođeni neke druge jonizujuće čestice.
Superpozicija električnog i magnetskog polja omogućila je da se ustanovi da ima nova čestica koja se rađa pozitivan naboj, po apsolutnoj vrijednosti jednak naboju elektrona, i masa približno jednaka masi vodonika. Očigledno, ovo je jezgro atoma vodika, kao a-čestica - jezgro atoma helijuma.
Još 1910-ih godina iznesena je ideja da se jezgra svih hemijskih elemenata sastoje od jezgara vodonika - to jest, jezgara najjednostavnijeg, prvog elementa u tabeli. Stoga je Rutherford nazvao novu česticu "proton", sa grčkog. protos- prvi. (Još ranije, 1815. godine, sličnu ideju o sastavu hemijskih elemenata izneo je hemičar William Prout).
Patrick Blackett nastavio je 1925. eksperimente sa dušikom koristeći komoru za oblake koju je on poboljšao (vidi str. 132). Automatizirao je snimanje maglovitih tragova jonizirajućih čestica s dvije kamere istovremeno iz različitih smjerova. To je omogućilo rekonstrukciju prostornog oblika putanja čestica. Nakon što je pregledao 23.000 fotografija, utvrdio je to a-česticu u sudaru apsorbuje jezgro dušika, nakon čega ovo novo jezgro izbacuje proton. Uzimajući u obzir očuvanje naboja i mase, nuklearna reakcija se može napisati na sljedeći način: ![]() Rutherford, 1919. Otkriće protona (18.1)
Rutherford, 1919. Otkriće protona (18.1)
Energija protona u Rutherfordovim eksperimentima bila je oko 6 MeV, a dužina putanje je bila 28 cm.
2. Svojstva protona. Proton u slobodnom stanju - stabilan elementarna čestica , jezgro atoma vodika. U nuklearnim reakcijama često se označava simbolom . masa protona m str skoro 2000 puta veća od mase elektrona ja, m str = 1836ja\u003d 1,67239 10 -27 kg.
Spin, tj sopstveni ugaoni moment proton je isto što i elektron. Njegova projekcija na fizičku osu može imati samo dvije vrijednosti, L sz =±ć/ 2. Spin kvantni broj s proton je, kao i elektron, polucijeli broj, . Stoga je opisan sistem protona, kao i sistem elektrona Fermi-Dirac statistika.
Magnetski spin moment protona. Kao što je već spomenuto u §2, u Borovoj teoriji atoma vodika, orbitalni magnetni moment elektrona u najnižem energetskom stanju ( n= 1) jednako je J ç Tl (vidi f. 2.18). Na višem energetskom nivou, magnetni moment u n puta više gde n– broj nivoa, M n = n M jedan . Minimalna vrijednost magnetnog momenta se naziva Bohr magneton. Ovo je minimalni magnetni moment u fizici elektronskih omotača atoma. Stoga se Borov magneton koristi kao mjerna jedinica za magnetne momente elektrona.
Iz eksperimenata Sterna i Gerlacha o cijepanju atomskih snopova u nehomogenom magnetskom polju slijedilo je da spin magnetni moment elektrona jednak je Borovom magnetonu. Stoga je nakon otkrića protona bilo prirodno pretpostaviti da je spin magnetni moment protona određen Bohrovom formulom magnetona, u kojoj umjesto mase elektrona ja treba da stoji masa protona m str. ![]() J ç
Tl. (18.2)
J ç
Tl. (18.2)
vrijednost M zovem nuklearni magneton. On je 1836 puta manji od Borovog magnetona i koristi se kao mjerna jedinica za magnetne momente u nuklearnoj fizici.
Ali mjerenja su pokazala da je spin magnetni moment protona 2,79 puta veći od nuklearnog magnetona i da je ![]() J ç
Tl. (18.3)
J ç
Tl. (18.3)
3. Nuklearne reakcije sa emisijom protona uočeno kasnije tokom granatiranja a-čestice bora, fluora, natrijuma, aluminijuma i fosfora.
primeti, to a-čestice mogu efikasno da komuniciraju samo sa lakim jezgrima. Da bi se savladalo električno odbijanje jezgra, a-čestica mora imati kinetičku energiju E, ne manje od potencijalne energije potrebne za reakciju približavanja jezgru. ![]() (18.4)
(18.4)
Odavde možete pronaći maksimalan broj Z element čije je jezgro dostupno
a-čestice sa energijom E. ![]() . (18.5)
. (18.5)
Radijus jezgra m a-čestice sa energijom E≈ 10 MeV, dobijamo
Ovo je precijenjen broj. Kao što pokazuju eksperimenti, efikasna interakcija
a-čestice sa jezgrima realno je samo za elemente sa Z≤ 20, odnosno do kalcijuma.
4. Otkriće neutrona. Do 1930. godine pokazalo se da neki elementi, na primjer, Be, Li, O 2, kada su ispaljeni a-čestice ne emituju protone. Stoga se postavilo pitanje: šta se dešava kada se granatira a-čestice jezgro ne emituje proton?
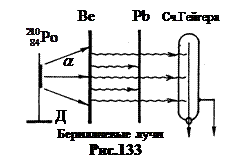 Godine 1930 Walter Bothe i Hans Becker postaviti eksperiment, čija je šema prikazana na slici 133. Na držač D je postavljen a- aktivni lijek. Njegova posebnost je u tome što ste doživjeli a- raspad jezgra polonijuma -210 pretvara se u jezgro stabilnog izotopa olova. Dakle, priprema polonijuma-210 ne daje nikakvo drugo zračenje. Energija a-čestica y je manja od y, iznosi 5,25 MeV. Ali da bi se prodrlo u jezgra lakog berilijuma odabranog za eksperimente, koji ima Z= 4, to je bilo dovoljno.
Godine 1930 Walter Bothe i Hans Becker postaviti eksperiment, čija je šema prikazana na slici 133. Na držač D je postavljen a- aktivni lijek. Njegova posebnost je u tome što ste doživjeli a- raspad jezgra polonijuma -210 pretvara se u jezgro stabilnog izotopa olova. Dakle, priprema polonijuma-210 ne daje nikakvo drugo zračenje. Energija a-čestica y je manja od y, iznosi 5,25 MeV. Ali da bi se prodrlo u jezgra lakog berilijuma odabranog za eksperimente, koji ima Z= 4, to je bilo dovoljno.
Strahovalo se da jezgra koja ne emituju protone emituju drugo zračenje koje ne daje bljeskove u cink sulfidu ZnS. Stoga je cink sulfidno sito zamijenjeno Geigerovim brojačem. Njegovo djelovanje temelji se na činjenici da nuklearna čestica koja leti u protujonizira plin u njemu. Kao rezultat, u krugu brojača pojavljuje se strujni impuls (za više detalja o Geigerovom brojaču, pogledajte str. 130).
Kada je ozračen a-čestice ploča od berilija, bora, litijuma, kako je iskustvo pokazalo, nastaje neka vrsta zračenja, što uzrokuje slaba pražnjenja Geigerovog brojača. Berilijum je davao posebno jako zračenje. Ove berilijum zraci su imali ogroman prodorni efekat: olovna ploča debljine 2 cm smanjila je njihov intenzitet za samo 14%.
Bothe i Becker su sugerirali da su berilijumski zraci veoma tvrdi g-quanta. Apsorpcijom u olovu utvrđeno je da je njihova energija 7 MeV. Ali energija a-čestica je bila 5,25 MeV. Odakle dolazi do povećanja energije?
Godine 1931. Irene i Frederic Joliot-Curie. Stavljajući listove parafina umjesto olovnih ploča, otkrili su da se iz parafina emituju protoni pod djelovanjem berilijumskih zraka, čiji je maksimalni domet u zraku bio 26 cm.Ovaj raspon je odgovarao energiji protona od 4,5 MeV.
Parafini su zasićeni ugljovodonicima opšta formula C n H 2 n+2 . U njima veliki broj atomi vodonika. Pojavu protona pri zračenju parafina berilijumskim zrakama su Curies tumačili kao rezultat Comptonovo rasipanje g-kvanta na protonima - jezgra atoma vodika. Proton trzanja se kreće naprijed kada se rasprši g kvant se reflektuje nazad, θ
= π
. Odavde ![]() gdje m str je masa protona, λ
0 je talasna dužina berilija g-quanta. Energija E nokautiranog protona trebao bi biti jednak gubitku energije g-kvantni, (18.6)
gdje m str je masa protona, λ
0 je talasna dužina berilija g-quanta. Energija E nokautiranog protona trebao bi biti jednak gubitku energije g-kvantni, (18.6)
Pretpostavimo to 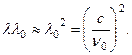 Onda
Onda 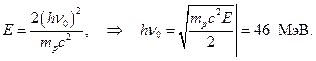
Dakle, energija berilija g-kvanta, izračunato iz apsorpcije u olovu, 7 MeV, iz energije protona izbačenih iz parafina - 46-48 MeV. Štaviše, ispostavilo se da α -čestice sa energijom od 5,25 MeV nokautiraju g-kvant sa energijom 46-48 MeV!
Godine 1932. uključen je u proučavanje prirode berilijumskih zraka. James Chadwick. Shema njegove instalacije praktički se nije razlikovala od sheme Bothea i Beckera, samo je umjesto Geigerovog brojača, on, kao i Curie, koristio jonizacijsku komoru. Chadwick je istraživao raspršivanje berilijumskih zraka ne samo parafinom, već i drugim supstancama. Energija g-kvanti mjereni iz energije jezgara azota su se pokazali jednaki hν= 150 MeV.
Dakle, hipoteza prema kojoj su berilijumski zraci g-kvanta, dovelo je do kontradiktornih rezultata. Ovisno o metodi mjerenja, energija g-kvanta je bio različit i iznosio je 7, 48, 150 MeV. Ovo je dokazalo netačnost ove hipoteze.
Iste 1932. Chadwick je došao do zaključka da je berilijumsko zračenje fluks neutralnih čestica koju je nazvao neutroni. Simbol za neutrone je . Nuklearna reakcija proizvodnje neutrona može se zapisati na sljedeći način:
![]() reakcija otkrića neutrona, 1930-32 .
(18.7)
reakcija otkrića neutrona, 1930-32 .
(18.7)
Chadwick je također napravio prva mjerenja mase neutrona. Ispostavilo se da je masa neutrona bliska masi protona. Tačna vrijednost mase neutrona dobivena je iz ravnoteže mase različitih nuklearnih reakcija koje uključuju neutrone.
5. Svojstva neutrona. slobodni neutron - nestabilna elementarna čestica, koji se raspada na proton, elektron i elektronski antineutrino. ![]() (18.8)
(18.8)
Srednji životni vijek neutrona τ ≈ 16 minuta. Masa neutrona je nešto veća od mase protona i jeste m n = 1838 ja\u003d 1,6760 10 -27 kg. Spin neutrona je ħç 2. Stoga su neutroni, poput elektrona i protona, opisani Fermi-Dirac statistika.
Odnos spin magnetnih momenata protona i neutrona je
M p cM n = - 3ç
2. "Minus" znači da su smjerovi intrinzičnih mehaničkih i magnetnih momenata neutrona su suprotne.
Velika prodorna moć neutrona je posljedica njihovog nedostatka električnog naboja. Neutroni praktički ne stupaju u interakciju s elektronskim omotačima atoma i, za razliku od a-čestice i protoni se ne odbijaju od jezgara. Stoga, čak i pri niskim energijama, neutroni mogu doći blizu atomskih jezgri i biti zarobljeni od njih.
Za registraciju brzih neutrona koriste se njihovi elastični sudari sa jezgrima vodika. Zbog praktične jednakosti masa protona i neutrona, prilikom elastičnog udara neutrona sa stacionarnim protonom, većina kinetičke energije neutrona se prenosi na potonji. Kao rezultat toga, neutron se praktično zaustavlja, a proton se kreće u istom smjeru s energijom bliskom početnoj energiji neutrona. Usput, proton proizvodi intenzivnu jonizaciju i stoga ga može registrovati jonizaciona komora, Geigerov brojač ili komora za oblake.
Nakon nekoliko uzastopnih sudara s atomskim jezgrama, brzi neutroni odustaju od svog viška energije i nakon toga izvode haotično kretanje toplinskim brzinama. Za takve termičke neutrone, gore opisana metoda registracije raspršivanjem na jezgrima atoma vodika nije prikladna. U ovom slučaju se koriste nuklearne reakcije u kojima neutron, koji prodire u jezgro, dovodi do bijega iz potonjeg. ačestice visoke energije. Na primjer, ![]() (18.10)
(18.10)
6. Problem strukture jezgra. Do početka 30-ih godina XX veka. Otkriveni su sljedeći strukturni elementi atoma: elektron, 1897, Thomson; proton, 1919. Rutherford;
neutron, 1932 Chadwick. Otkriće radioaktivnosti i promatranje prvih nuklearnih reakcija učinili su hitnim pitanje: kako je uređeno atomsko jezgro?
Prije svega, postalo je očito da se jezgro atoma ne može predstaviti kao lopta napravljena od nekih nepomičnih nuklearnih cigli. Jezgro atoma je veoma mali volumen prostora u kojem se kreću nuklearni elementi. To jest, to je sistem nuklearnih objekata koji se kreću i međusobno djeluju prema nekim još nepoznatim zakonima.
Prije svega, trebalo je odgovoriti na pitanje: od kojih se čestica sastoji jezgro. Istorijski gledano, razmatrane su dvije opcije: protonsko-elektronska i proton-neutronska jezgra.
a.Protonsko-elektronsko jezgro. Prije otkrića neutrona 1930 Paul Dirac analizirao je Prautovu ideju da su svi hemijski elementi sastavljeni od vodonika. Primijenjena na problem strukture jezgra, ova ideja se svodila na činjenicu da se sva jezgra elemenata sastoje od jezgara atoma vodika, odnosno od protona. (Izotop vodika deuterijum otkriven je tek 2 godine kasnije). Ali to znači da serijski broj elementa u periodnom sistemu mora biti jednak njegovom masenom broju. Ali takvih elemenata u tabeli nema. Helijum već ima serijski broj Z= 2 i maseni broj ALI= 4. Kao da su od 4 protona u jezgru 2 neutralizovana. Može se pretpostaviti da jezgro helija sadrži 4 protona i 2 elektrona. Ali u ovom slučaju, postoje kontradikcije sa Heisenbergovim principom nesigurnosti. Zaista, nesigurnost impulsa u jezgru, izražena iz relacije nesigurnosti za koordinatni impuls je: (18.11)
Ali nesigurnost koordinate Δ X ne može biti veći od polumjera jezgra, najmanje Δ X≈ r 0 . Iz eksperimenata Rutherforda 1909 r 0 ≈ 10 –15 m. Impuls elektrona u jezgru ne može biti manji od nesigurnosti impulsa, ![]() i njegovu minimalnu brzinu iz relativističke formule (18.12)
i njegovu minimalnu brzinu iz relativističke formule (18.12)
Evo ja je masa mirovanja elektrona. Nakon proračuna dobijamo v = 0,99998c, gdje With je brzina svjetlosti. Izračunato po relativističkoj formuli kinetička energija elektron u jezgru je 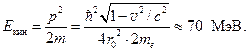
Ali elektroni emitovani iz jezgra na β -raspada, imaju energiju unutar 10 MeV. Za tako upečatljivu nesklad je vrlo teško naći uvjerljivo objašnjenje.
Druga poteškoća protonsko-elektronskog modela jezgra se zove azotna katastrofa. Njegova suština je sljedeća.
Iz hiperfinog cijepanja atomskih spektra bilo je moguće izračunati magnetni moment atomska jezgra. Ispostavilo se da je oko 1000 puta manji od spin magnetskog momenta elektrona. Ako postoji paran broj elektrona u jezgru, onda se tako mali magnetni moment jezgra može objasniti činjenicom da elektroni u jezgru formiraju parove sa suprotnim spinovima, pa je magnetni moment jezgra zbir momenti protona. A magnetski moment protona je 658 puta manji od momenta elektrona.
Ali u jezgru atoma dušika mora biti 14 protona i 7 elektrona. Ako 6 elektrona formira parove sa suprotnim spinovima, onda jedan elektron ostaje nesparen. Ovaj nespareni elektron treba da obezbedi jezgru dušika isti magnetni moment kakav ima, odnosno 1000 puta veći od jezgara sa parnim brojem elektrona. Ali ovo nije. Magnetski moment jezgra dušika je istog reda kao i kod drugih jezgara.
b.Proton-neutronsko jezgro. Manje od šest mjeseci nakon otkrića neutrona, gotovo istovremeno i nezavisno jedan od drugog Dmitrij Ivanenko i Werner Heisenberg predložio proton-neutron sastav jezgra. Proton-neutronski model jezgra razvijen kasnije odlično se slaže s eksperimentom i sada je općenito prihvaćen. Prema ovom modelu, jezgro atoma sadrži Z protone i A-Z neutroni. Evo Z- serijski broj elementa u periodnom sistemu. Core charge q= Ze +, dakle broj Zčesto zvao broj naplate. vrijednost ALI pozvao maseni broj. Ovo je cijeli broj jednak atomskoj masi elementa izraženoj u ugljičnim jedinicama i zaokružen na najbliži cijeli broj. Protoni i neutroni u jezgru se nazivaju nukleoni(od lat. jezgro- jezgro). Time se naglašava da su proton i neutron u sastavu jezgra jedna te ista čestica u različitim stanjima. Masovni broj ALI je broj nukleona u jezgru. Ovisno o odnosu između broja protona i neutrona u jezgrima, postoje izotopi, izobare i izotoni.
izotopi(od grčkog isos - jednak, topos - mjesto) - jezgre koje sadrže isti broj protona, odnosno imaju isti broj Z, i različit broj neutrona. Svi izotopi su smešteni u jednu ćeliju periodnog sistema i predstavljaju varijante jednog hemijski element. Izotopi se razlikuju po broju N neutrona u jezgru. Na primjer, izotopi vodonika:
Protium, , nukleus-proton, Z = 1, A = 1, N = A–Z= 0, nema neutrona.
Deuterijum, , jezgro-deuteron, Z = 1, A = 2, N= 1, jedan neutron.
Tricijum, , jezgro tritona, Z = 1, A = 3, N= 2, dva neutrona.
Izotopi helijuma:
, Z= 2 (dva protona), A = 3, N= 1 (jedan neutron), stabilan.
, Z = 2, A = 4, N= 2 (dva neutrona), stabilno.
, Z = 2, A = 6, N= 4 (četiri neutrona), nestabilno.
, Z = 2, A = 8, N= 6 (šest neutrona), nestabilno.
Trenutno poznati elementi imaju broj Z dostiže približno 105. Ovaj broj elemenata čini približno 1500 poznatih izotopa. Prosjek po artiklu
14 izotopa. Od toga 1 ç
5 - stabilan i 4 ç
5 - nestabilno.
Izotopi istog hemijskog elementa imaju istu hemikaliju i gotovo identičnu fizička svojstva. Stoga je odvajanje izotopa složen fizičko-hemijski problem. Izotopi vodonika se najviše razlikuju.
izobare(od izos- i grčki baros- gravitacija) - jezgra sa istim masenim brojem ALI. Na primjer, tricij i helijum. Imaju 3 nukleona, ali je odnos između protona i neutrona drugačiji. tricijum Z = 1, N= 2, za helijum Z = 2, N = 1.
izotoni su jezgra sa istim brojem neutrona. Poput izobare, izotoni su jezgra različitih hemijskih elemenata. Na primjer, jezgre i sadrže 3 neutrona.
Riječi izobare i izotoni koristi se mnogo rjeđe od te riječi izotopi.
1. Veličine jezgra određena na tri načina: raspršivanjem na jezgri brzih elektrona, proučavanjem spektra mezoatomi i difrakciju na jezgrima neutrona.
a. Rasipanje na jezgrima brzih elektrona omogućava vam da odredite električni radijus jezgra R email Elektroni, čija energija mora biti najmanje 100 MeV, doživljavaju elektromagnetsku, ali ne nuklearnu interakciju s jezgrom. Stoga se na osnovu njihovog raspršenja može suditi samo o raspodjeli protona u jezgru.
b. Spektri mezoatoma , odnosno atomi u kojima je zamijenjen jedan od elektrona mion. Muon µ - elementarna čestica, njen naboj jednak naboju elektrona, a masa je 207 puta veća, m= 207ja. Kao i elektron, mion ne učestvuje u nuklearnim interakcijama. Spektri mezoatoma daju više informacija o strukturi jezgra nego spektri običnih atoma, budući da se mion, zbog svoje veće mase, kreće 207 puta bliže jezgru od elektrona. Mion provodi relativno primjetno vrijeme čak i unutar jezgra.
in. Difrakcija na neutronskim jezgrama sa energijom reda od 20 MeV ima prednost koju doživljavaju neutroni nuklearna interakcija sa jezgrom. Radijus ove interakcije je veoma mali. Stoga se neutroni primjetno difraktiraju na jezgru, odnosno odstupaju od pravolinijskog kretanja, samo lete vrlo blizu jezgra i unutar samog jezgra. Iz širine difrakcionog maksimuma, koji formiraju neutroni koji su prošli izvan i unutar jezgra, može se procijeniti i veličina i stepen transparentnosti jezgra za neutrone.
Difrakcija neutrona na jezgrama omogućava određivanje radijusa područja u kojem djeluju nuklearne sile privlačenja. U stvari, ovo je područje u kojem su koncentrisani nukleoni jezgra. Iz eksperimenata proizlazi da polumjer jezgra je proporcionalan kubnom korijenu broja A nukleona koji se nalaze u njemu, ![]() m. (19.1)
m. (19.1)
Izračunajmo koncentraciju nukleona u jezgru. Za ovo, maseni broj A mora se podijeliti sa zapreminom jezgra. .
Množenje sa masom jednog nukleona m str= 1,67·10 -27 kg, dobijamo srednju gustinu ρ nuklearne supstance. .
Gustoća nuklearne materije ne zavisi od broja nukleona u jezgru. Ista je u svim jezgrima i ogromna je vrijednost. Jedan kubni milimetar takve supstance imao bi masu od 200.000 tona. To je gustina ρ nuklearne materije je konstantna, ukazuje na to da su nukleoni u jezgru u smislu pakiranja slični tekućim molekulima. Prosječna zapremina po nukleonu u jezgru ne zavisi od veličine jezgra, kao što prosječna zapremina po molekulu u tekućini ne ovisi o veličini kapi.
2. Nuklearne snage. Rutherfordovi eksperimenti iz 1909. disperzijom a-čestice su pokazale da je Coulombov zakon ispunjen u mikrokosmosu do veličine jezgara. Ali to znači da ogromne sile odbijanja moraju djelovati između protona u jezgri. Nađimo veličinu ovih sila za dva protona u jezgri helijuma. Broj nukleona u jezgri helijuma. Iz formule (19.1) poluprečnik jezgra helijuma R\u003d 1,25 10 -15 4 1/3 \u003d 2 10 -15 m. Pretpostavljamo da su protoni na krajevima prečnika jezgra 2 R= 4 10 -15 m Tada je odbojna sila između njih:
Zašto se jezgro, uprkos tako velikom međusobnom odbijanju protona, ne raspršuje na sastavne dijelove?
Eksperimentalno uočena stabilnost jezgara znači da pored električne sile odbijanja između nuklearnih čestica, postoje i sile privlačenja. To ne može biti snaga gravitaciono privlačenje. Njih potencijalna energija
– Gmp/2R= – 6,7 10 -11 (1,7 10 -27) 2 /4 10 -15 = – 5 10 -50 J, dok je potencijalna energija odbijanja protona (1/4 πε
0)/(e 2 /2R) ≈ 6 10 -14 J! Ovo je 36 redova veličine više.
Shodno tome, u slučaju atomskih jezgara, suočeni smo sa novom, posebnom vrstom interakcije. Ova interakcija se zove jaka i snage koje na to reaguju - nuklearna. Kompletna teorija nuklearne snage još nije izgrađen, iako je postigao veliki uspjeh u objašnjavanju i predviđanju mnogih eksperimentalnih činjenica. Glavne moderne ideje o nuklearnim silama su sljedeće:
a. Postojanje nuklearnog polja . Kao što su električne sile uslovljene postojanjem materijala elektromagnetno polje, nuklearne sile nastaju zbog postojanja materijalnog nuklearnog polja. Izvori EM polja su bilo koje električno nabijene čestice materije - elektroni, protoni, itd. Izvori nuklearnog polja su nukleoni - protoni i neutroni. Nukleoni imaju specifičnost nuklearno punjenje.
b. Naboj nezavisnost nuklearnih snaga . nuklearno punjenje nukleoni su isti po veličini i predznaku. Ne zavisi od toga da li nukleon ima električni naboj (proton) ili ne (neutron). Uz pomoć nuklearnih sila, neutron s neutronom, neutron s protonom i dva protona djeluju na isti način.
in. Nuklearne snage kratkog dometa. U poređenju sa Kulonovom i gravitacionim silama, koje se smanjuju proporcionalno kvadratu udaljenosti između tačkastih izvora (naelektrisanja, masa), nuklearne sile se smanjuju mnogo brže. Oni su veoma veliki na udaljenostima reda prečnika jezgra, ali su već na udaljenosti od tri prečnika praktički nevidljivi. Kada se nukleoni približavaju jedan drugome, privlačnost se zamjenjuje odbijanjem.
G. Nuklearne snage nisu centralne. električno polje okolo tačka naboj a gravitaciono polje oko masa tačaka je centralno simetrično. Nuklearno polje pojedinačnog nukleona nema centralnu simetriju. To je zbog prisustva spin mehaničkih i magnetnih momenata u nukleonima. Interakcija između nukleona zavisi od orijentacije njihovih spinova. Na primjer, neutron i proton se drže zajedno u jezgru teškog vodika - deuterona - samo ako su njihovi mehanički okreti međusobno paralelni.
d. Svojstvo zasićenja nuklearnih sila. Kao što je poznato, energija interakcije dva električna naboja ne zavisi od prisustva trećeg ( princip superpozicije). Sa uvođenjem svakog sljedećeg naelektrisanja, energija sistema raste proporcionalno količini unesenog naboja. Svaki električni naboj može komunicirati s neograničenim brojem drugih naboja. Nema zasićenja električnih sila.
Zasićenost nuklearnih sila je da svaki nukleon u jezgri može komunicirati s ograničenim brojem nukleona. Ovo je donekle slično hemijskoj valenciji elemenata. Na primjer, atom ugljika C može se kombinirati sa četiri atoma vodika H i formirati molekul metana CH 4 , sa dva atoma kisika (CO 2 ) i tako dalje. Ne postoji takva raznolikost među nukleonima kao među hemijskim elementima. Stoga se zasićenje nuklearnih sila očituje u činjenici da specifična energija vezivanja(energija po nukleonu) u jezgru se ne povećava sa povećanjem broja nukleona u jezgru, već ostaje približno konstantna.
3. Masa jezgra razlikuje se od mase atoma hemijskih elemenata samo po vrijednosti mase elektronske ljuske. U periodnom sistemu, mase atoma su izražene u jedinicama atomske mase a.m.u. Jedan a.m.u jednako 1 ç 12 masa atoma ugljika, 1 amu = 1,66 10 -27 kg. Pošto se u jezgru glavnog izotopa ugljika (99% na Zemlji) nalazi 12 nukleona, jasno je da a.m.u. blizu mase jednog nukleona.
Masa jednog elektrona ja= 5,5 10 -4 amu Odnos mase elektronske ljuske Zme na masu atoma je za vodonik ja/m() = 5,5 10 -4 ç 1,008 = 0,0005, odnosno 0,05%. Za ostale atome ovaj omjer je još manji, jer broj nukleona u jezgri raste brže od broja elektrona u atomu. u atomu uranijuma Zme/m() = 0,0002 (0,02%). Stoga, u slučajevima kada proračuni zahtijevaju tačnost ne više od četiri znamenke, masa atoma kemijskog elementa iz periodnog sistema može se uzeti kao masa jezgra.
Kao što je nuklearna fizika dotad nepoznati izotopi, uključujući i one koji nisu postojali u prirodi, otkriveni su i sintetizirani nuklearnim reakcijama.
Hemijske metode mjerenja atomske mase vještački izotopi pokazali su se malo efikasnim. Godine 1919 Francis Aston konstrukcije maseni spektrograf- uređaj sposoban da odvoji ione prema njihovoj masi sa velikom preciznošću.
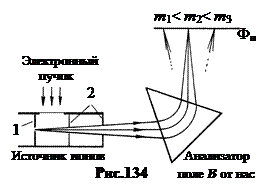 Svaki maseni spektrograf uključuje tri glavna dijela: jonski izvor, analizator i prijemnik. Ioni se formiraju u izvoru jona i formira se slabo divergentan snop. U analizatoru je snop podijeljen na nekoliko snopova, koji se razlikuju po ionskim masama i fokusirani su na površinu prijemnog uređaja - fotografske ploče. Slika 134 prikazuje dijagram jednog od ovih masenih spektrografa. Mlaz pare ispitivanog elementa ulazi u otvor 1 jonskog izvora i ionizira se snopom elektrona koji probija kroz njega. Nastali ioni se ubrzavaju i kolimiraju dijafragmama 2.
Svaki maseni spektrograf uključuje tri glavna dijela: jonski izvor, analizator i prijemnik. Ioni se formiraju u izvoru jona i formira se slabo divergentan snop. U analizatoru je snop podijeljen na nekoliko snopova, koji se razlikuju po ionskim masama i fokusirani su na površinu prijemnog uređaja - fotografske ploče. Slika 134 prikazuje dijagram jednog od ovih masenih spektrografa. Mlaz pare ispitivanog elementa ulazi u otvor 1 jonskog izvora i ionizira se snopom elektrona koji probija kroz njega. Nastali ioni se ubrzavaju i kolimiraju dijafragmama 2.
Analizator je sektorsko magnetno polje AT usmjeren okomito na ravan figure. U ovom magnetnom polju, ioni koji se emituju iz izvora pod neznatno drugačijim uglovima se odbijaju i fokusiraju. Radijus kružnice po kojoj se ion kreće u sektoru je veći, što je manji njegov specifični naboj, ![]() . (19.2)
. (19.2)
(Vidi električna energija, §14). Evo v je brzina jona, e/m je njegov specifičan naboj.
Kao rezultat toga, joni istog izotopa padaju na isto mjesto na fotografskoj ploči Fp, formirajući na njoj usku liniju, okomitu na ravan slike. Maseni spektrografi omogućavaju mjerenje masa izotopa s relativnom greškom od 10 -5 ¸10 -6 .
Ako fotografsku ploču zamijenimo Faradejevom čašicom i izmjerimo ionsku struju, možemo odrediti intenzitet snopa jona i pronaći relativnu količinu izotopa u mješavini jona. Takav uređaj se zove maseni spektrometar.
4 . Defekt mase i nuklearna energija vezivanja. Masa jezgra m i je uvijek manji od masa njegovih sastavnih nukleona Zm p+ (A-Z)m n.D vrijednost m = Zm p + (A-Z)m n –m i (19.3)
 pozvao defekt mase. Evo m str,m n,m i i su mase mirovanja protona, neutrona i jezgra.
pozvao defekt mase. Evo m str,m n,m i i su mase mirovanja protona, neutrona i jezgra.
Činjenica je da kada se slobodni nukleoni spoje, energija se oslobađa u obliku kvanta EM zračenja, koji odnose masu Δ m. Energija veze E broj nukleona u jezgru se izračunava po formuli E sv = D mc 2 , (19.4)
gdje c je brzina svjetlosti u vakuumu. Da bi se jezgro uništilo, odnosno podijelilo na nukleone, potrebno je prenijeti energiju E, ne manje od energije vezivanja, E≥ E Sv.
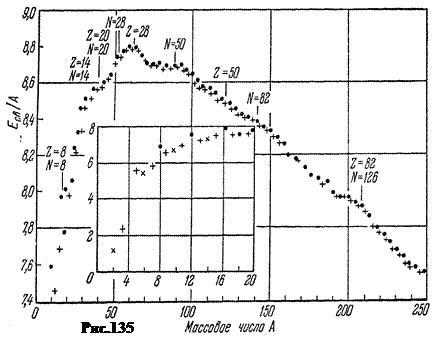
Indikativno za procjenu stabilnosti jezgara specifična energija vezivanja E Sv. cA, odnosno energija po 1 nukleonu. Slika 135 prikazuje eksperimentalnu ovisnost njegovog modula o masenom broju A stabilna jezgra u MeV/nukleonu. Crne tačke se odnose na parno-parna jezgra, u kojima je broj protona Z i broj neutrona A-Z- parni brojevi. Ravni križevi - do jezgara sa neparom A. Kosi krstovi se odnose na neparno-neparna jezgra.
Umetak prikazuje specifičnu energiju vezivanja za laka jezgra, počevši od deuterijuma ( A= 2) i završava neonskom ( A = 20).
U prvoj aproksimaciji, specifična energija vezivanja varira od 7,4 MeV ç nukleon u deuterijumu do 8,8 MeV ç nukleon kod gvožđa, odnosno unutar oko 1,4 MeV ê nukleon. Ali priroda promjene je indikativna. Od deuterijuma do gvožđa, veličina E Sv. cA raste, dostižući maksimum na A= 56, odnosno u oblasti jezgara gvožđa. Nakon gvožđa sa rastom A specifična energija vezivanja pada na 7,5 MeV ç nukleon na kraju periodnog sistema.
Maksimum krivulje odgovara najstabilnijim jezgrama. To uključuje jezgra E Sv. cA> 8,6 MeV ç nukleon počevši od parno-parnog kalcijuma i završavajući sa parno-parnim olovom sa E Sv. cA= 7,9 MeV ç nukleon. Najlakša jezgra sa A < 20 энергетически выгодно сливаться друг с другом в более тяжёлые с выделением fuzijska energija. Za najteže jezgre sa A> 207, naprotiv, koristan je proces fisije na fragmente, koji se nastavlja oslobađanjem energije, što se naziva atomski.
Zanimljivo je da su jezgra nekih elemenata na slici 135 nešto viša od toka krive. To su jezgre u kojima je broj protona Z ili broj neutrona N=A-Z jednaka tzv magični brojevi: 2, 8, 20, 28, 50, 82, 126. Ova jezgra imaju povećanu snagu u poređenju sa svojim susjedima. Dvostruko magična jezgra su posebno jaka, od kojih je jezgro toliko jako da čak i tokom raspada teških jezgara izleti netaknuto ( a-čestica).
5 . Spinovi jezgara. Kao što je već pomenuto u §18, protoni i neutroni imaju spin mehaničke momente, iste kao i elektroni. U projekciji na fizičku osu, spin mehanički momenti protona, neutrona i elektrona mogu poprimiti vrijednosti L sz = ± ћç 2.
Sve metode za eksperimentalno određivanje spinskih momenata Ls protoni, neutroni i jezgra su zasnovani na povezanosti mehaničkih spinskih momenata Ls sa magnetnim spin momentima gospođa. Poznavajući odnos između Ls i gospođa za ove čestice, prema veličini i karakteristikama magnetnog momenta M s, moguće je ustanoviti mehanički Ls.
Najranije eksperimentalne metode određivanje magnetnih spinskih momenata M s bili su zasnovani na proučavanju hiperfine strukture optičkih spektra vodonika (proton spin), deuterijuma (nuklearni spin proton + neutron → neutron spin) i drugih atoma. Kasnije su počeli da proučavaju ponašanje jezgara u magnetskom polju radiospektroskopijom. Spinovi jezgara kratkoživućih izotopa određuju se nuklearne reakcije na osnovu zakona održanja, spinovi pobuđenih jezgara - prema emisijama koje oni emituju g-zračenje.
Eksperimenti pokazuju da su momenti spina jezgra (mehanički, odnosno magnetni) jednaki geometrijskim sumama momenata nukleona koji čine jezgro. Treba imati na umu da je ukupni impuls svakog nukleona zbir spinskih i orbitalnih (odnosno povezanih s kretanjem nukleona duž određene "orbite" u jezgru) momenata. Orbitalni mehanički moment nukleona u jezgru, za razliku od spin momenta, može imati samo cjelobrojne vrijednosti. Ako a L sz= ± ћç 2, onda L lz =± nć, gdje n je cijeli broj. Nabrojimo glavne eksperimentalne činjenice o nuklearnim spinovima.
a. Spin mehaničke momente jezgara sa parom A je uvek ceo broj, sa neparnim A - poluceo broj . Na primjer, spin deuterona L sz = ± ( ћç 2+ћç 2) = ± ћ . Spinovi neutrona i protona u jezgri deuterija su paralelni.
b. Spin mehanički momenti svih parno-parnih jezgara u osnovnim stanjima jednaki su nuli . Pošto su spinovi u paru proton-neutron deuterijuma paralelni, ostaje da se zaključi da antiparalelni spinovi mogu biti samo u parovima istog imena, odnosno za proton-proton i neutron-neutron.
in. Spin mehanički momenti preostalih stabilnih jezgara ne prelaze 9ћç 2, odnosno vrlo su male u odnosu na zbir apsolutnih vrijednosti spinskih i orbitalnih momenata svih čestica koje ulaze u jezgro. Ovo sugerira da je većina nukleona čvrsto vezana u zatvorene ljuske koje imaju nula ukupni impuls i ne učestvuju u stvaranju nuklearnog spina.
6. Magnetski momenti jezgara. Svako jezgro sa spinom različitom od nule ima magnetni moment M karakterizira interakciju jezgra sa jednoličnim vanjskim magnetskim poljem B . Smjer magnetskog momenta M mikročestica se poklapa sa smjerom mehaničkog momenta spina Ls do potpisivanja. M s = g Ls (19.5)
Evo g – giromagnetski odnos. Pozitivan je za proton (vektori gospođa i Ls poklapaju, za neutron je negativan (vektori gospođa i Ls su suprotne). Postoji mnogo metoda za određivanje magnetnih momenata jezgara i nukleona. Razmotrimo tri od njih.
a. Proučavanje hiperfine strukture optičkih spektra. Ova metoda je već spomenuta u prethodnom paragrafu. Dodajmo samo da je na taj način bilo moguće utvrditi da su nuklearni magnetni momenti tri reda veličine manji od spin magnetnog momenta elektrona i imaju red nuklearni magneton M i = ećç 2m str= 5,05 10 -27 J ç Tl. Zbog toga hiperfino cijepanje spektralne linije tri reda veličine manje fine strukture, zbog interakcije spinskog momenta elektrona sa orbitalnim.
 b. Metoda nuklearne magnetne rezonancije
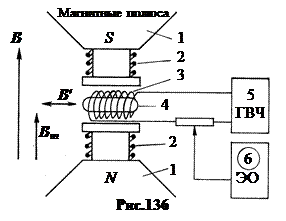
leži u činjenici da se spin jezgra smještenog u jakom konstantnom magnetskom polju može „prevrnuti“ pod djelovanjem slabog visokofrekventnog polja određene rezonantne frekvencije. Instalacioni dijagram je prikazan na sl.136.
b. Metoda nuklearne magnetne rezonancije
leži u činjenici da se spin jezgra smještenog u jakom konstantnom magnetskom polju može „prevrnuti“ pod djelovanjem slabog visokofrekventnog polja određene rezonantne frekvencije. Instalacioni dijagram je prikazan na sl.136.
 Tri magnetna polja. Prvo, snažno trajno magnetno polje B≈ 1 T koji stvaraju magneti 1. Svrha magnetnog polja B
je prekid veze između nuklearnog magnetskog momenta i elektronska školjka, stvaranje hiperfinog Zeemanovog cijepanja nuklearnih nivoa. Drugo, visokofrekventno polje koje stvara zavojnica 3 iz generatora 5 B
"
, usmjeren okomito B
. Frekvencija polja B
"
može promijeniti. Svrha ovog polja je rezonantno lomljenje nuklearnog spina. Treće, modulirajuće promjenjivo polje koje stvaraju zavojnice 2 B
m, usmjerena paralelno B
i ima nisku konstantnu frekvenciju od 50 Hz. Svrha ovog polja je da ponovi okretanje nuklearnog spina 50 puta u sekundi kako bi se dobila stacionarna slika na osciloskopu 6 u rezonanciji. Mjerenjem energije koju je uzorak apsorbirao pri rezonanciji, indukcija jakog magnetskog polja B
i frekvencije generatora, moguće je odrediti magnetni moment jezgara na savremenim instalacijama sa tačnošću od 6 decimala.
Tri magnetna polja. Prvo, snažno trajno magnetno polje B≈ 1 T koji stvaraju magneti 1. Svrha magnetnog polja B
je prekid veze između nuklearnog magnetskog momenta i elektronska školjka, stvaranje hiperfinog Zeemanovog cijepanja nuklearnih nivoa. Drugo, visokofrekventno polje koje stvara zavojnica 3 iz generatora 5 B
"
, usmjeren okomito B
. Frekvencija polja B
"
može promijeniti. Svrha ovog polja je rezonantno lomljenje nuklearnog spina. Treće, modulirajuće promjenjivo polje koje stvaraju zavojnice 2 B
m, usmjerena paralelno B
i ima nisku konstantnu frekvenciju od 50 Hz. Svrha ovog polja je da ponovi okretanje nuklearnog spina 50 puta u sekundi kako bi se dobila stacionarna slika na osciloskopu 6 u rezonanciji. Mjerenjem energije koju je uzorak apsorbirao pri rezonanciji, indukcija jakog magnetskog polja B
i frekvencije generatora, moguće je odrediti magnetni moment jezgara na savremenim instalacijama sa tačnošću od 6 decimala.
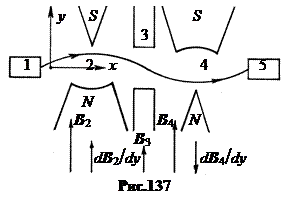
in. Metoda Isidora Rabija, 1937 Metoda nuklearne magnetne rezonancije ne može izmjeriti magnetni moment neutrona, jer se neutroni ne drže u ampuli, već postoje samo u snopovima. Šema Rabi metode je prikazana na slici 137. Snop neutrona iz izvora 1 sukcesivno prolazi kroz dva vrlo nehomogena magnetna polja 2 i 4 sa suprotno usmjerenim gradijentima dBcdy. U nehomogenom magnetnom polju, putanja čestice sa spinskim magnetnim momentom je zakrivljena duž ili protiv gradijenta, u zavisnosti od orijentacije magnetnog momenta. Prvo magnetno polje 2 savija putanju neutrona, drugo polje 4 ih fokusira na detektor 5. Ako se sada, u razmak 3 između polja, uključi kombinacija konstantno jakih homogenih i slabih visokofrekventnih magnetnih polja iz prethodnu šemu, tada će se spin neutrona preokrenuti u rezonanciji. Kao rezultat, ovi neutroni neće biti fokusirani drugim nehomogenim poljem 4 i neće pasti u detektor 5. Zbog toga će doći do oštrog pada u grafu intenziteta brojanja u detektoru u zavisnosti od frekvencije visoke frekvencije. -frekventno polje na rezonanciji. Njegov položaj će odrediti veličinu magnetskog momenta neutrona.
Rabi metoda također može koristiti molekularne zrake i odrediti magnetne momente jezgara.
Nabrojimo glavne eksperimentalne činjenice o magnetnim momentima nukleona i atomskih jezgara.
a. Magnetski spin momenti protona Mp i neutrona M n su: Mp= 2,79 M i, M n = –1,91 M i. Evo M i = ehç 2m str= 5,05 10 -27 J ç Tl je nuklearni magneton.
b . Magnetski momenti jezgara sa nultim spinom su nula.
in . Magnetski momenti jezgara sa spinom različitom od nule su reda nuklearnog magnetona.
G. Spin magnetni momenti nukleona nisu aditivni. Na primjer, deuteron se sastoji od protona i neutrona s paralelnim okretajima. Ukupni magnetni moment deuterona bi trebao biti M d = M p + M n= 2,79 M i – 1,91 M i = 0,88 M i. Ali iskustvo daje M d = 0,86 M i. Ova neaditivnost je povezana s necentralnošću sila koje djeluju između nukleona.
7 . Modeli atomskog jezgra. Dosljedna teorija jezgra još nije izgrađena zbog dvije glavne poteškoće: nedovoljnog poznavanja sila koje djeluju između nukleona i glomaznosti kvantni problem mnoga tijela. Na kraju krajeva, jezgro sa masenim brojem A mora biti opisan sistemom koji se sastoji od najmanje A jednačine. Ove poteškoće se mogu djelomično prevazići stvaranjem nuklearnih modela koji omogućavaju da se uz pomoć jednostavnih jednadžbi opiše određeni skup svojstava jezgre.
Razvijeno je desetak modela, od kojih svaki opisuje svoj skup nuklearnih svojstava i svoj raspon fenomena. Razmotrimo dva od njih.
a. model kapanja. Ponuđeno joj je Yakov Frenkel 1937. Jezgro u ovom modelu je upoređeno sa kapljicom tečnosti, pobuđeno jezgro je upoređeno sa zagrejanom kapljicom. Ako je E energija pobuđenog jezgra sa brojem nukleona A, zatim, dodijelivši 3 stepena slobode nukleonima, dobijamo:
![]() . (19.6)
. (19.6)
Na E = 10 MeV T≈ 10 9 K. Emisija neutrona, protona i a-čestice u takvom modelu mogu se protumačiti kao isparavanje jezgra kapi.
Osnova za model kapljice bilo je djelovanje nuklearnih sila kratkog dometa i neovisnost gustoće od masenog broja A. Model kapljice je omogućio da se izvede poluempirijska formula za energiju vezivanja čestica u jezgru i opiše proces fisije teških jezgara.
b. Shell model. Zaprošena je 1951. Maria Goeppert-Mayer. Osnova za model ljuske bila je činjenica postojanja posebno stabilnih jezgara, tzv magično i dvostruko magično.
U ovom modelu smatra se da se nukleoni kreću nezavisno jedan od drugog prosječno centralno simetrično polje. Pretpostavlja se da, kao i u atomu, jezgro ima diskretni nivoi, ispunjen nukleonima, uzimajući u obzir Paulijev princip. Ovi nivoi su grupisani u školjke, od kojih svaki može sadržavati određeni broj nukleona. Potpuno ispunjena ljuska formira stabilno jezgro.
Iz eksperimentalne činjenice postojanja magičnih i dvostruko magičnih jezgara, proizilazi da ispunjene školjke sadrže magični broj nukleona 2, 8, 20, 28, 50, 82, 126. Mnoga magijska jezgra su češća u Univerzumu od njihove ne-magične komšije. Pored dvostruko magičnog (s izuzetkom), ovo uključuje
Model ljuske je matematički dobro razvijen i omogućava da se objasne svojstva magičnih jezgara i susjednih jezgara koje se razlikuju za 1 nukleon (nedostaje ili višak). U ovom modelu, stvarne sile koje djeluju između nukleona zamjenjuju se samokonzistentnim poljem u kojem se nukleoni kreću nezavisno jedan od drugog. Shema izgradnje školjki donekle podsjeća na popunjavanje periodnog sistema, ali je inferiornija od njega po ozbiljnosti.
Rutherfordovi eksperimenti su dokazali da se atom sastoji od malog pozitivno nabijenog jezgra i elektrona koji se okreću oko njega. Ispostavilo se da je u poređenju sa veličinom samog atoma, jezgro izuzetno malo. Jezgro je 100.000 puta manje od atoma.
Ako se atomsko jezgro poveća na veličinu graška, tada će promjer atoma biti jednak visini Ostankino tornja.
Dalja istraživanja su pokazala da je naboj atomskog jezgra jednak proizvodu serijskog broja Z elementa u periodnom sistemu D.I. Mendeljejev dalje elementarnog naboja. To je atomski broj Z određuje broj elektrona u atomu, broj protona u jezgru.

Kada bi se jezgro sastojalo samo od protona, tada bi masa jezgra bilo kojeg kemijskog elementa bila jednaka masi Z protona. Ali u stvari, masa jezgara svih elemenata je mnogo veća. Stoga je 1920. Rutherford sugerirao postojanje električno neutralne čestice. Ova čestica je kasnije otkrivena eksperimentalno. Zvali su je neutron.
1932. predložili su proton-neutronski model atomsko jezgro. Protoni i neutroni se nazivaju nukleoni.
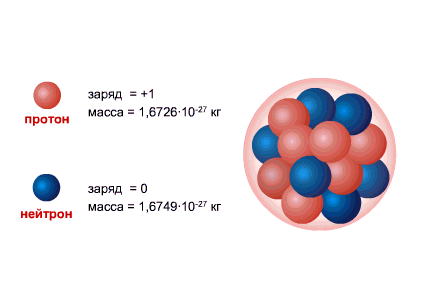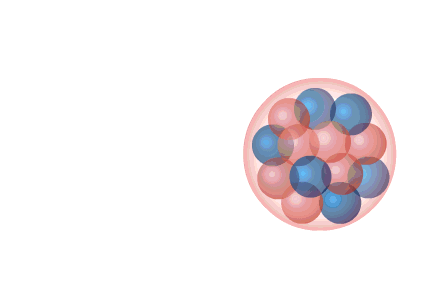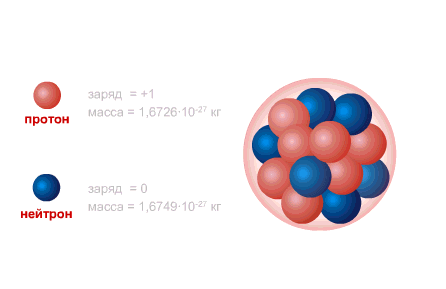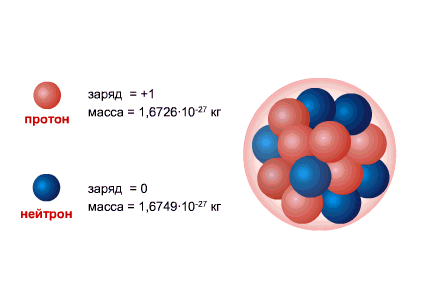
Ukupan broj nukleona (protoni + neutroni) se naziva maseni broj A. Trenutno su za atome hemijskih elemenata prihvaćene sledeće oznake:
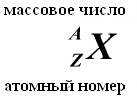

Stabilnost jezgra
Zašto je jezgro stabilno? Kulonove odbojne sile ogromne veličine, oko 230 N, djeluju između protona unutar jezgra, ali se jezgro ne raspada! Razlog stabilnosti je prisustvo sila različite prirode, koje se nazivaju jake interakcije.
Ove sile su 100 puta veće od Coulombovih odbojnih sila. Pojavljuju se samo na udaljenostima od 10-15 m. One su samo sile privlačenja.
Masa jezgra
Mase svih jezgara (osim vodonika) su manje od mase slobodnih protona i neutrona koji ih formiraju. Masovna razlika se zove defekt mase.
Otkriće neutrona odmah je dovelo do promjene ideje o strukturi atomskog jezgra. Hipotezu da jezgro sadrži protone i elektrone, koja je postojala prije otkrića neutrona, većina naučnika nije podržala. Godine 1932., iznenađujuće plodan za izvanredna otkrića, ruski naučnik Dmitrij Dmitrijevič Ivanenko iznio je hipotezu o protonsko-neutronskom modelu jezgra, elektroni u njegovom modelu nisu bili dio jezgra. Nešto kasnije, Heisenberg je izrazio sličan model jezgra. Mora se reći da su ovaj model mnogi naučnici prihvatili skeptično. Činilo im se da je to u suprotnosti sa emisijom elektrona tokom P-raspada. Heisenberg je podsjetio da su ga "najeminentniji fizičari žestoko kritizirali". Ivanenko je uložio mnogo truda kako da uvjeri naučnike u ispravnost svog otkrića, tako i da odbrani svoj prioritet. Ubrzo je protonsko-neutronski model jezgra prepoznat i postao općeprihvaćen, iako jezgro atoma još uvijek sadrži mnoge tajne. Recimo nekoliko riječi o česticama koje čine jezgro atoma. (Treba imati na umu da i protoni i neutroni, prema kvantnoj mehanici, također imaju valna svojstva).
PROTON je jezgro atoma vodonika, njegov naboj je po veličini jednak naboju elektrona i suprotnog predznaka (+e = 1,6 x 10-19 C.), a masa (mp = 1,6726485 ± 0,0000086) x 10-27 kg.
NEUTRON ima naelektrisanje jednako nuli i masu praktično jednaku masi protona (mm = 1,674954 ± 0,000009) x 10-27 kg. 1, Primljeni neutroni i protoni uobičajeno ime nukleoni. Ukupan broj nukleona u jezgru, tj. broj protona i neutrona u jezgru, naziva se maseni broj i označava se slovom A. Broj protona u jezgru označava se sa Z. Zove se atomski broj i također je jednak broju elektrona u spoljašnjoj ljusci atoma. Broj neutrona u jezgru N = A - Z.
Hemijski elementi, na prijedlog supružnika Joliot-Curie, označeni su sa dva indeksa lijevo od oznake elementa: gornji indeks označava maseni broj, donji indeks označava broj protona, na primjer, 13 Al, 11 H. U jezgrima istog hemijskog elementa broj neutrona može biti različit, a broj protona isti. Takve jezgre, koje imaju isti broj protona, ali različit broj neutrona, nazivaju se izotopi. Neki izotopi se ne pojavljuju u prirodi, ali se mogu dobiti u naučnim laboratorijama kao rezultat nuklearnih reakcija.
Atomsko jezgro- centralni dio atom, u kojem je glavni težina(preko 99,9%). Jezgro je pozitivno nabijeno, naboj jezgra određuje hemijski element kojoj pripada atom. Veličina jezgara različitih atoma je nekoliko femtometri, što je više od 10 hiljada puta manje od veličine samog atoma.
Studije atomskih jezgara nuklearna fizika.
Atomsko jezgro se sastoji od nukleoni- pozitivno naelektrisan protona i neutralan neutroni, koji su međusobno povezani pomoću jaka interakcija. Proton i neutron imaju svoj vlastiti ugaoni moment ( nazad), jednak [sn 1] i povezane magnetni moment. Jedini atom koji ne sadrži neutron u jezgru je laki vodonik ( protium).
Atomsko jezgro, koje se smatra klasom čestica sa određenim brojem protona i neutrona, obično se naziva nuklid .
Broj protona u jezgru naziva se njegov broj naplate- ovaj broj je jednak serijskom broju element kojoj pripada atom tabela (periodični sistem elemenata) Mendeljejev. Broj protona u jezgru određuje strukturu elektronska školjka neutralni atom i tako Hemijska svojstva odgovarajući element. Broj neutrona u jezgru naziva se njegovim izotopski broj. Zovu se jezgra sa istim brojem protona i različitim brojem neutrona izotopi. Zovu se jezgre s istim brojem neutrona, ali različitim brojem protona izotoni. Termini izotop i izoton se takođe koriste u vezi sa atomima koji sadrže naznačena jezgra, kao i za karakterizaciju nehemijskih varijanti jednog hemijskog elementa. Ukupan broj nukleona u jezgru naziva se njegovim maseni broj() i približno je jednaka prosječnoj masi atoma, naznačenoj u periodnom sistemu. Zovu se nuklidi s istim masenim brojem, ali različitim protonsko-neutronskim sastavom izobare.
Kao i svaki kvantni sistem, jezgra mogu biti u metastabilnom pobuđenom stanju, au nekim slučajevima životni vijek ovo stanje se računa u godinama. Takva pobuđena stanja jezgara nazivaju se nuklearnih izomera .
Rutherfordovi eksperimenti su dokazali da se atom sastoji od malog pozitivno nabijenog jezgra i elektrona koji se okreću oko njega. Ispostavilo se da je u poređenju sa veličinom samog atoma, jezgro izuzetno malo. Jezgro je 100.000 puta manje od atoma.
Ako se atomsko jezgro poveća na veličinu graška, tada će promjer atoma biti jednak visini Ostankino tornja.
Dalja istraživanja su pokazala da je naboj atomskog jezgra jednak proizvodu serijskog broja Z elementa u periodnom sistemu D.I. Mendeljejev o elementarnom naboju. To je atomski broj Z određuje broj elektrona u atomu, broj protona u jezgru.

Kada bi se jezgro sastojalo samo od protona, tada bi masa jezgra bilo kojeg kemijskog elementa bila jednaka masi Z protona. Ali u stvari, masa jezgara svih elemenata je mnogo veća. Stoga je 1920. Rutherford sugerirao postojanje električno neutralne čestice. Ova čestica je kasnije otkrivena eksperimentalno. Zvali su je neutron.
1932. predložili su proton-neutronski model atomsko jezgro. Protoni i neutroni se nazivaju nukleoni.

Ukupan broj nukleona (protoni + neutroni) se naziva maseni broj A. Trenutno su za atome hemijskih elemenata prihvaćene sledeće oznake:
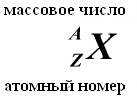

Stabilnost jezgra
Zašto je jezgro stabilno? Kulonove odbojne sile ogromne veličine, oko 230 N, djeluju između protona unutar jezgra, ali se jezgro ne raspada! Razlog stabilnosti je prisustvo sila različite prirode, koje se nazivaju jake interakcije.
Ove sile su 100 puta veće od Coulombovih odbojnih sila. Pojavljuju se samo na udaljenostima od 10-15 m. One su samo sile privlačenja.
"Struktura atomskog jezgra" - Ernest Rutherford (struktura atoma). Možete umreti od nevidljivog. Becquerel Antoine Henri - 1897 "Heroj kratkih ruku" Masovna greška?m ENERGIJA!!! Igor Vasiljevič Kurčatov. Struktura atoma. biološki efekat na organizam. Struktura atomskog jezgra. Radioaktivnost - spontano zračenje (djelovanje soli uranijuma na fotografsku ploču).
"Struktura jezgra atoma" - Nuklearni reaktor. Radioaktivna transformacija atomskih jezgara. Masovni brojevi hemijski elementi. Struktura atoma. Jezgra uranijuma su bombardovana neutronima. Rutherfordov model atoma. Folija od ispitivanog metala. Sastav atomskog jezgra. Rutherfordovi eksperimenti 1. Zrno radijuma stavljeno je u olovnu posudu debelih stijenki.
“Struktura jezgra” fizike” - Proaktinije. Proton-neutronski model atomskog jezgra. Poluživot. Saznajte više o povijesti otkrića neutrona. Broj naplate. radijacije. Koliko nukleona sadrže jezgra. Struktura atomskog jezgra. Nepoznati proizvod. Uređaj. Izotopi. Particle. Neutron. Radijacija. Struktura atoma. Helijumsko jezgro. Novi element.
"Struktura atoma i atomskog jezgra" - Energetski nivo(elektronski sloj). Napišite elektronsku formulu. Raspodjela elektrona po podnivoima. Sastav atoma. Primjeri elektronskih formula atoma. Ciljevi. Elektronski grafički dijagram atoma dušika. Pronalaženje elektrona u atomu. Otvaranje jezgra. Slika orbitala elektrona. Pravila za raspodjelu elektrona na energetskom nivou.
"Sastav atomskog jezgra" - NUKLEARNE SILE - privlačne sile koje vezuju protone i neutrone u jezgru. Broj naboja je jednak naboju jezgra, izražen u elementarnom električnih naboja. Broj punjenja jednak je rednom broju hemijskog elementa. Zadaci. Ne zavisi od prisustva punjenja. Plan lekcije. Opšti oblik osnovne oznake. Sastav atomskog jezgra.
"Sastav jezgra atoma" - Dimenzije atomskih jezgara. Sastav jezgra atoma. Core charge. Proton-neutronski model jezgra. Jezgro atoma hemijskog elementa. Proton i neutron. Jezgro atoma. Radioaktivnost. Grafikon specifične veze nukleona u jezgru. Shema Rutherfordovih eksperimenata. Broj naplate. Svojstva nuklearnih sila. Broj neutrona u jezgru atoma. Otkriće neutrona.
Ukupno ima 7 prezentacija u ovoj temi






