Energetski prijelazi u atomu
Kao rukopis
fizika
Bilješke sa predavanja
(7. dio. Atomska fizika. laseri)
Za studente smera 230400
« informacioni sistemi i tehnologije"
Elektronski obrazovni resurs
Sastavio: Kandidat fizičko-matematičkih nauka, vanredni profesor V.V. Konovalenko
Zapisnik broj 1 od 04.09.2013
Atomska fizika
Atom vodonika.
Prisjetite se toga sistem koji se sastoji od fiksnog jezgra i elektrona koji se kreće oko njega naziva se atom sličan vodiku ili jon sličan vodoniku.
Polje u kojem se elektron kreće je centralno simetrično. Stoga se pri rješavanju Schrödingenrove jednadžbe u ovom slučaju koristi sferni koordinatni sistem: Schrödingenrova jednadžba za elektron u centralnom polju jezgra sa nabojem ima oblik:
 (35.1)
(35.1)
Zamjenom Laplaceovog operatora u sfernim koordinatama u ovu jednačinu dobijamo:
Rešenja (35.2) zadovoljavajuća standardnim uslovima, dobijaju se za bilo koju pozitivu E i za diskretne negativne vrijednosti:
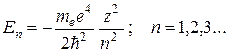 (35.3)
(35.3)
Vrijednosti pozitivne energije odgovaraju elektronu koji leti u blizini jezgra i povlači se u beskonačnost. Takav elektron nije vezan za jezgro, ne formira atom (ili ion) i nije od interesa.
Elektron vezan za jezgro odgovara negativnim vrijednostima energije (35.3). Mora se naglasiti da ove vrijednosti odgovaraju vrijednostima dobijenim u Borovoj teoriji, ali u kvantna mehanika one su posljedica Schrödingerove jednadžbe, a dodatne pretpostavke u obliku postulata nisu potrebne.
Vlastite funkcije Schrödingerove jednadžbe sadrže tri cjelobrojna parametra: n,l,m:
![]()
n- zove se glavni kvantni broj i poklapa se sa brojem nivoa energije u (35.3).
l i m – azimutalni i magnetni kvantni brojevi , koji određuju modul i projekciju ugaonog momenta na određeni pravac.
Rešenja koja zadovoljavaju standardne uslove dobijaju se samo za vrednosti l ne prelazi . Stoga, za dato n, azimutalni kvantni broj l može biti važno
![]() (35.4)
(35.4)
Za dato l magnetni kvantni broj m može poprimiti različite vrijednosti:
(35.5)
Energija elektrona elektrona u atomu vodika ovisi samo o nšef kvantni broj(vidi (35.3)), dakle, svaki energetski nivo odgovara nekoliko vlastitih funkcija koje se razlikuju po vrijednostima l i m. Na ovaj način, atom vodika može imati istu energiju, budući da je u stanjima opisanim različitim valnim funkcijama. Energetska stanja u ovom slučaju se nazivaju degenerisati , a broj različitih stanja koja odgovaraju datoj energiji je višestrukost degeneracije odgovarajućeg energetskog nivoa.
Višestrukost degeneracije nivoi energije vodonik je lako izračunati. Svaki od n brojčane vrijednosti l odgovara 2 l+ 1 vrijednost m. Dakle, multiplicitet degeneracije može se izračunati po formuli:
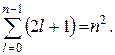
Podsjetimo da azimutalni kvantni broj određuje vrijednost ugaonog momenta i stanja elektrona u atomu vodika s različitim vrijednostima azimutnog kvantnog broja l razlikuju se po veličini ugaonog momenta. Elektron u stanju sa
l= 0 – pozvaos -elektron ( s stanje);
l= 1 - pozvanstr -elektron (p stanje)
l= 2– pozvand -elektron (d stanje)
l= 3 - pozvanf -elektron (f stanje) itd.
Prilikom označavanja stanja u kojem se elektron nalazi, uzima se vrijednost glavnog kvantnog broja n označiti ispred simbola kvantnog broja l. Dakle, elektron n= 3 at l = 1 je označen simbolima 3 str.
Zbog l< n moguća su sledeća stanja:
2s 2str
3s 3str 3d
4s 4str 4d 4f itd.
Kao iu Borovoj teoriji, kvantna mehanika pretpostavlja da se svjetlost emituje i apsorbira kada se elektron kreće s jednog nivoa na drugi. Međutim, foton ima sopstveni ugaoni moment približno jednaka Stoga, kada se foton emituje ili apsorbuje, ugaoni moment atoma se mora promeniti za pravilo odabira za azimutalni kvantni broj:
Očigledno, ovo pravilo je jednostavno posljedica zakona održanja ugaonog momenta.
Dijagram energetskih nivoa atoma vodika.
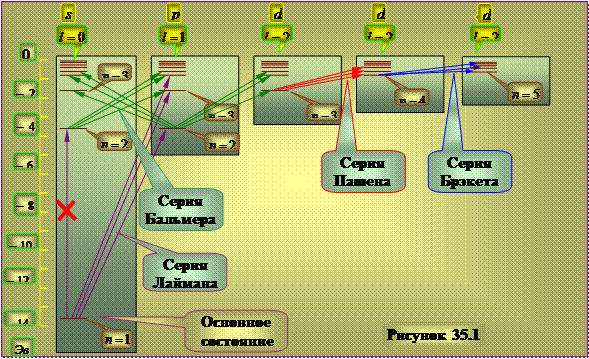 |
Efekat pravila odabira(35.6) dovodi do činjenice da se svi prelazi između energetskih nivoa zapravo ne mogu ostvariti. Na primjer prijelaz iz stanja 2 s in 1s ne može se dogoditi jer je u suprotnosti sa pravilom odabira. S tim u vezi, šema energetskih nivoa elektrona u atomu vodonika može se predstaviti kao što je prikazano na slici 35.1.
1s stanje je osnovno stanje atoma vodika gde atom vodonika ima najmanju energiju. Kada ga atom apsorbira, foton potpuno nestaje, prenoseći svoju energiju na atom, budući da je nedjeljiv. Apsorbirajući atom je obično u osnovnom stanju, tako da bi se apsorpcijski spektar atoma vodika trebao sastojati od linija koje odgovaraju prijelazima 1 s-np, što je u potpunosti u skladu sa eksperimentalnim rezultatima.
Elektron u atomu vodika
Vlastite funkcije Schrödingerove jednadžbe za atom vodonika dijele se na dva faktora, od kojih jedan ovisi samo o r, a drugi iz uglova J i j.
Multiplikator je stvaran, - imaginaran. Funkcija je vlastita funkcija operatora kvadrata ugaonog momenta. Za s-stanja elektrona (tj. sa ugaonim momentom jednakim nuli), ova funkcija je konstanta, a -funkcije oblika zavise samo od r.
element volumena dV sferni koordinatni sistem se može predstaviti kao
![]()
gdje d W = je element solidnog ugla.
Vjerovatnoća dP pronalaženje elektrona u elementu dV
Uzimajući integral od (35.7) preko čvrstog ugla 4 str, nalazimo vjerovatnoću pronalaženja elektrona u tankom sfernom sloju radijusa r i debljina dr:.
![]() (35.9)
(35.9)
Pošto se pretpostavlja da je Y normalizovan, integral u (35.9) je jednak jedan, i
![]() (35.10)
(35.10)
Iz (35.9) slijedi da je gustoća vjerovatnoće pronalaženja elektrona na udaljenosti r od jezgra ,
Duge okomite linije pokazuju poluprečnike odgovarajućih Borovih orbita.
Slika 35.1
Spectra alkalni metali
Ovi spektri su slični emisionom spektru atoma vodika, ali samo kvalitativno. Uočeno je nekoliko serija linija, a najintenzivnije od njih su imenovane na osnovu eksperimentalno uočenih karakteristika:
oštar(oštar) - Linije ove serije izgledale su vrlo jasne i uske.
Dom(glavni) - linije ove serije su takođe uočene u apsorpcionom i emisionom spektru, što ukazuje da odgovaraju prelazu atoma u osnovno stanje;
mutno(difuzno) - linije ove serije izgledale su mutno, nejasno;
main(osnovno) - linije ove serije ličile su na niz linija atoma vodika.
Utvrđeno je da se smatra serije linija su povezane s prijelazima vanjskog (valentnog) ili optičkog elektrona .
Sistem energetskih nivoa koji odgovara emisiji naznačenih linija za atom natrijuma ima oblik približno prikazan na slici 35.3.
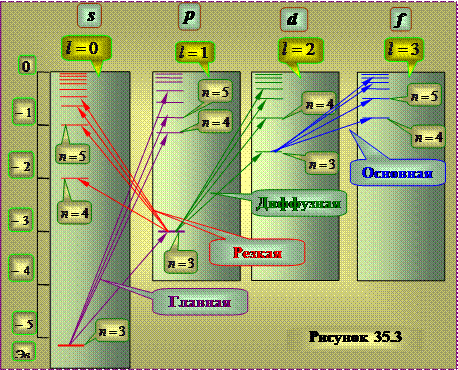 Za razliku od atoma vodonika, ispostavlja se da energija stanja zavisi ne samo od vrednosti kvantnog broja n, već i od broja niza članova.
Niz pojmova, kao u atomu vodika, odgovara različitim vrijednostima azimutnog kvantnog broja l.
Za razliku od atoma vodonika, ispostavlja se da energija stanja zavisi ne samo od vrednosti kvantnog broja n, već i od broja niza članova.
Niz pojmova, kao u atomu vodika, odgovara različitim vrijednostima azimutnog kvantnog broja l.
Ovi zaključci odgovaraju rezultatima kvantnomehaničkih proračuna - rješenju Schrödingerove jednadžbe za elektron koji se kreće u centralno simetrična ne-kulonova polje. Polje jezgra kod atoma alkalnih metala djelomično je zaštićeno elektronima unutrašnjih elektronskih omotača atoma. U ovom slučaju, polje zadržava sfernu simetriju, ali varira od udaljenosti do jezgra prema zakonu različitom od Coulombovog zakona. U takvom polju ispada da energija elektrona zavisi od kvantnog broja: Uobičajeno je reći da degeneracija je uklonjena azimutalni kvantni broj . Kako god, U osnovi, energija zavisi od glavni kvantni broj n.
Odlučio to ugaoni moment atomskog ostatka alkalnih atoma nakon uklanjanja optičkog elektrona je nula . Dakle, azimutalni kvantni broj L rezultirajućeg ugaonog momenta atom poklapa se sa azimutalni kvantni broj valence elektron. Kada je atom pobuđen (tj. kada je nekim djelovanjem prebačen iz stanja s minimalnom energijom u stanje s višom energijom) i kada emituje svjetlost samo se stanje menja valentni elektron , stoga je shema nivoa atoma identična shemi jednadžbe valentnog elektrona.
Pojmovi koji odgovaraju stupcima nivoa mogu se označiti na dijagramu nivoa energije simbolima nS, nP, nD i nF. Zatim frekvencije spektralne linije, jednak razlici između članova konačnog i početnog stanja, može se predstaviti u sljedećem obliku: pobuđena stanja se ne mogu smatrati striktno stacionarnim. Zbog činjenice da su vrijeme i energija kanonski konjugirane veličine, odnos nesigurnosti određuje konačnu širinu G energetskih nivoa:
Samo osnovno stanje ne dozvoljava spontane prelaze a njegova energija ima strogo definisanu vrijednost.
U skladu sa konačnim G, frekvencijski opseg emitovanih fotona
Za vidljivo svetlo sa odgovarajućim ![]() to takozvana prirodna širina linije
.
to takozvana prirodna širina linije
.
Toplotno kretanje atoma dovodi do Doplerovog širenja spektralnih linija. U ovom slučaju, za zračenje s talasnom dužinom na temperaturi T\u003d 1000 K, vrijednost je dobivena ![]() , što je višestruko veće od prirodne širine spektralnih linija.
, što je višestruko veće od prirodne širine spektralnih linija.
Energija atoma vodika, kao što slijedi iz (6), određena je samo glavnim kvantnim brojem n. najniži nivo energije E 1 , odgovarajući n \u003d 1, odgovara minimalnoj mogućoj energiji atoma i naziva se glavnom. Svi ostali energetski nivoi E n (E n > E 1 , n= 2,3,..) nazivaju se pobuđenim. Dijagram energetskih nivoa atoma vodika sa grafikom zavisnosti potencijalne energije U(r) od udaljenosti do jezgra prikazan je na sl. 2. Za negativne vrijednosti energije (E<0) движение электрона является связанным. По мере роста главного квантового числа n уровни располагаются теснее и при n→ ∞ E ∞ =0.
Za pozitivne vrijednosti energije, kretanje elektrona je slobodno, područje kontinuiranog spektra E> 0 (osenčeno na slici 2) odgovara jonizovanom atomu. Energija jonizacije atoma vodika

Šema energetskih nivoa atoma vodika (slika 2a) i prijelaza
između njih (slika 2b). [E] - eV.
Zadata vrijednost energije, osim E 1, odgovara nekoliko različitih stanja atoma, koji se razlikuju u vrijednostima kvantnih brojeva l i m. Uslovne vrijednosti sa l= 0, 1, 2,… označavaju se latiničnim slovima s, p, d, f,… Vrijednost glavnog kvantnog broja je označena brojem prije oznake orbitalnog kvantnog broja. Na primjer, elektroni u stanju n= 1 i l= 0 su označene sa 1s, u stanju n= 2 i l\u003d 0, 1 - 2s i 2p; With n=3 - 3s, 3p, 3d, itd.
Uzimajući u obzir različite vrijednosti kvantnih brojeva n i l Općenito prihvaćen je dijagram slike energetskih nivoa, prikazan na sl. 3.

Šema energetskih nivoa atoma vodika i prijelaza između njih, uzimajući u obzir orbitalni kvantni broj l.
Emisija i apsorpcija svjetlosti od strane atoma nastaje kada elektron prijeđe s jednog energetskog nivoa na bilo koji drugi, a energija emitiranog (apsorbiranog) kvanta jednaka je:
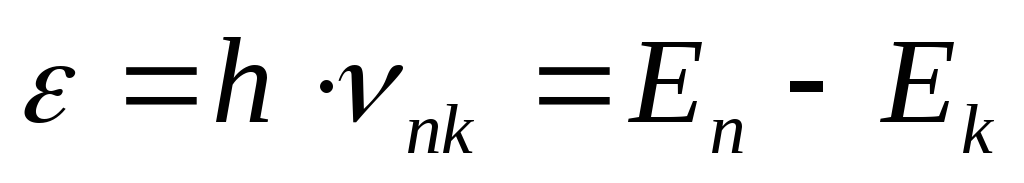 (18) gdje n,
k
su brojevi energetskih nivoa (stanja), respektivno, ν je frekvencija elektromagnetnog zračenja prelaza n→
k.
U procesu emisije (apsorpcije) svjetlosti mogu nastati samo takvi prijelazi, uslijed kojih su promjene orbitalnih i magnetnih kvantnih brojeva određene uvjetima:
(18) gdje n,
k
su brojevi energetskih nivoa (stanja), respektivno, ν je frekvencija elektromagnetnog zračenja prelaza n→
k.
U procesu emisije (apsorpcije) svjetlosti mogu nastati samo takvi prijelazi, uslijed kojih su promjene orbitalnih i magnetnih kvantnih brojeva određene uvjetima:
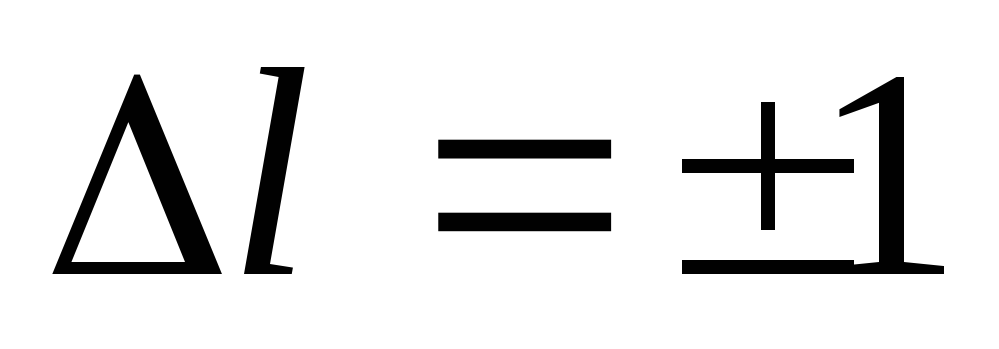 (19)
(19)
 (20)
(20)
Formule (19) i (20) se nazivaju selekcionim pravilima, koja ograničavaju broj mogućih prelaza elektrona u atomu.
Uzimajući u obzir (6), frekvenciju zračenja pri prelasku atoma vodika (Z = 1) iz stacionarnog stanja n u stabilno stanje k sa manje energije je:
 (21)
(21)
Gdje k, n-celi brojevi; k < n.
Jer  , tada formula (21), određivanjem valnih dužina odgovarajućih prijelaza, poprima oblik:
, tada formula (21), određivanjem valnih dužina odgovarajućih prijelaza, poprima oblik:
 (22)
(22)
Gdje je R Rydbergova konstanta jednaka
 (23)
(23)
Iz izraza (21) i (22) slijedi da je za dato k i promjene vrijednosti n (n >k) spektralne linije formiraju grupe ili serije. U emisionom spektru atoma vodika, kao što slijedi iz (22), razlikuju se sljedeće serije čije se valne dužine nalaze po formulama:
Lymanova serija (ultraljubičasto područje spektra):
 , gdje n=2,3,4,…
(24)
, gdje n=2,3,4,…
(24)
 (24a)
(24a)
Balmer serija (vidljivi spektar):
 , gdje n=
3,4,5,…
(25)
, gdje n=
3,4,5,…
(25)
Paschen serija (infracrveni spektar):
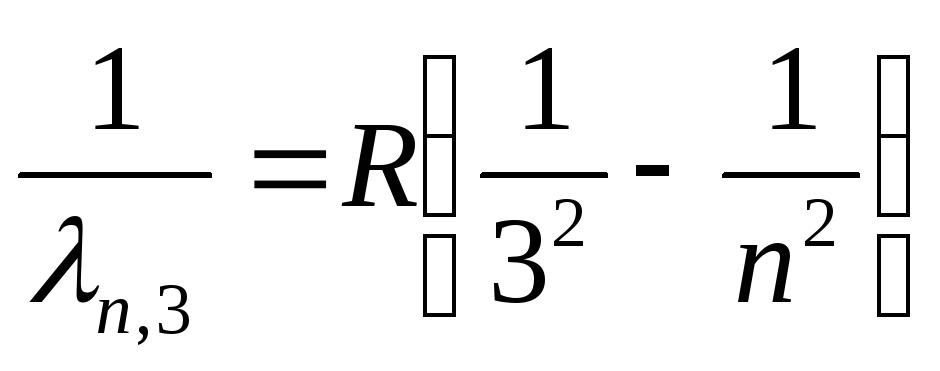 , gdje n=
4,5,6,…
(26)
, gdje n=
4,5,6,…
(26)
Serija nosača (daleko infracrveno):
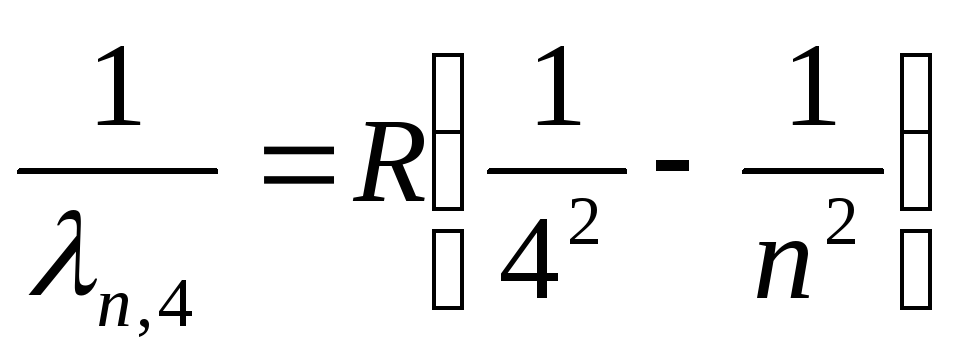 , gdje n=5,6,7,…
(27)
, gdje n=5,6,7,…
(27)
Formule (24a)-(27a) u skladu sa pravilima selekcije (19) određuju stanja elektrona, tokom prelaza između kojih se emituju spektralne linije redukovane serije u atomu vodonika. Za serije Lyman i Balmer, oni su prikazani na sl. 3 potpuno.
Treba napomenuti da se formule (21)-(22), dobijene teoretski u kvantnoj mehanici za izračunavanje talasnih dužina (frekvencija) spektralnih linija atoma vodika, poklapaju sa generalizovanom Balmerovom formulom (1), prethodno dobijenom empirijskim generalizacijom eksperimentalni podaci.
atom vodonika
Atom vodonika
atom vodonika- vezani sistem koji se sastoji od pozitivno nabijenog jezgra - protona i negativno nabijenog elektrona.
Veličina atoma određena je njegovom veličinom elektronska školjka≈ 10 -8 cm.
Energije vezanih stanja elektrona dobijaju se rješavanjem Schrödingerove jednadžbe s potencijalom V(r) = -e 2 /r i određene su relacijom
gdje je n glavni kvantni broj koji određuje energije različitih stanja elektrona u atomu vodika (n = 1, 2, 3…), R je Rydbergova konstanta
(R = 1,0974 10 5 cm -1).
Svaki nivo sa glavnim kvantnim brojem n odgovara n stanja koja se razlikuju po kvantnim brojevima l = 0, 1, 2, ..., (n-1). Ovakva degeneracija nivoa energije tipična je samo za Kulonovo polje. Osim toga, svako od ovih l-degeneriranih stanja je (2l + 1) puta degenerirano u magnetskom broju
m = ±l, ±(l-1),...±1, 0. Dakle, ukupni multiplicitet degeneracije stacionarne kvantno stanje sa glavnim kvantnim brojem n je dat sa .
Ovo razmatranje važi pod uslovom da je spin elektrona nula. Pošto elektron ima spin s = 1/2, ukupni ugaoni moment elektrona će biti određen sa vektorska suma njegove orbitalne i spinske momente
=
+
.
Pošto je spin elektrona s = 1/2, njegov ukupni ugaoni moment J može biti samo poluceo broj.
Za datu vrijednost orbitalnog momenta l u atomu vodika moguća su dva stanja koja se razlikuju u vrijednostima ukupnog momenta kretanja = + = l + 1/2 i
j = l - s = l - 1/2. Ove dvije vrijednosti se razlikuju u međusobnoj orijentaciji orbitalnog i spinskog vektora. Energije elektrona u stanjima l + 1/2 i l - 1/2 u Kulonovom polju protona se donekle razlikuju, a degeneracija u energiji stanja je podignuta. Ova dodatna interakcija naziva se spin-orbitna interakcija. Uzimajući u obzir uklanjanje degeneracije, obogaćuje se spektar nižih stanja atoma vodika i dolazi do finog cijepanja energetskih nivoa. Umjesto dva niža nivoa vodonika bez uzimanja u obzir spin-orbitnog cijepanja (glavni 1s i prvi pobuđeni 2s2p (slika 1a)) s obzirom na spin-orbitno cijepanje, postoje četiri (slika 1b) . Kvantne karakteristike ovih nivoa date su u tabeli. Nivo sa velikom vrednošću j = l + 1/2 nalazi se više u energiji od nivoa sa j = l - 1/2. Stanja s različitim vrijednostima l, ali istom vrijednošću nj i dalje su degenerirana. Na primjer, 2s 1/2 i 2p 1/2 .
Kvantne karakteristike elektrona u najnižem
stanja atoma vodonika
| n | l | s | j = l ± s | oznaka nivoa |
| 1 | 0 | 1/2 | 1/2 | 1s 1/2 |
| 2 | 0 1 |
1/2 1/2 |
1/2 1/2, 3/2 |
2s 1/2 2p 1/2, 2p 3/2 |
| 3 | 0 1 2 |
1/2 1/2 1/2 |
1/2 1/2, 3/2 3/2, 5/2 |
3s 1/2 3p 1/2 , 3p 3/2 3d 1/2 , 3d 3/2 |
Od tačnog rješenja relativistička jednačina Dirac za elektron sa spinom s = 1/2 prati ovisnost energije nivoa atoma vodika od kvantnih brojeva n i j
 ,
,
gdje je α = 1/137 konstanta fine strukture. Korekcija u E nj ne zavisi od kvantnog broja l. Dakle, energije stanja sa istim j i različitim l moraju biti jednake. Fino cijepanje nivoa δE j+1,j za dati n je određeno relacijom
Cepanje nivoa sa n = 2 je ≈ 4,5·10 -5 eV.
Jezgro atoma vodika - proton - takođe ima svoj moment - spin s = 1/2. Ovo također neznatno mijenja interakciju elektrona sa protonom, jer postoji dodatna interakcija magnetnog momenta protona, uzrokovana prisustvom njegovog spina, sa magnetsko polje elektron. Veličina ove interakcije zavisi od međusobne orijentacije spin momenta protona i ukupnog momenta elektrona. Tako se javlja još jedan tip cijepanja atomskih nivoa, nazvan hiperfino, jer je njegova vrijednost mnogo manja od finog cijepanja. Hiperfino cijepanje će se uočiti već za osnovno stanje
(n = 1, l = 0). Prijelaz između dva podnivoa hiperfinog cijepanja osnovnog stanja vodonika dovodi do zračenja talasne dužine λ = 21 cm (frekvencija zračenja 1420 MHz). Uz pomoć ovog zračenja obično se registruje međuzvjezdani vodonik u Univerzumu.
Stanja od n = 2 do n = ∞ nazivaju se pobuđena stanja. Energija pobude E ex (energija koja se mora prijaviti sistemu tako da pređe iz početnog stanja n i u konačno stanje n f) određuje se iz relacije

Sva stanja od n = 1 do n = ∞ su vezana stanja jer imaju negativne energije. Kako se n približava beskonačnosti, energije stanja se približavaju jedna drugoj, a razlika u energijama susjednih stanja postaje toliko mala da se podijeljeni nivoi spajaju, a diskretni spektar nivoa se pretvara u kontinuirani (kontinuirani). Kada energija elektrona postane pozitivna (E > 0), sistem postaje nevezan i elektron postaje slobodan. Energetski spektar slobodnog elektrona je kontinuiran.
Prijelazi iz stanja n = 2, 3, … ∞ u stanje n = 1 formiraju Lymanovu seriju. Prijelazi iz stanja n = 3, 4, … ∞ u stanje n = 2 su Balmerovi redovi. Prijelazi između stanja s negativnom energijom (E< 0) приводят
к образованию дискретного спектра переходов, в то время как переходы между
состояниями с E >0 i stanja sa E< 0 дают непрерывный спектр переходов.
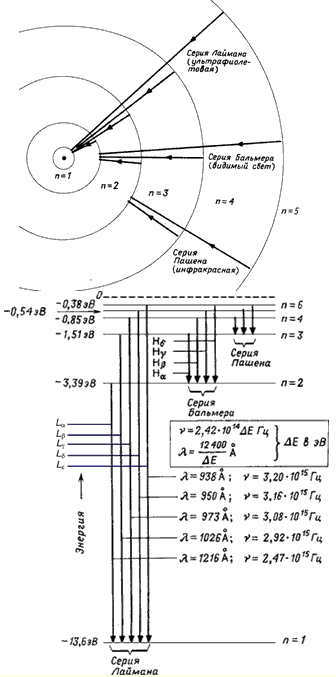
Rice. 2. Šema nivoa atoma vodonika.
Prema tačnom rješenju Diracove jednačine, energetski nivoi sa istom vrijednošću kvantnog broja n = 1, 2, 3,... i istom vrijednošću ukupnog impulsa
j = 1/2, 3/2,... moraju se podudarati u energiji bez obzira na vrijednost kvantnog broja l. 1947. W. Lamb i R. Riserford otkrili su pomak u nivoima 2s 1/2 i 2p 1/2 u atomu vodonika. Ovaj pomak nivoa se zove Lamb shift
. Glavni razlog Lambovog pomaka je zbog radijacionih korekcija:
- Emisija virtuelnih fotona vezanog elektrona.
- Vakumska polarizacija - rađanje parova elektron-pozitron u vakuumu.
Ove dvije korekcije u potpunosti objašnjavaju uočeni Lambov pomak nivoa 2s 1/2 i 2p 1/2 (ΔE = 4,5·10 -6 eV).
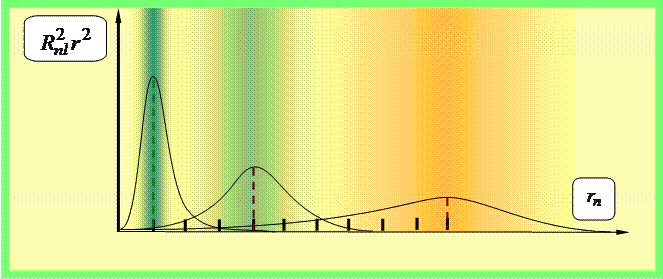
Vjerovatnoća dw pronalaženja elektrona u zapremini dV u određenoj tački prostora je data sa
dw = |ψ(x, y, z)|2 dV = |R nl (r)Y lm (θ,φ)| 2 r 2 sinθdθdφdr =
= |R nl (r)| 2 r 2 |Y lm (θ,φ)| 2 sinθdθdφdr,
razlaže se na radijalnu vjerovatnoću ||R nl (r)| 2 r 2 | 2 r 2 dr i ugaoni - |Y lm (θ,φ)| 2 dΩ. Distribucije ovih vjerovatnoća su date na sl. 3–5.
Pretpostavimo da shema nižih energetskih nivoa atoma određenog elementa ima oblik prikazan na slici, a atomi su u stanju sa energijom.Elektron, sudarivši se s jednim od takvih atoma u mirovanju, dobija dodatnu energiju kao rezultat sudara. Ispostavilo se da je impuls elektrona nakon sudara s atomom jednak. Odredite kinetičku energiju elektrona prije sudara. Zanemaruje se mogućnost emisije svjetlosti od strane atoma u sudaru s elektronom. Zanemarite efekat trzanja.
Rješenje.
str elektron je povezan sa njegovom kinetičkom energijom relacijom ili gdje m je masa elektrona.
shodno tome,
Gost 18.05.2012 17:00
Objasnite zašto je elektron prešao u stanje E(0) i zašto tu energiju (3,5 eV) dodajemo energiji elektrona?
Gost
Dobar dan!
Prema Borovim postulatima, atom može postojati samo u strogo određenim stanjima. Kada se atom i elektron sudare, zakon održanja energije je ispunjen. U skladu sa uslovom, energija elektrona se povećala, što znači da je energija atoma morala da se smanji. Pošto je atom na prvom energetskom nivou, jedini način da smanji svoju energiju je da ode na nulti nivo. U tom slučaju njegova energija opada za. Budući da se vjerovatnoća zračenja prema uvjetu može zanemariti, a vrijednost kinetičke energije trzaja jezgra zbog njegove malenosti, zaključujemo da je sva ta energija prenosi na elektron.
Vitalij 22.03.2016 07:54
Zdravo!
Postoji nekoliko pitanja u problemu 3045 iz fizike:
1) Da li sam dobro shvatio da se sistem indirektno odnosi na 2 elektrona? Jedan je u polju centralnih sila jezgra. Drugi - slobodni elektron koji leti pored atoma i uslovno nikada ne stupa u interakciju sa jezgrom, već sa "atomskim" elektronom - samo u trenutku prenosa momenta?
2) Ako je odgovor na prvo pitanje "da", onda je shema "energetskih nivoa atoma" - da li su to dozvoljeni energetski nivoi vezanog, "atomskog" elektrona?
3) Da li je tačno da je dolazni elektron na nivou E (beskonačno) ili više?
4) Prolazni elektron koji je stupio u interakciju s e-poštom. u atom nije zarobljen? Odleti li sa još više energije?
5) Koja vrsta energije se može pripisati energiji elektrona koji prolazi (kinetička, itd.) u trenutku njegovog približavanja atomu?
Nakon što odgovorim na ova pitanja, moći ću odlučiti da li postoji greška u problemu ili ne. Izvinite što pišem ovde, u Kini postoje problemi sa pristupom VK.
Anton
1) Ne, problem je oko atoma i slobodnog elektrona.
2) U ovom problemu nije potrebno razmatrati doprinose elektrona atoma i njegovog jezgra energetskim nivoima atoma. Atom se smatra jednim objektom sa datim energetskim spektrom.
3) Slobodni elektron nije dio atoma, nije ispravno staviti njegovu energiju na dijagram energetskih nivoa atoma (njegova energija se može prikazati jedan pored drugog). Ako govorimo o mogućem spektru kinetičke energije slobodnog elektrona, onda je on kontinualan (ne diskretan): U ovom problemu kinetička energija slobodni elektron prije sudara bio je 1,45 eV, a nakon sudara 4,95 eV.
4) Elektron je stupio u interakciju s atomom u cjelini i od njega primio dio energije.
5) Kinetički.
Pretpostavimo da shema nižih energetskih nivoa atoma određenog elementa ima oblik prikazan na slici, a atomi su u stanju sa energijom.Elektron, sudarajući se s jednim od ovih atoma, dobija dodatnu energiju kao rezultat sudara. Kinetička energija elektrona prije sudara bila je jednaka Odredite impuls elektrona nakon sudara s atomom. Zanemaruje se mogućnost emisije svjetlosti od strane atoma prilikom sudara s elektronom, prije sudara atom se smatra nepokretnim.
Rješenje.
Ako je pri sudaru sa atomom elektron dobio energiju, tada je atom prešao u stanje, pa je nakon sudara kinetička energija elektrona postala jednaka gdje je energija elektrona prije sudara; odavde: Impuls str elektron je povezan sa njegovom kinetičkom energijom relacijom gdje m je masa elektrona.
shodno tome,
odgovor:
Slika prikazuje energetske nivoe atoma i ukazuje na talasne dužine fotona koji se emituju i apsorbuju tokom prelaska sa jednog nivoa na drugi. Koja je talasna dužina fotona emitovanih tokom prelaska sa nivoa na nivo ako je ?
Rješenje.
Frekvencija fotona koji emituje ili apsorbuje atom tokom prelaska sa jednog energetskog nivoa na drugi proporcionalna je energetskoj razlici između ovih nivoa. Stoga imamo:
Odavde (jer):
Slika prikazuje nivoe energije elektronske ljuske atoma i ukazuje na frekvencije fotona koji se emituju i apsorbuju tokom prelaza sa jednog nivoa na drugi. Koja je talasna dužina fotona apsorbovanih tokom prelaska sa nivoa na nivo if
Rješenje.
Frekvencija fotona koji atom emituje ili apsorbuje tokom prelaska sa jednog energetskog nivoa na drugi proporcionalna je energetskoj razlici između ovih nivoa:
Stoga pišemo: Odavde:
odgovor:
Slika prikazuje nekoliko energetskih nivoa atoma i ukazuje na talasne dužine fotona koji se emituju i apsorbuju tokom prelaska sa jednog nivoa na drugi.
Eksperimentalno je utvrđeno da je minimalna talasna dužina za fotone emitovane tokom prelaza između ovih nivoa Koja je vrednost ako ?
Rješenje.
Minimalna talasna dužina odgovara maksimalnoj frekvenciji i energiji fotona. To je i
Frekvencija fotona koji emituje ili apsorbuje atom tokom prelaska sa jednog energetskog nivoa na drugi proporcionalna je energetskoj razlici između ova dva nivoa. Zbog toga
Energetski nivoi elektrona u atomu vodika dati su formulom gdje je . Kada atom prelazi iz stanja u stanje, atom emituje foton. Jednom kada se nađe na površini fotokatode, foton izbacuje fotoelektron. Talasna dužina svjetlosti koja odgovara crvenoj granici fotoelektričnog efekta za površinski materijal fotokatode, Koja je maksimalna moguća kinetička energija fotoelektrona?
Rješenje.
Prema Borovim postulatima, svjetlost se emituje kada atom prijeđe na niže energetske nivoe, dok fotoni nose energiju jednaku razlici između energija početnog i konačnog stanja. Dakle, emitovani foton je imao energiju
Izvor: Jedinstveni državni ispit iz fizike 06.06.2013. glavni talas. Sibir. Opcija 1.
EV gdje . Kada atom prelazi iz stanja u stanje, atom emituje foton. Kada se nađe na površini fotokatode, ovaj foton izbacuje fotoelektron. Frekvencija svjetlosti koja odgovara crvenoj ivici fotoelektričnog efekta za materijal površine fotokatode, Hz. Koliki je najveći mogući impuls fotoelektrona?
Rješenje.
Prema jednadžbi fotoelektričnog efekta, maksimalna kinetička energija emitovanih fotoelektrona povezana je sa energijom fotona i radnom funkcijom relacijom
Izvor: Jedinstveni državni ispit iz fizike 06.06.2013. glavni talas. Sibir. Opcija 2.
Energetski nivoi elektrona u atomu vodonika dati su formulom eV, gdje je . Kada atom prelazi iz stanja u stanje, atom emituje foton. Kada se nađe na površini fotokatode, ovaj foton izbacuje fotoelektron. Talasna dužina svjetlosti koja odgovara crvenoj granici fotoelektričnog efekta za površinski materijal fotokatode, Koliki je maksimalni mogući modul momenta fotoelektrona?
Rješenje.
Prema Borovim postulatima, svjetlost se emituje kada atom prijeđe na niže energetske nivoe, dok fotoni nose energiju jednaku razlici između energija početnog i konačnog stanja. Dakle, emitovani foton je imao energiju
Prema jednadžbi fotoelektričnog efekta, maksimalna kinetička energija emitovanih fotoelektrona povezana je sa energijom fotona i radnom funkcijom relacijom
Radna funkcija je povezana sa talasnom dužinom crvene granice relacijom:
Dakle, maksimalni mogući impuls fotoelektrona je
Izvor: Jedinstveni državni ispit iz fizike 06.06.2013. glavni talas. Sibir. Opcija 3.
Energy levels of manner of manner terms
gdje . Kada atom prelazi iz stanja u stanje, atom emituje foton. Kada se nađe na površini fotokatode, ovaj foton izbacuje fotoelektron. Frekvencija svjetlosti koja odgovara crvenoj ivici fotoelektričnog efekta za materijal površine fotokatode, Hz. Kolika je maksimalna moguća kinetička energija fotoelektrona?
Rješenje.
Prema Borovim postulatima, svjetlost se emituje kada atom prijeđe na niže energetske nivoe, dok fotoni nose energiju jednaku razlici između energija početnog i konačnog stanja. Dakle, emitovani foton je imao energiju
Prema jednadžbi fotoelektričnog efekta, maksimalna kinetička energija emitovanih fotoelektrona povezana je sa energijom fotona i radnom funkcijom relacijom
Radna funkcija je povezana sa frekvencijom crvene ivice relacijom:
Dakle, maksimalna moguća kinetička energija fotoelektrona je






