Entropiya entalpiyasi ichki energiya farqi nimada. Ichki energiya va entalpiya
KIMYOVIY TERMODINAMIKA ASOSLARI
Kimyoviy termodinamikaning asosiy tushunchalari. Tizim, muvozanat holati va termodinamik jarayon. Keng va intensiv xususiyatlar. Davlat funktsiyalari va jarayon funktsiyalari. Umumiy holatda jarayon funktsiyasi bo'lgan termodinamik kattalik holat funksiyasi xossalarini egallashi mumkinmi? Ha bo'lsa, misollar keltiring.
Termodinamikaning birinchi qonuni. Ichki energiya. Issiqlik va ish energiya uzatish shakllari sifatida. Bu qiymatlarning izoxorik va izotermik jarayonlardagi o'zaro bog'liqligi.
Termodinamikaning birinchi qonuni, termodinamikaning 1-qonunining formulalari. Tizimning ichki energiyasi. Issiqlik va ish energiya uzatish shakllari sifatida. Termodinamikaning 1-qonuni izotermik va izoxorik jarayonlarga tatbiq etiladi.
R= holat parametrlari koordinatalarida bitta grafikda sxematik chizingf(V) ideal ikki atomli gazning bir xil boshlang'ich holatidan hajmining ikki baravar ortishigacha qaytariladigan izotermik va qaytar izobarik kengayish jarayonlari. Yuqoridagi jarayonlarning qaysi biri uchun kengaytirish ishlari kattaroq ekanligini tushuntiring?
Gaz uchun diagrammadagi adiabatik chizma (qalin chiziq). - gaz bosimi; - hajm.
Muayyan holatda, ish hajmini o'zgartirish orqali amalga oshirilganda, uni quyidagi tarzda aniqlash mumkin: gaz silindrsimon idishga oson sirg'aluvchi piston bilan mahkam yopilgan bo'lsin, agar gaz kengaysa, u harakat qiladi. piston va segmentga o'tayotganda ishni bajaring
bu erda F - gazning pistonga ta'sir qiladigan kuchi. Keling, tenglamani qayta yozamiz:
bu erda s - pistonning maydoni. Keyin ish bo'ladi
gaz bosimi qayerda, kichik hajm o'sishi. Xuddi shunday, tenglama o'zboshimchalik bilan kesma shakli bo'lgan idishlar uchun ham amal qilishini ko'rish mumkin.
Izokorik va izobarik molyar issiqlik sig'imlari. Ular o'rtasidagi aloqa uchun ideal gaz. Izobar issiqlik sig'imining kristall, suyuq va gazsimon holatdagi moddalar uchun haroratga bog'liqligi.
Suyuqlikni qizdirganda va qattiq moddalar ularning hajmi amalda o'zgarmaydi va kengaytirish ishi nolga teng bo'ladi. Shuning uchun, tana tomonidan qabul qilingan barcha issiqlik miqdori uning ichki energiyasini o'zgartirish uchun ketadi. Suyuqlik va qattiq moddalardan farqli o'laroq, issiqlik uzatish jarayonida gaz o'z hajmini sezilarli darajada o'zgartirishi va ishni bajarishi mumkin. Shuning uchun gazsimon moddaning issiqlik sig'imi termodinamik jarayonning tabiatiga bog'liq. Odatda, gazlarning issiqlik sig'imining ikkita qiymati hisobga olinadi: C V – izoxorik jarayonda molyar issiqlik sig'imi (V= const) va C p – izobarik jarayonda molyar issiqlik sig'imi (p= const).
Jarayonda doimiy hajm gaz ishlamaydi A= 0. 1 mol gaz uchun termodinamikaning birinchi qonunidan kelib chiqadi
qaerda ∆ V- 1 mol ideal gazning harorati D ga o'zgarganda hajmining o'zgarishi T. Bu quyidagilarni nazarda tutadi:
qayerda R universal gaz doimiysi. Da p= const
Shunday qilib, molyar issiqlik sig'imlari o'rtasidagi munosabatni ifodalovchi munosabat C p va C V, shaklga ega ( Mayer formulasi ):
|
C p = C V + R. |
|
Fazali o'tish paytida(bir kristalli modifikatsiyadan boshqasiga, dan qattiq holat suyuqlikka va boshqalarga) issiqlik sig'imi keskin o'zgaradi, aksariyat moddalar uchun esa C V erish nuqtasida bir oz ko'proq suyuqlik C V kristalli (1.7-rasm). |
|||
|
| |||
|
| |||
|
Guruch. 1.7. Issiqlik sig'imiga bog'liqlik HCl harorat T T F.P. - harorat fazali o'tish; T PL. - erish harorati; T KIP. - qaynash harorati | |||
|
3. Gaz va suyuq moddalarning issiqlik sig'imi odatda harorat oshishi bilan ortadi (1.8-rasm). | |||
|
| |||
|
Odatda moddalarning issiqlik sig'imi 298 dan T gacha bo'lgan haroratga bog'liqligi tasvirlangan | |||
|
Organik moddalar uchun empirik tenglama bo'yicha: C P = a + ichida T + c T 2 (1.22) |
| ||
6. Ichki energiya va entalpiya si, ularning munosabati. Moddaning ichki energiyasi va entalpiyasining haroratga bog'liqligi. Tegishli tenglamalarni integrallash.
ichki energiya sistema tananing barcha zarralarining bir-biri bilan o'zaro ta'sirining potentsial energiyasining yig'indisi deb ataladi va kinetik energiya ularning harakatlari, ya'ni. ichki energiya tizim translatsiya va energiyadan iborat aylanish harakati molekulalar, molekulalarni tashkil etuvchi atomlar va atom guruhlarining molekula ichidagi tebranish harakati energiyasi, atomlardagi elektronlarning aylanish energiyasi, atomlar yadrolarida mavjud bo'lgan energiya, molekulalararo o'zaro ta'sir energiyasi va boshqa energiya turlari.
Jismning ichki energiyasining mutlaq qiymati noma'lum, ammo kimyoviy hodisalarni o'rganish uchun tizimning bir holatdan ikkinchi holatga o'tishida faqat ichki energiyaning o'zgarishini bilish muhimdir.Ko'pgina jarayonlarda energiya qisman o'tkazilishi mumkin. issiqlik shaklida va qisman ish shaklida.
Shunday qilib, issiqlik va ish energiyani bir tanadan ikkinchisiga o'tkazishning ikki xil shaklini sifat va miqdoriy jihatdan tavsiflaydi; ular energiya bilan bir xil birliklarda o'lchanadi.
Har qanday turdagi ish yoki energiya ikki omilning ko'paytmasi sifatida ifodalanishi mumkin: intensivlik koeffitsienti sig'im koeffitsientining o'zgarishiga, shuningdek ekstensivlik omili deb ataladi (agar intensivlik omili jarayon davomida doimiy bo'lib qolsa) Demak, masalan, normal ish (mexanik) tengdir. qo'llaniladigan kuch va yo'l o'sishi mahsulotiga:
Agar issiqlik Q tizimga (modda yoki moddalar to'plami) berilsa, u holda energiyaning saqlanish qonuniga ko'ra, u odatda tizimning ichki energiyasini U oshirishga va A ishni bajarishga sarflanadi, ya'ni.
(1) bu erda U - boshlang'ich U BOSHLANGAN holatidan oxirgi U CON holatiga o'tish paytida tizimning ichki energiyasining o'zgarishi.
![]() Kimyoviy reaksiyalarda ish asosan tashqi bosimga qarshi ish bilan tavsiflanadi. Birinchi yaqinlashishda u tizimning bosim va hajm o'zgarishi V mahsulotiga teng:
Kimyoviy reaksiyalarda ish asosan tashqi bosimga qarshi ish bilan tavsiflanadi. Birinchi yaqinlashishda u tizimning bosim va hajm o'zgarishi V mahsulotiga teng:
(2) bu erda V - jarayondagi hajm o'zgarishi.
Izoxorik jarayon bilan A = 0, chunki sistema hajmida hech qanday o'zgarish bo'lmaydi ( V=0).Shuning uchun tizimning 1-holatdan 2-holatga o'tishi tenglikka mos keladi:
(3) Demak, reaksiya V=const da davom etsa, Q V issiqlikning ajralib chiqishi va yutilishi ichki energiyaning U o‘zgarishi bilan bog‘liq.
Izobar jarayon uchun V - reaksiya mahsulotlarining hajmlari yig‘indisi bilan boshlang‘ich moddalar hajmlari yig‘indisi o‘rtasidagi farq (P=const).
![]() (4) Izobarik jarayon uchun Q P issiqlik effekti quyidagilarga teng bo'ladi:
(4) Izobarik jarayon uchun Q P issiqlik effekti quyidagilarga teng bo'ladi:
![]() (5)(6)
(5)(6)
Belgilang, (8) - Entalpiya
Entalpiya ichki energiya yig'indisiga va hajm va bosim ko'paytmasiga teng.
Entalpiya ichki energiya kabi moddaning tabiatiga, bosim va haroratga bog'liq holda davlatning keng funktsiyasidir. Tizimning fazaviy holati o'zgarmaydigan harorat oralig'ida entalpiya asosiy parametrlarning monotonik funktsiyasidir.
bular. H - Q p reaksiyaning p=const da issiqlik effekti.
Entalpiya davlat funktsiyasidir, ya'ni. uning o'zgarishi tizimning berilgan boshlang'ich va oxirgi holatlari bilan belgilanadi va o'tish yo'liga bog'liq emas.
xira [H]=[kJ] yoki [kJ/mol]
Shunday qilib, da izoxorik Reaksiyaning texnologik issiqlik effekti:
termal effekt(issiqlik kimyoviy reaksiya) - doimiy hajm yoki bosim sharoitida reaksiya jarayonida tizim tomonidan chiqarilgan yoki yutilgan issiqlik (energiya) miqdori va hosil bo'lgan mahsulotlar dastlabki modda bilan bir xil haroratga ega.
ideal gazning ichki energiyasi hajm va bosimga bog'liq emas, balki faqat haroratning funksiyasi bo'lsa, u holda (2.7) tenglamaga asoslanib, uni integrallashgandan so'ng, biz har qanday haroratda ichki energiyani olamiz. T:
U T = U o + Bilan V (T – T o). (5.2) Ideal gazning entalpiyasi ham ichki energiya kabi faqat haroratga bog'liq. Chunki ta'rifga ko'ra, H = U + pV, va 1 mol gaz uchun pV = RT va ( Bilan R – Bilan V)
=R, keyin H = U o + Bilan R (T – T o). (5.3) at ideal gazning izoxor va izobar potensiallari doimiy harorat(4.28) va (4.34) integral tenglamalar bilan aniqlanadi. At ideal gazning bir mol uchun T= const dF =
– pdf =
– 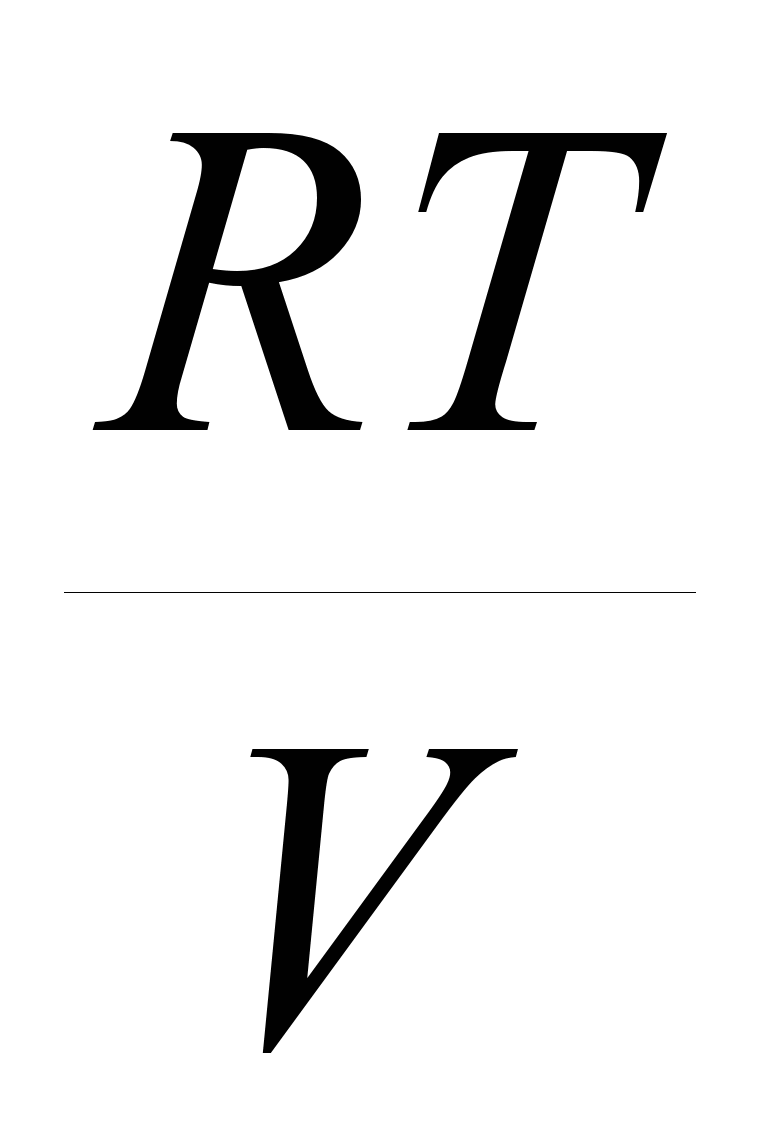 dV, (5. 4) bu yerdan integrallashdan keyin olamiz F = F(T)
– RT ln v.(5.5)
dV, (5. 4) bu yerdan integrallashdan keyin olamiz F = F(T)
– RT ln v.(5.5)
Termokimyo. Gess qonuni va uning termodinamik asoslanishi. Doimiy bosim va doimiy hajmdagi kimyoviy reaksiyaning issiqlik effektlari o'rtasidagi bog'liqlik.
Hess qonuni- termokimyoning asosiy qonuni, u quyidagicha tuzilgan:
Izobarik-izotermik yoki izoxorik-izotermik sharoitda amalga oshiriladigan kimyoviy reaksiyaning issiqlik effekti faqat boshlang'ich moddalar va reaktsiya mahsulotlarining turi va holatiga bog'liq va uning paydo bo'lish yo'liga bog'liq emas..
Boshqacha qilib aytganda, har qanday jarayonda ajralib chiqadigan yoki yutilgan issiqlik miqdori, berilgan kimyoviy o'zgarish bir yoki bir necha bosqichda davom etishidan qat'i nazar, har doim bir xil bo'ladi (agar moddalarning harorati, bosimi va agregat holati bir xil bo'lsa).

Rasmda A 1, A 2 ... boshlang'ich moddalarining B 1, B 2 ... reaktsiya mahsulotiga aylanishining ba'zi bir umumlashtirilgan kimyoviy jarayonining sxematik tasviri ko'rsatilgan, bu turli usullar bilan bir, ikki yoki ikkita usulda amalga oshirilishi mumkin. uch bosqich, ularning har biri termal effekt bilan birga keladi DH i. Gess qonuniga ko'ra, barcha bu reaktsiyalarning issiqlik effektlari quyidagi munosabat bilan bog'liq.
TERMOKIMYOVIY TENGLAMALAR
Hess qonuni
Barcha sifatli hisob-kitoblar Gess qonuniga muvofiq amalga oshiriladi:
Reaksiya entalpiyasining o'zgarishi faqat boshlang'ich moddalar va reaktsiya mahsulotlarining fizik holatiga va kimyoviy tabiatiga bog'liq va reaktsiyaning oraliq bosqichlariga bog'liq emas. (1840)
Gess qonunining oqibatlari:
1) To'g'ridan-to'g'ri reaksiyaning issiqlik effekti kattaligi bo'yicha teng va teskari reaksiyaning issiqlik effektiga ishorasi bo'yicha qarama-qarshidir.
2) Reaksiyaning issiqlik effekti mahsulotlar va boshlang‘ich moddalar reaksiyasining hosil bo‘lish entalpiyalari yig‘indilarining ayirmasi stexiometrik koeffitsientlarga ko‘paytiriladi.
3) Reaksiyaning issiqlik effekti dastlabki moddalar va mahsulotlar reaktsiyasining yonish entalpiyalari yig'indilari orasidagi ayirmaning stexiometrik koeffitsientlarga ko'paytirilishiga teng.
Termodinamik parametrlar
Termodinamik parametrlar jismoniy miqdorlar, termodinamik tizimlardagi holat va jarayonlarni tavsiflovchi.
Ular termodinamik xususiyatlar deb ham ataladi. Ular intensiv (modda miqdoriga bog'liq bo'lmagan) - bu harorat, bosim, kontsentratsiya va keng (modda miqdoriga bog'liq) - bu massa, hajm, energiyaga bo'linadi. Termodinamik xususiyatlarning qiymatlari to'plami xarakterlanadi termodinamik holat tizimlari.
Termodinamik xususiyatlar termodinamik tizimlarni tavsiflash uchun ishlatiladi va ko'pincha miqdorlar to'plami sifatida miqdoriy jihatdan taqdim etiladi.
Ichki energiya va entalpiya
Entalpiya - issiqlik chiqishi va ishlarning bajarilishi tufayli energiya tizimidagi o'zgarishlarni hisobga oladigan umumlashtirilgan parametr. Entalpiya tizimning issiqlik miqdori deb ham ataladi, chunki doimiy bosimda entalpiyaning o'zgarishi so'rilgan issiqlikka teng. Bu tizimning keng qamrovli xususiyati.
Agar faqat suyuqliklar va qattiq moddalar, u holda reaksiya entalpiyasining o'zgarishi taxminan ichki energiyaning o'zgarishiga teng bo'ladi. Buning sababi, hajmning o'zgarishi amalda nolga teng va kengaytirish ishi bajarilmaganligi ma'lum bo'ladi.
Ammo agar kimyoviy reaksiya natijasida gazsimon moddalar ajralib chiqsa yoki so'rilsa, u holda tenglama to'liq ishlatiladi. Ideal gazning izotermik kengayishida ichki energiya nolga teng. Umumiy holatda tizimdagi energiyaning o'zgarishi tizim va o'rtasidagi almashinuv bilan bog'liq holda sodir bo'ladi muhit issiqlik yoki ish.
Entropiya va uning izolyatsiyalangan va yopiq tizimlarda sodir bo'ladigan jarayonlarni tavsiflashdagi roli
Entropiya - bu tizimdagi tasodifiy yoki tartibsizlikni tushuntiruvchi miqdoriy termodinamik xususiyat; boshqacha qilib aytganda, tashkilotning etishmasligi. Buzilish qanchalik katta bo'lsa, entropiya qiymati shunchalik katta bo'ladi va aksincha. Entropiya S=klnW sistema ehtimoliga proporsional, bu yerda k - Voltsman doimiysi. Koinotning entropiyasi doimo ortib boradi. Termodinamikaning ikkinchi qonuniga ko'ra izolyatsiya qilingan tizimlar faqat entropiya ortishi kuzatiladigan shunday jarayonlar mumkin. Entropiya maksimal mumkin bo'lgan darajaga yetganda, tizimda muvozanat paydo bo'ladi. 0 K da sof, mukammal kristalning entropiyasi nolga teng (termodinamikaning uchinchi qonuni).
Agar tizim izolyatsiyalanmagan bo'lsa, u holda qaytarilmas jarayonlar davomida tizim va atrof-muhit entropiyalarining o'zgarishlar yig'indisi doimo ijobiy bo'ladi. Bu yig'indi faqat termodinamik qaytar jarayonlarda nolga teng.
Yopiq tizimlarda faqat entropiya yordamida yo'nalish va muvozanatni aniqlash mumkin emas, ular umumlashtirilgan parametrlardan foydalanadilar: Helmgolts energiyasi va Gibbs energiyasi.
Gelmgolts energiyasi V va T doimiy bo'lgan jarayonlarda ishlatiladi. dA=dU-TdS
Gibbs energiyasi P va T doimiy bo'lgan jarayonlarda ishlatiladi. dG=dH-TdS 298K
Entalpiya va entropiyaning o'zgarishini sifat jihatidan aniqlash
O'zgartirish erkin energiya tizimda sodir bo'layotgan jarayonlarni tavsiflashda uning roli yopiq tizim
G qiymati tizimning foydali ishni bajarish qobiliyatini tavsiflaydi
Jarayonning yo'nalishini aniqlash uchun Gibbs energiyasidan foydalanish mumkin.
Agar G<0, то процесс протекает самопроизвольно.
Agar G=0 bo'lsa, muvozanat yuzaga keladi.
KIMYOVIY MUVOZANAT
Kimyoviy muvozanatga ta'sir etuvchi omillar
Tizimning kimyoviy muvozanatiga kontsentratsiya, bosim (gazsimon moddalar uchun), harorat, shuningdek katalizatorlar ta'sir qiladi.
Muvozanat konstantasi
Muvozanat konstantasi nisbatga teng bo'lib, uning numeratori reaktsiya mahsulotlarining muvozanat konsentrasiyalari mahsulotini o'z ichiga oladi va maxraj boshlang'ich moddalar kontsentratsiyasining mahsulotidir, shu bilan birga barcha kontsentratsiya qiymatlari teng kuchlarda olinadi. reaksiya tenglamasida stexiometrik koeffitsientlarga. Va shuningdek, muvozanat konstantasi to'g'ridan-to'g'ri va teskari reaktsiyalarning tezlik konstantalari nisbatiga teng.
Kimyoviy muvozanatning o'zgarishi
Kimyoviy muvozanatning holati quyidagi reaktsiya parametrlariga bog'liq: harorat, bosim va kontsentratsiya. Ushbu omillarning kimyoviy reaktsiyaga ta'siri 1885 yilda frantsuz olimi Le Shatelier tomonidan umumiy ma'noda ifodalangan naqshga bo'ysunadi.
Kimyoviy muvozanatga ta'sir qiluvchi omillar:
1) harorat
Haroratning oshishi bilan kimyoviy muvozanat endotermik (absorbtsiya) reaksiyaga, pasayganda esa ekzotermik (izolyatsiya) reaktsiyaga o'tadi.
CaCO3=CaO+CO2 -Q t →, t↓ ←
N2+3H2↔2NH3 +Q t ←, t↓ →
2) bosim
Bosim oshganda kimyoviy muvozanat moddalarning kichikroq hajmiga, pasayganda esa kattaroq hajmga siljiydi. Bu tamoyil faqat gazlar uchun amal qiladi, ya'ni. agar reaksiyada qattiq moddalar ishtirok etsa, ular hisobga olinmaydi.
CaCO3=CaO+CO2 P ←, P↓ →
1mol=1mol+1mol
3) boshlang'ich moddalar va reaktsiya mahsulotlarining konsentratsiyasi
Boshlang'ich moddalardan birining konsentratsiyasining oshishi bilan kimyoviy muvozanat reaktsiya mahsulotlariga, reaktsiya mahsulotlarining konsentratsiyasining oshishi bilan esa boshlang'ich moddalarga o'tadi.
S2+2O2=2SO2 [S],[O] →, ←
Katalizatorlar kimyoviy muvozanatning siljishiga ta'sir qilmaydi!
10. LE - CHATELIER printsipi (misolni ko'rib chiqing)
Agar tizim muvozanatda bo'lsa, u holda shartlardan biri (harorat, kons., bosim) o'zgarganda, muvozanat o'zgarishga qarshi bo'lgan reaktsiya yo'nalishi bo'yicha siljiydi. N2(g)+3H2(g)<->2NH3(g) +Q
Katalizatorlar
Katalizator kimyoviy reaktsiya tezligini o'zgartiradigan, ammo yakuniy mahsulotlarning bir qismi bo'lmagan moddadir. Katalizatorlar muvozanat reaktsiyasi aralashmasining tarkibiga ta'sir qilmaydi, ammo reaktsiyani tezlashtiradi, bu kimyoviy muvozanatga erishish uchun zarur bo'lgan vaqtni qisqartiradi. Katalizatorlar (musbat katalizatorlar) va inhibitorlar (salbiy katalizatorlar) mavjud.
Gomogen va geterogen kataliz
Gomogen katalizda reaktivlar va katalizator bir fazali tizimni hosil qiladi - gaz yoki suyuqlik, katalizator va reaktivlar o'rtasida interfeys yo'q. Gomogen kataliz uchun kimyoviy reaksiya tezligi katalizator konsentratsiyasiga mutanosib ekanligi aniqlandi.
Geterogen katalizda reaksiyaga kirishuvchi moddalar va katalizator turli fazalar sistemasini hosil qiladi. Bunday holda, katalizator va reaktivlar o'rtasida interfeys mavjud. Katalizator odatda qattiq, reaktivlar esa gazlar yoki suyuqliklardir. Qattiq katalizatorning faolligi uning sirtining xususiyatlariga (hajmi, kimyoviy tarkibi, tuzilishi va holati) bog'liq. Ijobiy katalizatorlarning ta'siri reaksiyaning faollashuv energiyasining pasayishiga, boshqacha aytganda, energiya to'sig'i balandligining pasayishiga qadar kamayadi. Bu energiya darajasi past bo'lgan faollashtirilgan kompleks hosil qiladi va reaktsiya tezligi sezilarli darajada oshadi.
ATOMNING TUZILISHI VA DAVRIY QONUNI
Izotoplar, izobarlar, yadrolarning turi?
Izotoplar birinchi marta 1912 yilda J.J.Tomson tajribalarida, elektr va magnit maydonda zaryadlangan zarrachalarning burilishlarini kuzatganida kashf etilgan. Izotoplar bir xil yadroviy zaryadlarga ega, ammo massa raqamlari har xil bo'lgan bir xil kimyoviy element atomlarining navlari deb ataldi. Tabiatdagi elementlar izotoplar aralashmalaridan iborat, masalan, tabiiy uglerod 12 6 C va 13 6 C. Ammo atomlarning massasi juda kichik, shuning uchun atom massa birliklari deb ataladigan nisbiy birliklar uglerod 12 massasining 1/12 qismini tashkil qiladi. .
Izobarlar - bir xil massa soniga ega, ammo atom raqamlari har xil bo'lgan turli xil kimyoviy elementlar atomlarining navlari.
Asosiy turlari:
Shredinger tenglamasi
Potensial energiya V bo'lgan kuchlar maydonida bir o'lchovli fazoda harakatlanadigan elektron uchun quyidagi ko'rinishga ega:
-(h^2/8pi^2m)d^2shox/dx^2+Vhorns=Eshoxlar
Bu tenglamada m - elektron massasi, x - elektronning x o'qi bo'yicha koordinatasi, E - umumiy energiya, shoxlar - to'lqin funktsiyasi. To'lqin funksiyasining x koordinatasiga nisbatan ikkinchi hosilasi.
to'lqin raqamlari
l to'lqin uzunligiga bog'liq bo'lgan miqdor: k= 2p/l (2p uzunlikdagi to'lqinlar soni). V. spektroskopiyasida toʻlqin uzunligiga (1/l) oʻzaro kattalik koʻpincha deyiladi.
Pauli printsipi
Har bir orbital faqat ikkita elektronni o'z ichiga olishi mumkin va ularning spinlari qarama-qarshidir. Atomda to'rtta kvant soni bir xil bo'lgan ikkita elektron bo'lishi mumkin emas.
Gund qoidasi
Bir xil energiyaga ega bo'lgan bir nechta mumkin bo'lgan orbitallar orasida eng barqaror konfiguratsiya eng ko'p juftlanmagan elektronlarga ega bo'lgan konfiguratsiyadir.
kvant raqamlari
Bosh kvant soni n elektronning umumiy energiyasini aniqlaydi. Har bir raqam energiya darajasiga mos keladi. n=1,2,3,4…yoki K,L,M,N…
Orbital kvant soni l energiya darajasidagi pastki darajalarni aniqlaydi. l kvant soni orbitallarning shaklini aniqlaydi (n-1) 0,1,2...
Magnit kvant soni ml pastki darajadagi orbitallar sonini aniqlaydi. …-2,-1,0,+1,+2… Pastki sathdagi orbitallarning umumiy soni 2l+1.
Spin kvant soni ms ikki xil orientatsiyaga ishora qiladi +1/2 -1/2 Har bir orbitalda qarama-qarshi spinli faqat ikkita elektron bo'lishi mumkin.
Elementlarning oksidlanish darajalari
Oksidlanish darajasi (oksidlanish soni, rasmiy zaryad) - oksidlanish, qaytarilish va oksidlanish-qaytarilish reaktsiyalari jarayonlarini qayd qilish uchun yordamchi shartli qiymat, molekuladagi atomga tegishli elektr zaryadining raqamli qiymati, elektronlar juftligini olib yuradi. aloqa butunlay ko'proq elektronegativ atomlar tomon siljiydi.
Oksidlanish darajasi haqidagi g'oyalar noorganik birikmalarning tasnifi va nomenklaturasi uchun asos bo'lib xizmat qiladi.
Oksidlanish darajasi molekuladagi yoki kimyoviy rasmiy birlikdagi ionning zaryadiga yoki atomning rasmiy zaryadiga mos keladi, masalan:
Oksidlanish darajasi element belgisi ustida ko'rsatilgan. Atomning zaryadini ko'rsatishdan farqli o'laroq, oksidlanish darajasini ko'rsatganda, birinchi navbatda belgi, keyin esa raqamli qiymat qo'yiladi, aksincha emas:
Oksidlanish darajasi,
To'lovlar.
Oddiy moddadagi atomning oksidlanish darajasi nolga teng, masalan:
Molekuladagi atomlarning oksidlanish darajalarining algebraik yig'indisi har doim nolga teng:
Oksidlanish darajasi tushunchasi stoikiometrik bo'lmagan birikmalarga (KS 8, Mo 5 Si 3, Nb 3 B 4 va boshqalar) juda mos keladi. Masalan, taniqli pirit qovurish reaktsiyasida:
4FeS 2 + 11O 2 \u003d 2Fe 2 O 3 + 8SO 2
dastlabki birikmada temirning oksidlanish darajasini +3 olish eng qulaydir (garchi haqiqatda temir atomi o'zidan 2 elektronni siqib chiqaradi, ya'ni temirning oksidlanish darajasi +2 ga teng), oltingugurt uchun esa -3 ga teng. /2 (!), bu an'anaviy birlik sifatida oksidlanish darajasining ta'rifiga mutlaqo zid emas va boshqa oksidlanish-qaytarilish jarayonlaridagi kabi reaktsiyani tenglashtirishga imkon beradi.
Molekuladagi atomlarning umumiy oksidlanish darajasi har doim nolga teng.
KIMYOVIY BOG'
Aloqa tartibi
Molekulyar orbitallar nazariyasidagi bog`lanish tartibi ifoda bilan aniqlanadi
![]()
bu yerda va mos ravishda bog‘lovchi va bo‘shashuvchi orbitallardagi elektronlarning umumiy soni.
Kimyoviy bog'lanish turlari
Ma'lumki, atomlar bir-biri bilan qo'shilib oddiy va murakkab moddalar hosil qilishi mumkin. Bunda turli xil kimyoviy bog'lanishlar hosil bo'ladi: ion, kovalent (qutbsiz va qutbli), metall va vodorod. Elementlar atomlarining eng muhim xususiyatlaridan biri, ular o'rtasida qanday bog'lanish hosil bo'lishini aniqlaydi - ion yoki kovalent, elektronegativlik, ya'ni. birikmadagi atomlarning elektronlarni o'ziga jalb qilish qobiliyati.
Kimyoviy bog'lanish turi elementlarning birlashtiruvchi atomlarining elektronegativlik qiymatlaridagi farq qanchalik kattaligiga bog'liq. Bog'ni tashkil etuvchi elementlarning atomlari elektromanfiyligi jihatidan qanchalik farq qilsa, kimyoviy bog'lanish shunchalik qutbli bo'ladi. Kimyoviy bog'lanish turlari o'rtasida keskin chegara chizish mumkin emas. Ko'pgina birikmalarda kimyoviy bog'lanish turi oraliq; masalan, yuqori qutbli kovalent kimyoviy bog'lanish ionli bog'ga yaqin. Cheklovchi holatlardan qaysi biri tabiatan kimyoviy bog'lanishga yaqinroq ekanligiga qarab, u ion yoki kovalent qutb bog'lanish deb ataladi.
Elektron gibridlanish
Orbitallarning gibridlanishi - bu ko'p atomli molekula markaziy atomining turli (s, p, d) orbitallarini bir xil miqdordagi orbitallarning ko'rinishi bilan aralashtirishning faraziy jarayoni bo'lib, ular xarakteristikalari bo'yicha ekvivalentdir. Gibridlanish turlari
[tahrirlash] sp gibridizatsiyasi
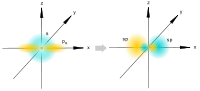
sp gibridlanishi
Bitta s- va bitta p-orbitallarni aralashtirishda paydo bo'ladi. Ikki ekvivalent sp-atom orbitallari hosil bo'ladi, ular 180 graduslik burchak ostida chiziqli joylashgan va uglerod atomining yadrosidan turli yo'nalishlarga yo'naltirilgan. Qolgan ikkita gibrid bo'lmagan p-orbitallar o'zaro perpendikulyar tekisliklarda joylashgan va p-bog'larning hosil bo'lishida ishtirok etadilar yoki yolg'iz elektron juftlari bilan band bo'ladilar.
[tahrirlash] sp 2 gibridizatsiyasi

sp 2 gibridlanishi
Bir s- va ikkita p-orbitallarni aralashtirishda paydo bo'ladi. Uch gibrid orbitallar bir xil tekislikda joylashgan va uchburchakning uchlariga 120 graduslik burchak ostida yo'naltirilgan o'qlar bilan hosil bo'ladi. Gibrid bo'lmagan p-atomik orbital tekislikka perpendikulyar bo'lib, qoida tariqasida p-bog'larning hosil bo'lishida ishtirok etadi.
[tahrirlash] sp 3 gibridlanishi
![]()
sp 3 gibridlanishi
Bir s- va uchta p-orbitallarni aralashtirishda yuzaga keladi, shakli va energiyasi bir xil bo'lgan to'rtta sp3-gibrid orbitallarni hosil qiladi. Ular boshqa atomlar bilan to'rtta s-bog' hosil qilishi yoki yolg'iz elektron juftlari bilan to'ldirilishi mumkin.
sp3-gibrid orbitallarning o'qlari muntazam tetraedrning uchlariga yo'naltirilgan. Ularning orasidagi tetraedral burchak 109°28" ni tashkil etadi, bu eng kichik elektron itarilish energiyasiga to'g'ri keladi. Sp3 orbitallari boshqa atomlar bilan ham to'rtta s-bog' hosil qilishi yoki bo'linmagan elektron juftlari bilan to'ldirilishi mumkin.
Gibridlanish va molekulyar geometriya
Atom orbitallarining gibridlanishi haqidagi g'oyalar Gillespi-Nyholm elektron juftlarini itarish nazariyasi asosida yotadi. Gibridlanishning har bir turi markaziy atomning gibrid orbitallarining qat'iy belgilangan fazoviy yo'nalishiga mos keladi, bu esa uni noorganik kimyoda stereokimyoviy tushunchalarning asosi sifatida ishlatishga imkon beradi.
Jadvalda gibridlanishning eng keng tarqalgan turlari va molekulalarning geometrik tuzilishi o'rtasidagi muvofiqlik misollari keltirilgan, bunda barcha gibrid orbitallar kimyoviy bog'lanishlar hosil bo'lishida ishtirok etadi (bo'linmagan elektron juftlari mavjud emas).
| Gibridlanish turi | Gibrid orbitallar soni | Geometriya | Tuzilishi | Misollar |
| sp | Chiziqli | | BeF 2, CO 2, NO 2 + | |
| sp 2 | uchburchak |  | BF 3 , NO 3 – , CO 3 2– | |
| sp 3 | tetraedral | 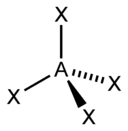 | CH 4, ClO 4 –, SO 4 2-, NH 4 + | |
| dsp2 | tekis kvadrat |  | Ni(CO) 4 , XeF 4 | |
| sp 3 d | Olti burchakli | 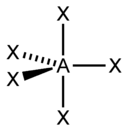 | PCl 5, AsF 5 | |
| sp 3 d 2 | Oktaedral | 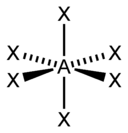 | SF 6 , Fe(CN) 6 3– , CoF 6 3– |
Sigma va pi ulanishi
Sigma- va pi-bog'lar (s- va p-bog'lar), kovalent kimyoviy bog'lanishlar, elektron zichlik taqsimotining aniq, ammo turli fazoviy simmetriyasi bilan tavsiflanadi. Ma'lumki, kovalent bog'lanish o'zaro ta'sir qiluvchi atomlarning elektronlarining ijtimoiylashuvi natijasida hosil bo'ladi. Olingan s-bog'li elektron buluti aloqa chizig'iga, ya'ni o'zaro ta'sir qiluvchi atomlarning yadrolarini bog'laydigan chiziqqa nisbatan simmetrikdir. Kimyoviy birikmalardagi oddiy bog'lanishlar odatda (t-bog'lar (qarang. Oddiy bog'). p-bog' elektron buluti bog'lanish chizig'idan o'tadigan tekislikka nisbatan simmetrikdir (1-rasm, b), va bu tekislikda (tugun deb ataladi) ) elektron zichligi tengdir Yunoncha s va p harflarining ishlatilishi atom elektronlarini belgilashda ularning lotin harflari s va p harflariga mos kelishi bilan bog'liq bo'lib, ular ishtirokida birinchi marta bu mumkin bo'ladi. mos ravishda s- va p-bog'larni hosil qilish uchun.p z) Dekart koordinatalarining mos o'qlariga (x, y, z) nisbatan simmetrik bo'lsa, u holda bitta p-orbital, masalan, p z, s- hosil bo'lishida ishtirok etsa. bog'lanish (z o'qi - aloqa liniyasi), qolgan ikkita p-orbital (p x, p y) ikkita p-bog'ning hosil bo'lishida ishtirok etishi mumkin (ularning tugun tekisliklari mos ravishda yz va xz bo'ladi; 2-rasmga qarang). ) d- (1-rasmga qarang) va f ham atomning s va p-bog'lari -elektronlarini hosil qilishda ishtirok etishi mumkin.Agar molekuladagi atomlar o'rtasida bo'lsa. ikkala s- va p-bog'lar bir vaqtning o'zida hiqichoq bo'ladi, keyin hosil bo'lgan bog'lanish ko'p bo'ladi (2-rasmga qarang). ko'p bog'lanish, qo'sh bog'lanish, uch bog'lanish va valentlik).  Guruch. 1. s - s-, s - p s - , p s - p s - o'zaro ta'sirlar (a) va p p - natijasida p-bog'lanishlar natijasida s-bog' hosil bo'lishida orbitallarning fazoviy yo'nalishini sxematik ko'rinishi. , p p -, d p - d p - o'zaro ta'sirlar ( b). Guruch. 1. s - s-, s - p s - , p s - p s - o'zaro ta'sirlar (a) va p p - natijasida p-bog'lanishlar natijasida s-bog' hosil bo'lishida orbitallarning fazoviy yo'nalishini sxematik ko'rinishi. , p p -, d p - d p - o'zaro ta'sirlar ( b). 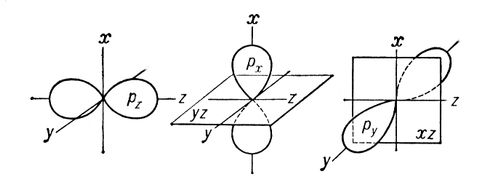 Guruch. 2. Bulutlar p x -, p y -, p z - elektronlarning sxematik tasviri. Dekart koordinatalarining o'qlari va tugun tekisliklari p x - va p y - orbitallar ko'rsatilgan. Guruch. 2. Bulutlar p x -, p y -, p z - elektronlarning sxematik tasviri. Dekart koordinatalarining o'qlari va tugun tekisliklari p x - va p y - orbitallar ko'rsatilgan. |
Dipol momenti
Yagona va ko'p ulanish
s va p munosabatlari. Yagona va ko'p obligatsiyalar
Ikki atom ham bir-biri bilan bir nechta bog'lanish, ya'ni qo'sh va uch bog'lanish hosil qilishi mumkin. Bunday holda, birinchi hosil bo'lgan komponent har doim s-bog' bo'ladi (u eng yuqori kuchga ega va molekulaning geometrik shaklini aniqlaydi).
Ikkinchi va uchinchi komponentlar p-bog'lar deb ataladi, ular har qanday orbitallarning lateral qoplanishi natijasida hosil bo'ladi, bundan tashqari. s-orbitallar: 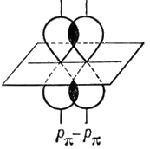

Masalan, 2 p-ikki uglerod atomining orbitallari o'zaro o'zaro hosil bo'lishi mumkin bitta, juft va uchlik ulanishlar. Birinchi holda, molekulaning skeleti hosil bo'ladi etan C2H6.
Da ikki barobar birinchi navbatda uglerod atomlarini bog'lash 2 p-orbitallar s-bog', ikkinchisi esa p-bog' hosil qiladi; bu holda molekulaning skeleti hosil bo'ladi etilen C2H4.
Da uchlik bog'lanish (bitta s-bog', ikkita p-bog') molekulaning asosiy suyagi hosil bo'ladi. asetilen C2H2.
Bunday ko'p aloqalar har doim bitta bog'lanishga qaraganda qisqaroq va kuchliroq bo'lib, ularni uzish qiyinroq. Ko'pincha bu tushuntiradi kimyoviy inertlik moddalar - azot N 2 (:N≡N:) va karbonat angidrid CO 2 (O=C=O) kabi.
Bilan zarrachalarga misollar karrali bog'lar ham SO 3, SO 2, NO 2 molekulalari va CO 3 2−, SO 4 2−, SO 3 2− anionlaridir.
Ion bog'lanish va uning xossalari
Bir yoki bir nechta elektronning atomlar o'rtasida to'liq o'tkazilishi natijasida hosil bo'ladi. Elektron(lar)ni bergan atom kationga, uni qabul qilgan atom esa anionga aylanadi. Ion qarama-qarshi zaryadlangan ionlar orasidagi elektrostatik tortishish kuchlari natijasida paydo bo'ladi. Ion bog'lanish atomlari elektromanfiylik qiymatlarida katta farqga ega bo'lgan birikmalar va elementlarga xosdir, u gidroksidi metallar (elektromusbat elementlar) va galogenlar (elektronegativ elementlar) atomlari o'rtasida sodir bo'ladi. XUSUSIYATLARI
Ionli birikmalarning tuzilishi
Ideal ionli birikmaning tuzilishi, farqli o'laroq ionlar orasidagi maksimal tortishish va o'xshash ionlarning minimal itarilishi tufayli, asosan, kationlar va anionlarning ion radiuslari nisbati bilan belgilanadi. Buni oddiy geometrik konstruktsiyalar bilan ko'rsatish mumkin.
51. Donor-akseptor aloqasi. Uning xossalari, misollar keltiring
Donor-akseptor mexanizmi (aks holda muvofiqlashtirish mexanizmi) - bu ikkita atom yoki bir guruh atomlar o'rtasida kovalent kimyoviy bog'lanishni shakllantirish usuli bo'lib, u elektron juftligi, donor atomi va erkin orbital tufayli amalga oshiriladi. qabul qiluvchi atom.
"Donor-akseptor aloqasi" yoki "koordinatsion aloqa" atamalari noto'g'ri, chunki bu kimyoviy bog'lanishning bir turi emas, balki uning shakllanishining o'ziga xosligini tavsiflovchi nazariy modeldir. Donor-akseptor mexanizmi orqali hosil bo'lgan kovalent kimyoviy bog'lanishning xossalari almashinish mexanizmi orqali hosil bo'lgan bog'lanish xususiyatlaridan hech qanday farq qilmaydi (masalan, ammoniy ionidagi N-H bog'lari NH 4+ yoki gidroksoniy ionidagi O-H bog'lari). H 3 O +).

Ammiak va bor triflorid qo'shimchasining hosil bo'lishi
Donorlar odatda azot, kislorod, fosfor, oltingugurt va boshqalar atomlari bo'lib, ular kichik valentlik orbitallarda bo'linmagan elektron juftlariga ega. Akseptor rolini ionlangan vodorod atomi H +, ba'zi p-metallar (masalan, AlH 4 - ionini hosil qilishda alyuminiy) va, xususan, to'ldirilmagan energiya hujayralariga ega bo'lgan d-elementlar bajarishi mumkin. valent elektron qatlami.
Donor-akseptor mexanizmi nuqtai nazaridan murakkab (koordinatsion) birikmalarning molekulalari va molekulyar ionlarida lokalizatsiyalangan kovalent bog'lanishlarning shakllanishi tasvirlangan: bog'lanish ligand elektronlarining yolg'iz juftligi va erkin orbital tufayli hosil bo'ladi. kompleks hosil qiluvchi atom. Donor-akseptor mexanizmi, shuningdek, zaryad o'tkazuvchi komplekslar kabi reaktsiya oraliqlarining shakllanishini ham tavsiflaydi.
Donor-akseptor mexanizmi modeli faqat valentlik kontseptsiyasi doirasida kovalent bog'lanishlar hosil bo'lganda elektron zichligini lokalizatsiya qilish (valentlik sxemalari usuli) doirasida mavjud. Molekulyar orbital usul doirasida bunday tasvirlarga ehtiyoj qolmaydi.
Vodorod aloqasi
Bu molekulalararo o'zaro ta'sirlarning bir turi. Bu bog'lanishlar juda elektronegativ A atomiga kovalent bog'langan H atomi va bog'ni hosil qilish uchun erkin juft elektronni ta'minlay oladigan elektronegativ B atomi orasidagi zaif doimiy kuchlardir. Vodorod aloqasi uchta nuqta bilan ifodalanadi. -A-N ... B-
Vodorod aloqalari faqat eng elektron manfiy elementlarning atomlari bilan hosil bo'ladi. Ularning eng muhimlari F, O, N, Cl. QO'SHIMCHA
53. Molekulyar ta’sir kuchlari, ularning xossalari (van der Vaals kuchlari)
Van der Vaals kuchlari o'zaro ta'sirlarning bir nechta turlarini o'z ichiga oladi: orientatsion dipol-dipol, induksiya va dispersiya.
1) Agar bir xil moddaning ikkita molekulasi yoki har xil moddalar doimiy dipol bo'lsa, u holda ular bir-biriga qarama-qarshi zaryadlangan qirralar bilan tortiladi va shunga mos ravishda fazoda yo'naltiriladi. FORMULA (172-bet).
2) Induktiv o'zaro ta'sir qutbli molekula qo'shni qutbsiz molekulaning qutblanishiga olib keladi (dipolni induktsiya qiladi). Bundan tashqari, ular kosmosda bir-biriga nisbatan yo'naltirilgan. Yakuniy natija - o'zaro ta'sir: dipol - induktsiyalangan dipol. FORMULA (172-bet).
3) Dispersion o'zaro ta'sirlar neytral atomlar, masalan, nobel gaz atomlari yoki molekulalar, shu jumladan qutbsiz molekulalar o'rtasidagi zaif tortishish kuchlari. FORMULA (173-bet).
ECHIMLAR
Yechim nima
Eritmalar - ikki yoki undan ortiq komponentlarni o'z ichiga olgan o'zgaruvchan tarkibli termodinamik barqaror bir hil tizimlar. Konsentratsiyasi boshqa barcha moddalardan katta bo'lgan moddalar erituvchi, boshqa moddalar esa erigan deb ataladi. Eritmadagi erituvchining fazaviy holati o'zgarmaydi, masalan, suv eritmada suyuq holatda qoladi. Eritmalar suyuq, qattiq va gazsimon.
Suv
Suv er yuzidagi eng keng tarqalgan erituvchilardan biridir. Suv molekulasi burchakli tuzilishga ega: (105 daraja). O-H kimyoviy bogʻi kovalent, lekin umumiy elektron jufti O atomiga tortiladi.Har bir H atomida musbat zaryad, O.da manfiy zaryad paydo boʻladi. Bu qisman zaryadlar molekulaning qutblanishini hosil qiladi, bu esa erituvchi sifatida suvga o'ziga xos xususiyatlarni beradi. Toza suv O va OH ning past konsentratsiyasiga ega va elektr tokini yomon o'tkazuvchi hisoblanadi. Molekulyar vodorod aloqalari suvning xususiyatlariga sezilarli ta'sir ko'rsatadi. Vodorod aloqalari bilan bog'langan suv molekulalari ochiq fazoviy panjara hosil qiladi. Suv uchta agregat holatida bo'lishi mumkin: suyuq, qattiq (muz) yoki gazsimon (bug '). Suvning bug'lanishi va muzning sublimatsiyasi har qanday haroratda sodir bo'ladi.
Suv molekulalari assotsiatsiyasi
Doimiy dipollar bo'lgan suv molekulalari o'zaro bog'liq bo'lishi mumkin
qarama-qarshi zaryadlangan qutblarni jalb qilish ikki, uch va hokazolarda birlashtirilishi mumkin.
Biroq, bu holatda harakat qiluvchi jozibali kuchlar kichik, suvda esa shunga o'xshash
dipol assotsiatsiyasi faqat kichik rol o'ynaydi.
Suv molekulalarining assotsiatsiyasi uchun asosiy ahamiyatga ega
vodorod aloqalari deb ataladi. Ikkinchisi vodorodni jalb qilish tufayli paydo bo'ladi
Quyidagi sxema bo'yicha bir suv molekulasi kislorodga o'tadi:
H
?
O-N O-N
.
.
H
Bunday diqqatga sazovor joylarning ehtimoli borligi haqidagi taxminga mos keladi
molekulada vodorod (?H = ?0,33) va kislorod (?O = ?0,66) uchun samarali zaryadlar
suv.
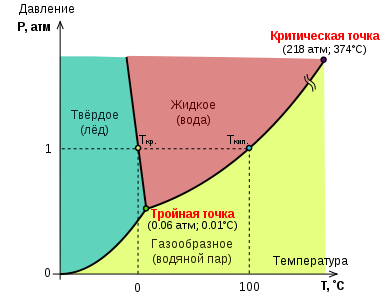
Suv holati diagrammasi
Noelektrolitlarning eritmalari
Noelektrolitlar - suvli eritmalari va eritmalari elektr tokini o'tkazmaydigan moddalar, chunki ularning molekulalari ionlarga ajralmaydi.
65. Raulning birinchi va ikkinchi qonunlari!
Raulning birinchi qonuni eritma ustidagi toʻyingan bugʻ bosimini uning tarkibiga bogʻlaydi; u quyidagicha tuzilgan:
Eritma komponentining to'yingan bug'ining qisman bosimi uning eritmadagi mol ulushiga to'g'ridan-to'g'ri proportsionaldir va proportsionallik koeffitsienti sof komponent ustidagi to'yingan bug' bosimiga teng.
Kitob 2-qism 1.6
Elektrolit eritmalari
Kuchli elektrolitlar suvli eritmalarda deyarli butunlay ionlarga parchalanganligi sababli, ionlarning konsentratsiyasi yuqori bo'lishi mumkin. Kuchli elektrolitlarning konsentrlangan eritmalarida ionlar shunchalik yaqinlashadiki, ular orasidagi o'zaro ta'sir juda muhim bo'ladi. Ionlararo o'zaro ta'sir tufayli ionlarning harakatchanligi pasayadi va kimyoviy reaktsiyalarda ionlarning ishtirokida konsentratsiyani kamaytirish effekti hosil bo'ladi. Shuning uchun ionlar kimyoviy reaksiyalarga haqiqiy kontsentratsiyasiga muvofiq emas, balki ularning ko'rinadigan konsentratsiyasiga - faolligiga muvofiq kiradi. Eritmadagi ionning faolligi va konsentratsiyasi o'rtasida bog'liqlik mavjud: ai=yi*ci .
Izotonik nisbat
Ideal bo'lmagan yechimlarning ularning fizik xususiyatlariga ta'sirini hisobga olish imkonini beradi. Erigan moddalar molekulalari dissotsilanishi mumkin, bu elektrolitlar eritmalari uchun xosdir, lekin dissotsilanish bilan birga molekulalarning assotsiatsiyasi ham sodir bo'lishi mumkin. Eritmadagi zarrachalar sonining ularning dissotsilanish va assotsiatsiya jarayonlari tufayli o'zgarishini hisobga olish uchun izotonik koeffitsient i qo'llaniladi.
Izotonik koeffitsient erigan moddaning zarrachalari sonining dastlabki holatdagi zarrachalari soniga nisbatini ifodalaydi. Noelektrolitlar eritmalari uchun izotonik koeffitsient 1 ga, dissotsilanish jarayoni i.k. 1 dan katta, assotsiatsiya 1 dan kichik. Izotonik koeffitsientni eksperimental aniqlash erigan moddaning dissotsilanish yoki assotsiatsiya darajasini hisoblash imkonini beradi.
Amfoter gidroksidlar
Amfoter gidroksidlar kislotali muhitda asos kabi, ishqoriy muhitda esa kislota kabi harakat qiladigan kimyoviy moddalardir.
Har bir davr ichida metallarning xossalariga ega bo'lgan elementlar metallarning ham, metall bo'lmaganlarning ham xususiyatlarini ko'rsatadigan elementlar bilan almashtiriladi. Bu elementlarning birikmalari amfoter deyiladi. Alyuminiy elementi birikmalarda metall va metall bo'lmagan xususiyatlarni namoyish etadi. Shunga o'xshash xususiyatlar A-guruhlarining elementlari - Be, Ga, Ge, Sn, Pb, Sb, Bi va boshqalar, shuningdek, B-guruhlarning aksariyat elementlari - Cr, Mn, Fe, Zn, Cd va boshqalar. Ularning deyarli barchasi suvda erimaydi va kuchsiz elektrolitlardir.
Qizdirilganda aralashmalar parchalanadi. Ko'pgina hollarda metall gidroksidning o'zaro ta'sirida tegishli kislotaning gidroksosalti hosil bo'ladi: masalan, Al(3+), Cr(3+), Zn(2+) va boshqa ko'plab metallar uchun o'zaro ta'sir shunday davom etadi. Bu reaktsiya teskari bo'lib, muvozanat holati muhitning metall pH tabiatiga va qisman haroratga bog'liq. Metallning koordinatsion soni past bo'lgan ionlar eritmada ham bo'lishi mumkin.
Ion faolligi
Faoliyat (ionlar) - eritmadagi ionlar orasidagi elektrostatik o'zaro ta'sirni hisobga olgan holda samarali kontsentratsiya. Faoliyat konsentratsiyadan ma'lum miqdorda farq qiladi. Faoliyatning (a) eritmadagi moddaning konsentratsiyasiga nisbati (c, g-ion / l da) faollik koeffitsienti deb ataladi: g \u003d a / c.
Faoliyat omili
Aktivlik koeffitsienti - bu eritmaning berilgan komponenti faolligining uning konsentratsiyasiga nisbati, bu haqiqiy eritmalar xossalarining ideal eritmalar xossalaridan chetlanishini tavsiflaydi. Ideal eritmalarda va cheksiz suyultirishda K. va. birga teng. K. a ning taxminiy qiymatlari. Debay-Gyukkel tenglamasi bilan hisoblangan.
Suv dissotsiatsiyasi
Suvning dissotsiatsiyasi - bu suvning tarkibiy kimyoviy elementlarga parchalanishi, ba'zida parchalanuvchi eritmada bo'lmagan yoki parchalanish boshlanishidan oldin kamroq miqdorda bo'lgan yangi elementlarning paydo bo'lishi bilan sodir bo'ladi. dissotsiatsiya jarayoni.
Suvning dissotsiatsiyasi endotermik reaksiya (qarang. Endotermik reaksiya), ya'ni. atrof-muhitdan issiqlikni yutish bilan ketadi.
Suvni ajratishning ma'lum usullari:
1. Suvli elektrolitlar eritmalarini elektroliz qilish. - bugungi kunda ma'lum bo'lgan eng kam samarali suv parchalanish usuli, chunki bu holda energiya asosan o'tkazgichni - elektrolitni isitish uchun sarflanadi, shuning uchun tarqalib ketgan eritma nafaqat soviydi, balki aksincha, sezilarli darajada ta'sir qiladi. isitish. 20-asr sanoatida aynan shu usul eng koʻp qoʻllanilgan edi, chunki u talabni taʼminlaydi va qayta tiklanmaydigan energiya manbalari kabi elektr energiyasi olinadigan tovarlarga, masalan, neftga, yuqori narxlarni ushlab turishga imkon beradi. gaz, ko'mir va boshqalar.
2. Markazdan qochma maydonda suvning parchalanish jarayoni modeli Masalan, aylanuvchi barabanga qizdirilgan elektrolit quyiladi, bunda aylanish jarayonida boshlanayotgan elektrokimyoviy jarayon natijasida suv vodorod va kislorodga parchalanadi. Bu jarayon tashqi manbaning kinetik energiyasi va qizdirilgan elektrolitning issiqlik energiyasidan foydalangan holda suvni parchalaydi. Ushbu jarayonga asoslanib, bir qator patentlar mavjud bo'lib, ulardan biri (RU 98/00190 (22.06.1998)) mualliflar - Kudymov G.I. va Studennikov V.V. Ular, boshqa narsalar qatorida, atrof-muhitning issiqligini o'zlashtiradigan issiqlik pompasi kabi joylashtirilgan, shuning uchun bu erda vodorod-kislorod aralashmasini ishlab chiqarish ko'p jihatdan atrof-muhit energiyasi yoki energiya tufayli amalga oshiriladi. odatda qaytarib bo'lmaydigan issiqlikni yo'qotadi, masalan, chiqindi gazlar ichki yonish dvigatellari .
Suvning ion mahsuloti
Suv ionlari konsentratsiyasi mahsulotining muvozanat qiymati suvning ion mahsuloti deyiladi. U Kv deb belgilangan va 10 -14 Kv \u003d (H +) (OH -) ga teng.
Vodorod indeksi (pH)
pH - vodorod ionlarining muvozanat konsentratsiyasining manfiy o'nlik logarifmi. Eritma muhitini aniqlash uchun pH qiymatidan foydalanish mumkin. PH qiymati maxsus qurilma - pH o'lchagich yordamida, shuningdek indikatorlar yordamida aniqlanadi. Shuningdek, pH ni gidroksid ionlarining pH=14-pOH muvozanat konsentratsiyasi orqali aniqlash mumkin.
Eruvchanlik mahsuloti
Yomon eriydigan ionli birikmaning toʻyingan eritmasida maʼlum haroratda uning ionlari konsentratsiyasining koʻpaytmasi doimiy qiymat boʻlib, eruvchanlik mahsuloti deyiladi. PR faqat yomon eriydigan kuchli elektrolitlar uchun amal qiladi, ya'ni eritmada ular to'liq ionlarga parchalanishi va ikkilamchi reaktsiyalarda qatnashmasligi kerak.
Agar birikmaning kimyoviy formulasi birlikdan tashqari stoxiometrik koeffitsientlarni o'z ichiga olsa, u holda ion kontsentratsiyasi ularning stexiometrik koeffitsientlariga teng kuchlarda olinadi.
Uchta gidroliz holati
Gidrolizning uchta varianti mavjud:
1) Kation gidrolizi - zaif asos kationi va kuchli kislota anioni bo'lgan tuzning gidrolizi.
2) Anion gidrolizi - kuchli asos kationi va kuchsiz kislota anioni bo'lgan tuzning gidrolizi.
3) Kation va anion bilan gidroliz - kuchsiz asosning kationi va kuchsiz kislotaning anioni bo'lgan tuzning gidrolizlanishi.
bufer eritmalari
Moddaning (yoki tizimning) ichki energiyasi bu moddani tashkil etuvchi zarrachalarning umumiy energiyasidir (shuningdek, § 54 ga qarang). U zarrachalarning kinetik va potentsial energiyalaridan tashkil topgan. Kinetik energiya - zarrachalarning translatsiya, tebranish va aylanish harakati energiyasi; potentsial energiya zarralar o'rtasida ta'sir qiluvchi tortishish va itarilish kuchlariga bog'liq.
Ichki energiya moddaning holatiga bog'liq. Muayyan jarayonda AU tizimining ichki energiyasining o'zgarishini aniqlash mumkin. Ayrim jarayon natijasida sistema A ishni bajarayotib, tashqi muhitdan issiqlikni yutish bilan birga dastlabki holat 1 dan oxirgi holat 2 ga o‘tsin.
Ko'rinib turibdiki, tizimning ichki energiyasi A ga kamayadi, Q ga ortadi va yakuniy holatda ga teng bo'ladi.
bu yerda va - sistemaning dastlabki (1) va yakuniy (2) holatlardagi ichki energiyasi. Agar farqni bilan belgilasak, tenglamani quyidagicha ifodalash mumkin:
![]()
Bu tenglama energiyaning saqlanish qonunini ifodalaydi, unga ko'ra ichki energiyaning o'zgarishi jarayonning borish usuliga bog'liq emas, faqat tizimning boshlang'ich va oxirgi holatlari bilan belgilanadi. Biroq, energiyaning qaysi qismi ishni bajarish uchun ketadi va nima issiqlikka aylanadi - bu jarayon qanday amalga oshirilishiga bog'liq: ish va issiqlik o'rtasidagi nisbat har xil bo'lishi mumkin. Xususan, agar jarayon davomida hech qanday ish bajarilmasa, shu jumladan tashqi bosimga qarshi kengayish ishi, ya'ni tizimning hajmi o'zgarmasa, u holda
doimiy hajm sharoitida tizim tomonidan yutilgan issiqlik qayerda.
Oxirgi tenglama turli jarayonlarda ichki energiyaning o'zgarishini aniqlash imkonini beradi. Masalan, moddani doimiy hajmda qizdirganda, ichki energiyaning o'zgarishi ushbu moddaning issiqlik sig'imi bilan belgilanadi:
Bu erda doimiy hajmdagi moddaning molyar issiqlik sig'imi; n - moddaning miqdori; yakuniy va dastlabki haroratlar orasidagi farqdir.
Kimyoviy reaksiya tizimning hajmi o'zgarmasdan ketayotgan bo'lsa, ichki energiyaning o'zgarishi bu reaktsiyaning teskari belgi bilan olingan issiqlik effektiga teng bo'ladi.
bu erda n - moddaning miqdori; Cp - doimiy bosimdagi moddaning molyar issiqlik sig'imi.
Moddaning agregatsiya holatidagi o'zgarishlar va allotropik o'tishlar bilan entalpiyaning o'zgarishi mos keladigan o'zgarishlarning issiqligiga (erish, qaynash, bir modifikatsiyadan ikkinchisiga o'tish) kattaligi bo'yicha teng, ammo belgisiga qarama-qarshidir. Nihoyat, kimyoviy reaksiya bo'lsa, entalpiyaning o'zgarishi qarama-qarshi belgi bilan olingan doimiy harorat va doimiy bosimda amalga oshirilgan reaksiyaning issiqlik effektiga teng bo'ladi.
Entalpiya, ichki energiya kabi, moddaning energiya holatini tavsiflaydi, lekin tashqi bosimni engish uchun sarflangan energiyani, ya'ni kengayish ishini o'z ichiga oladi. Ichki energiya singari, entalpiya tizimning holati bilan belgilanadi va bu holatga qanday erishilganiga bog'liq emas. Gazlar holatida, ma'lum bir jarayon davomida va o'rtasidagi farq sezilarli bo'lishi mumkin. Tarkibida gazlar bo'lmagan tizimlarda jarayon bilan birga keladigan ichki energiya va entalpiyadagi o'zgarishlar bir-biriga yaqin bo'ladi. Bu moddalarning kondensatsiyalangan (ya'ni qattiq yoki suyuq) holatlardagi jarayonlarida hajm o'zgarishi odatda juda kichik bo'lishi va qiymat bilan solishtirganda kichik bo'lishi bilan izohlanadi.

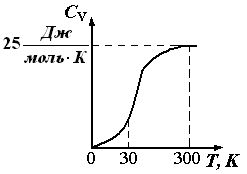 Guruch. 1.6. Kristalli moddalarning issiqlik sig'imining haroratga bog'liqligi
Guruch. 1.6. Kristalli moddalarning issiqlik sig'imining haroratga bog'liqligi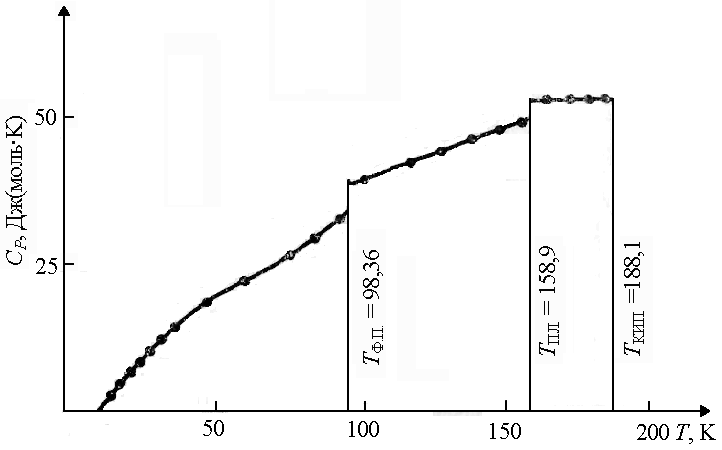
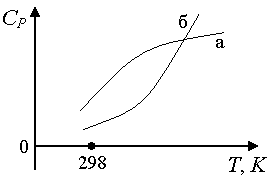 Guruch. 1.8. Gazlar issiqlik sig'imining haroratga bog'liqligi: a) egri chiziq past bo'lsa ^
T yuqoriga qaraganda kattaroq egrilikka ega, uni quyidagi shakldagi empirik kuch qatori bilan tavsiflash afzaldir: C P
= a + ichidaT + c'/T 2; b) egri chiziq b Shaklning quvvat seriyasi: C P = a + ichidaT + cT 2
Guruch. 1.8. Gazlar issiqlik sig'imining haroratga bog'liqligi: a) egri chiziq past bo'lsa ^
T yuqoriga qaraganda kattaroq egrilikka ega, uni quyidagi shakldagi empirik kuch qatori bilan tavsiflash afzaldir: C P
= a + ichidaT + c'/T 2; b) egri chiziq b Shaklning quvvat seriyasi: C P = a + ichidaT + cT 2




