Göreceli kütle nedir. Atomik kütle formülü
Herhangi bir cismin kütlesi vardır. Elma çuvalı gibi bir beden alalım. Bu vücudun kütlesi var. Kütlesi, torbadaki her elmanın kütlesinin toplamı olacaktır. Bir torba pirincin de kütlesi vardır, bu da çok küçük ve hafif olmalarına rağmen tüm pirinç tanelerinin kütlesinin eklenmesiyle belirlenir.
Bütün bedenler maddeden yapılmıştır. Bir cismin kütlesi, kendisini oluşturan maddelerin kütlesinden oluşur. Maddeler sırayla parçacıklardan, moleküllerden veya atomlardan oluşur, bu nedenle bir maddenin parçacıklarının da kütlesi vardır.
§ 2. Atomik kütle birimi
Bir oksijen atomunun kütlesi yaklaşık on altı kat daha büyüktür ve 2.66'dır.∙ 10-23 g, bir karbon atomunun kütlesi 1.99∙ 10 -23 g Bir atomun kütlesi gösterilir -ben.
Bu durumda, bir hidrojen atomunun kütlesi 1 amu, bir oksijen atomunun kütlesi 16 amu ve bir karbon atomunun kütlesi 12 amu olacaktır.
Kimyagerler, uzun süredir, herhangi bir elementin bir atomunun, bizim için tanıdık ve uygun olan kütle birimlerinde (gram, kilogram vb.) Ne kadar ağır olduğu konusunda en ufak bir fikre sahip değildi.
Bazı elementlerin atomlarının diğerlerinden kaç kat daha ağır olduğu belirlenmeye çalışıldı. Böylece, bilim adamları bir elementin atomunun kütlesini başka bir elementin atomunun kütlesi ile karşılaştırmaya çalıştılar.
Bu sorunun çözümü de büyük zorluklarla ve her şeyden önce bir standart seçimiyle, yani. kimyasal element, kalan elementlerin atomik kütlelerinin karşılaştırılmasının yapılması gerektiğine göre.
§3 . Göreceli atomik kütle
19. yüzyılın bilim adamları, bu sorunu, maddelerin bileşimini belirlemek için deneysel veriler temelinde çözdüler. En hafif atom olan hidrojen atomu standart olarak alındı. Deneysel olarak, oksijen atomunun hidrojen atomundan 16 kat daha ağır olduğu bulundu. bağıl kütle(hidrojen atomunun kütlesine göre) 16'dır.
 Bu değer harflerle belirtilmiştir. Bir r (dizin " r " - ilk harften ingilizce kelime"akraba" - akraba). Bu nedenle, kimyasal elementlerin bağıl atom kütlelerinin değerinin kaydı şöyle görünmelidir: hidrojenin bağıl atom kütlesi 1, oksijenin bağıl atom kütlesi 16, karbonun bağıl atom kütlesi 12'dir.
Bu değer harflerle belirtilmiştir. Bir r (dizin " r " - ilk harften ingilizce kelime"akraba" - akraba). Bu nedenle, kimyasal elementlerin bağıl atom kütlelerinin değerinin kaydı şöyle görünmelidir: hidrojenin bağıl atom kütlesi 1, oksijenin bağıl atom kütlesi 16, karbonun bağıl atom kütlesi 12'dir.
Bağıl atom kütlesi, bir kimyasal elementin atomunun kütlesinin, standart olan bir atomun kütlesinden kaç kat daha büyük olduğunu gösterir, bu nedenle bu değerin boyutu yoktur.
Daha önce de belirtildiği gibi, başlangıçta atom kütlelerinin değerleri, hidrojen atomunun kütlesine göre belirlendi. Daha sonra, atomik kütleleri belirlemek için standart, bir karbon atomunun kütlesinin 1/12'siydi (bir karbon atomu, bir hidrojen atomundan 12 kat daha ağırdır).
Bir elementin bağıl atom kütlesi ( bir r ) bir kimyasal elementin atomunun kütlesinin bir karbon atomunun kütlesinin 1/12'sine oranıdır.
Kimyasal elementlerin atom kütlelerinin değerleri, periyodik kimyasal element sisteminde D.I. Mendeleyev. Periyodik tabloya bir göz atın ve hücrelerinden herhangi birini, örneğin 8 numarayı düşünün.
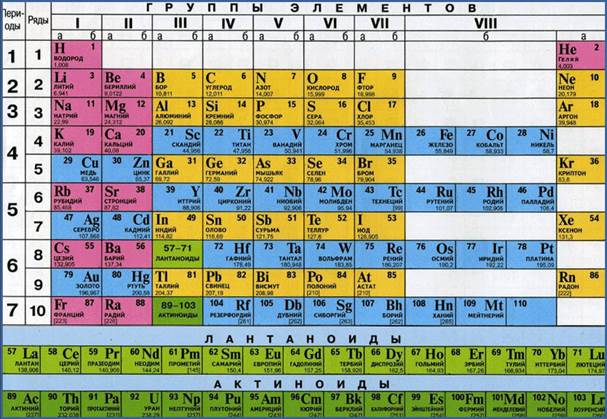
Altında kimyasal işaret ve alt satırdaki isim değeri gösterir atom kütlesi kimyasal element:oksijenin bağıl atom kütlesi 15.9994'tür. Lütfen dikkat: hemen hemen tüm kimyasal elementlerin bağıl atom kütleleri kesirli bir değere sahiptir. Bunun nedeni izotopların varlığıdır. İzotoplara aynı kimyasal elementin, kütlece biraz farklı atomlar dendiğini hatırlatmama izin verin.
Okulda, hesaplamalar genellikle tam sayılara yuvarlanmış göreceli atom kütlelerinin değerlerini kullanır. Ancak birkaç durumda kesirli değerler kullanılır, örneğin: klorun bağıl atom kütlesi 35.5'tir.
§ 4. Bağıl moleküler ağırlık
Atom kütlelerinin toplamı bir molekülün kütlesine eşittir.
Bir maddenin bağıl moleküler ağırlığı, bu maddenin bir molekülünün kütlesinin, bir karbon atomunun kütlesinin 1/12'sinden kaç kez daha büyük olduğunu gösteren bir sayıdır.
Bağıl moleküler ağırlık − ile gösterilirBay
Maddelerin bağıl moleküler ağırlığı, maddelerin bileşimini ifade eden kimyasal formüllerden hesaplanır. Göreceli moleküler kütleyi bulmak için, bir maddenin molekülünü oluşturan elementlerin bağıl atom kütlelerinin değerlerini, kantitatif bileşimi, yani her bir elementin atom sayısını dikkate alarak toplamak gerekir. (içinde kimyasal formüller indeksler kullanılarak ifade edilir). Örneğin, aşağıdaki formüle sahip suyun bağıl moleküler ağırlığı H2O , göreceli iki değerin toplamına eşittir
hidrojenin atom kütlesi ve oksijenin bağıl atom kütlesinin bir değeri:![]()
Formüle sahip sülfürik asidin bağıl moleküler ağırlığı H 2 SO 4 toplamına eşittir
bağıl hidrojen atom kütlesinin iki değeri, bağıl kükürt atom kütlesinin bir değeri ve bağıl atom oksijen kütlesinin dört değeri:![]() .
.
Bağıl moleküler ağırlık, boyutsuz bir miktardır. Atomik kütle birimlerinde ifade edilen gerçek molekül kütlesi ile karıştırılmamalıdır.
Edebiyat:
OLUMSUZLUK. Kuznetsova. Kimya. 8. sınıf. için öğretici Eğitim Kurumları. – M. Ventana-Graf, 2012.
Görsel tasarım için kullanılan kaynaklar:
http://www.google.ru/imgres?imgurl=http%3A%2F%2Fwww.pskgu.ru%2Febooks%2Fkimages%2Fst000_26.jpg&imgrefurl=http%3A%2F%2Fwww.pskgu.ru%2Febooks%2Fkps018. htm&h=333&w=400&tbnid=aUsXyHOtCzUHGM%3A&zoom=1&docid=G82TADT3Vv3rxM&ei=VwB3VP7OC-a6ygP61oKQDw&tbm=isch&ved=0CEsQMygW&dur&
atom kütlesi atom veya molekülü oluşturan tüm proton, nötron ve elektronların kütlelerinin toplamıdır. Proton ve nötronlarla karşılaştırıldığında elektronların kütlesi çok küçüktür, bu nedenle hesaplamalarda dikkate alınmaz. Resmi bir bakış açısından yanlış olsa da, bu terim genellikle bir elementin tüm izotoplarının ortalama atom kütlesini belirtmek için kullanılır. Aslında, bu göreceli atom kütlesi olarak da adlandırılır. atom ağırlığıöğe. Atom ağırlığı, bir elementin doğal olarak oluşan tüm izotoplarının atom kütlelerinin ortalamasıdır. Kimyagerler işlerini yaparken bu iki tür atom kütlesini birbirinden ayırmalıdırlar - örneğin yanlış bir atom kütlesi değeri, bir reaksiyon ürününün verimi için yanlış bir sonuca yol açabilir.
adımlar
Elementlerin periyodik tablosuna göre atom kütlesini bulma
- Atomik kütle birimi kütleyi karakterize eder gram cinsinden verilen elementin bir molü. Bu değer, belirli bir maddenin belirli sayıda atomunun veya molekülünün kütlesini kolayca mollere dönüştürmek için kullanılabildiğinden, pratik hesaplamalarda çok yararlıdır ve bunun tersi de geçerlidir.
-
Mendeleev'in periyodik tablosundaki atom kütlesini bulun.Çoğu standart masalar Mendeleev, her elementin atom kütlelerini (atom ağırlıklarını) içerir. Kural olarak, kimyasal elementi gösteren harflerin altında, elementin bulunduğu hücrenin altında bir sayı olarak verilirler. Bu genellikle bir tamsayı değil, bir ondalıktır.
Periyodik tablonun elementlerin ortalama atom kütlelerini gösterdiğini unutmayın. Daha önce belirtildiği gibi, periyodik tablodaki her element için verilen bağıl atom kütleleri, bir atomun tüm izotoplarının kütlelerinin ortalamalarıdır. Bu ortalama değer birçok pratik amaç için değerlidir: örneğin, birkaç atomdan oluşan moleküllerin molar kütlesinin hesaplanmasında kullanılır. Ancak tek tek atomlarla uğraşırken bu değer genellikle yeterli olmaz.
- Ortalama atom kütlesi birkaç izotopun ortalaması olduğundan, periyodik tabloda verilen değer değildir. kesin herhangi bir tek atomun atom kütlesinin değeri.
- Tek tek atomların atom kütleleri, tek bir atomdaki tam proton ve nötron sayısı dikkate alınarak hesaplanmalıdır.
Atom kütlesinin nasıl yazıldığını öğrenin. Atom kütlesi, yani belirli bir atom veya molekülün kütlesi, standart SI birimleriyle ifade edilebilir - gram, kilogram vb. Ancak, bu birimlerde ifade edilen atomik kütlelerin son derece küçük olması nedeniyle, genellikle birleşik atomik kütle birimleri veya kısaca a.u.m. olarak yazılırlar. atomik kütle birimleridir. Bir atomik kütle birimi, standart karbon-12 izotopunun kütlesinin 1/12'sine eşittir.
Tek bir atomun atom kütlesinin hesaplanması
-
Belirli bir elementin veya izotopunun atom numarasını bulun. Atom numarası, bir elementin atomlarındaki proton sayısıdır ve asla değişmez. Örneğin, tüm hidrojen atomları ve sadece bir protonları var. Sodyum on bir protona sahip olduğu için atom numarası 11'dir, oksijen ise sekiz protona sahip olduğu için atom numarası sekizdir. Herhangi bir elementin atom numarasını Mendeleev'in periyodik tablosunda bulabilirsiniz - neredeyse tüm standart versiyonlarında, bu numara kimyasal elementin harf tanımının üzerinde belirtilmiştir. Atom numarası her zaman pozitif bir tam sayıdır.
- Bir karbon atomuyla ilgilendiğimizi varsayalım. Karbon atomlarında her zaman altı proton vardır, dolayısıyla atom numarasının 6 olduğunu biliyoruz. Ayrıca periyodik tabloda, karbon (C) bulunan hücrenin en üstünde "6" sayısının olduğunu görüyoruz. atom karbon numarası altıdır.
- Bir elementin atom numarasının, periyodik tablodaki göreceli atom kütlesi ile benzersiz bir şekilde ilişkili olmadığına dikkat edin. Özellikle tablonun üst kısmındaki elementler için bir elementin atom kütlesi atom numarasının iki katı gibi görünse de hiçbir zaman atom numarasını iki ile çarparak hesaplanmaz.
-
Çekirdekteki nötron sayısını bulun. Aynı elementin farklı atomları için nötron sayısı farklı olabilir. Aynı elementin aynı sayıda protona sahip iki atomu farklı sayıda nötrona sahip olduğunda, bunlar o elementin farklı izotoplarıdır. Asla değişmeyen proton sayısının aksine, belirli bir elementin atomlarındaki nötronların sayısı sıklıkla değişebilir, bu nedenle bir elementin ortalama atom kütlesi, iki bitişik tam sayı arasında ondalık kesir olarak yazılır.
Proton ve nötron sayısını toplayın. Bu, bu atomun atom kütlesi olacaktır. Çekirdeği çevreleyen elektronların sayısını görmezden gelin - toplam kütleleri son derece küçüktür, bu nedenle hesaplamalarınız üzerinde çok az etkisi vardır veya hiç etkisi yoktur.
Bir elementin bağıl atom kütlesini (atom ağırlığı) hesaplama
-
Numunede hangi izotopların olduğunu belirleyin. Kimyagerler genellikle kütle spektrometresi adı verilen özel bir alet kullanarak belirli bir numunedeki izotopların oranını belirler. Ancak eğitim sırasında bu veriler size bilimsel literatürden alınan değerler şeklinde görev, kontrol vb. koşullarda verilecektir.
- Bizim durumumuzda, iki izotopla uğraştığımızı varsayalım: karbon-12 ve karbon-13.
-
Örnekteki her izotopun göreli bolluğunu belirleyin. Her element için farklı oranlarda farklı izotoplar oluşur. Bu oranlar hemen hemen her zaman yüzde olarak ifade edilir. Bazı izotoplar çok yaygındır, diğerleri ise çok nadirdir - bazen o kadar nadirdir ki tespit edilmesi zordur. Bu değerler kütle spektrometrisi kullanılarak belirlenebilir veya bir referans kitabında bulunabilir.
- Karbon-12 konsantrasyonunun %99 ve karbon-13'ün %1 olduğunu varsayın. Karbonun diğer izotopları Gerçekten var, ancak bu durumda ihmal edilebilecek kadar küçük miktarlarda.
-
Her izotopun atom kütlesini numunedeki konsantrasyonuyla çarpın. Her izotopun atom kütlesini yüzdesiyle çarpın (ondalık olarak ifade edilir). Yüzdeleri dönüştürmek için ondalık, sadece 100'e bölün. Ortaya çıkan konsantrasyonlar her zaman 1'e kadar eklemelidir.
- Örneğimiz karbon-12 ve karbon-13 içerir. Karbon-12 örneğin %99'u ve karbon-13 %1 ise, 12'yi (karbon-12'nin atom kütlesi) 0,99 ve 13'ü (karbon-13'ün atom kütlesi) 0,01 ile çarpın.
- Referans kitapları, bir elementin tüm izotoplarının bilinen miktarlarına dayalı yüzdeler verir. Çoğu kimya ders kitabı bu bilgiyi kitabın sonundaki bir tabloda içerir. İncelenen numune için, izotopların bağıl konsantrasyonları bir kütle spektrometresi kullanılarak da belirlenebilir.
-
Sonuçları ekleyin.Önceki adımda elde ettiğiniz çarpma sonuçlarını toplayın. Bu işlemin bir sonucu olarak, elementinizin nispi atom kütlesini bulacaksınız - söz konusu elementin izotoplarının atom kütlelerinin ortalama değeri. Bir element, belirli bir elementin belirli bir izotopu değil de bir bütün olarak düşünüldüğünde, kullanılan bu değerdir.
- Örneğimizde, karbon-12 için 12 x 0.99 = 11.88 ve karbon-13 için 13 x 0.01 = 0.13. Bizim durumumuzdaki bağıl atom kütlesi 11.88 + 0.13 = 12,01 .
- Bazı izotoplar diğerlerinden daha az kararlıdır: çekirdeğinde daha az proton ve nötron bulunan elementlerin atomlarına bozunurlar ve onu oluşturan parçacıkları serbest bırakırlar. atom çekirdeği. Bu tür izotoplara radyoaktif denir.
Atomların ve moleküllerin kütleleri çok küçüktür, bu nedenle bir ölçüm birimi olarak atomlardan birinin kütlesini seçmek ve ona göre kalan atomların kütlelerini ifade etmek uygundur. Bu, bir hidrojen atomunun kütlesini bir birim olarak alarak bir atom kütleleri tablosu derleyen atom teorisinin kurucusu Dalton'un yaptığı şeydir.
1961 yılına kadar fizikte, bir oksijen atomunun kütlesinin 1/16'sı 16 O bir atomik kütle birimi (kısaltılmış amu) ve kimyada - bir karışım olan doğal oksijenin ortalama atom kütlesinin 1/16'sı olarak alındı. üç izotoptan oluşur. Kimyasal kütle birimi, fiziksel olandan %0.03 daha büyüktü.
Şu anda fizik ve kimyada birleşik bir ölçüm sistemi benimsenmiştir. Karbon atomunun kütlesinin 1/12'si 12 C, standart atomik kütle birimi olarak seçilir.
1 ay \u003d 1/12 m (12 C) \u003d 1.66057 × 10 -27 kg \u003d 1.66057 × 10 -24 g.
TANIM
Bir elementin bağıl atom kütlesi (A r)- bu, bir element atomunun ortalama kütlesinin bir atomun 12 C kütlesinin 1/12'sine oranına eşit boyutsuz bir miktardır.
Bağıl atom kütlesi hesaplanırken, yerkabuğundaki elementlerin izotoplarının bolluğu dikkate alınır. Örneğin, klorun 35 Cl (%75.5) ve 37 Cl (%24.5) olmak üzere iki izotopu vardır.Klorun bağıl atom kütlesi:
Ar (Cl) \u003d (0,755 × m (35 Cl) + 0,245 × m (37 Cl)) / (1/12 × m (12 C) = 35,5.
Bağıl atom kütlesi tanımından, bir atomun ortalama mutlak kütlesinin, bağıl atom kütlesi çarpı amu'ya eşit olduğu sonucu çıkar:
m(Cl) = 35.5 × 1.66057 × 10 -24 = 5.89 × 10 -23 g.
Problem çözme örnekleri
ÖRNEK 1
| Egzersiz yapmak | Aşağıdaki maddelerden hangisinde oksijen elementinin kütle oranı daha fazladır: a) çinko oksitte (ZnO); b) magnezyum oksitte (MgO)? |
| Çözüm |
Çinko oksidin moleküler ağırlığını bulun: Mr(ZnO) = Ar(Zn) + Ar(O); Mr(ZnO)=65+16=81. M = Mr, yani M(ZnO) = 81 g/mol olduğu bilinmektedir. O zaman çinko oksit içindeki oksijenin kütle fraksiyonu şuna eşit olacaktır: ω (O) = Ar (O) / M (ZnO) × %100; ω(O) = 16 / 81 × %100 = %19,75. Magnezyum oksitin moleküler ağırlığını bulun: Mr(MgO) = Ar(Mg) + Ar(O); Bay (MgO) = 24+ 16 = 40. M=Mr, yani M(MgO) = 60 g/mol olduğu bilinmektedir. O zaman magnezyum oksit içindeki oksijenin kütle fraksiyonu şuna eşit olacaktır: ω (O) = Ar (O) / M (MgO) × %100; ω (O) = 16 / 40 × %100 = %40. Bu nedenle, oksijenin kütle fraksiyonu, 40 > 19.75 olduğundan magnezyum oksitte daha fazladır. |
| Cevap | Oksijenin kütle fraksiyonu magnezyum oksitte daha fazladır. |
ÖRNEK 2
| Egzersiz yapmak | Aşağıdaki bileşiklerden hangisinde metalin kütle oranı daha fazladır: a) alüminyum oksitte (A1203); b) demir oksitte (Fe 2 O 3)? |
| Çözüm | HX bileşiminin molekülündeki X elementinin kütle oranı aşağıdaki formülle hesaplanır: ω (X) = n × Ar (X) / M (HX) × %100. Önerilen bileşiklerin her birindeki her oksijen elementinin kütle fraksiyonunu hesaplayalım (D.I. Mendeleev'in Periyodik Tablosundan alınan göreceli atomik kütlelerin değerleri tamsayılara yuvarlanacaktır). Alüminyum oksidin moleküler ağırlığını bulun: Mr (Al203) = 2×Ar(Al) + 3×Ar(O); Bay (Al 2 O 3) \u003d 2 × 27 + 3 × 16 \u003d 54 + 48 \u003d 102. M \u003d Mr, yani M (Al 2 O 3) \u003d 102 g / mol olduğu bilinmektedir. O zaman oksit içindeki alüminyumun kütle oranı şuna eşit olacaktır: ω (Al) \u003d 2 × Ar (Al) / M (Al 2 O 3) × %100; ω (Al) \u003d 2 × 27 / 102 × %100 \u003d 54 / 102 × %100 \u003d %52,94. Demir oksidin (III) moleküler ağırlığını bulun: Mr (Fe 2 O 3) = 2×Ar(Fe) + 3×Ar(O); Bay (Fe 2 O 3) \u003d 2 × 56 + 3 × 16 \u003d 112 + 48 \u003d 160. M \u003d Mr, yani M (Fe 2 O 3) \u003d 160 g / mol olduğu bilinmektedir. O zaman oksit içindeki demirin kütle fraksiyonu şuna eşit olacaktır: ω (O) \u003d 3 × Ar (O) / M (Fe203) × %100; ω (O) = 3×16 / 160 × %100 = 48 / 160× %100 = %30. Bu nedenle, alüminyum oksitte metalin kütle oranı, 52.94 > 30 olduğundan daha büyüktür. |
| Cevap | Metalin kütle oranı alüminyum oksitte daha fazladır. |






