Kimyasal elementlerin bağıl atom kütlesi
Ders 4. Kimyasal elementler. Kimyasal elementlerin belirtileri. Göreceli atomik kütle.
Kimyasal element- aynı cins atomların toplamıdır.
Neden özdeş atomlar bu şekilde adlandırıldı?“Element” kelimesi (lat. elementum) antik çağda (Cicero, Ovid, Horace tarafından) bir şeyin parçası olarak (konuşma unsuru, eğitim unsuru vb.) kullanılmıştır. Eski zamanlarda, “Kelimeler harflerden oluşuyorsa, bedenler de elementlerden oluşur” sözü çok yaygındı. Bu nedenle, bu kelimenin olası kökeni: Latin alfabesindeki bir dizi ünsüz harf adıyla: l, m, n, t ("el" - "em" - "en" - "tum").
KİMYASAL DİL
İnsanoğlu birçok farklı dil kullanır. Doğal dillere ek olarak (Japonca, İngilizce, Rusça - toplamda 2,5 binden fazla), örneğin Esperanto gibi yapay diller de vardır. Yapay diller arasında çeşitli bilimlerin dilleri öne çıkmaktadır. Yani kimya kendi kimyasal dilini kullanır. kimyasal dil- kimyasal bilgilerin kısa, öz ve görsel olarak kaydedilmesi ve iletilmesi için tasarlanmış bir semboller ve kavramlar sistemi. Çoğu doğal dilde yazılan bir mesaj cümlelere, cümleler kelimelere ve kelimeler harflere bölünür.
Sizinle özel, kimyasal bir dilde konuşacağız. İçinde, anadili Rusçamızda olduğu gibi, önce harfleri öğreneceğiz - kimyasal semboller, sonra kelimeler yazmayı öğreneceğiz - bunlara dayalı formüller ve daha sonra ikincisinin yardımıyla - cümleler - kimyasal reaksiyon denklemleri:
Bulgar eğitimciler Cyril ve Methodius, Slav alfabesinin yazarlarıdır. Ancak kimyasal yazının babası, harfler - semboller olarak öneren İsveçli bilim adamı J. Ya. Berzelius'tur. kimyasal elementler Latince adlarının ilk harflerini kullanın veya birkaç öğenin adı bu harfle başlıyorsa, adın sonraki harflerinden bir tane daha ilk harfe ekleyin.
Kimyasal işaretler (kimyasal semboller) - kimyasal elementlerin harf tanımları. Elementin Latince adının ilk veya ilk ve aşağıdaki harflerinden birinden oluşurlar, örneğin karbon - C (Karboeum), kalsiyum - Ca (Kalsiyum), kadmiyum - Cd ...
Kimyasal element sembolükimyasal bir elementin sembolüdür.
Geçmiş referansı: Kimyagerin Antik Dünya ve Orta Çağ'da, sembolik görüntüler, harf kısaltmaları ve her ikisinin kombinasyonları, maddeleri, kimyasal işlemleri ve cihazları belirtmek için kullanıldı. Antik çağın yedi metali, yedi göksel cismin astronomik işaretleri ile tasvir edilmiştir: Güneş ( ☉ , altın), Aylar (☽ , gümüş), Jüpiter (♃ , kalay), Venüs (♀, bakır), Satürn (♄ , kurşun), Merkür (☿ , cıva), Mars (♁, ütü).
15-18. yüzyıllarda keşfedilen metaller - bizmut, çinko, kobalt - isimlerinin ilk harfleriyle belirlendi. Şarap ruhunun işareti (lat. spiritus vini) S ve V harflerinden oluşur. Güçlü votka (lat. aqua fortis, nitrik asit) ve altın votka (lat. aqua regis, aqua regia, karışımı hidroklorik ve nitrik asitler) sırasıyla suÑ işareti ve büyük harf F ve R'den oluşur. Camın işareti (lat. vitrum) iki harf V'den oluşur - düz ve ters.
Antik kimyasal işaretleri düzene sokma girişimleri 18. yüzyılın sonuna kadar devam etti. AT erken XIX yüzyılda, İngiliz kimyager J. Dalton, kimyasal elementlerin atomlarını, içine noktalar, kısa çizgiler, metallerin İngilizce adlarının ilk harfleri vb.
Dalton'un kimyasal işaretleri Büyük Britanya ve Batı Avrupa'da bir miktar dağıtım kazandı, ancak kısa süre sonra İsveçli kimyager J. J. Berzelius'un 1814'te önerdiği tamamen alfabetik işaretlerle değiştirildi. Kimyasal işaretleri derlemek için ifade ettiği ilkeler bu güne kadar güçlerini korudu. Rusya'da Berzelius'un kimyasal belirtileri hakkında ilk basılı rapor 1824'te Moskova doktoru I. Ya. Zatsepin tarafından yapıldı.
GÖRECELİ ATOMİK KÜTLE
Geçmiş referansı: İngiliz bilim adamı John Dalton (1766-1844) derslerinde öğrencilere ahşaptan oyulmuş atom modellerini göstererek, atomların nasıl birleşerek oluşturabileceklerini gösterdi. çeşitli maddeler. Öğrencilerden birine atomun ne olduğu sorulduğunda, "Atomlar, Bay Dalton'un icat ettiği, farklı renklere boyanmış tahta küplerdir."
Elbette Dalton, "küpleri" ile değil, on iki yaşında bir okul öğretmeni olduğu gerçeğiyle bile ün kazanmadı. Modern atom teorisinin ortaya çıkışı Dalton adıyla ilişkilidir. Bilim tarihinde ilk kez atomların kütlelerini ölçmenin imkanını düşünmüş ve bunun için özel yöntemler önermiştir. Atomları doğrudan tartmanın imkansız olduğu açıktır. Dalton yalnızca "gaz halindeki ve diğer cisimlerin en küçük parçacıklarının ağırlıklarının oranı"ndan, yani bunların göreceli kütlelerinden bahsetti. Bugün bile, herhangi bir atomun kütlesi tam olarak bilinmesine rağmen, son derece sakıncalı olduğu için asla gram olarak ifade edilmez. Örneğin, Dünya'da bulunan elementlerin en ağırı olan bir uranyum atomunun kütlesi sadece 3.952 10'dur. –22 d.Bu nedenle, atomların kütlesi, belirli bir elementin atom kütlesinin, bir standart olarak alınan başka bir elementin atom kütlesinden kaç kez daha büyük olduğunu gösteren göreli birimlerde ifade edilir. Aslında bu, Dalton'a göre “ağırlık oranı”, yani. akraba atom kütlesi. Atomların kütleleri çok küçüktür.
Bazı atomların mutlak kütleleri:
m(C) \u003d 1.99268 ∙ 10 -23 g
m(H) \u003d 1.67375 ∙ 10 -24 g
m(O) \u003d 2,656812 ∙ 10 -23 g
Şu anda fizik ve kimyada birleşik bir ölçüm sistemi benimsenmiştir. Tanıtılan atomik kütle birimi (a.m.u.)
m (a.m.u.) \u003d 1/12 m (12C) \u003d 1.66057 ∙ 10 -24 g.
Ar(H) = m(atom) / m (a.m.u.) = 1.67375 ∙ 10 -24 g / 1.66057 ∙ 10 -24 g = 1.0079 amu
Ar - verilen bir atomun bir 12C atomunun 1/12'sinden kaç kez daha ağır olduğunu gösterir, bu boyutsuz bir miktardır.
Göreceli atomik kütle
kütlesi 12 a.m.u olan bir karbon atomunun kütlesinin 1/12'sidir.
Bağıl atom kütlesi boyutsuz bir niceliktir!!!
Örneğin, bir oksijen atomunun bağıl atom kütlesi 15.994'tür. Göreceli atomik kütle değerlerinin kendilerinin dikkate alınması her zaman gerekli değildir. D. I. Mendeleev tarafından periyodik kimyasal elementler sisteminde verilen değerleri kullanabilirsiniz. Şu şekilde yazılmalıdır:
Ar(O) = 16 .
Her zaman yuvarlatılmış değeri kullanırız.
İstisna klor atomunun bağıl atom kütlesini temsil eder: Ar(Cl) = 35.5.
Bir atomun mutlak ve bağıl kütleleri arasındaki ilişki, aşağıdaki formülle temsil edilir:
Doğadaki elementlerin dağılımı. Kozmik maddenin ana kütlesi H ve He'dir (%99.9).
107 kimyasal elementten sadece 89'u doğada bulunur; nükleer reaksiyonlar(ihmal edilebilir miktarlarda Te, Pm, Np, Fr, uranyumun kendiliğinden fisyonlanması sırasında oluşur ve uranyum cevherlerinde bulunur). Dünyanın erişilebilir kısmında, atom numaraları 8 ile 26 arasında değişen 10 element en yaygın olanıdır ve yerkabuğunda aşağıdaki nispi miktarlarda bulunurlar:
Listelenen 10 element, yer kabuğunun kütlesinin %99,92'sini oluşturur.
eleman |
atomik numara |
|
47,00 |
||
29,50 |
||
8,05 |
||
4,65 |
||
Bu yazıda, kimyasal elementlerin kütlesini ifade etmek için farklı olasılıkları ele alacağız.
Atomlar kendi aralarında farklılık gösterir: kütle, boyut ve yapı.
Atomların kütlesi ve boyutları.
Günümüz bilimi, bir atomun kütlesini ve boyutunu belirleme yeteneğine sahiptir. En küçük atom He'dir (helyum), yaklaşık olarak boyutu 0.00000000098m'dir. (98 * 10 -10). Ve en hafif atom H (hidrojen) atomudur ve kütlesi 0.0000000000000000000000000016735kg'dır. (1.6735 * 10 −27).
Kimyasal elementlerin atomlarının çoğu genellikle bir helyum atomundan çok daha büyüktür.
Ve en büyük atom Fr (fransiyum) atomudur ve boyutu yaklaşık 0.000000000686m'dir. He (helyum) atomundan 7 kat daha büyüktür.
Farklı kimyasal elementlerin daha fazla atomunun kütlesi daha farklıdır, bir atomun kütlesi m a harfi ile gösterilir ve SI ile ifade edilir.
Ve kütlenin hacim birimi
19. yüzyılda atomik - moleküler öğretilerin oluşumu sırasında. insanlar henüz atomların tam boyutlarını ve kütlelerini bilmiyorlardı, bu yüzden bilim adamları göreli değerlerini kullanmaya başladılar. Göreceli değerler kütle oranlarından hesaplanmıştır. basit maddeler birbirleriyle tepkiler halinde. Bilim adamları kimyagerler, atomların kütleleriyle orantılı olduklarını öne sürdüler. John Dalton, en hafif atomun karşılaştırma birimini benimsedi - H (hidrojen)
Karşılaştırma olarak, karbon a.e.m (atomik kütle birimi) kütlesinin 1/12'si kullanılır. Uluslararası atama - u (birim - birim).
Atomik kütle birimi- bu bir karbon atomunun kütlesinin 1/12'sidir ve 1,66 10 -27 kg'a eşittir.
Bağıl atom kütlesi hakkında.
Çeşitli elementlerin ortalama kütlelerini a.e.m (u) ile karşılaştırarak, kimyasalın göreceli atomik kütlelerinin değerleri elde edilebilir. elementler. Bağıl atom kütlesi fiziksel miktar, bir kimyasal elementin atomunun kütlesinin bir karbon atomunun 1/12'sinden kaç kez daha büyük olduğunu gösteren.
Notasyon: A r Formülü.
Ders materyallerinden bazı kimyasal elementlerin atomlarının diğer kimyasal elementlerin atomlarından kütle olarak farklı olduğunu öğreneceksiniz. Öğretmen size kimyagerlerin elektron mikroskobuyla bile göremeyeceğiniz kadar küçük atomların kütlesini nasıl ölçtüğünü anlatacak.
Konu: İlk kimyasal fikirler
Ders: Kimyasal elementlerin bağıl atom kütlesi
19. yüzyılın başlarında (Robert Boyle'un çalışmasından 150 yıl sonra), İngiliz bilim adamı John Dalton, kimyasal elementlerin atomlarının kütlesini belirlemek için bir yöntem önerdi. Bu yöntemin özünü ele alalım.
Dalton, molekülün buna göre bir model önerdi. karmaşık madde farklı kimyasal elementlerin sadece bir atomunu içerir. Örneğin, bir su molekülünün 1 hidrojen atomu ve 1 oksijen atomundan oluştuğuna inanıyordu. Dalton'a göre basit maddelerin bileşimi ayrıca bir kimyasal elementin sadece bir atomunu içerir. Şunlar. Bir oksijen molekülü bir oksijen atomundan oluşmalıdır.
Ve sonra, bir maddedeki elementlerin kütle kesirlerini bilerek, bir elementin atomunun kütlesinin başka bir elementin atomunun kütlesinden kaç kez farklı olduğunu belirlemek kolaydır. Böylece Dalton, bir maddedeki bir elementin kütle fraksiyonunun, atomunun kütlesi tarafından belirlendiğine inanıyordu.
Magnezyum oksit içindeki magnezyumun kütle fraksiyonunun %60 ve oksijenin kütle fraksiyonunun %40 olduğu bilinmektedir. Dalton'un akıl yürütme yolunu izleyerek, bir magnezyum atomunun kütlesinin bir oksijen atomunun kütlesinden 1,5 kat daha büyük olduğunu söyleyebiliriz (60/40 = 1.5):
Bilim adamı, hidrojen atomunun kütlesinin en küçük olduğunu fark etti, çünkü. hidrojenin kütle fraksiyonunun başka bir elementin kütle fraksiyonundan daha büyük olacağı karmaşık bir madde yoktur. Bu nedenle, elementlerin atomlarının kütlelerini hidrojen atomunun kütlesi ile karşılaştırmayı önerdi. Ve bu şekilde, kimyasal elementlerin bağıl (hidrojen atomuna göre) atomik kütlelerinin ilk değerlerini hesapladı.
Hidrojenin atom kütlesi birim olarak alındı. ve anlamı bağıl kütle kükürt 17 çıktı. Ancak elde edilen tüm değerler ya yaklaşık ya da yanlış çünkü. o zamanın deney tekniği mükemmel olmaktan uzaktı ve Dalton'un maddenin bileşimi üzerine kurulumu yanlıştı.
1807 - 1817'de. İsveçli kimyager Jöns Jakob Berzelius, elementlerin göreli atom kütlelerini iyileştirmek için çok fazla araştırma yaptı. Modern olanlara yakın sonuçlar almayı başardı.
Berzelius'un çalışmasından çok sonra, kimyasal elementlerin atomlarının kütleleri, bir karbon atomunun kütlesinin 1/12'si ile karşılaştırılmaya başlandı (Şekil 2).
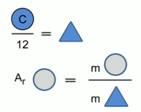
Pirinç. 1. Bir kimyasal elementin bağıl atom kütlesini hesaplama modeli
Bir kimyasal elementin bağıl atom kütlesi, bir kimyasal elementin atomunun kütlesinin, bir karbon atomunun kütlesinin 1/12'sinden kaç kez daha büyük olduğunu gösterir.
Nispi atom kütlesi gösterilir Ar , atom kütlelerinin oranını gösterdiği için ölçü birimi yoktur.
Örneğin: A r (S) = 32, yani. bir kükürt atomu, bir karbon atomunun kütlesinin 1/12'sinden 32 kat daha ağırdır.
Bir karbon atomunun 1/12'sinin mutlak kütlesi, değeri yüksek doğrulukla hesaplanan ve 1.66 * 10 -24 g veya 1.66 * 10 -27 kg olan bir referans birimdir. Bu referans kütlesi denir Atomik kütle birimi (a.u.m.).
Kimyasal elementlerin bağıl atom kütlelerinin değerlerinin ezberlenmesine gerek yoktur, kimya üzerine herhangi bir ders kitabında veya referans kitabında ve ayrıca D.I.'nin periyodik tablosunda verilmiştir. Mendeleyev.
Bağıl atom kütlelerinin değerlerini hesaplarken, tam sayılara yuvarlamak gelenekseldir.
Bir istisna, klorun bağıl atom kütlesidir - klor için 35.5 değeri kullanılır.
1. Kimyadaki görev ve alıştırmaların toplanması: 8. sınıf: P.A. Orzhekovsky ve diğerleri "Kimya, 8. Sınıf" / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel. – E.: AST: Astrel, 2006.
2. Ushakova O.V. Kimya çalışma kitabı: 8. sınıf: P.A. Orzhekovsky ve diğerleri “Kimya. Sınıf 8” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; altında. ed. Prof. P.A. Orzhekovsky - M.: AST: Astrel: Profizdat, 2006. (s. 24-25)
3. Kimya: 8. sınıf: ders kitabı. genel için kurumlar / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak. M.: AST: Astrel, 2005.(§10)
4. Kimya: inorg. kimya: ders kitabı. 8 hücre için. genel kurumlar / G.E. Rudzitis, FuGyu Feldman. - M.: Eğitim, JSC "Moskova ders kitapları", 2009. (§§8,9)
5. Çocuklar için ansiklopedi. Cilt 17. Kimya / Bölüm. V.A tarafından düzenlendi. Volodin, lider. ilmi ed. I. Leenson. – E.: Avanta+, 2003.
Ek web kaynakları
1. Tek bir dijital eğitim kaynakları koleksiyonu ().
2. "Kimya ve Yaşam" dergisinin elektronik versiyonu ().
Ev ödevi
s.24-25 Sayı 1-7 itibaren Çalışma kitabı kimyada: 8. sınıf: P.A. Orzhekovsky ve diğerleri “Kimya. Sınıf 8” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; altında. ed. Prof. P.A. Orzhekovsky - M.: AST: Astrel: Profizdat, 2006.






