Atomların enerji seviyeleri. Bohr varsayımları ve yörünge niceleme
Çekirdeğe çekim kuvvetlerinin etkisi altındaki bir elektron için, Schrödinger denkleminin hiçbiri için değil, yalnızca belirli enerji değerleri için çözümler vardır. Böylece, bir atomdaki bir elektronun enerji durumlarının kuantizasyonu (yani, Bohr'un ilk postülası), elektronun doğasında bulunan dalga özelliklerinin bir sonucu olarak ortaya çıkar ve özel postülaların eklenmesini gerektirmez.
Ve bir şey sizin için iyi olmadığında, kas aslında zayıflık gösterir, ancak yalnızca içinden geçen enerji zayıfladığı için. Kendiniz veya başkaları hakkında olumsuz düşüncelere sahip olduğunuzda, aynı zamanda bir madde, yiyecek veya ilaç, niyet veya karar sizin için doğru olmadığında veya sadece sizin yararınıza olmadığında enerjiniz zayıflar.
Enerji testi nedir?
Bu, enerjinizin dürüst bir tepkisidir, vücudunuzdaki kasların tepkisine "olumlu". Elinizi resimde gösterildiği gibi yukarı ve aşağı kaldırın, elinizi uzatın ama fazla zorlamadan isminizi söyleyin. Enerjiniz ifadeyle tutarlı olduğu ve bunun sizin için doğru olduğunu bildiği için kas güçlü kalacağı için muhtemelen kolunu hareket ettiremeyecek.
Son ifadeyi daha iyi anlamak için, atomun basitleştirilmiş bir modelini, bir elektronun yalnızca atomu oluşturabileceği "tek boyutlu bir atom" düşünün. salınım hareketleri uç noktalar arasında.
Ayrıca, atomun sınırlarının elektron için aşılmaz olduğunu, böylece yalnızca atomun içinde olabileceğini varsayıyoruz. Bir atomdaki elektronun durumunun belirli bir dalga ("de Broglie dalgası") ile karakterize edildiğini zaten biliyoruz. Ancak bu dalganın yayılmasını, suyun yüzeyinde oluşan bir dalganın atılan bir taştan hareketine benzer bir şey olarak hayal etmek yanlış olur: Bir su dalgası, oluştuğu yerden süresiz olarak hareket eder ve yavaş yavaş yayılır. bir atomdaki bir elektron kararlı iken, zaman içinde kararlılığa sahip değildir. Bu nedenle, bir atomdaki elektronun durumu ile üzerinde durağan dalgaların oluştuğu sesli bir sicimin durumu arasındaki analoji daha doğru olacaktır.
Arkadaşınızın elinizin gücünü test etmesine izin verin ve onu ne kadar kolay çıkaracağını görün. Enerji sisteminiz bunun doğru olmadığını biliyor. Şimdi hoş ve neşeli bir şey hayal edin ve test kasların gücünü gösterecek ve kolunuz açık kalacaktır. Diğer kişi için olumsuz bir düşünce veya kötü bir şey düşünün veya ağladığınızı ve üzgün olduğunuzu hayal edin ve eliniz kolayca çekilecektir. Negatif olduğunuzda, stres altında olduğunuzda veya bir şeyler ters gittiğinde veya sizin için iyi olmadığında bunun enerjinizi nasıl zayıflattığını göreceksiniz.
Tabii ki, basit ve Genel açıklama enerji testi. Size birçok şey söyleyebilir ve eğer çok amatörseniz onunla ilgilenirsiniz. Bununla birlikte, enerji psikolojisinde bir araç olarak kullanıldığında, enerji meridyen tıkanıklıklarını tespit etmenin yanı sıra enerji akışını ve dolayısıyla sağlığınızı dengelemek ve yenilemek için en uygun yolu bulmak için son derece güvenilir ve güvenli bir araç haline gelir.
Şek. Şekil 6, uç noktaları sabit olan, salınan bir ipte ortaya çıkan duran dalgaları şematik olarak göstermektedir. Antinodlar n harfi ile işaretlenmiş noktalarda görünür - burada salınım genliği maksimumdur, y noktalarında dize salınmaz - bunlar salınım genliğinin sıfır olduğu düğümlerdir; düğümler ve antinodlar arasında yer alan noktalarda salınım genliği ara değerlere sahiptir. İpin uç noktaları sabit olduğu için burada mutlaka düğümler vardır. Sıradan bir "hareket eden" dalgadan farklı olarak, duran bir dalga uzayda hareket etmez ve enerjiyi aktarmaz, bu sadece ipin bir noktasından diğerine aktarılır. Sabit uçlu bir ipte, duran dalganın uzunluğunun herhangi bir uzunlukta olamayacağını, sadece tüm ipin sığacağı şekilde olduğunu görmek kolaydır (Şekil 6) tam sayı yarım dalgalar: bir (Şek. 6, a), iki (Şek. 6, b), üç (Şek. 6, c), vb.
Yukarıda açıklanan enerji testi yöntemleri, terapistiniz veya arkadaşınız olabilecek bir partnerle yapılır. Kendinizi test etmenin ve ihtiyacınız olan cevapları almanın başka yolları da var. Karmaşık, uygun fiyatlı ve sindirimi kolay değildirler. Bu, kendi sağlığınızın sorumluluğunu üstlenmenin ve kendi enerjinizle "konuşmayı" öğrenmenin başka bir yoludur.
Bu şekilde, şüphe duyduğunuz kararları, karşılaştığınız tamamen yaşam kararlarını ve sağlığınız ve yaşamınız için önemli olan birçok şeyi güvenilir bir şekilde test edebilirsiniz. Enerji testinin olanakları pratikte sınırsızdır, çünkü tüm cevapların gerçekte olduğu bilinçaltı zihninize giden bir kısayoldur.
Söz konusu atomun tek boyutlu modelinde de Broglie dalgası da durmalıdır: bu, elektronun atomun sınırlarının ötesine geçemeyeceği gerçeğinden ve dolayısıyla dalga fonksiyonundan (yani dalga genliği) kaynaklanır. ) atomun sınırlarında yok olmalıdır. Bu nedenle şek. 6, bu atomda oluşabilen de Broglie durağan dalgaları olan tek boyutlu bir atom modeli olarak düşünülebilir.
Tek boyutlu bir atomun uzunluğu l ise, o zaman Şekil 2'deki a, b ve c durumları için. 6 de Broglie dalga boyu aşağıdaki gibi ifade edilecektir:
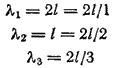
Bu nedenle, duran bir dalga ancak aşağıdaki durumlarda oluşabilir:
nerede, yani bir tamsayı.
Pirinç. 6. Bir ipte duran dalgalar.
Öte yandan, de Broglie denklemine göre
Son iki denklemin doğru kısımlarını eşitleyerek elektron hızı ifadesini elde ederiz:
Şimdi, elektronun hızını bildiğimize göre onu bulabiliriz. kinetik enerji E:
n bir tam sayı olduğundan, son ifade tek boyutlu bir atomdaki bir elektronun enerjisinin keyfi değerlere sahip olamayacağını gösterir: n=1 için kesrin değerine eşittir, n=2 için 4 kat daha büyüktür , için n=3 - 9 kat daha fazla, vb. Böylece, tek boyutlu bir atom durumunda dalga özellikleri de Broglie denklemi ile ifade edilen elektron, aslında elektronun enerji durumlarının kuantizasyonuna sahiptir. Bu durumda, bir elektronun izin verilen enerji seviyeleri, kuantum sayısı olarak adlandırılan bir n tamsayısının değeri ile belirlenir.
Elbette, elektron enerjisi için bulunan ifade, atomun basitleştirilmiş bir modelini ifade eder. Ancak gerçek bir atom için, Schrödinger denkleminin çözümü, bir atomdaki bir elektronun enerji durumlarının kuantize olduğu sonucuna da götürür.
Tek boyutlu bir atom modeli, durağan durumdaki bir atomdaki bir elektronun neden elektromanyetik enerji yaymadığını anlamayı mümkün kılar (Bohr'un teorisinin ikinci varsayımı). Bohr-Rutherford modeline göre, bir atomdaki bir elektron ivme ile sürekli hareket yaptı, yani her zaman durumunu değiştirdi; elektrodinamiğin gereklerine uygun olarak, aynı zamanda enerji yaymalıdır. Atomun tek boyutlu modelinde, durağan durum, duran bir de Broglie dalgasının oluşumu ile karakterize edilir; Bu dalganın dalga boyu sabit kaldığı sürece elektronun durumu değişmeden kalır, böylece radyasyon oluşmaz.
Bir durağan durumdan diğerine (Bohr'un terminolojisinde, bir sabit yörüngeden diğerine) geçiş sırasında elektronun durumu sorunu da netleşir. Örneğin, Şekil 1'e karşılık gelen durumdan bir elektron ise. 6, a, Şekil 2'ye karşılık gelen duruma girer. 6b, o zaman bu geçiş sırasında de Broglie dalga boyu, duran bir dalga oluşumu koşulunu karşılamayan değişken bir değere sahip olacaktır. Bu nedenle elektronun bu süre içindeki durumu kararsız olacaktır; de Broglie dalga boyu tekrar duran bir dalganın oluşum koşuluna karşılık gelene kadar, yani elektron yeni bir durağan duruma gelene kadar değişecektir.
Basitleştirilmiş tek boyutlu bir atom modelinde, bir elektronun çekirdeğe göre konumu bir koordinat tarafından belirlenir ve durumu bir kuantum sayısının değeri ile belirlenir. İki boyutlu (düz) bir atom modelinde, bir elektronun konumu iki koordinat tarafından belirlenir; buna göre, durumu iki kuantum sayısının değerleri ile karakterize edilir. Benzer şekilde, bir atomun üç boyutlu (hacimsel) modelinde, bir elektronun durumu, üç kuantum sayısının değerleri ile belirlenir. Son olarak, gerçek atomları oluşturan elektronların özelliklerinin incelenmesi, elektronun, elektronun uzamsal konumu ile ilgili olmayan bir nicelleştirilmiş fiziksel özelliğinin (spin denilen, bkz. § 30) daha olduğunu gösterdi. Bu nedenle, gerçek bir atomdaki bir elektronun durumunun tam bir açıklaması için dört kuantum sayısının değerlerini belirtmek gerekir.
28. Ana kuantum sayısı. Yani tek boyutlu bir atom modelinde, bir elektronun enerjisi ancak belirli değerler alabilir, yani kuantize edilir. Gerçek bir atomdaki bir elektronun enerjisi de nicelenmiş bir niceliktir. Bir atomdaki bir elektronun olası enerji durumları, pozitif tamsayı değerleri alabilen n ana kuantum sayısının değeri ile belirlenir: 1, 2, ... vb. Elektron, n = 1'de en düşük enerjiye sahiptir. n arttıkça elektronun enerjisi artar. Bu nedenle, ana kuantum sayısının belirli bir değeri ile karakterize edilen bir elektronun durumuna genellikle bir atomdaki elektronun enerji seviyesi denir: n=1'de elektron birinci enerji seviyesinde, n=2'dedir. - ikincisinde vb.
Ana kuantum sayısı ayrıca elektron bulutunun boyutunu da belirler. Elektron bulutunun boyutunu artırmak için, bir kısmını çekirdekten daha uzak bir yere taşımak gerekir. Bu, elektronun çekirdeğe elektrostatik çekim kuvvetleri tarafından önlenir, bunun üstesinden gelmek için enerji harcaması gerekir. Bu yüzden büyük boy Elektron bulutu, bir atomdaki bir elektronun daha yüksek bir enerjisine ve sonuç olarak, temel kuantum sayısı n'nin daha büyük bir değerine karşılık gelir. Ana kuantum sayısının aynı değeri ile karakterize edilen elektronlar, atomda yaklaşık olarak aynı boyutta elektron bulutları oluşturur; Dolayısıyla atomda elektron katmanlarının varlığından ya da elektron kabukları temel kuantum sayısının belirli değerlerine karşılık gelir.
Bir atomdaki bir elektronun (yani elektron katmanları veya kabuklar için) farklı n değerlerine karşılık gelen enerji seviyeleri için, aşağıdaki harf gösterimleri kabul edilir.
Bir atomdaki bir elektronun durumu, dört kuantum sayısı ile karakterize edilir. Ana kuantum sayısı n, bir atomdaki bir elektronun enerjisini ve AO'nun boyutunu belirler, yani. elektronun çekirdeğe olan uzaklığı. Ana kuantum sayısı n, 1, 2, 3, 4 tamsayılarının değerlerini alır… Aynı n değerine sahip elektron kümesine enerji seviyesi denir. Çekirdekten (n=1) birinci enerji seviyesindeki elektronlar en düşük enerjiye sahiptir; n arttıkça elektronun enerjisi ve çekirdeğe olan uzaklığı artar. Bir atomun elektronlarının toplam enerjilerinin minimum olduğu enerji seviyelerinde olduğu duruma, ana veya uyarılmamış durum denir. Enerji değerleri daha yüksek olan durumlara uyarılmış durumlar denir. Enerji seviyeleri harflerle gösterilir:
Sayısal değer n 1 2 3 4 5 6 7
Harf tanımı K L M N O P Q
Temel durumdaki bir atomdaki enerji seviyelerinin sayısı, elementin bulunduğu periyodun sayısına eşittir.
Aynı enerji seviyesinde, enerjide birbirinden farklı çeşitli şekillerde atomik orbitaller olabilir. Bu nedenle, enerji seviyeleri alt seviyelere ayrılır. Alt seviyedeki elektron enerjisi ve atomik yörüngenin şekli, yörünge kuantum sayısı ile karakterize edilir. ben. Anlam ben temel kuantum sayısına bağlıdır: ben 0 ile (n–1) arasında değerler alır, yani 0, 1, 2, 3… (n–1). Belirli bir enerji seviyesinde, aynı değerle karakterize edilen bir dizi elektron ben, enerji alt düzeyi olarak adlandırılır. Alt düzeyler harflerle gösterilir:
yörünge kuantum sayısı ben 0 1 2 3
Enerji alt seviye tanımı s p d f
Böylece, ben = 0, 1, 2, 3 elektronlar sırasıyla s-, p-, d-, f-alt seviyelerindedir. Çeşitli alt düzeylerdeki elektronlara s-, p-, d-, f-elektronları denir. Bu durumda, s-, p-, d-, f-elektronları veya s-, p-, d-, f-atomik orbitallerin durumlarından da söz edilir.
18. Temel kuantum sayısı.
Temel kuantum sayısı, bir enerji seviyesinde bir elektronun durumunun tanımı olan bir tamsayıdır. Enerji seviyesi yakın enerji değerlerine sahip bir atomdaki bir elektronun durağan durumları kümesidir. Temel kuantum sayısı, elektronun çekirdeğe olan mesafesini belirler ve karakterize eder. elektron enerjisi bu seviyeyi işgal eden
19. Yörünge kuantum sayısı. Elektron bulutlarının formları
yörünge kuantum sayısı- kuantum fiziğinde, bir atomdaki bir elektronun dalga fonksiyonunun genliğinin dağılımının şeklini, yani elektron bulutunun şeklini belirleyen kuantum sayısı ℓ. Ana (radyal) kuantum sayısı ile belirtilen enerji seviyesinin alt seviyesini belirler n ve değerleri alabilir
bir özdeğer mi Şebeke yörünge momentumu elektronun açısal momentumundan farklı olan elektron j sadece spin operatöründe s:
Yörünge kuantum sayısı ile toplam momentumun kuantum sayısı arasındaki fark, mutlak değerde (elektron dönüşü) geçmez. Azimut kuantum sayısı, elektron bulutunun uzaydaki yönünü belirler.
Mekanik modele göre elektron bulutu şekli atom, atomun çekirdeğinin şeklinin bir sonucudur. Atomları birbirine bağlayan kuvvetlerin kaynakları elektron bulutlarının örtüşen bölgeleridir. Örtüşme bölgeleri, aynı anda her iki temas eden atomun elektron bulutlarının bir parçasıdır. Daha fazla örtüşen bölge, atomlar arasındaki bağ daha güçlüdür. Elektron bulutunun yörüngesinin çoğu üzerindeki her elektronu, esas olarak çekirdeğin protonlarından biri ile etkileşime girerek elektron bulutunun bir parçasını oluşturur - bir elektron lobu. Ancak örtüşen bölgelerde elektronlar bir elektron lobundan diğerine hareket edebilir. Tamamlanmış nükleer kabuğun protonlarıyla ilişkili elektron yaprakları, atomlar arası bağlara katılmaz. Sınırları çekirdeğin merkezine izole elektron yapraklarının uçlarından çok daha yakın olan sürekli bir elektron bulutunda birleşirler. Bu nedenle, sürekli bir elektron bulutu, komşu atomların elektron bulutlarına ulaşmaz ve onlarla örtüşme bölgeleri oluşturma yeteneğine sahip değildir. Atomlar arası bağlar sadece izole elektron yaprakları oluşturabilir. Katı elektron bulutlarının çok ötesine uzanırlar ve diğer atomların benzer elektron loblarına çekilirler ve örtüşen bölgeler oluştururlar. Atomların çekimi, gravidinamik çekim kuvvetleri ile elektron kabuğunun elastikiyet kuvvetleri arasında bir dengeye ulaşılıncaya kadar gerçekleşir. Bundan, bir atomun elektron bulutunun sınırlarının katı bir şekilde sabit olmadığı ve atomların yoğunluğundaki bir değişiklikle değişebileceği sonucu çıkar. Buna göre atomun boyutu da değişebilir. Maksimum paketlemede özdeş atomik izomerlerin elektron bulutları arasındaki örtüşme bölgelerinin teorik olarak olası konfigürasyonlarını oluşturmaya çalışalım. Aynı türden bu tür birbirine yapışmış atomlar, tek bir kristal oluşturabilir - periyodik bir yapıya sahip hacimli dev bir molekül.






