Obținem masa molară în moli. Un mol este o unitate de cantitate a unei substanțe. Masă molară. Folosind formule noi, rezolvăm probleme
Lecție de chimie în clasa a VIII-a pe tema „Cantitatea de substanță. Molie"
Obiectivele lecției:
- pentru a familiariza elevii cu o nouă mărime fizică - cantitatea unei substanțe, cu unitatea de măsură a acesteia - o mol; învață să folosești cantitatea de materie și alunița.
Dați conceptul de masă molară, continuați formarea conceptului de cantitate de substanță, capacitatea de a utiliza această valoare, îmbogățiți conținutul formula chimica.
Sarcini:
Să formeze în timpul lecției conceptele de „cantitate de substanță”, „numărul lui Avogadro”.
Pentru a forma capacitatea de a rezolva probleme folosind conceptele de „cantitate de substanță”, „număr Avogadro”.
Continuați să dezvoltați abilități experimentale în lucrul cu substanțe, capacitatea de a observa, analiza, trage concluzii, evidenția informațiile necesare.
Rezultat planificat:
Elevii cunosc conceptele de „cantitate de substanță”, „număr Avogadro”, pot rezolva probleme de calcul folosind aceste concepte
Tipul de lecție: TIC combinate - o lecție folosind metode de predare interactive.
Planul lecției.
eu etapă. Organizarea timpului
Salutare, crearea unei dispoziții emoționale pozitive.
Verificarea elevilor pentru clasă.
Buna ziua prieteni!(marca lipsă)
Mă bucur să te văd. Văd chipuri inteligente și amabile în fața mea. Pentru a înțelege cum vom lucra astăzi, vreau să știu în ce dispoziție ești. Dacă ești într-o dispoziție bună, zâmbește-mi. Uitați-vă unii la alții, zâmbiți!
Sunt sigur că lecția de astăzi ne va aduce satisfacții și va fi fructuoasă, iar dispoziția voastră nu se va înrăutăți până la sfârșitul lecției.
II etapă. Actualizarea cunoștințelor și abilităților necesare, inclusiv verificarea teme pentru acasă(diapozitivul 2)
Unde în Tabelul Periodic sunt elementele corespunzătoare substanțe simple metale?
Unde se găsesc nemetale în Tabelul Periodic?
Care sunt generalii proprietăți fizice metale?
Ce este alotropia?
Dați exemple de alotropie?
Completați propozițiile: (diapozitivul 3)
Cunoscut 22 metaloid
Cristale de iod Violet culorile
nemetal lichid brom
Forme de carbon diamant si grafit
După ce se formează o furtună în aer ozon
Din propozițiile de mai jos, scrieți numerele corespunzătoare metalelor într-o coloană și numerele corespunzătoare nemetalelor într-o altă coloană. (diapozitivul 4)
1. Stare agregată: solid.
2. Au un luciu metalic.
3. Nu au un luciu metalic.
5. Conductiv electric.
6. Gazos.
7. În stare solidă - fragilă.
8.Plastic.
9. Nu conduce căldura.
Metalele
1,2,4,5,8
nemetale
1,3, 6,7, 9
(diapozitivul 5) Evaluează-ți starea înainte de un subiect nou.
III etapă. Explicarea noului material. (diapozitivul 6)
Lipiciul s-a vărsat - cuvintele s-au lipit împreună. Separați cuvintele unul de celălalt cu liniuțe.
zahăr|aluniță|apă|cantitate|una|substanță|
Profesorul comunică scopurile și obiectivele lecției.
Înregistrarea subiectului lecției (diapozitivul 7)
Profesorul reamintește elevilor că chimia este știința substanțelor și a transformărilor lor. Pentru a obține o anumită cantitate de produs (în laborator chimic sau la fabrică) este necesar să se ia strict definite cantitate iniţială substante.
Chimiștii, efectuând experimente, au observat că compoziția produselor unor reacții depinde de rapoartele în care au fost luați reactanții.
(diapozitivul 8) De exemplu, dacă cărbunele este ars în exces de oxigen, se produce dioxid de carbon:
C + O 2 → CO 2
Și dacă luați de 2 ori mai puțin, obțineți monoxid de carbon:
C + 0,5O 2 → CO 2
În primul caz, 1 moleculă de oxigen a reacționat cu 1 atom de carbon, iar în al doilea caz, o moleculă de oxigen a reacționat cu doi atomi de carbon.
Se pune întrebarea: cum se măsoară un anumit număr de atomi sau molecule?
Este ușor de măsurat masa unei substanțe (cu ajutorul cântarelor) sau volumul unui gaz sau lichid (cu ajutorul ustensilelor de măsură). Deci ai nevoie cantitate fizica, care vă permite să convertiți numărul de atomi sau molecule în masă sau volum.
Să efectuăm calcule simple: masa celui mai ușor atom - hidrogen este de 1,66 10 -24 g, această masă este luată ca unitate de masă atomică relativă: Ar(H) = 1. Să presupunem acum că avem 1 g de atomi de hidrogen. Câți atomi vor fi în această masă? Pentru a calcula, trebuie să împărțiți masa unei porțiuni de hidrogen la masa unui atom de hidrogen: 1 g: 1,66 11 -24 g ≈ 6,02 10 23 atomi.
În masa (în grame) a oricărui element, numeric egală cu relativul masă atomică, va conține același număr de atomi ai acelui element.
Masa (în grame) a oricărei substanțe, numeric egală cu greutatea sa moleculară relativă, va conține același număr de molecule. Aceasta este o valoare constantă, se numește numărul lui Avogadro, notat cu N A .
(diapozitivul 9)
(diapozitivul 10)Ce asociații evocă desenul? (mol). Unitatea de măsurare a cantității de substanță se numea „ cârtiță"
Cantitatea de substanță care conține 6,02 10 23 unități structurale ale unei substanțe se numește molem .(diapozitivul 11)
Pe baza exemplelor luate în considerare, profesorul adaugă că numărul altor particule se măsoară și în moli: atomi, ioni, electroni etc.
(diapozitivul 12/1)1 mol de orice substanță în orice starea de agregare conţine N A = 6∙10 23 moleculele sale.
cârtiță - unitate cantitate de substanță .
Cantitatea de substanță este o mărime fizică introdusă pentru a lega numărul de unități structurale ale unei substanțe și masa sau volumul acesteia.
(diapozitivul 12/2) Se notează cantitatea de substanță n(ro) sau (nu) (învechit), măsurat în alunițe.
n[mol]
(diapozitivul 13)Slide generală a cantității de substanță.
(diapozitivul 14-15) 1 mol din orice substanță are o masă egală numeric cu masa moleculară relativă, dar având o unitate de g/mol
Această masă se numește molar , notat cu M.
Mr = M [g/mol]
Cum poți vedea 1 mol dintr-o substanță?
Luați o lingură, umpleți-o cu apă și turnați-o într-un pahar. Acesta va fi aproximativ 1 mol de apă. Se toarnă încă o lingură de apă într-un pahar. Acum există 2 moli din această substanță în sticlă. Să mai adăugăm o lingură. Cantitatea de apă va deveni egală cu 3 mol.
(diapozitivul 16)Demonstrați clasei câteva substanțe cantitatea de 1 mol: 56 g pulbere de fier ( Fe ), 58 g sare ( NaCl ), 342 g zahăr ( C 12 H 22 O 11 )
(diapozitivul 17-18)Determinarea masei molare a anumitor substante
(diapozitivul 19) Cantitatea de substanță și masa sunt legate prin următoarea relație:
m = n M
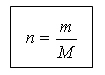
Cantitatea de substanță și numărul de unități structurale N sunt legate prin următoarea relație:
N = N A n
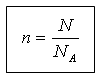
- Deci, cum calculăm numărul de particule conținute în trei moli de apă? (diapozitivul 20)
Este necesar să înmulțiți cantitatea de substanță luată (în acest caz, apă) cu constanta Avogadro:
N(H 2 O) \u003d 3 mol 6 10 23 molecule \u003d 18 10 23
(diapozitivul 22) Evaluează-ți starea în lecție
IV etapă. Consolidare. Rezolvarea problemelor.
Aflați masa a 10 moli de azot? (diapozitivul 23)
Soluţie:
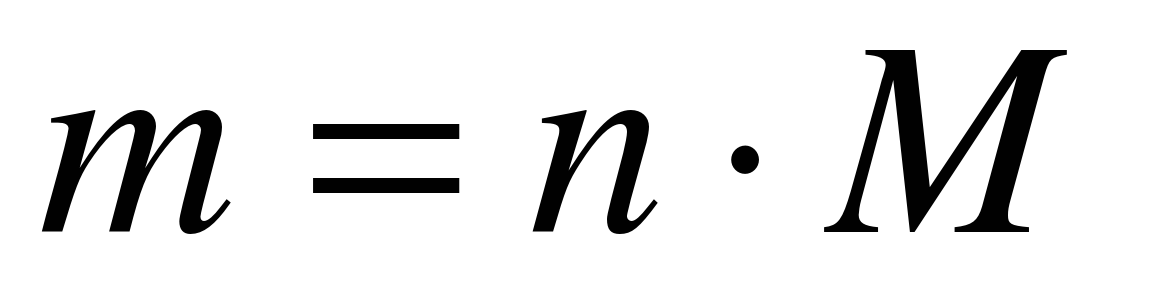
M (N 2) \u003d 28 g / mol
m (N 2) \u003d 10 mol * 28 g / mol
Răspuns: m (N 2) \u003d 280 g
Dat:
n (N 2) \u003d 10 mol
Găsi:
m (N2) - ?
(diapozitivul 24)V etapă.Teme pentru acasă
§15, ex. 1-3
Răspunde la întrebare:
Câte molecule de zahăr sunt conținute într-o bucată de zahăr rafinat știind că masa unei bucăți este de 1,3 g?






