Dobivanje radioaktivnih izotopa. Sinopsis časa iz fizike "Dobijanje radioaktivnih izotopa i njihova primjena" (11. razred)
Cilj: _________________________________________________________________________________________________________________________________________________________________________________________________
Zadatak:________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Tokom nastave
I . Motivacija.
II . Ažuriranje znanja. (slajd 2-3)
III . Rješavanje problema (slajd 4)
a) 7p+7n; b) 18r + 22n; c) 33r + 42n; d) 84r + 126n.
(nitrogen N , argon Ar , arsenik As , polonijum Po )
IV. Učenje novog gradiva
(slajd 5) Na osnovu proton-neutronskog modela strukture atomskih jezgara, dato je objašnjenje zanimljivih eksperimentalnih činjenica , otvoren u prve dve decenije XX in .
Soddy je 1911. sugerirao mogućnost postojanja elemenata sa istim hemijskim svojstvima, ali se posebno razlikuju po radioaktivnosti.
U to vrijeme Mnogi naučnici su proučavali svojstva radioaktivnih elemenata. Tokom ovog radaizvedeni su različiti eksperimenti, uključujući mjerenja masa atomskih jezgara. (Tačnije, izmjerene su mase jona, ali u ovom slučaju se masa jezgra, jona i atoma može smatrati istom, jer je masa svih elektrona u atomu zanemarljiva u odnosu na masu atoma jezgro.)
Ovisno o vrijednostima Z , A , N razlikovati:
izotopi
izobare
izotoni
jezgra sa istim Z ,
ali drugačiji A
jezgra sa istim A , ali drugačije Z
Jezgra sa istim brojem neutrona N
Pogledajmo pobliže izotope. Proučavanjem svojstava radioaktivnih elemenata ustanovljeno je da je isto hemijski element Postoje atomi sa jezgrima različite mase. Tako je, na primjer, pronađeno nekoliko varijanti atoma uranijuma: s masama jezgara približno jednakim 234 a. e.m., 235 a. e. m., 238 a. e. m. i 239 a. e. m. Štaviše, svi ovi atomi su imaliista hemijska svojstva. Ušli su u hemijske reakcije na isti način, formirajući ista jedinjenja.
Imati ista hemijska svojstva znači da svi ovi atomi imaju isti broj elektrona u elektronskom omotaču. , što znači i identična nuklearna punjenja .
Ako su naboji jezgara atoma isti, onda ti atomi zaista pripadaju istom hemijskom elementu (uprkos razlikama u njihovim masama) i imaju isti serijski broj u tabeli D. I. Mendeljejeva, tj. zauzimaju u ovoj tabeli ista ćelija, isto mesto. Otuda naziv svih varijanti jednog hemijskog elementa:izotopi (od grčkih reči isos - isto i topos - mjesto).
izotopi - to su varijante datog hemijskog elementa koje se razlikuju po masi atomskih jezgara.
Zahvaljujući stvaranju proton-neutronskog modela jezgra (tj. otprilike dvije decenije nakon otkrića izotopa), bilo je moguće objasniti zašto atomska jezgra sa istim nabojem imaju različite mase. Očigledno,izotopi sadrže isti broj protona, ali različit broj neutrona.
Trenutno je utvrđeno postojanje izotopa u svim hemijskim elementima. Neki elementi imaju samo nestabilne (tj. radioaktivne) izotope. Izotopi su u najtežem elementu koji postoji u prirodi - uranijumu (relativne atomske mase 238, 235 itd.) iu najlakšem - vodoniku (relativne atomske mase 1, 2, 3).
(slajd 6) Postoje tri izotopa vodonika: (protium), (deuterijum) i (tricijum). jezgro izotopa uopšte nema neutronaje jedan proton. Prema tome, njegov naboj je jednak elementarnom električni naboj(broj ispod), a masa je približno 1 AJ. e. m. (broj iznad). U sastavu jezgra deuterijuma () uključuje dvije čestice: proton i neutron. Stoga je masa deuterija približno 2 AJ. e. m. Jezgro tricijuma se sastoji od tri čestice: jednog protona i dva neutrona. Prema tome, masa tricijuma je približno 3 AJ. jesti.
Postojanje izotopa je razlog da se relativne atomske mase većine hemijskih elemenata u tabeli D. I. Mendeljejeva izražavaju kao razlomak. Budući da se hemijski elementi obično sastoje od mješavine nekoliko izotopa, potrebno je naznačitiprosječna vrijednost mase jezgara atoma svih izotopa datog elementa . A ova prosječna vrijednost najčešće se ispostavlja kao razlomak. Na primjer, u prosjeku, na 100 atoma hlora Clima 75 atoma mase 35 a. e. m. i 25 atoma sa masom od 37 am. e. m. (mase se uzimaju u cijele brojeve). Prosječna vrijednost mase atoma u ovom slučaju se izračunava na sljedeći način:
U nuklearnoj industriji, radioaktivni izotopi imaju sve veću vrijednost za čovječanstvo.
(slajd 7) Radioaktivni izotopi se proizvode u nuklearnim reaktorima i akceleratorima elementarne čestice.
Hemijska svojstva radioaktivnih izotopa ne razlikuju se od svojstava neradioaktivnih izotopa istih elemenata, ali su izvori radioaktivnog zračenja.
Elementi koji ne postoje u prirodi. Via nuklearne reakcije moguće je dobiti radioaktivne izotope svih hemijskih elemenata koji se javljaju u prirodi samo u stabilnom stanju. Elementi pod brojevima 43, 61, 85 i 87 uopšte nemaju stabilne izotope i prvo su dobijeni veštačkim putem. Na primjer, element s atomskim brojem 43, nazvan tehnecij, ima najdugovječniji izotop s vremenom poluraspada od oko milion godina.
Uz pomoć nuklearnih reakcija,transuranski elementi. Već znate za neptunijum i plutonijum. Osim njih, primljeni su i sljedeći elementi:americijum ( Z = 95), curium ( Z = 96), berkelium ( Z = 97), kalifornij ( Z = 98), einsteinium ( Z = 99), fermijum ( Z = 100), mendelevium ( Z = 101), nobelijum ( Z = 102), Lawrencium ( Z = 103), rutherfordium ( Z = 104), dubnium ( Z = 105), seaborgium ( Z = 106), bohrium ( Z = 107), hassium ( Z = 108), meitnerium ( Z= 109), kao i elementi označeni brojevima 110, 111 i 112, koji još nemaju opštepriznata imena. Elementi koji počinju od broja 104 sintetizovani su po prvi put u Dubni kod Moskve ili u Nemačkoj.
obeleženih atoma. Trenutno, kako u nauci tako iu proizvodnji, sve se više koristi radioaktivni izotopi raznih hemijskih elemenata. Ima najveću primjenumetoda obeleženih atoma.
Metoda se zasniva na činjenici da se hemijska svojstva radioaktivnih izotopa ne razlikuju od svojstava neradioaktivnih izotopa istih elemenata.
Radioaktivni izotopi se mogu otkriti vrlo jednostavno - njihovim zračenjem. Radioaktivnost je vrsta oznake koja se može koristiti za praćenje ponašanja elementa u različitim kemijskim reakcijama i fizičkim transformacijama tvari. Metoda obilježenih atoma postala je jedna od najefikasnijih metoda za rješavanje brojnih problema u biologiji, fiziologiji, medicini itd.
Radioaktivni izotopi - izvori zračenja . Radioaktivni izotopi se široko koriste u nauci, medicini i tehnologiji kao kompaktni izvori γ-zraka. Uglavnom se koristi radioaktivni kobalt .
(slajd 8)Radioaktivni izotopi u biologiji i medicini. Jedna od najistaknutijih studija provedenih uz pomoć obilježenih atoma bila je proučavanje metabolizma u organizmima. Dokazano je da se u relativno kratkom vremenu tijelo gotovo potpuno obnavlja. Njegovi sastavni atomi su zamijenjeni novim.
Samo je željezo, kao što su pokazali eksperimenti na izotopskom proučavanju krvi, izuzetak od ovog pravila. Gvožđe je deo hemoglobina u crvenim krvnim zrncima. Kada su radioaktivni atomi gvožđa uvedeni u hranu, ustanovljeno je da oni gotovo i ne ulaze u krvotok. Tek kada ponestane zaliha gvožđa u telu, telo počinje da ga apsorbuje.
Ako nema dovoljno dugovječnih radioaktivnih izotopa, kao što su, na primjer, kisik i dušik, izotopski sastav stabilnih elemenata se mijenja. Dakle, dodavanjem viška izotopa kiseoniku otkriveno je da je slobodni kiseonik koji se oslobađa tokom fotosinteze izvorno bio deo vode, a ne ugljen-dioksid.
Radioaktivni izotopi se koriste u medicini, kako u dijagnostičke tako iu terapijske svrhe.
Radioaktivni natrijum, ubrizgan u malim količinama u krv, koristi se za proučavanje cirkulacije.
Jod se intenzivno taloži u štitnoj žlijezdi, posebno kod Gravesove bolesti. Praćenjem taloženja radioaktivnog joda pomoću brojača, dijagnoza se može brzo postaviti. Velike doze radioaktivnog joda uzrokuju djelomično uništavanje abnormalno razvijajućih tkiva, pa se radioaktivni jod koristi za liječenje Gravesove bolesti.
Intenzivno γ-zračenje kobalta koristi se u liječenju raka (kobalt pištolj).
Radioaktivni izotopi u industriji. Područje primjene radioaktivnih izotopa u industriji nije ništa manje opsežno. Jedan primjer je način praćenja trošenja klipnih prstenova u motorima. unutrašnjim sagorevanjem. Zračenjem klipnog prstena neutronima izazivaju nuklearne reakcije u njemu i čine ga radioaktivnim. Kada motor radi, čestice materijala prstena ulaze u ulje za podmazivanje. Ispitivanjem nivoa radioaktivnosti ulja nakon određenog vremena rada motora utvrđuje se istrošenost prstena.
Radioaktivni izotopi omogućavaju suđenje o difuziji metala, procesima u visokim pećima itd. Snažno γ-zračenje radioaktivnih preparata koristi se za proučavanje unutrašnje strukture metalnih odlivaka kako bi se otkrili defekti na njima.
radioaktivni izotopi u poljoprivreda. Radioaktivni izotopi se sve više koriste u poljoprivredi. Ozračenje sjemena biljaka (pamuk, kupus, rotkvica, itd.) malim dozama γ-zraka iz radioaktivnih preparata dovodi do primjetnog povećanja prinosa.
Velike doze zračenja uzrokuju mutacije u biljkama i mikroorganizmima, što u nekim slučajevima dovodi do pojave mutanata s novim vrijednim svojstvima (radioselekcija). Tako su uzgojene vrijedne sorte pšenice, pasulja i drugih kultura, a dobijeni su visokoproduktivni mikroorganizmi koji se koriste u proizvodnji antibiotika. Gama zračenje radioaktivnih izotopa se također koristi za kontrolu štetnih insekata i za očuvanje prehrambeni proizvodi.
Obilježeni atomi se široko koriste u poljoprivrednoj tehnologiji. Na primjer, da bi se saznalo koje od fosfatnih gnojiva biljka bolje apsorbira, razna gnojiva su označena radioaktivnim fosforom. . Ispitivanjem biljaka na radioaktivnost može se odrediti količina fosfora koju apsorbuju iz različitih vrsta đubriva.
Radioaktivni izotopi u arheologiji . Metodom radioaktivnog ugljika dobijena je zanimljiva aplikacija za određivanje starosti antičkih predmeta organskog porijekla (drvo, ugalj, tkanine itd.). Biljke uvijek imaju β-radioaktivni ugljični izotop sa vremenom poluraspadaT= 5700 godina. Nastaje u Zemljinoj atmosferi u maloj količini iz dušika pod djelovanjem neutrona. Potonji nastaju zbog nuklearnih reakcija uzrokovanih brzim česticama koje ulaze u atmosferu iz svemira (kosmičke zrake).
Kombinirajući se s kisikom, ovaj izotop ugljika stvara ugljični dioksid, koji apsorbiraju biljke, a preko njih i životinje. Jedan gram ugljika iz uzoraka mladih šuma emituje oko petnaest β-čestica u sekundi.
Nakon smrti organizma, njegovo nadopunjavanje radioaktivnim ugljikom prestaje. Dostupna količina ovog izotopa se smanjuje zbog radioaktivnosti. Određivanjem postotka radioaktivnog ugljika u organskim ostacima može se odrediti njihova starost ako se kreće u rasponu od 1000 do 50 000, pa čak i do 100 000 godina. Ova metoda se koristi za utvrđivanje starosti egipatskih mumija, ostataka praistorijskih požara itd.
V . Konsolidacija proučenog materijala
Šta su izotopi?
Koja je sličnost jezgara atoma izotopa?
Kako je postojanje jezgara sa identične optužbe i razne mase?
Opišite izotope vodonika.
Zašto je masa atoma većine hemijskih elemenata u periodnom sistemu izražena kao razlomak? Navedite primjer.
VI. Zadaća
U nuklearnoj industriji, radioaktivni izotopi imaju sve veću vrijednost za čovječanstvo. Izotopi su varijante istog hemijskog elementa koji su slični po svom fizičkom i hemijska svojstva ali sa različitim atomskim masama. Naziv "izotopi" predložio je 1910. godine engleski radiohemičar Frederick Soddy, koji ga je formirao od dvije grčke riječi: isos - isto i topos - mjesto. Izotopi zauzimaju isto mjesto u ćeliji Mendeljejevljevog periodičnog sistema elemenata. Uz pomoć nuklearnih reakcija moguće je dobiti radioaktivne izotope svih kemijskih elemenata koji se javljaju u prirodi samo u stabilnom stanju. Ali uvijek postoje izuzeci. Takvi hemijski elementi koji se nalaze pod brojem u tabeli D.I. Mendeljejev: 43, 61, 85 i 87 nemaju stabilne izotope i prvi put su dobijeni veštački. Uz pomoć nuklearnih reakcija dobijeni su transuranski elementi: neptunijum, plutonijum. Osim njih, dobijeni su i sljedeći elementi: americij (Z = 95), kurij (Z = 96), berkelijum (Z = 97), kalifornij (Z = 98), einsteinium (Z = 99), fermijum (Z = 100), mendelevij (Z = 101), nobelijum (Z = 102), lorencijum (Z = 103), ruterfordijum (Z = 104), dubnij (Z = 105), siborgijum (Z = 106), borij (Z = 107) , hassium (Z = 108), meitnerium (Z = 109), kao i elementi označeni brojevima 110, 111 i 112, koji još nemaju opštepriznata imena. Elementi koji počinju od broja 104 sintetizovani su po prvi put u Dubni kod Moskve ili u Nemačkoj. Trenutno, kako u nauci tako i u proizvodnji, sve više se koriste radioaktivni izotopi različitih hemijskih elemenata. Najveću primjenu ima metoda označenih atoma. Ova metoda iskorištava činjenicu da hemijski i mnogi fizička svojstva radioaktivni izotop se ne razlikuje od stabilnih izotopa istog elementa. Istovremeno, radioaktivni izotop se može lako identificirati po njegovom zračenju (pomoću, na primjer, brojača plinskog pražnjenja). Dodavanjem radioaktivnog izotopa elementu koji se proučava i hvatanjem njegovog zračenja u budućnosti, možemo pratiti put ovog elementa u tijelu, u hemijska reakcija, pri topljenju metala itd. Metoda označenih atoma postala je jedna od najefikasnijih metoda u rješavanju brojnih problema biologije, fiziologije, medicine itd. Radioaktivni izotopi su izotopi bilo kojeg elementa periodnog sistema D. I. Mendeljejeva, čiji atomi imaju nestabilna jezgra i prelaze u stabilno stanje radioaktivnim raspadom, praćenim zračenjem.Radioaktivni izotopi se koriste u medicini kako u dijagnostičke tako iu terapeutske svrhe. Radioaktivni natrijum, unesen u malim količinama u krv, koristi se za proučavanje cirkulacije krvi, jod se intenzivno deponuje u štitnoj žlezdi, posebno kod Gravesove bolesti. Praćenjem taloženja radioaktivnog joda pomoću brojača, dijagnoza se može brzo postaviti. Velike doze radioaktivnog joda uzrokuju djelomično uništavanje abnormalno razvijajućih tkiva, pa se radioaktivni jod koristi za liječenje Gravesove bolesti. Intenzivno kobalt gama zračenje se koristi u liječenju raka (kobalt pištolj). Područje primjene radioaktivnih izotopa u industriji nije ništa manje opsežno. Jedan primjer bi bila metoda za praćenje trošenja prstena u klipu motora s unutrašnjim sagorijevanjem. Zahvaljujući radioaktivnim izotopima, određuju se razne vrste oštećenja metalnih konstrukcija. Radioaktivni izotopi omogućavaju suđenje o difuziji metala, procesima u visokim pećima, itd. Radioaktivni izotopi se koriste u poljoprivredi. Zračenje sjemena biljaka (pamuk, kupus, rotkvica i dr.) malim dozama - zraka iz radioaktivnih preparata dovodi do primjetnog povećanja prinosa. Velike doze zračenja uzrokuju mutacije u biljkama i mikroorganizmima, što u nekim slučajevima dovodi do pojave mutanata s novim vrijednim svojstvima (radioselekcija). Primjeri su nove sorte pasulja, pšenice. Gama zračenje radioaktivnih izotopa se također koristi za kontrolu štetnih insekata i za očuvanje hrane. Radioaktivni izotopi se koriste u arheologiji, antropologiji i geologiji. Metodom radioaktivnog ugljika dobijena je zanimljiva aplikacija za određivanje starosti antičkih predmeta organskog porijekla (drvo, ugalj, tkanine itd.). Radiokarbonsku metodu geohronologije razvio je 1946. godine W.F. Libby, koja je primila za njega nobelova nagrada na hemiji 1960. Najbolji rezultati se postižu pri određivanju starosti vune, sjemena, ljuske i kostiju. Da biste odredili starost uzorka, izmjerite aktivnost p-zračenja (broj raspada u minuti) po 1 g ugljika koji se nalazi u njemu. Ovo omogućava određivanje starosti uzorka pomoću krivulje radioaktivnog raspada za izotop. Ova metoda se koristi za utvrđivanje starosti egipatskih mumija, ostataka praistorijskih požara itd.
1 slajd

2 slajd
Definicija Izotopi (od drugog grčkog ισος - "jednak", "isti" i τόπος - "mjesto") - varijeteti atoma (i jezgara) kemijskog elementa koji imaju isti atomski broj, ali su različite masene brojeve. Naziv je dobio zbog činjenice da su svi izotopi jednog atoma smješteni na istom mjestu (u jednoj ćeliji) periodnog sistema. Hemijska svojstva atoma zavise od strukture elektronska školjka, koji je, pak, određen uglavnom nabojem jezgra Z (tj. brojem protona u njemu), i gotovo ne ovisi o njegovom maseni broj A (to jest, ukupan broj protona Z i neutrona N).

3 slajd
Otkriće izotopa Prvi dokaz da supstance koje imaju isto hemijsko ponašanje mogu imati različita fizička svojstva došao je iz proučavanja radioaktivnih transformacija atoma teških elemenata. U 1906-1907, pokazalo se da proizvod radioaktivnog raspada uranijuma - jonijuma i produkt radioaktivnog raspada torija - radiotorijum imaju ista hemijska svojstva kao torij, ali se razlikuju od njega. atomska masa i karakteristike radioaktivnog raspada. Kasnije je ustanovljeno da sva tri proizvoda imaju isti optički i rendgenski spektar. Takve supstance, identične po hemijskim svojstvima, ali različite po masi atoma i nekim fizičkim svojstvima, na predlog engleskog naučnika Sodija, od 1910. godine počele su da se nazivaju izotopi.

4 slajd
Izotopi u prirodi Vjeruje se da je izotopski sastav većine elemenata na Zemlji isti u svim materijalima. Neki fizički procesi u prirodi dovode do narušavanja izotopskog sastava elemenata (prirodno frakcionisanje izotopa, karakteristično za lake elemente, kao i izotopski pomaci tokom raspada prirodnih dugoživućih izotopa). Postepena akumulacija u mineralima jezgara - produkata raspada nekih dugovječnih nuklida koristi se u nuklearnoj geohronologiji. Od posebnog značaja su procesi formiranja izotopa ugljenika u gornjim slojevima atmosfere pod uticajem kosmičkog zračenja. Ovi izotopi su raspoređeni u atmosferi i hidrosferi planete i uključeni su u promet ugljika živih bića (životinja i biljaka). Proučavanje distribucije izotopa ugljika je osnova radiokarbonske analize.
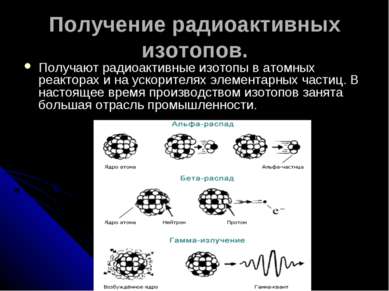
5 slajd
Dobivanje radioaktivnih izotopa. Nabavite radioaktivne izotope u nuklearnim reaktorima i akceleratorima čestica. Velika grana industrije trenutno se bavi proizvodnjom izotopa.

6 slajd
Primjena u biologiji i medicini Jedna od najistaknutijih studija provedenih uz pomoć označenih atoma bila je proučavanje metabolizma u organizmima. Dokazano je da se u relativno kratkom vremenu tijelo gotovo potpuno obnavlja. Njegovi sastavni atomi su zamijenjeni novim. Samo je željezo, kao što su pokazali eksperimenti na izotopskom proučavanju krvi, izuzetak od ovog pravila. Gvožđe je deo hemoglobina u crvenim krvnim zrncima. Kada su radioaktivni atomi gvožđa uvedeni u hranu, ustanovljeno je da oni gotovo i ne ulaze u krvotok. Tek kada ponestane zaliha gvožđa u telu, telo počinje da ga apsorbuje. Ako nema dovoljno dugovječnih radioaktivnih izotopa, kao što su, na primjer, kisik i dušik, izotopski sastav stabilnih elemenata se mijenja. Tako je dodavanjem viška izotopa kisiku otkriveno da je slobodni kisik koji se oslobađa tokom fotosinteze izvorno bio dio vode, a ne ugljičnog dioksida.

7 slajd
Industrijske primjene Jedan primjer je metoda praćenja istrošenosti klipnih prstenova u motorima s unutrašnjim sagorijevanjem. Zračenjem klipnog prstena neutronima izazivaju nuklearne reakcije u njemu i čine ga radioaktivnim. Kada motor radi, čestice materijala prstena ulaze u ulje za podmazivanje. Ispitivanjem nivoa radioaktivnosti ulja nakon određenog vremena rada motora utvrđuje se istrošenost prstena. Radioaktivni izotopi omogućavaju suđenje o difuziji metala, procesima u visokim pećima itd. Snažno zračenje radioaktivnih preparata koristi se za proučavanje unutrašnje strukture metalnih odlivaka kako bi se otkrili defekti na njima.

8 slajd
Izotopi u poljoprivredi Radioaktivni izotopi se sve više koriste u poljoprivredi. Zračenje sjemena biljaka (pamuk, kupus, rotkvica i dr.) malim dozama - zraka iz radioaktivnih preparata dovodi do primjetnog povećanja prinosa. Velike doze zračenja uzrokuju mutacije u biljkama i mikroorganizmima, što u nekim slučajevima dovodi do pojave mutanata s novim vrijednim svojstvima (radioselekcija). Tako su uzgojene vrijedne sorte pšenice, pasulja i drugih kultura, a dobijeni su visokoproduktivni mikroorganizmi koji se koriste u proizvodnji antibiotika. Gama zračenje radioaktivnih izotopa se također koristi za kontrolu štetnih insekata i za očuvanje hrane.

9 slajd
Izotopi u arheologiji Zanimljiva primjena za određivanje starosti antičkih predmeta organskog porijekla (drvo, drveni ugalj, tkanine itd.) dobijena je metodom radioaktivnog ugljika. Biljke uvijek imaju -radioaktivni ugljični izotop s poluživotom od T = 5700 godina. Nastaje u Zemljinoj atmosferi u maloj količini iz dušika pod djelovanjem neutrona. Potonji nastaju zbog nuklearnih reakcija uzrokovanih brzim česticama koje ulaze u atmosferu iz svemira (kosmičke zrake).