Talasne dužine spektralnih linija vodonika. Apsolutni minimum. Kako kvantna teorija objašnjava naš svijet
Postulati koje je iznio Bohr omogućili su izračunavanje spektra atoma vodika i sistemi nalik vodoniku- sistemi koji se sastoje od jezgra sa nabojem Ze i jedan elektron (na primjer, He +, Li 2+ joni), kao i teoretski izračunati Rydbergovu konstantu.
Prateći Bora, razmotrimo kretanje elektrona u sistemu nalik vodiku, ograničavajući se na kružne stacionarne orbite. Rešavajući zajedno jednačinu (208.1) m e v 2 /r=Ze 2 /(4 0 r 2) koju je predložio Rutherford i jednačinu (210.1), dobijamo izraz za poluprečnik n-te stacionarne orbite:
gdje je n=1, 2, 3, ... . Iz izraza (212.1) slijedi da polumjeri orbita rastu proporcionalno kvadratima cijelih brojeva.
Za atom vodonika (Z=1), radijus prve orbite elektrona na n=1, tzv. prvi Borov radijus(a), jednako

što odgovara proračunima zasnovanim na kinetičkoj teoriji gasova. Budući da se radijusi stacionarnih orbita ne mogu izmjeriti, da bi se teorija provjerila potrebno je obratiti se takvim veličinama koje se mogu eksperimentalno izmjeriti. Ova količina je energija koju emituju i apsorbuju atomi vodonika.
Ukupna energija elektrona u sistemu nalik vodoniku je zbir njegove kinetičke energije (m e v 2 /2) i potencijalna energija u elektrostatičkom polju jezgra (-Ze 2 / (4 0 r)):

(uzeli smo u obzir da je m e v 2 /2 = 1 / 2 Ze2(4 0 r) (vidi.
(208.1)). Uzimajući u obzir vrijednosti (212.1) kvantizirane za polumjer n-te stacionarne orbite, dobijamo da energija elektrona može uzeti samo sljedeće dozvoljene diskretne vrijednosti:

gdje znak minus znači da je elektron u vezanom stanju.
Iz formule (212.3) slijedi da energetska stanja atoma formiraju niz energetskih nivoa koji se mijenjaju ovisno o vrijednosti P. Integer n u izrazu (212.3), koji određuje nivoe energije atoma, naziva se glavni kvantni broj. Energetsko stanje sa n=1 je osnovno (normalno) država; stanja sa /r > 1 su uzbuđen. Energetski nivo koji odgovara osnovnom stanju atoma naziva se osnovno (normalno) nivo; svi ostali nivoi su uzbuđen.
Davanje n različite cjelobrojne vrijednosti, dobijamo za atom vodonika

(Z=1), prema formuli (212.3), mogući nivoi energije, šematski prikazani na sl. 294. Energija atoma vodika sa povećanjem n raste (njegova negativna vrijednost se smanjuje) i nivoi energije se približavaju granici koja odgovara vrijednosti n= . Stoga atom vodika ima najnižu energiju (E 1 = - 13,55 eV) na n= 1 i maksimum (E 1 = 0) na n = (kada se elektron ukloni iz atoma). Dakle, vrijednost E =0 odgovara jonizacija atom (otkinuti elektron s njega).
Prema Borovom drugom postulatu (vidi (210.2)), tokom prelaska atoma vodika (Z=1) iz stacionarnog stanja nWith veća energija u stacionarno stanje m sa manjom energijom a emituje se kvant
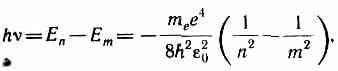
odakle frekvencija zračenja

R=m e e 4 /(8h 3 2 0 ).
Korištenje u proračunu R modernim vrijednostima univerzalnih konstanti, dobijamo vrijednost koja se poklapa s eksperimentalnom vrijednošću Rydbergove konstante u empirijskim formulama za atom vodika (vidi §209). Ova koincidencija uvjerljivo dokazuje ispravnost formule koju je dobio Bohr
(212.3) za nivoe energije sistema sličnog vodoniku.
Zamjena, na primjer, u formulu
(212.4) m=1 i n=2, 3, 4, ..., dobijamo grupu linija koje formiraju Lymanovu seriju (vidi § 209) i odgovaraju prelazima elektrona sa pobuđenih nivoa (n=2, 3, 4, .. .) na glavnoj (m=1). Slično, kada se zamijeni m=2, 3, 4, 5,
6 i njihove odgovarajuće vrijednosti n dobijamo niz Balmer, Paschen, Bracket, Pfund i Humphrey (neki od njih su šematski prikazani na slici 294), opisan u § 209. Stoga, prema Borovoj teoriji, koja je kvantitativno objasnila spektar atoma vodika, spektralne serije odgovaraju zračenju koje nastaje prelaskom atoma u dato stanje iz pobuđenih stanja koja se nalaze iznad datog.
Spektar apsorpcije atoma vodika je linijski, ali sadrži samo Lymanovu seriju. To je također objašnjeno Borovom teorijom. Budući da su slobodni atomi vodika obično u osnovnom stanju (stacionarno stanje sa najnižom energijom pri n= 1), onda kada se atomima prenese određena energija izvana, mogu se posmatrati samo prijelazi
atoma iz osnovnog stanja u pobuđeno (nastaje Lymanova serija).
Bohrova teorija bila je veliki korak u razvoju atomske fizike i važan korak u stvaranju kvantne mehanike. Međutim, ova teorija ima unutrašnje kontradikcije (s jedne strane primjenjuje zakone klasične fizike, a s druge strane temelji se na kvantnim postulatima). Ispitivala je spektre atoma vodika i sistema sličnih vodoniku i izračunala frekvencije spektralne linije, međutim, nije mogao objasniti njihov intenzitet i odgovoriti na pitanje: zašto dolazi do određenih prijelaza? Ozbiljan nedostatak Borove teorije bila je nemogućnost da se ona koristi za opisivanje spektra atoma helijuma, jednog od najjednostavnijih atoma odmah iza atoma vodika.
test pitanja
Zašto je nuklearni model atoma propao?
Zašto je Balmerov niz među različitim serijama spektralnih linija atoma vodika bio prvi koji je proučavan?
Šta znače brojevi m i n u generaliziranoj Balmerovoj formuli?
Koja je frekvencija zračenja atoma vodika koja odgovara kratkotalasnoj granici Bracket serije?
Objasnite značenje Borovih postulata. Kako objašnjavaju linijski spektar atom? Na kojim delovima krive na Sl. 293 da li su elastični i na kojima su uočeni neelastični sudari elektrona sa atomima?
Koji su glavni inputi koji se mogu izvući iz eksperimenata Franka i Hertza? Koristeći Bohrov model, označite spektralne linije koje se mogu pojaviti kada atom vodika pređe u stanja sa n=3 i n=4.
Na skali talasnih dužina nacrtajte tri linije svake od prve dve spektralne serije atoma vodika.
Zašto apsorpcijski spektar atoma vodika sadrži samo Lymanovu seriju? Pokažite da se formula (212.3) može napisati kao E n =-13,55/n 2 , gdje je E izraženo u elektron voltima.
Zadaci
27.1. Odrediti maksimalnu i minimalnu energiju fotona u ultraljubičastom nizu spektra atoma vodika (Lymanova serija).
27.2. Odredite valnu dužinu koja odgovara granici Balmerove serije.
27.3. Koristeći Borovu teoriju, odredite orbitalni magnetni moment elektrona koji se kreće duž druge orbite atoma vodika.
27.4. Koristeći Borovu teoriju, odredite promjenu orbitalnog mehaničkog momenta elektrona tokom njegovog prijelaza iz pobuđenog stanja (n=2) u osnovno stanje uz emisiju fotona talasne dužine =1,212 10 -7 m. [ L = h=1,05 10 -3 4 J s]
27.5. Odrediti jonizacijski potencijal atoma vodika.
27.6. Na osnovu činjenice da je energija jonizacije atoma vodika E i = 13,6 eV, odredite drugi potencijal pobude ovog atoma.
27.7 . Na osnovu činjenice da je energija jonizacije atoma vodika £" = 13,6 eV, odredite u elektron voltima energiju fotona koja odgovara najdužoj liniji talasne dužine Lymanovog niza.
* I. Rydberg (1854-1919) - švedski naučnik, specijalista u oblasti spektroskopije.
Studije emisionih spektra razrijeđenih plinova (tj. emisionih spektra pojedinačnih atoma) su pokazale da svaki plin ima dobro definiran linijski spektar, koji se sastoji od pojedinačnih spektralnih linija ili grupa blisko raspoređenih linija. Najviše proučavan je spektar najjednostavnijeg atoma - atoma vodika.
Švicarski naučnik I. Balmer (1825-1898) pokupio je empirijsku formulu koja opisuje sve spektralne linije atoma vodika poznate u to vrijeme u vidljivo područje spektra:
gdje je R "= 1,10 10 7 m -1 - konstantnoRydberg . Kako je v = c/, onda je formula
(209.1) može se prepisati za frekvencije:

gdje je R \u003d R "c \u003d 3,29 10 15 s -1 također Rydbergova konstanta.
Iz izraza (209.1) i (209.2) slijedi da se spektralne linije razlikuju u različitim vrijednostima n, formiraju grupu ili niz linija tzv Balmer serija. Sa povećanjem n linije serije se približavaju; značenje n= definiše granica serije, kojoj se kontinuirani spektar prislonjuje sa strane visokih frekvencija.
Kasnije (početkom 20. veka) otkriveno je još nekoliko serija u spektru atoma vodonika. AT ultraljubičasto područje spektra nalazi Lyman serija:

AT infracrveni spektar takođe su pronađeni: Paschen serija
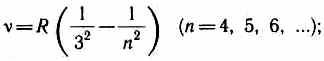
Serija nosača
Pfund serija

Humphrey serija

Sve gore navedene serije u spektru atoma vodika mogu se opisati jednom formulom tzv po generaliziranoj Balmerovoj formuli:

gdje m ima konstantnu vrijednost u svakoj datoj seriji, m= 1, 2, 3, 4, 5, 6 (definira seriju), n uzima cjelobrojne vrijednosti počevši od m+1 (definira pojedinačne linije ove serije).
Proučavanje složenijih spektra – spektra para alkalnih metala (na primjer, Li, Na, K) – pokazalo je da su predstavljeni skupom nepravilno raspoređenih linija. Rydberg ih je uspio podijeliti u tri serije, od kojih se svaka nalazi kao linije Balmerove serije.
Gore navedene serijske formule odabrane su empirijski i dugo vremena nisu imale teoretsko opravdanje, iako su eksperimentalno potvrđene s vrlo visokom preciznošću. Gornji oblik serijskih formula, zadivljujuće ponavljanje cijelih brojeva u njima, univerzalnost Rydbergove konstante svjedoče o dubokoj fizičkog čula otkrili zakonitosti, koje je bilo nemoguće otkriti u okviru klasične fizike.
§210. Borovi postulati
Prvi pokušaj da se izgradi kvalitativno nova - kvantna - teorija atoma, napravio je 1913. danski fizičar Niels Bohr (1885-1962). On je sebi postavio cilj da u jedinstvenu cjelinu poveže empirijske pravilnosti linijskih spektra, Rutherfordov nuklearni model atoma i kvantnu prirodu emisije i apsorpcije svjetlosti. Bohr je svoju teoriju zasnovao na dva postulata.
Bohrov prvi postulat (postulat stacionarnog stanja): u atomu postoje stacionarna (koja se ne mijenjaju s vremenom) stanja u kojima on ne zrači energiju. Stacionarna stanja atoma odgovaraju stacionarnim orbitama duž kojih se kreću elektroni. Kretanje elektrona u stacionarnim orbitama nije praćeno emisijom elektromagnetnih talasa.
U stacionarnom stanju atoma, elektron koji se kreće duž kružne orbite mora imati diskretne kvantizirane vrijednosti ugaonog momenta koji zadovoljavaju uvjet
m e vr n = h(n= 1, 2, 3, ...), (210.1)
gdje m e je masa elektrona, v- njegova brzina duž n-te orbite poluprečnika r n , h=h/(2). Bohrov drugi postulat (pravilo frekvencije): kada se elektron kreće s jedne stacionarne orbite na drugu, jedan foton se emituje (apsorbira) energijom
h =E n -E m , (210.2)
jednaka razlici energije odgovarajućih stacionarnih stanja ( E n i E m - respektivno, energije stacionarnih stanja atoma prije i poslije zračenja (apsorpcije)). At E m < E n emituje se foton (prijelaz atoma iz stanja sa višom energijom u stanje sa nižom energijom, tj. prijelaz elektrona iz orbite koja je udaljenija od jezgra u bližu), kada E m > E n- njegovu apsorpciju (prijelaz atoma u stanje s višom energijom, tj. prijelaz elektrona na orbitu koja je udaljenija od jezgra). Skup mogućih diskretnih frekvencija v = = (E n -E m )/h kvantne prelaze i određuje linijski spektar atoma.
Njegove spektralne serije su najbolje proučene. Oni se dobro pridržavaju Rydbergove formule:
1 λ = R (1 n ′ 2 − 1 n 2) (\displaystyle (\frac (1)(\lambda ))=R\left((\frac (1)((n")^(2))) -(\frac (1)(n^(2)))\desno)),gdje R= 109 677 cm −1 je Rydbergova konstanta za vodonik, n'- glavni nivo serije.
Zovu se spektralne linije koje se pojavljuju tokom prijelaza na glavni energetski nivo rezonantan, ostalo - podređeni.
Fizika spektralnih serija
Atom vodonika sastoji se od elektrona koji se okreće oko jezgra. Elektromagnetska sila između elektrona i protona jezgra uzrokuje prisustvo skupa kvantna stanja elektrona, od kojih svaki ima svoju energiju. Ova stanja su prikazana u Borovom modelu kao zasebne orbite elektrona. Svaka orbita ili stanje odgovara cijelom broju n.
Spektralna emisija nastaje kada elektron prelazi iz stanja više energije u stanje niže energije. Niže energetsko stanje se označava n′, a više energetsko stanje n. Energija emitovanog fotona odgovara razlici između ta dva stanja. Kako je energija svakog stanja uvijek ista, razlika između njih je također uvijek ista, a prijelaz će uvijek emitovati foton sa konstantnom energijom.
Spektralne linije su grupisane u seriju po n'. Linije se nazivaju uzastopno od najniže frekvencije grčkim slovima. Na primjer, linija 2 → 1 se zove Lyman-alfa (Ly-α) linija, a 7 → 3 Paschen-delta (Pa-δ).
Vodonik ima linije koje ne spadaju u ove serije, kao što je linija od 21 centimetar. Ove linije odgovaraju rjeđim procesima u atomu, kao što su hiperfini prijelazi. Fina struktura također uključuje uniformne spektralne linije koje se pojavljuju kao dvije ili više usko grupisanih finih linija zbog relativističkih efekata.
Lyman serija
otvoren T. Lyman 1906. godine. Sve linije serije su u ultraljubičastom opsegu. Serija odgovara Rydbergovoj formuli za n' = 1 i n = 2, 3, 4, … ; linija L α = 1216 Å je rezonantna linija vodonika. Granica serije je 911,8 Å.
Balmer serija
Otkrio I. Ya. Balmer 1885. godine. Prve četiri linije serije su u vidljivom opsegu i bile su poznate mnogo prije Balmera, koji je predložio empirijsku formulu za njihove valne dužine i na osnovu nje predvidio postojanje drugih linija ove serije u ultraljubičastom području. Serija odgovara Rydbergovoj formuli za n' = 2 i n = 3, 4, 5, … ; linija H α = 6565 Å, granica serije - 3647 Å.
Paschen Series
Brackett serija
Otkrio ga je F.S. Bracket 1922. Sve linije serije su u bliskom infracrvenom opsegu. Serija odgovara Rydbergovoj formuli za n' = 4 i n = 5, 6, 7, … ; linija B α = 40 522 Å. Granica serije je 14,588 Å.
Pfund serija
Otkrio ga je A. G. Pfund 1924. Linije serije su u bliskom (deo srednjeg) infracrvenog opsega. Serija odgovara Rydbergovoj formuli za n' = 5 i n = 6, 7, 8, … ; linija Pf α = 74 598 Å. Granica serije je 22,794 Å.
Spektralne linije vodonika
Prvi pokušaj da se objasni linijski spektar vodonika u vidljivom opsegu napravio je 1885. školski učitelj i matematičar Johann Balmer (1825–1898). Balmer je primijetio da su frekvencije f ove linije u vidljivom dijelu spektra mogu se opisati formulom
f ~(1/2 2)-(1/n 2).
Simbol ~ znači proporcionalan, odnosno ukazuje na prisustvo konstantnog faktora, o čemu se govori u nastavku. U ovoj jednačini n - cijeli broj veći od 2, tj. 3, 4, 5, itd.
Ove linije u vidljivom dijelu spektra nazivaju se Balmerovim nizom. Kasnije su otkrivene linije u ultraljubičastom i infracrvenom dijelu spektra. Nazvani su serijal Lyman i Paschen, po njihovim otkrivačima - američki fizičar i spektroskopist Theodor Lyman (1874–1954) i njemački fizičar Louis Carl Heinrich Friedrich Paschen (1865–1947). Godine 1888, švedski fizičar i spektroskopist Johannes Rydberg (1854–1919) objavio je formulu koja opisuje sve spektralne linije vidljive u emisiji lučne lampe vodonika i u spektru apsorpcije sunčeve i zvjezdane svjetlosti. Rydbergova formula za frekvenciju spektralnih linija vodika ima oblik
f =R H [(1/ n 1 2)-(1/n 2 2)],
gdje n 1 su cijeli brojevi koji počinju od 1 i n 2 - ostali cijeli brojevi koji moraju biti veći n jedan . Značenje n 1 =1 daje Lymanovu seriju, n 1 \u003d 2 - Balmer, n 1 \u003d 3 - Pašenova serija.
Konstantno R H se naziva Rydbergova konstanta za atom vodonika. Njegova vrijednost je R H=109677.6 cm-1 i izraženo brojem talasa ( cm-jedan). Kada koristite ovu vrijednost u Rydbergovoj formuli, frekvencije spektralnih linija, određene cijelim brojevima n 1 i n 2 su izražene talasnim brojevima. Da biste rezultat preveli u herce, potrebno je pomnožiti rezultirajuću vrijednost brzinom svjetlosti, odnosno sa 3 10 10 cm/sec. Da bismo pronašli talasnu dužinu spektralne linije, potrebno je uzeti recipročnu frekvenciju izraženu u broju talasa, odnosno podeliti jednu sa frekvencijom izraženom u broju talasa. Na primjer, ako n 1 =2, i n 2 =3, dakle
f =R H[(1/2 2)-(1/3 2)] = R H[(1/4)-(1/9)] = 1,52 10 4 cm -1
je frekvencija izražena kao broj talasa. Recipročna vrijednost ovog broja je 6,56 10 -5 cm = 656 10 -9 m = = 656 nm. Dakle, talasna dužina je 656 nm je crvena linija u Balmerovoj seriji prikazanoj na sl. 9.2.
Kada se raspravlja o sl. 8.7 već smo raspravljali o diskretnosti optičkih prelaza između kvantnih energetskih nivoa za česticu u kutiji. Na sl. 8.7 prikazuje prelaze između stanja čestice u kutiji, u kojoj n =1 se pretvara u n =2 i n =1 se pretvara u n =3. U tom smislu, ne bi trebalo da bude veliko iznenađenje da optički prelazi u atomu vodika mogu odgovarati diskretnom skupu frekvencija koje zavise od celih brojeva. Međutim, 1888. godine, kada je dobijena Rydbergova formula, preostalo je još 12 godina prije nego što se ideja o kvantiziranju energetskih nivoa, koji su povezani cijelim brojevima prema Rydbergovoj formuli, može shvatiti kao optički prijelazi između diskretne energije. nivoi povezani sa atomom vodonika.
Rice. 9.3. Dijagrami nekih energetskih nivoa koji generišu Lyman i Balmer seriju emisionih linija vodonika. Strelice prema dolje pokazuju kako svjetlost emituje vodonik, na primjer u lučnoj lampi. Nakon apsorpcije, koja daje tamne linije na Sl. 9.2, strelice bi bile usmjerene prema gore. Intervali između nivoa prikazani su konvencionalno, a ne u skali.
Neki od energetskih nivoa koji dovode do Lyman i Balmerove serije prikazani su na Sl. 9.3. Ovdje, strelice usmjerene prema dolje odgovaraju emisionim linijama koje se uočavaju u lučnoj lampi vodonika. Atom vodonika, koji je u početku na višem energetskom nivou, na kraju prelazi na niži nivo. Energija se čuva kroz emisiju fotona. Da bi sačuvao energiju, foton mora nositi energiju jednaku razlici između originalne, veće nivo energije i niži energetski konačni nivo. Najmanja moguća vrijednost n 1 u Rydbergovoj formuli jednako je 1, i n 2 bi trebalo biti više n jedan . Strelica označena 2–1 odgovara emisiji iz nivoa n =2 po nivou n =1.
Sljedeća najveća energija zračenja u Lymanovoj seriji dobija se prelaskom sa nivoa n =3 po nivou n =1. U Rydbergovoj formuli, sljedeća moguća vrijednost za n 1 je jednako 2 i n 2 bi trebalo biti više n jedan . Stoga je najniža energija emisione linije u Balmerovoj seriji označena sa 3–2. Kada je atom vodonika na nivou n =3, ide na nivo n =2, očuvanje energije je obezbeđeno emisijom fotona talasne dužine 656 nm. Kada svjetlost padne na atome vodonika, dolazi do apsorpcije, što bi se na istom dijagramu moglo prikazati strelicama usmjerenim prema gore.






