1 atomsko jezgro njegov sastav. Atomsko jezgro. Električni kvadrupolni moment
Raspad klastera
Atomsko jezgro- središnji dio atoma, u kojem je koncentrisana njegova glavna masa (više od 99,9%). Jezgro je pozitivno nabijeno, naboj jezgra određuje kemijski element kojem je atom dodijeljen. Dimenzije jezgara različitih atoma su nekoliko femtometara, što je više od 10 hiljada puta manje od veličine samog atoma.
Drugi zanimljiva činjenica je da je za veće elemente omjer neutrona i protona obično oko 5, ali ne i veći. To ukazuje da kada bi njihovi protoni i neutroni bili ravnomjerno raspoređeni duž lanca, tada bi bilo jedan ili dva neutrona između para protona, ali nikada tri neutrona u nizu.
Ovako bi dva i tri neutrona izgledali u sendviču između protona. Kao što se može vidjeti, kada postoje dva neutrona, čini se da se protoni mogu vezati za svoje vanjske negativne naboje i tako ih održavati stabilnima. Kada postoje tri neutrona, prosječan neutron je teško obezbijediti, a postoji i veliki broj negativnih naboja blizu jedan drugom. Stoga je malo vjerovatno da će situacija sa tri neutrona biti stabilna.
Atomsko jezgro, koje se smatra klasom čestica sa određenim brojem protona i neutrona, obično se naziva nuklid.
Broj protona u jezgru naziva se njegov broj naboja - ovaj broj je jednak rednom broju elementa kojem atom pripada, u periodnom sistemu. Broj protona u jezgru određuje strukturu elektronske ljuske neutralnog atoma, a time i hemijska svojstva odgovarajućeg elementa. Broj neutrona u jezgru se naziva njegovim izotopski broj. Jezgra sa istim brojem protona i različitim brojem neutrona nazivaju se izotopi. Jezgra sa istim brojem neutrona, ali različitim brojem protona nazivaju se izotonima. Termini izotop i izoton se takođe koriste u odnosu na atome koji sadrže naznačena jezgra, kao i za karakterizaciju nehemijskih varijanti jednog hemijskog elementa. Ukupan broj nukleona u jezgru naziva se njegov maseni broj () i približno je jednak prosječnoj masi atoma, naznačenoj u periodnom sistemu. Nuklidi sa istim maseni broj, ali različite proton-neutronske kompozicije nazivaju se izobare.
Čini se da određena pravila upravljaju formiranjem stabilnih izotopa.
- Proton se ne može direktno vezati za drugi proton na kraju lanca.
- Neutron ne može biti na kraju lanca.
- Ne može biti više od dva neutrona u nizu.
- Potrebni su veliki predmeti više neutrona i pridržavajte se pravila.
Kao i svaki kvantni sistem, jezgra mogu biti u metastabilnom pobuđenom stanju, a u nekim slučajevima životni vijek takvog stanja se računa u godinama. Takva pobuđena stanja jezgri nazivaju se nuklearni izomeri.
Kratka istorija otkrića
Rasipanje naelektrisanih čestica može se objasniti pretpostavkom da se atom sastoji od centralnog električnog naboja koncentrisanog u tački i okruženog jednoličnom sfernom distribucijom suprotnog elektriciteta. jednake veličine. Sa takvom strukturom atoma, α- i β-čestice, kada prođu blizina od centra atoma, doživljavaju velika odstupanja, iako je vjerovatnoća takvog odstupanja mala.
Svojstva nuklearnih sila, njihov opis i porijeklo
Vodonik-3 krši pravilo 2 jer je u osnovi stabilan. Ova stabilnost je moguća jer je protonsko širenje helijuma-3 dovoljno za elektron. Što se tiče pravila 1, ovo se odnosi samo na protone na kraju lanca, a ne na lanac, budući da par protona može biti zaštićen okolnim neutronima.
Dodajući pravilo 3, ova dva neutrona u nizu ne bi trebala biti blizu kraja lanca, jer nema dovoljno protona protona da ih drže na mjestu. To jest, sekvencirani neutroni moraju biti ugrađeni u lanac. Ovo ukazuje na to zašto manjim elementima nije dozvoljeno da imaju sekvencionirane neutrone jer njihov lanac nije dovoljno dug.
Tako je Rutherford otkrio atomsko jezgro, od tog trenutka počela je nuklearna fizika, proučavajući strukturu i svojstva atomskih jezgara.
Nakon otkrića stabilnih izotopa elemenata, jezgru najlakšeg atoma dodijeljena je uloga strukturne čestice svih jezgara. Od 1920. godine jezgro atoma vodika ima službeni naziv - proton. Nakon srednje protonsko-elektronske teorije strukture jezgra, koja je imala mnogo očiglednih nedostataka, prije svega, bila je u suprotnosti s eksperimentalnim rezultatima mjerenja spinova i magnetnih momenata jezgara, James Chadwick je 1932. otkrio novu električki neutralnu česticu. , nazvan neutron. Iste godine Ivanenko i, nezavisno, Heisenberg, izneli su hipotezu o protonsko-neutronskoj strukturi jezgra. Ovu hipotezu u potpunosti je potvrdio čitav kasniji tok razvoja nuklearne fizike i njene primjene.
Prethodna zapažanja ne objašnjavaju u potpunosti sve izotope. Na primjer, helijum-8 je stabilniji od helijuma-7, a litijum-11 je stabilniji od litijuma. U oba slučaja, veći izotop ima više neutrona i očekujemo manju stabilnost. U slučaju litijuma, zanimljiva studija je otkrila da su jezgra litijuma-11 i litijuma-12 mnogo veća od litijuma. Moguće je da su dodatni neutroni nekako odvojeni od ostatka lanca i da lebde na određenoj udaljenosti. Na primjer, litijum-11 se može napraviti od litijuma-9 i dva neutrona koji se drže na određenoj udaljenosti.
Nuklearna fizika
Po prvi put, naboje atomskih jezgara odredio je Henry Moseley 1913. godine. Njihova eksperimentalna zapažanja naučnik je protumačio ovisnost talasne dužine rendgenskih zraka o određenoj konstanti, mijenjajući se za jedan od elementa do elementa i jednaku jedan za vodonik:
Kako bi se to moglo dogoditi nije jasno. teorije atomski modeli: John Dalton Materija se sastoji od nedjeljivih atoma, oni su neuništivi. Svi atomi datog elementa su identični po svojim fizičkim i hemijskim svojstvima. Atomi različitih elemenata razlikuju se po fizičkom i hemijska svojstva. Atomi različitih elemenata kombinuju se u jednostavne omjere između cijelih brojeva i formiraju molekule. hemijske reakcije sastoji se u kombinaciji razdvajanja ili preuređivanja atoma. Ograničenja: Nije mogao objasniti zašto i kako se atomi spajaju u složene atome. Priroda sila koje drže atome zajedno u atomima spojeva. Zašto atomi ne mogu postojati u slobodnom stanju i zašto atomi jedinjenja mogu postojati slobodno. Izgleda da se sladoled sa komadićima čokolade kasnije pokazao pogrešnim. Ograničenja: Nije bio u stanju objasniti rezultat eksperimenta raspršenja objašnjen Rutherfordovim eksperimentom. Nije imala eksperimentalne dokaze u prilog tome. Na osnovu toga objašnjeno je termoionsko zračenje, fotoelektrično zračenje i jonizacija. To je zbog raspršivanja α-čestica atomima folije. Što se tiče stabilnosti atoma, elektroni koji se okreću oko jezgra imaju centripetalno ubrzanje. Prema elektrodinamici, ubrzane nabijene čestice zrače energiju u obliku elektromagnetnih valova. Zbog toga rotirajući elektroni moraju neprekidno emitovati elektromagnetski talasi. Zbog ovog kontinuiranog gubitka energije elektrona, radijusi njihovih orbita moraju se stalno smanjivati, i na kraju elektron mora pasti u jezgro. Dakle, atom ne može ostati stabilan. Rutherfordov model također nije objasnio spektar linije. Nedostaci modela Rutherford Niels David Bohr Teorije atomskog modela: Borova teorija Fiksne kružne orbite: Elektroni se kreću oko jezgra u koncentričnim kružnim orbitama. Kada se rotiraju u stabilnim orbitama, elektroni ne zrače energiju, uprkos njihovom ubrzanju prema centru orbite. Svaka od fiksnih orbita povezana je s određenom količinom energije, koja se zove stacionarna energija. Skakanje elektrona sa jednog energetskog nivoa na drugi. Nema objašnjenja za Zeeman i Starkov efekat: uticaj električnih i magnetnih polja na spektralnih atoma. Kada se magnetsko polje primeni na atom, njegove uobičajene spektralne linije se dele. Ovaj efekat je poznat kao Zeemanov efekat. Spektralne linije takođe se razdvaja u prisustvu električnog polja. Ovaj efekat je poznat kao Starkov efekat. Klasifikacija atoma: Izomeri su molekuli sa istom molekulskom formulom, ali različite hemijske strukture. Ovo pravilo je preciznije za veće jezgre. Za sve poznate izotope prirodnih elemenata, samo njih 250 je stabilno . Svi ovi stabilni izotopi imaju atomski broj između 1 i . Masa jezgra bit će manja od mase svih protona i neutrona koji ga čine. Razlika se naziva defekt mase, koji se pretvara u energiju ako se jezgro uništi. Količina energije koja drži nukleone zajedno naziva se energija vezivanja. Ova količina energije je veća za jezgra koja su stabilna nego za nestabilna jezgra. Atomska masa i jedinice energije. Položaj elektrona u orbitalama.
- Svaka materija je sastavljena od osnovnih objekata koji se nazivaju elementi.
- Jezgro se sastoji od protona i neutrona, koji se nazivaju nukleoni.
- Većina mase atoma pripada jezgru.
I - trajno.
Iz čega je Moseley zaključio da atomska konstanta pronađena u njegovim eksperimentima, koja određuje valnu dužinu karakterističnog rendgenskog zračenja i poklapa se sa serijskim brojem elementa, može biti samo naelektrisanje atomsko jezgro koji je postao poznat kao Moseleyjev zakon .
Težina
Zbog razlike u broju neutrona, izotopi elementa imaju različite mase, što je važna karakteristika jezgra. AT nuklearna fizika masa jezgara se obično mjeri u jedinicama atomske mase ( a. jesti.), za jedan a. e. m. uzeti 1/12 mase 12 C nuklida. Treba napomenuti da je standardna masa koja se obično daje za nuklid masa neutralnog atoma. Za određivanje mase jezgra potrebno je od mase atoma oduzeti zbir masa svih elektrona (točnija vrijednost će se dobiti ako uzmemo u obzir i energiju veze elektrona sa jezgrom) .
Ali u atomima, elektroni su tu, pored protona u jezgri. Zašto se elektroni ne sakriju pravo u jezgro i zalijepe se za protone? Elektroni moraju pasti u jezgro. Svako ko je ikad sjedio u četvrtom razredu zna da kada utrljate balon o kosu ili džemper, možete ga zalijepiti za zid. To možete učiniti jer je trenje uzrokovalo da balon akumulira mnogo elektrona. Elektroni privlače protone i odbijaju ih drugi elektroni, pa kada se balon gurne blizu zida, elektroni u zidu jure unutra, ostavljajući izložene protone.
Osim toga, energetski ekvivalent mase često se koristi u nuklearnoj fizici. Prema Einstein relaciji, svaka vrijednost mase odgovara ukupna energija:
, gdje je brzina svjetlosti u vakuumu.Odnos između a. e.m. i njegov energetski ekvivalent u džulima:
Ovi polugoli protoni bili su neodoljivi za elektrone u balonu, a elektroni su jurili prema protonima, uzimajući balon sa sobom. Pitanje je zašto su se ti elektroni uopće preselili iz vaše kose u balon? Da su toliko zadivljeni protonima, imali bi ih puno u vašoj kosi. Nenabijeni atomi para jednaki su broju elektrona i protona. Elektroni se moraju približiti atomskom jezgru.
U klasičnoj fizici, elektroni moraju pasti u jezgro, čak i ako ih ne privlači naboj protona. Rani modeli atoma imali su elektrone koji se okreću oko jezgra, slično kao što se planeta okreće oko Sunca. Orbitiranje u krugu znači stvaranje velike promjene smjera, što znači ubrzanje. Kada električni naboj podvrgnut ubrzanju, emituje elektromagnetno zračenje. Elektromagnetno zračenje je energija, a elektron može izgubiti jednu od dvije vrste energije: kinetičku energiju ili potencijalnu energiju.
Radijus
Analiza raspada teških jezgara prečistila je Rutherfordovu procjenu i povezala polumjer jezgra s masenim brojem jednostavnim odnosom:
,gdje je konstanta.
Kako poluprečnik jezgra nije čisto geometrijska karakteristika i prvenstveno je povezan sa radijusom delovanja nuklearnih sila, vrednost zavisi od procesa, tokom čije analize je dobijena vrednost, prosečne vrednosti m, dakle poluprečnika jezgra u metrima:
U svakom slučaju, na kraju će se srušiti u jezgro. Kinetičko i potencijalno energetsko rješenje. Razmotrimo jednu elektroniku koja lebdi u svemiru. Kako mjerimo njegovu kinetičku i potencijalnu energiju? Počnite tako što ćete zamisliti jedan proton, daleko. Zajedno se mogu kombinovati i formirati atom vodika. Kada mjerimo njihov napredak jedni prema drugima, u smislu energije, vidjet ćemo mnogo od onoga što vidimo u klasičnoj fizici.
Elektron koji se približava protonu imat će kinetičku energiju i potencijalnu energiju. Kada je daleko, imaće relativno ogromnu količinu potencijalna energija, baš kao što objekti podignuti visoko iznad zemlje imaju ogromnu količinu potencijalne energije. Kako se kreće prema protonu, gubi dio te potencijalne energije. Neki od njih zrače kao elektromagnetna energija. Neki od njih se pretvaraju u kinetičku energiju. Kinetička energija zadržava skok elektrona i sprečava ga da ostane u jezgru i ne kombinuje se sa protonom.
Kernel moments
Poput nukleona koji ga čine, jezgro ima svoje momente.
Spin
Budući da nukleoni imaju svoj mehanički moment, ili spin, jednak , tada i jezgra moraju imati mehaničke momente. Osim toga, nukleoni sudjeluju u jezgru u orbitalnom kretanju, koje je također karakterizirano određenim kutnim momentom svakog nukleona. Orbitalni momenti uzimaju samo cjelobrojne vrijednosti (Diracova konstanta). Svi mehanički momenti nukleona, i spinovi i orbitalni, sabiraju se algebarski i čine spin jezgra.
Ovdje, gdje je špil malo presavijen u korist elektrona koji nisu u kombinaciji s protonima. Kinetička energija, ako je elektron u jezgru, je beskonačna. Potencijalna energija, ako je elektron u jezgru, je negativna beskonačnost. ako želite izračunati kinetičku energiju u bilo kojoj tački, to je polovina potencijalne energije. Drugim riječima, kinetička energija ima veću težinu i elektron ostaje izvan jezgra.
Postoji problem sa razmišljanjem o elektronima kao o malim komadićima materije koji se okreću oko velikog komada materije. U stvari, ne ponašaju se tako. Elektron se ne može smatrati planetom i umjesto toga treba ga smatrati nekom vrstom oblaka vjerovatnoće. I to ne u smislu da je ovo najkorisniji način razmišljanja o tome - to je ono što elektron zapravo jeste. Da bismo razumjeli ponašanje elektrona, moramo razmisliti gdje će ovaj oblak biti najgušći ili gdje najvjerovatnije elektron, ili tamo gdje postoji maksimalni negativni naboj.
Unatoč činjenici da broj nukleona u jezgri može biti vrlo velik, spinovi jezgara su obično mali i ne iznose više od nekoliko, što se objašnjava posebnošću interakcije istoimenih nukleona. Svi upareni protoni i neutroni međusobno djeluju samo na način da se njihovi spinovi međusobno poništavaju, odnosno parovi uvijek djeluju s antiparalelnim spinovima. Ukupni orbitalni moment para je također uvijek nula. Kao rezultat toga, jezgre koje se sastoje od parnog broja protona i parnog broja neutrona nemaju mehanički impuls. Spinovi različiti od nule postoje samo za jezgra koja u svom sastavu imaju nesparene nukleone, spin takvog nukleona se dodaje njegovom vlastitom orbitalnom momentu i ima neku polucijelu vrijednost: 1/2, 3/2, 5/2. Jezgra neparno-neparnog sastava imaju cjelobrojne spinove: 1, 2, 3, itd.
fisije atomskih jezgara
Pogledajmo ponovo putovanje do jezgra proton-vodonik, osim što biste to učinili kada biste svaki mali volumen prostora izmjerili vjerovatnostnim metrom. Daleko od jezgra, merač verovatnoće ne bi registrovao praktično nikakvu verovatnoću negativnog naelektrisanja. Kako se polako približavate, mjerač se penje i penje sve dok ne registruje najveću vjerovatnoću na jezgri. Čini se da je to u suprotnosti sa onim što smo upravo gore shvatili i stvarnošću.
Trik je da se shvati da mala količina prostora na liniji na nekoj udaljenosti od jezgre nije najbolji način mjerenje vjerovatnoće da se elektron nalazi u bilo kojem određenom volumenu prostora. Nije nas briga da li je elektron iznad, ispod, lijevo ili desno od jezgra. Samo želimo da bude malo dalje. To znači da može biti bilo gdje na sferičnoj "ljusci" oko jezgra. Ono što želimo je volumen ove školjke.
Magnetski trenutak
Spin mjerenja su omogućena prisustvom direktno povezanih magnetnih momenata. Mere se u magnetonima i za različite jezgre su od -2 do +5 nuklearnih magnetona. Zbog relativno velike mase nukleona, magnetni momenti jezgara su vrlo mali u odnosu na elektrone, pa je njihovo mjerenje mnogo teže. Kao i spinovi, magnetni momenti se mjere spektroskopskim metodama, a najpreciznija je metoda nuklearne magnetne rezonancije.
Magnetski moment par-parova, poput spina, jednak je nuli. Magnetski momenti jezgara sa nesparenim nukleonima formiraju se unutrašnjim momentima ovih nukleona i momentom povezanim sa orbitalnim kretanjem nesparenog protona.
Električni kvadrupolni moment
Atomska jezgra sa spinom većim ili jednakim jedinici imaju kvadrupolne momente različite od nule, što ukazuje da nisu baš sferne. Kvadrupolni moment ima predznak plus ako je jezgro produženo duž ose spina (fusiformno tijelo), a znak minus ako je jezgro rastegnuto u ravni okomitoj na os spina (lentikularno tijelo). Poznata su jezgra sa pozitivnim i negativnim kvadrupolnim momentima. Odsustvo sferne simetrije u električnom polju koje stvara jezgro s kvadrupolnim momentom različitom od nule dovodi do stvaranja dodatnih energetskih nivoa atomskih elektrona i pojave hiperfinih strukturnih linija u spektrima atoma, među kojima razmaci zavise od kvadrupolnog momenta. .
Energija veze
Stabilnost jezgra
Iz činjenice smanjenja prosječne energije vezivanja za nuklide s masenim brojevima većim ili manjim od 50-60, slijedi da je za jezgra s malim, proces fuzije energetski povoljan - termonuklearna fuzija, što dovodi do povećanja mase broj, a za jezgra sa velikim - proces fisije. Trenutno se odvijaju oba ova procesa koji dovode do oslobađanja energije, pri čemu je ovaj drugi temelj moderne nuklearne energije, a prvi je u razvoju.
Detaljne studije su pokazale da stabilnost jezgara značajno zavisi i od parametra - odnosa broja neutrona i protona. U prosjeku, za najstabilnija jezgra , dakle, jezgra lakih nuklida su najstabilnija na , a sa povećanjem masenog broja, elektrostatičko odbijanje između protona postaje sve primjetnije, a područje stabilnosti se pomiče prema ( vidi sliku sa objašnjenjem).
Ako uzmemo u obzir tablicu stabilnih nuklida koji se javljaju u prirodi, možemo obratiti pažnju na njihovu distribuciju prema parnim i neparnim vrijednostima i . Sva jezgra sa parnim vrijednostima ovih količina su jezgra lakih nuklida , , , . Među izobarama sa neparnim A, po pravilu je samo jedna stabilna. U slučaju parnih, često postoje dvije, tri ili više stabilnih izobara, stoga su parno-parne najstabilnije, najmanje - neparno-neparne. Ovaj fenomen ukazuje na to da i neutroni i protoni imaju tendenciju grupisanja u antiparalelne parove.
Do 20-ih godina 20. stoljeća, fizičari više nisu sumnjali da atomska jezgra koje je otkrio E. Rutherford 1911. godine, kao i sami atomi, imaju složenu strukturu. U to su ih uvjerile brojne eksperimentalne činjenice akumulirane do tada: otkriće radioaktivnosti, eksperimentalni dokaz nuklearnog modela jezgra, mjerenje omjera e/m za elektron, α-česticu i za tzv. nazvana H-čestica - jezgro atoma vodika, otkriće umjetne radioaktivnosti i nuklearne reakcije, mjerenje naboja atomskih jezgara, itd. Sada je to čvrsto utvrđeno ta atomska jezgra razni elementi Sastoje se od dvije čestice, protona i neutrona.
Prva od ovih čestica je atom vodika iz kojeg je uklonjen samo jedan elektron. Ova čestica je već uočena u eksperimentima J. Thomsona (1907), koji je uspio izmjeriti omjer e/m u njoj. Godine 1919. E. Rutherford je otkrio jezgra atoma vodika u produktima fisije jezgara atoma mnogih elemenata. Rutherford je ovu česticu nazvao proton. On je sugerirao da su protoni dio svih atomskih jezgara. Šema Rutherfordovih eksperimenata prikazana je na sl. jedanaest.
Rutherfordov uređaj se sastojao od evakuirane komore u kojoj se nalazio kontejner K sa izvorom α-čestica. Prozor komore je bio prekriven metalnom folijom F, čija je debljina odabrana tako da α-čestice ne mogu prodrijeti kroz njega. Izvan prozora je bila mreža E, presvučena cink sulfidom. Koristeći mikroskop M, bilo je moguće uočiti scintilacije na mjestima gdje teške nabijene čestice udaraju u ekran. Kada je komora napunjena dušikom pod niskim pritiskom, na ekranu su se pojavili svjetlosni bljeskovi koji su ukazivali na pojavu strujanja nekih čestica sposobnih da prodru kroz F foliju, što je gotovo potpuno blokiralo protok α-čestica.
Odmaknuvši ekran E od prozora kamere, mjerio je Rutherford znači slobodan put uočene čestice u vazduhu. Ispostavilo se da je približno jednaka 28 cm, što se poklopilo sa procjenom dužine putanje H-čestica koju je ranije uočio J. Thomson. Studije uticaja na čestice koje su izbačene iz jezgri dušika električnim i magnetskim poljem pokazale su da te čestice imaju pozitivan elementarni naboj i da je njihova masa jednaka masi jezgra atoma vodika. Nakon toga, eksperiment je izveden s nizom drugih plinovitih tvari. U svim slučajevima utvrđeno je da α-čestice izbijaju H-čestice ili protone iz jezgara ovih supstanci. Prema savremenim merenjima, pozitivan naboj proton je tačno jednak elementarnom naboju e = 1,60217733 10 –19 C, odnosno jednak je po modulu negativni naboj elektron. Trenutno je jednakost naelektrisanja protona i elektrona potvrđena sa tačnošću od 10-22. Takva podudarnost naboja dvije različite čestice je iznenađujuća i ostaje jedna od temeljnih misterija moderne fizike.
Slika 11. Šema Rutherfordovih eksperimenata za detekciju protona u produktima nuklearne fisije. K - olovni kontejner sa radioaktivnim izvorom α-čestica, F - metalna folija, E - ekran obložen cink sulfidom, M - mikroskop.
masa protona, prema savremenim mjerenjima, jednako je mp = 1,67262 10 -27 kg. U nuklearnoj fizici, masa čestice se često izražava u jedinicama atomske mase (a.m.u.) jednakim 1/12 mase atoma ugljika s masenim brojem 12:1 a.u. e.m. = 1,66057 10 -27 kg.
Dakle, m p = 1,007276 a. e. m. U mnogim je slučajevima zgodno izraziti masu čestice u ekvivalentnim vrijednostima energije u skladu s formulom E = mc 2 . Pošto je 1 eV = 1,60218 10 -19 J, u energetskim jedinicama masa protona je 938,272331 MeV. Tako je u Rutherfordovom eksperimentu otkrivena pojava cijepanja jezgara dušika i drugih elemenata pri udaru brzih α-čestica, te se pokazalo da su protoni dio jezgara atoma. Nakon otkrića protona, sugerirano je da se jezgra atoma sastoje samo od protona. Međutim, ispostavilo se da je ova pretpostavka neodrživa, jer omjer naboja jezgra i njegove mase ne ostaje konstantan za različite jezgre, kao što bi bio da su u sastav jezgara uključeni samo protoni. Za teže jezgre ovaj omjer se ispostavlja manjim nego za laka, odnosno kada se kreće ka težim jezgrama, masa jezgra raste brže od naboja. Godine 1920. Rutherford je pretpostavio postojanje kruto vezanog kompaktnog para proton-elektron u sastavu jezgara, koji je električki neutralna formacija - čestica čija je masa približno jednaka masi protona. Čak je smislio ime za ovu hipotetičku česticu - neutron.
Bila je to vrlo lijepa, ali, kako se kasnije pokazalo, pogrešna ideja. Elektron ne može biti dio jezgra. Kvantno-mehanički proračun zasnovan na relaciji nesigurnosti pokazuje da elektron lokalizovan u jezgru, odnosno oblast veličine R ≈ 10–13 cm, mora imati kolosalnu kinetička energija, što je mnogo redova veličine veće od nuklearna energija vezivanja po čestici. Ideja o postojanju teške neutralne čestice Rutherfordu se učinila toliko privlačnom da je odmah pozvao grupu svojih učenika, predvođenih Jamesom Chadwickom, da potraže takvu česticu. Dvanaest godina kasnije, 1932. godine, Chadwick je eksperimentalno istražio zračenje koje se javlja kada se berilij ozrači α-česticama i otkrio da je to zračenje mlaz neutralnih čestica mase približno jednake masi protona. Ovako je otkriven neutron. Na sl. 12 prikazuje pojednostavljeni dijagram podešavanja za detekciju neutrona.
Kada se berilij bombarduje α-česticama koje emituje radioaktivni polonijum, nastaje jako prodorno zračenje koje može savladati takvu prepreku kao što je sloj olova debljine 10–20 cm. Ovo zračenje su gotovo istovremeno sa Chadwickom uočili supružnici Joliot-Curie Irene i Frederic (Irene je kćerka Pjera Kirija), ali su pretpostavili da su to visokoenergetski γ-zraci. Otkrili su da ako se parafinska ploča postavi na put zračenja berilijuma, tada se ionizirajuća moć ovog zračenja naglo povećava. Oni su dokazali da berilijumsko zračenje izbija protone iz parafina, koji su prisutni u velikim količinama u ovoj tvari koja sadrži vodonik. Na osnovu slobodnog puta protona u vazduhu, procenili su energiju γ-kvanta koji je u stanju da prenese potrebnu brzinu protonima u sudaru.
Ispostavilo se da je ogroman - oko 50 MeV. J. Chadwick je 1932. godine izveo seriju eksperimenata na sveobuhvatnom proučavanju svojstava zračenja koje nastaje zračenjem berilija α-česticama. U svojim eksperimentima, Chadwick je koristio različite metode za proučavanje jonizujućeg zračenja. Na sl. 12 prikazuje Geigerov brojač dizajniran za detekciju nabijenih čestica. Sastoji se od staklene cijevi obložene s unutarnje strane metalnim slojem (katoda) i tanke niti koja ide duž ose cijevi (anode). Cev je napunjena inertnim gasom (obično argonom) pod niskim pritiskom. Nabijena čestica koja leti kroz plin uzrokuje jonizaciju molekula. Slobodni elektroni nastali kao rezultat jonizacije se ubrzavaju električno polje između anode i katode do energija pri kojima počinje udarna ionizacija. Pojavljuje se lavina jona, a kratki impuls struje pražnjenja prolazi kroz brojač. Drugi važan instrument za proučavanje čestica je takozvana komora oblaka, u kojoj brzo nabijena čestica ostavlja trag (trag). Putanja čestice se može posmatrati direktno ili fotografisati.
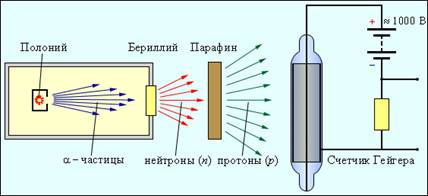
Slika 12. Šema podešavanja za detekciju neutrona.
Djelovanje komore za oblake, stvorene 1912. godine, zasniva se na kondenzaciji prezasićene pare na jonima koji nastaju u radnoj zapremini komore duž putanje nabijene čestice. Koristeći komoru za oblak, može se promatrati zakrivljenost putanje nabijene čestice u električnom i magnetna polja. J. Chadwick je u svojim eksperimentima uočio u komori oblaka tragove jezgara dušika koje su doživjele sudar sa berilijumskim zračenjem. Na osnovu ovih eksperimenata, on je napravio procjenu energije γ-kvanta, koji je sposoban da informiše jezgre dušika o brzini uočenoj u eksperimentu. Ispostavilo se da je to 100–150 MeV. Tako ogromna energija ne bi mogla imati γ-kvante koje emituje berilijum. Na osnovu toga, Chadwick je zaključio da, pod djelovanjem α-čestica, iz berilija ne emituju bezmaseni γ-kvant, već teške čestice.
Budući da su ove čestice bile vrlo prodorne i nisu direktno ionizirale plin u Geigerovom brojaču, stoga su bile električno neutralne. Ovako je dokazano postojanje. neutron- čestice koje je Rutherford predvidio više od 10 godina prije Chadwickovih eksperimenata. Neutron je elementarna čestica. Ne treba ga predstavljati kao kompaktan par proton-elektron, kao što je prvobitno predložio Rutherford. Prema modernim mjerenjima, masa neutrona m n = 1,67493 10 -27 kg = 1,008665 a.u. e. m. U energetskim jedinicama, masa neutrona je 939,56563 MeV. Masa neutrona je otprilike dvije mase elektrona veća od mase protona. Neposredno nakon otkrića neutrona, ruski naučnik D. D. Ivanenko i njemački fizičar V. Heisenberg iznijeli su hipotezu o protonsko-neutronskoj strukturi atomskih jezgara, koja je u potpunosti potvrđena kasnijim istraživanjima.
Protoni i neutroni se nazivaju nukleoni. Uveden je niz oznaka za karakterizaciju atomskih jezgara. Broj protona koji čine atomsko jezgro označava se simbolom Z i naziva se broj naplate ili atomski broj (ovo je serijski broj u periodnom sistemu Mendeljejeva). Nuklearni naboj je Ze, gdje je e elementarnog naboja. Broj neutrona je označen simbolom N. Ukupan broj nukleoni (tj. protoni i neutroni) se nazivaju maseni broj A: A=Z+N.
Jezgra hemijskih elemenata su označena simbolom , gde je X hemijski simbol elementa. Na primjer, - vodonik, - helijum, - kiseonik, - ugljenik, - uranijum. Jezgra istog hemijskog elementa mogu se razlikovati po broju neutrona. Takva jezgra se nazivaju izotopi. Većina hemijskih elemenata ima nekoliko izotopa. Na primjer, vodonik ima tri izotopa: - obični vodonik, - deuterijum i - tricijum. Ugljik ima 6 izotopa, kiseonik 3. Hemijski elementi in prirodni uslovi obično mješavina izotopa. Prisustvo izotopa određuje vrijednost atomske mase prirodnog elementa u periodnom sistemu Mendeljejeva. Tako, na primjer, relativna atomska masa prirodni ugljenik je 12.011.






