Maseni broj neutrona je isti. Velika enciklopedija nafte i gasa
Fizika 9 razred
Tema: Struktura atoma i atomskog jezgra. Upotreba energije atomskih jezgara
Lekcija 56 Masovni broj. Napunite
broj. nuklearne snage
Yeryutkin Evgeny Sergeevich
Nastavnik fizike najviša kategorija GOU SOSH №1360
Moskva
Zdravo! Današnja lekcija će biti posvećena pitanju koje se odnosi na diskusiju o strukturi atomskog jezgra, broju naboja, masenom broju, takođe ćemo govoriti o tome šta je nuklearne snage. Naša lekcija je sumiranje nekog međurezultata o svim prethodno proučavanim pitanjima. Želio bih reći da smo proučavali pitanja vezana za strukturu atoma i strukturu jezgra. Stoga ćemo danas pričati o tome. Neki rezime prethodnih tema, prethodna pitanja. Prije nego što pređemo na prvo pitanje, razgovaraćemo o ovome. U prethodnoj lekciji smo rekli da je Rutherford u svojim eksperimentima ustanovio da postoji takva čestica kao što je proton. Nešto kasnije, 1932. godine, Chadwick je ustanovio da postoji još jedna čestica koja se zove neutron. Nakon ovog otkrića, nezavisno jedno od drugog, dvoje ljudi, ruski naučnik Ivanenko i nemački naučnik Hajzenberg, predložili su proton-neutronski model za strukturu atomskog jezgra. Prema ovoj teoriji Ivanenko-Heisenberg, jezgro bilo kojeg atoma sadrži protone i neutrone. Te protone i neutrone zajedno, one koji se nalaze u jezgri atoma, odlučeno je nazvati nukleoni. Na ovaj način, "nukleon" (od latinskog "nukleus") - zajednički naziv za protone i neutrone. One čestice koje imaju naboj, i one čestice koje nemaju naboj, neutroni, sve te čestice zajedno se nazivaju nukleoni. Hajde da pričamo o nečem drugom. Ideju o nuklearnom naboju prvi je iznio 1913. godine engleski naučnik Henry Moseley. On je predložio da budući da je atom električno neutralan, ordinal broj elementa, pomnoženo sa elementarnim električni naboj, ovo je naboj jezgra. Kako je Moseley došao do ovog zaključka? Činjenica je da broj elektrona u atomu odgovara serijskom broju. To znači da je naboj svih elektrona proizvod serijskog broja i naboja jednog elektrona. Pošto je jezgro koncentrisano pozitivan naboj, tako da se isto može reći i za jezgro. Hajde da pogledamo kako je došlo Moseley upravo na ono što nazivamo brojem naplate. pogledajte:
qI = Z . | e|
qI- nuklearno punjenje
e - naelektrisanje elektrona
Zje broj protona u jezgru, broj naboja
Naboj broja, prema ovoj izjavi, definira se kao proizvod serijskog broja i elementarnog električnog naboja. U ovom slučaju e - ovo je naboj elektrona, zove se elementarni električni naboj, a uzima se po modulu, jer je jasno da je naboj jezgra pozitivan. U ovom slučaju, serijski broj se počeo nazivati brojem naboja, serijski broj je broj koji odgovara broju protona u jezgri. Dakle, kada govorimo o serijskom broju, možemo govoriti o broju protona u jezgru. Sljedeći broj o kojem treba govoriti je masovni broj. On, ovaj broj, označen je slovom A, a isti se taj broj uzima iz periodnog sistema i zaokružuje na cijele brojeve. Tada možemo govoriti o jednadžbi, koja se u cijelom svijetu naziva Ivanenko-Heisenbergova jednačina. Ova jednačina se sastoji od tri broja: masenog broja, broja naboja i broja neutrona. Pogledajmo kako se to piše i kako se označavaju ove veličine.
Ivanenko-Heisenbergova jednadžba
A =Z + N
A je maseni broj
Zje broj elementa,
Nje broj neutrona u jezgru
Pogledajte: maseni broj A govori koliko nukleoni ulazi u jezgro. Ispostavilo se da je, prema periodnom sistemu, određivanje masenog broja hemijski element, određujemo broj nukleona u jezgru atoma.
Z, kao što smo rekli, biće redni broj i broj protona u jezgru. N je u ovom slučaju broj neutrona. Dakle, iz ove jednačine možemo odrediti broj neutrona, broj protona, znajući maseni broj i serijski broj. Ovdje je potrebno napomenuti jednu važnu tačku. Činjenica je da je 1913. drugi naučnik Sodi (sećate se da je ovaj čovek radio sa Rutherfordom) ustanovio zanimljivu stvar. Utvrđeno je da postoje hemijski elementi sa potpuno istim hemijskim svojstvima, ali različitim masenim brojevima. Elementi koji imaju isto Hemijska svojstva, ali s različitim masenim brojevima, postali su poznati kao izotopi. izotopi - To su hemijski elementi sa istim hemijskim svojstvima, ali sa različite težine atomska jezgra.
Također treba dodati da izotopi imaju različitu radioaktivnost. Sve ovo zajedno dovelo je do proučavanja ove problematike. Prikazuje izotope lakih i teških hemijskih elemenata. da vidimo. Izabrali smo posebno različita područja periodnog sistema kako bismo pokazali da gotovo svi hemijski elementi imaju izotope.
izotopi:
H - protiumU
H - deuterijumU
H - tricijum
Vodonik ima tri od ovih izotopa. Prvi izotop H naziva se protij. Imajte na umu da je serijski broj postavljen ispod, ovo je broj Z, a na vrhu je napisan maseni broj - ovo je broj A. Iznad A, ispod Z, a ako shvatimo da to znači da je u jezgru atom protijuma najjednostavniji hemijski element, najrasprostranjeniji u svemiru. Postoji samo 1 proton, a neutrona u ovom jezgru uopšte nema. Postoji druga vrsta vodonika - to je deuterijum. Vjerovatno su mnogi čuli ovu riječ. Imajte na umu: serijski broj je 1, a maseni broj 2. Dakle, jezgro deuterijuma se već sastoji od 1 protona i jednog neutrona. A postoji još jedan izotop vodonika. Zove se tricijum. Tricijum je pravedan (redni broj jedan), a maseni broj ukazuje da postoje 2 neutrona u jezgru ovog izotopa. I drugi element je uranijum. Sasvim druga strana periodnog sistema. To su već teški elementi. Uranijum ima 2 uobičajena izotopa. Ovo je uranijum 235. Serijski broj je 92, a maseni broj 235. Odmah možete govoriti o tome kako se jezgro jednog elementa razlikuje od drugog. Drugi izotop: takođe serijski broj 92, i maseni broj 238. Vrlo često, kada u pitanju o izotopima, posebno uranijumu, nikada ne reci serijski broj. Kažu samo "uranijum", imenuju hemijski element i kažu da mu je maseni broj 238. Ili uranijum 235. O ovom pitanju raspravljamo iz prostog razloga što znamo koliko je ovaj hemijski element danas važan za energiju naše zemlje i opšte za svetsku energiju u celini.
Sljedeće pitanje koje se moramo dotaknuti proizilazi iz rečenog. Kako se te čestice, ti nukleoni, drže unutar jezgra? Nazvali smo različite hemijske elemente, različite izotope, posebno za teške elemente, gdje su nukleoni, tj. protona i neutrona, mnogo. Kako, kako se drže unutar jezgra? Znamo da je u jezgru na maloj udaljenosti veličina jezgra vrlo, vrlo mala, može se prikupiti veliki broj čestica nukleona. Kako su ovi nukleoni tamo tako gusto, čvrsto držani, kojim silama? Zaista, zbog elektrostatičkog odbijanja, ove čestice se moraju vrlo brzo raspasti, raspršiti. Znamo da se privlače samo suprotni naboji, čestice nabijene suprotnim nabojima. Ako su čestice nabijene istim imenom, jasno je da se moraju odbijati. Unutar jezgra su protoni. Oni su pozitivno nabijeni. Veličina kernela je vrlo mala. U istom jezgru postoje i neutroni, što znači da moraju postojati sile koje drže zajedno te i druge čestice. Te same sile se nazivaju nuklearne sile. Nuklearne sile su privlačne sile koje djeluju između nukleona. Možemo reći da ove sile imaju svoja posebna svojstva.
Prva imovina o kojoj trebamo razgovarati je to nuklearne sile moraju premašiti sile elektrostatičkog odbijanja. I to je tako, kada ih je bilo moguće odrediti, pokazalo se da su 100 puta veće od sila elektrostatičkog odbijanja. Još jedna veoma važna napomena je to nuklearne snage djeluju na maloj udaljenosti. Na primjer, 10 -15 m - ovo je promjer jezgre, te sile djeluju. Ali čim se veličina jezgra poveća na 10 -14, što se činilo prilično malo, to dovodi do činjenice da će se jezgro nužno raspasti. Na ovoj udaljenosti nuklearne sile više nisu aktivne. I sile elektrostatičkog odbijanja nastavljaju djelovati i upravo su one odgovorne za to što se jezgro raspada.
Još jedna stvar koju treba reći o nuklearnim snagama je to oni nisu centralni, tj. ne djeluju duž prave linije koja povezuje ove čestice. I činjenica da nuklearne sile ne zavise od toga da li čestica ima naboj ili ne, jer i protoni i neutroni ulaze u jezgro. Ove čestice su zajedno. Dakle, zaključak je: ove čestice, nukleoni, drže se u jezgru zbog nuklearnih sila, a te sile djeluju samo u jezgru. Također se može primijetiti da su nuklearne snage važne u smislu nuklearne stabilnosti. Odgovoran za dugovječnost postojanja ovog elementa. U zaključku, možemo napomenuti još jednu stvar: kada govorimo o energiji, upravo će tu nuklearne sile igrati glavnu ulogu. O tome ćemo govoriti u narednim lekcijama. Doviđenja.
Zadatak za lekciju.
1. Odredite nukleonski sastav jezgara gvožđa(broj nukleona, protona, neutrona).
2. U jezgru atoma hemijskog elementa ima 22 protona i 26 neutrona. Imenujte ovaj hemijski element.
3. Procijenite jačinu gravitacijske interakcije između dva neutrona u jezgru. Masa neutrona je približno jednaka 1,7 * 10 -27 kg, uzeti razmak između neutrona jednak 10 -15 m, vrijednost gravitacijske konstante je 6,67 * 10-11 (N * m 2) / kg 2.
Masovni broj
Poznavanje masenog broja omogućava vam da procijenite masu jezgra i atoma. Ako je maseni broj poznat, onda je masa M atom i njegovo jezgro se procjenjuju iz sljedeće relacije M ≈ A m N, gdje m N ≈ 1,67 10 −27 kg je masa nukleona, odnosno protona ili neutrona. Na primjer, atom aluminija-27 i njegovo jezgro sadrže 27 nukleona (13 protona i 14 neutrona). Njegova masa je približno jednaka 27 1,67 10 −27 kg ≈ 4,5 10 −26 kg. Ako je potrebno s većom preciznošću dobiti masu jezgra, onda se mora uzeti u obzir da su nukleoni u jezgru vezani silama nuklearnog privlačenja, pa prema tome, u skladu s relacijom E=mc 2 masa jezgra se smanjuje. Masi atoma treba dodati i ukupnu masu elektrona u orbitama oko jezgra. Međutim, sve ove korekcije ne prelaze 1%.
| 238 92 U | → | 234 90 Th | + | 4 2 On |
na lijevoj strani maseni broj početnog jezgra je 238, a na desnoj strani reakcije nalaze se dva jezgra masenih brojeva 234 i 4, što daje ukupno 238. S obzirom da je maseni broj alfa čestice (jezgro helijuma-4) je 4, alfa-raspad smanjuje maseni broj raspadajućeg jezgra za 4 jedinice. Bilo koji tip beta raspada (beta minus raspad, pozitronski raspad, hvatanje elektrona, sve vrste dvostrukog beta raspada) ne mijenja maseni broj, jer u ovom procesu samo transformacija nekih nukleona jezgra iz jedne vrste u drugu (protoni u neutrone ili nazad). Izomerni prijelaz također ne mijenja masu core number.
Bilješke
vidi takođe
Wikimedia fondacija. 2010 .
Pogledajte šta je "Masni broj" u drugim rječnicima:
- (broj nukleona, simbol A), ukupan broj NUKLENA (NEUTRONA i PROTONA) u NUKLEARU ATOMA. Obično se piše kao superskript ispred hemijskog simbola elementa. Dakle, najlakši element, vodonik, ima samo jedan proton u jezgru, i ... ... Naučno-tehnički enciklopedijski rečnik
Ukupan broj nukleona (neutrona i protona) u at. jezgro. Različito za izotope iste hem. element. Fizički enciklopedijski rječnik. M.: Sovjetska enciklopedija. Glavni i odgovorni urednik A. M. Prokhorov. 1983. MESNI BROJ ... Physical Encyclopedia
Broj nukleona u atomskom jezgru. Obično je naznačeno u gornjem lijevom dijelu simbola kemijskog elementa (na primjer, 10V) ... Veliki enciklopedijski rječnik
MASOVNI BROJ- ukupan broj nukleona (protona i neutrona) u atomskom jezgru, označen kao A i označen indeksom u gornjem lijevom dijelu simbola odgovarajućeg elementa, na primjer. 32S označava izotop sumpora sa masenim brojem 32 (A = 32). Masa izotopa jednaka je cijeloj ... ... Velika politehnička enciklopedija
maseni broj- — [Ya.N. Luginsky, M.S. Fezi Zhilinskaya, Yu.S. Kabirov. Engleski ruski rečnik elektrotehnike i energetike, Moskva] Teme iz elektrotehnike, osnovni pojmovi EN masovni broj ... Priručnik tehničkog prevodioca
Broj nukleona u atomskom jezgru. Obično je naznačeno u gornjem lijevom dijelu simbola kemijskog elementa (na primjer, 10V). * * * MASOVI BROJ MASI BROJ, broj nukleona u atomskom jezgru. Obično je naznačeno u gornjem levom uglu simbola hemijskog elementa ... ... enciklopedijski rječnik
maseni broj- masės skaičius statusas T sritis Standardizacija ir metrologija apibrėžtis Atomo branduolio nukleonų skaičius. atitikmenys: engl. maseni broj; nuklearni broj; nukleonski broj vok. Massenzahl, f; Nukleonenzahl, f rus. maseni broj, n; broj… … Penkiakalbis aiskinamasis metrologijos terminų žodynas
maseni broj- masės skaičius statusas T sritis chemija apibrėžtis Atomo branduolio nukleonų skaičius. atitikmenys: engl. maseni broj; nuklearni broj; nukleonski broj eng. maseni broj... Chemijos terminų aiskinamasis žodynas
maseni broj- masės skaičius statusas T sritis fizika atitikmenys: angl. maseni broj; nuklearni broj; nukleonski broj vok. Massenzahl, f; Massezahl, f; Nukleonenzahl, f rus. maseni broj, n pranc. nombre de masse, m; nombre de nucléons, m … Fizikos terminų žodynas
Broj nukleona (protona i neutrona) u atomskom jezgru; označen slovom A i obično se označava u gornjem lijevom kutu pored simbola elementa, na primjer, 32S znači izotop sumpora s A = 32. M. h. I nuklearni naboj Z, izražen u jedinicama elementarnih ... Velika sovjetska enciklopedija
Središte atoma sadrži većinu njegove mase i sav njegov pozitivan naboj. Ovo područje atoma naziva se jezgrom.
Dimenzije atoma su m, a dimenzije jezgra 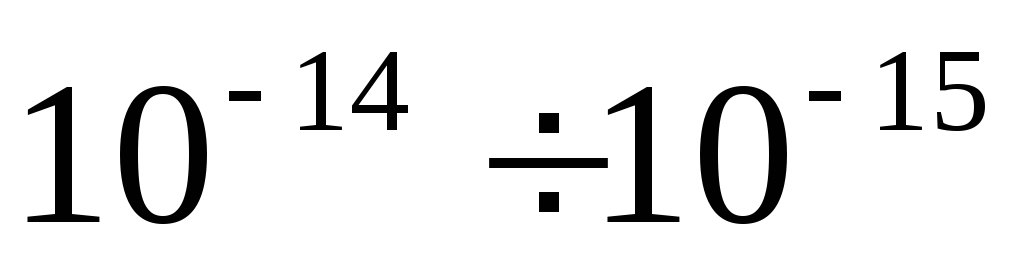 m masa jezgra je 99,95% mase atoma. U neutralnom atomu Z elektrona. Nuklearni naboj je pozitivan i višestruki od elementarnog naboja
m masa jezgra je 99,95% mase atoma. U neutralnom atomu Z elektrona. Nuklearni naboj je pozitivan i višestruki od elementarnog naboja 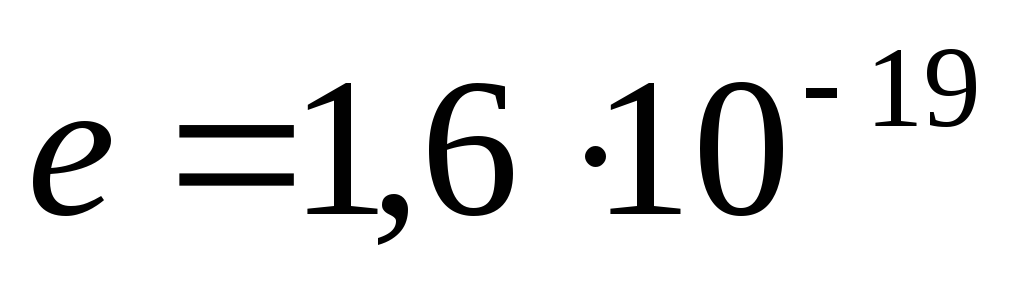 Cl. Nuklearni naboj se može predstaviti kao
Cl. Nuklearni naboj se može predstaviti kao 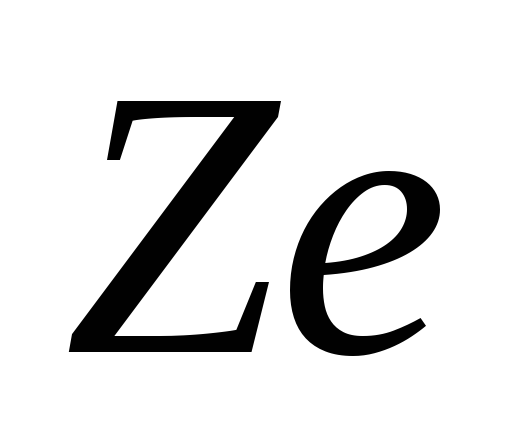 , gdje Z- broj naboja, poklapa se sa hemijskim brojem periodnog sistema i jednak je broju protona koji ulaze u jezgro.
, gdje Z- broj naboja, poklapa se sa hemijskim brojem periodnog sistema i jednak je broju protona koji ulaze u jezgro.
Druga najvažnija karakteristika jezgra je njegova masa. Ispostavilo se da je masa jezgra veća od zbira masa protona koji ulaze u jezgro.
Sugerirano je da jezgro sadrži neutralne čestice. 1932. Chadwig je otkrio neutrone. Ivanenko i Heisenberg su predložili protonsko-neutronsku teoriju jezgra. Jezgro se dijeli na protone i neutrone. Zovu se nukleoni. Ukupan broj nukleoni u jezgru naziva masovnim brojemA
.
Ukupan broj neutrona je N=A-Z. Masa mirovanja protona je 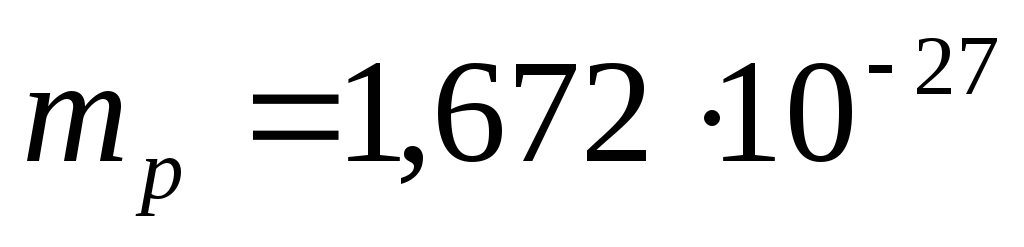 kg, masa neutrona je
kg, masa neutrona je 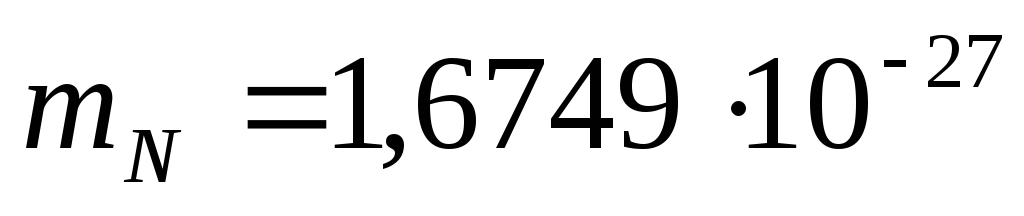 kg.
kg.
Jezgro hemijskog elementa je označeno istim simbolom kao i neutralni atom. 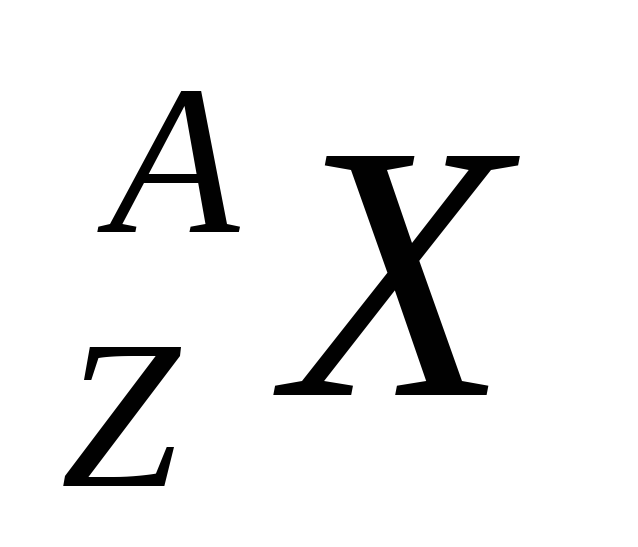 , gdje Z- atomski broj (nuklearni naboj), A- maseni broj (broj nukleona u jezgru). Jezgra sa istim brojem naboja, ali različite mase nazivaju se izotopi (izotopi se razlikuju po broju neutrona). Jezgra sa istim masenim brojem, ali različitim nabojem nazivaju se izobare.
, gdje Z- atomski broj (nuklearni naboj), A- maseni broj (broj nukleona u jezgru). Jezgra sa istim brojem naboja, ali različite mase nazivaju se izotopi (izotopi se razlikuju po broju neutrona). Jezgra sa istim masenim brojem, ali različitim nabojem nazivaju se izobare.
28. Svojstva nuklearnih sila.
Karakteristike nuklearnih sila:
29. Radioaktivnost. Alfa i beta raspad. Pravila pomjeranja.
Radioaktivnost se zove transformacija nestabilnih izotopa jednog hemijskog elementa u izotope drugog elementa, praćena emisijom određenih čestica. Prirodna radioaktivnost se odnosi na radioaktivnost uočenu u prirodnim nestabilnim izotopima. Umjetna radioaktivnost naziva se radioaktivnost izotopa dobivenih kao rezultat nuklearnih reakcija.
Radioaktivno zračenje ima složen sastav. U magnetnom polju, uski snop radioaktivnog zračenja se deli na tri komponente:

 -čestice -
protok jezgara helijuma sa nabojem Z=2
e i maseni broj A=4
(
-čestice -
protok jezgara helijuma sa nabojem Z=2
e i maseni broj A=4
(![]() ). Brzina
). Brzina  -čestice je jednako
-čestice je jednako 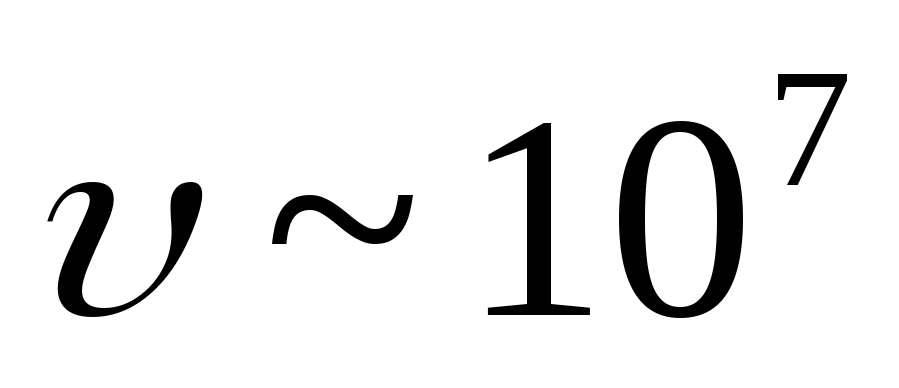 gospođa. Ulazak u supstancu
gospođa. Ulazak u supstancu  -čestice aktivno stupaju u interakciju s atomima i molekulama, ioniziraju ih i pobuđuju. Kada energija
-čestice aktivno stupaju u interakciju s atomima i molekulama, ioniziraju ih i pobuđuju. Kada energija  -čestica se svodi na toplotno kretanje, hvata dva elektrona i pretvara se u atom helija ( On). Prije toga ona prolazi kroz stazu koja se zove trčanje. Zbog jake interakcije sa materijom, domet je kratak. List papira ili odjeća se drže
-čestica se svodi na toplotno kretanje, hvata dva elektrona i pretvara se u atom helija ( On). Prije toga ona prolazi kroz stazu koja se zove trčanje. Zbog jake interakcije sa materijom, domet je kratak. List papira ili odjeća se drže  -čestice. Aluminijski lim debljine 0,05 mm također kasni
-čestice. Aluminijski lim debljine 0,05 mm također kasni  -čestice. Jonizujuća sposobnost
-čestice. Jonizujuća sposobnost  -čestice su velike i jednake
-čestice su velike i jednake 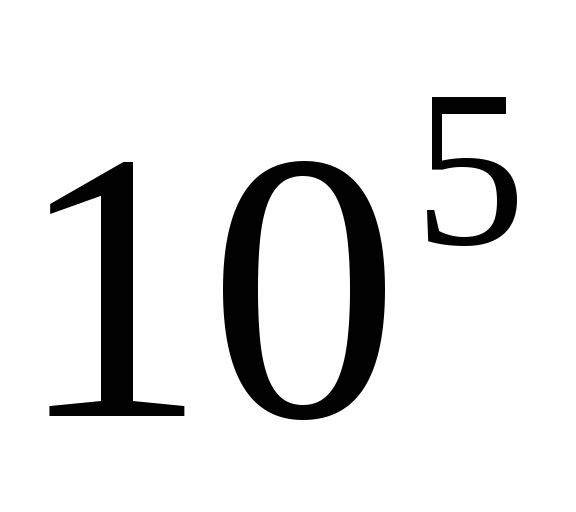 pare preko trčanja.
pare preko trčanja.
 -čestice
je tok elektrona koji brzinom bježi iz jezgara
-čestice
je tok elektrona koji brzinom bježi iz jezgara 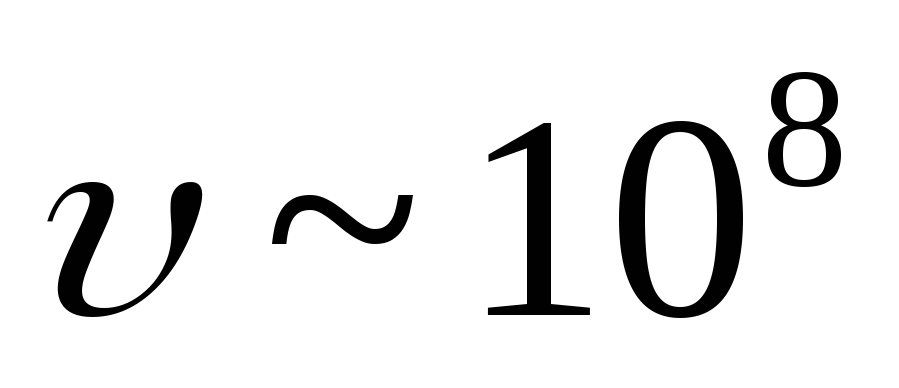 gospođa. Jezgro emituje elektron kada neutron postane proton:
gospođa. Jezgro emituje elektron kada neutron postane proton:
gdje  - simbol elektrona,
- simbol elektrona, 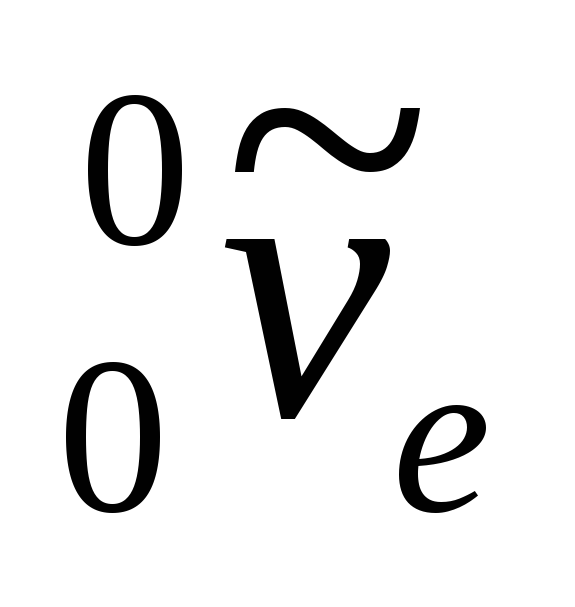 - elektronski antineutrino.
- elektronski antineutrino.
Jonizujuća sposobnost  čestice stotine puta manje od
čestice stotine puta manje od  -čestice, a prodorna moć je veća.
-čestice, a prodorna moć je veća.  - zračenje je odloženo slojem aluminijuma debljine 2 mm.
- zračenje je odloženo slojem aluminijuma debljine 2 mm.
Proučavanje atomskih jezgara počelo je nakon utvrđivanja sledećih eksperimentalnih činjenica: 1) otkriće prirodne radioaktivnosti od strane francuskog naučnika Henrija Bekerela 1896. godine; 2) otkriće izotopije hemijskih elemenata 1910. godine od strane engleskog naučnika Sodija; 3) nuklearni model atoma, koji je 1911. predložio veliki engleski fizičar Ernest Rutherford.
Rutherford je, istražujući radioaktivnost, 1908. godine došao do zaključka da tokom radioaktivnog raspada dolazi do transformacije atoma nekih hemijskih elemenata u atome drugih elemenata. Kasnije, proučavajući prolazak a-čestica sa energijom od nekoliko megaelektron-volti kroz tanke filmove zlata, Rutherford je otkrio nuklearni model atoma, nakon čega je postalo jasno da se tokom radioaktivnosti jezgra nekih elemenata pretvaraju u jezgra drugih elemenata.
Otkriće izotopije odigralo je dalju ulogu. Atomske težine, tj. mase atoma hemijski čistih elemenata, po pravilu, izražavaju se u a.m.u. brojevi koji nisu baš bliski cijelim brojevima. Na primjer, atomska težina bora (B) je 10,82; Ne - 20,183; Cl - 35,457; Fe -56,85 ;… . Otkrićem izotopije ustalilo se mišljenje da je kemijski čist element mješavina izotopa koji se međusobno razlikuju po atomskoj težini. Pokazalo se da su atomske težine izotopa bliže cijelim brojevima od atomskih težina elemenata, a što su bliže, to je izotop lakši, tj. što je manja njegova atomska težina. Ovo je dovelo naučnike do ideje da se jezgro sastoji od čestica čije su atomske težine bliske jedinici. Ovaj uslov dobro zadovoljava jezgro atoma vodika - proton, čija je atomska težina blizu jedinice (1,008). Osim toga, budući da je naboj protona pozitivan, pojavila se ideja da sastav jezgra mora nužno uključivati protone. Ostalim sastavnim česticama jezgra trebalo je dugo da se shvate. Fenomen prirodne β-aktivnosti kao da ukazuje na to da su elektroni uključeni u sastav jezgra. Stoga je predložen protonsko-elektronski model jezgra. Međutim, pokazalo se da je model proton-elektrona neodrživ. Prema ovom modelu, spin jezgra sastavljenog od parnog broja protona i elektrona mora biti ceo broj (spin protona, kao i spin elektrona, je ½ ħ), a u praksi, poluceli brojevi se takođe posmatraju. Model nije objasnio zašto je magnetni moment jezgra 2000 puta manji od magnetnog momenta elektrona. Konačno, pokazalo se da je model proton-elektrona u suprotnosti sa Hajzenbergovim principom. Poznavajući veličinu jezgra, moguće je procijeniti veličinu impulsa elektrona, koji je dio jezgra, i, posljedično, veličinu njegove energije. Takve procjene daju da je energija elektrona u jezgru oko 200 MeV. Prema eksperimentu, energija veze jedne čestice u jezgru je 7 - 8 MeV. Osim toga, energija od 200 MeV je mnogo puta veća od energije elektrona koje emituje jezgro tokom β-raspada.
Izlaz iz poteškoća pronađen je nakon što je 1932. Rutherfordov zaposlenik, Chadwick, otkrio novu elementarna čestica- neutron. Masa neutrona je približno jednaka masi protona, malo je veća, a električni naboj je 0. Ubrzo nakon otkrića neutrona, 1934. godine, sovjetski fizičar D.D. Ivanenko iznio je hipotezu o protonu. neutronska struktura jezgra. Ovu istu hipotezu nezavisno je predložio Heisenberg.
Trenutno protonsko-neutronska struktura jezgra je univerzalno priznata i leži u osnovi modernih ideja o jezgri i cjelokupnoj nuklearnoj fizici.
Prema savremenim podacima, proton (p) ima pozitivan naboj, jednak naboju elektroda qp= 1.6. 10 -19 C i masa mirovanja m str= (1,0075957 ±0,000001) amu = (1836,09±0,01) ja.
Neutron (n) - neutralna čestica sa masom mirovanja m n= (1,008982 ±0,000003)a.m.u. = (1838,63 ± 0,01) ja, gdje je 1amu = 1,667 . 10 -27 kg - 1/12 mase atoma C 12;
ja= 9.106. 10 -31 kg – masa mirovanja elektrona.
U modernoj fizici se vjeruje da su proton i neutron dva stanja naelektrisanja iste čestice, koja se nazivaju nukleon(od lat. nucleus - jezgro). Dakle, proton je protonsko stanje nukleona, neutron je neutronsko stanje nukleona. Ukupan broj nukleona u atomskom jezgru naziva se maseni broj A.
Atomsko jezgro karakterizira naboj Ze , gdje Z je broj naboja jezgra, jednak broju protona u jezgru i poklapa se sa serijskim brojem hemijskog elementa u periodičnom sistemu elemenata Mendeljejeva. Trenutno poznatih 107 elemenata periodnog sistema imaju brojeve naelektrisanja jezgara od Z = 1 do Z = 107. Pošto je Z jednako broju protona u jezgru, broj neutrona u jezgru je: N = A - Z . nuklearna fizika uobičajeno je da se jezgro označi istim simbolom kao neutralni atom: , gdje X- simbol
hemijski element, Z- atomski broj (broj protona u jezgru), ALI- maseni broj (broj nukleona u jezgru).
Pošto je atom neutralan, naboj jezgra određuje broj elektrona u atomu. Broj elektrona određuje njihovu distribuciju po stanjima u atomu, što zauzvrat određuje hemijska svojstva atoma. Shodno tome, nuklearni naboj određuje specifičnosti datog hemijskog elementa, odnosno određuje broj elektrona u atomu, njihovu konfiguraciju elektronske školjke, veličina i priroda intraatomskog električnog polja.
Kerneli sa istim Z, ali drugačijim ALI(tj. sa različitim brojem neutrona) nazivaju se izotopi, a jezgra sa istim ALI, ali različite Z izobare. Na primjer, vodonik ( Z= 1) ima tri izotopa; - protij ( Z =1, N= 0) ; - deuterijum, ( Z =1, N= 1); - tricijum ( Z =1, N= 2). U velikoj većini slučajeva, izotopi istog hemijskog elementa imaju istu hemikaliju i skoro identičnu fizička svojstva(izuzetak su izotopi vodonika), koji su uglavnom određeni strukturom elektronskih ljuski, koja je ista za sve izotope datog elementa.
Sljedeća jezgra mogu poslužiti kao primjer izobarnih jezgara: , , . Trenutno je poznato više od 2500 jezgara koje se razlikuju Z, ili A, ili oboje.
Rutherford je to pokazao atomska jezgra imaju dimenzije od približno 10 -14 - 10 -15 m (za poređenje, linearne dimenzije atoma su približno 10-10 m). Radijus jezgra - dat empirijskom formulom R = R 0 A 1/3 gdje R0= (1,3 ÷ 1,7) 10 -15 m. Međutim, kada se koristi ovaj koncept, mora se voditi računa zbog njegove dvosmislenosti, na primjer, zbog zamućenja granice jezgra. Volumen jezgra je proporcionalan broju nukleona u jezgru. Prema tome, gustina nuklearne materije je približno ista za sve jezgre: ρ » 10 17 kg/m 3 .
Masovni broj
Poznavanje masenog broja omogućava vam da procijenite masu jezgra i atoma. Ako je maseni broj poznat, onda je masa M atom i njegovo jezgro se procjenjuju iz sljedeće relacije M ≈ A m N, gdje m N ≈ 1,67 10 −27 kg je masa nukleona, odnosno protona ili neutrona. Na primjer, atom aluminija-27 i njegovo jezgro sadrže 27 nukleona (13 protona i 14 neutrona). Njegova masa je približno jednaka 27 1,67 10 −27 kg ≈ 4,5 10 −26 kg. Ako je potrebno s većom preciznošću dobiti masu jezgra, onda se mora uzeti u obzir da su nukleoni u jezgru vezani silama nuklearnog privlačenja, pa prema tome, u skladu s relacijom E=mc 2 masa jezgra se smanjuje. Masi atoma treba dodati i ukupnu masu elektrona u orbitama oko jezgra. Međutim, sve ove korekcije ne prelaze 1%.
92 238 U → 90 234 T h + 2 4 H e (\displaystyle (\mathsf (_(92)^(238)U\rightarrow _(90)^(234)Th+_(2)^(4)He) )))Na lijevoj strani maseni broj početnog jezgra je 238, na desnoj strani reakcije nalaze se dva jezgra masenih brojeva 234 i 4, što ukupno daje 238. Uzimajući u obzir činjenicu da je maseni broj alfa čestica (jezgro helijuma-4) je 4, alfa-raspad smanjuje maseni broj raspadajućeg jezgra za 4 jedinice. Bilo koje vrste






