Moddaning suyuq holati suyuqliklarning xususiyatidir. Atamalar, ta'riflar va parametrlar. Agar kapillyarlarning dumaloq kesimi bo'lsa, u holda
Suyuq holatda zarralar orasidagi masofa gaz holatiga qaraganda ancha kichikdir. Zarrachalar hajmning asosiy qismini egallaydi, doimo bir-biri bilan aloqa qiladi va bir-biriga tortiladi. Zarrachalarning ayrim tartiblanishi (qisqa diapazondagi tartib) kuzatiladi. Zarrachalar bir-biriga nisbatan harakatlanadi.
Suyuqliklarda zarralar o'rtasida van der Vaals o'zaro ta'sirlari paydo bo'ladi: dispersiya, orientatsiya va induksiya. Muayyan kuchlar bilan birlashgan zarralarning kichik guruhlari deyiladi klasterlar. Bir xil zarrachalar bo'lsa, suyuqlikdagi klasterlar deyiladi sheriklar
Tog' jinsiga botganda tog 'jins hajmiga teng suv hajmi siljiydi. Taqqoslash uchun, yog'och bloki o'z vazniga teng suv hajmini siqib chiqarmaguncha, tortishish kuchi ostida suvga cho'kib, yanada nozikroq harakat qiladi.
Suyuqliklarning bug'lanishi va kondensatsiyasi
Barcha kuchlar barqarorlashganda, daraxt tushishni to'xtatadi. Qadimgi yunon matematigi, fizigi, astronomi va faylasufi Arximed tomonidan o'ylab topilgani uchun bu Arximed printsipi deb ataladi. Arximed. Bundan tashqari, printsip shuni ko'rsatadiki, yog'och blokni qo'llab-quvvatlovchi kuchlar unga yuqoriga va ichkariga qaratilgan bo'lib, suzish markazi deb ataladigan nuqtada yakunlanadi. Har doim suzuvchi jismning massa markazidan yuqorida, suzish markazining joylashuvi ob'ektning barqarorligini ko'rsatishga qodir.
Suyuqliklarda vodorod aloqalarining hosil bo'lishi zarrachalarning tartiblanishini oshiradi. Biroq, vodorod aloqalari va van der Vaals kuchlari mo'rt - suyuqlik holatidagi molekulalar doimiy xaotik harakatda bo'ladi, bu deyiladi. jigarrang harakati.
Suyuq holat uchun molekulalarning Maksvell-Boltzman tezligi va energiyasi bo'yicha taqsimlanishi o'rinlidir.
Suzuvchanlik markazi va massa markazi orasidagi masofa qanchalik katta bo'lsa, jism shunchalik barqaror bo'ladi, ya'ni uning ag'darilishi ehtimoli shunchalik past bo'ladi. Boshqa xarakterli xususiyat suyuqliklar shundan iboratki, agar zichroq suyuqlik kamroq zichroq suyuqlikka quyilsa va ikkalasi aralashmasa, ular bir-biridan ajralib chiqadi va zichroq suyuqlik tepada va zichroq suyuqlik quyida qoladi. Buning klassik misoli neft va suv bilan sodir bo'ladigan ajralishdir.
Suv osti kemalari ishda suzishning ajoyib namunasidir. Okean yuzasida sayohat qilganda, suv osti kemasining o'rtacha zichligi suvnikidan bir oz kamroq. Biroq, u sho'ng'in uchun ketganda, suv osti kemasi suv olishi kerak. Bu keyinchalik uning suvdan tashqaridagi zichligini oshiradi, natijada uning oqishi mumkin bo'ladi.
Suyuqliklar nazariyasi gazlarnikiga qaraganda ancha kam rivojlangan, chunki suyuqliklarning xossalari bir-biriga yaqin joylashgan molekulalarning geometriyasi va qutbliligiga bog'liq. Bundan tashqari, suyuqliklarning aniq tuzilishining yo'qligi ularning tavsifini rasmiylashtirishni qiyinlashtiradi - ko'pgina darsliklarda suyuqliklarga gazlar va kristall qattiq moddalarga qaraganda ancha kam joy ajratiladi.
Yana suv yuzasiga ko'tarilishi uchun suv osti kemasi suv idishlari orqali puflashi kerak. Bu vazifani ularga havo puflash orqali amalga oshiradi, bu esa o'z navbatida suvni siqib chiqaradi va suv osti kemasining zichligini kamaytiradi. Suyuqlik bosimi va sirt tarangligi.
Garchi bu aniq fakt bo'lmasa-da, u qaysi chuqurlikdan tushganidan qat'i nazar, suv osti kemasining haqiqiy suzish qobiliyati hech qanday tarzda o'zgarmaydi. Buning sababi shundaki, suv mohiyatan siqilmaydi va uning zichligi har qanday chuqurlikda deyarli bir xil bo'ladi. Ammo zichlik o'zgarmasa ham, suv bosimi tomonidan qo'yilgan so'nggi nuqta bor, bu ob'ekt ustidagi suv massasi qo'shilgan chuqurlik bilan chiziqli ravishda ortadi.
Suyuqliklar va gazlar o'rtasida keskin chegara yo'q - u butunlay yo'qoladi tanqidiy nuqtalar . Har bir gaz uchun harorat ma'lum bo'lib, undan yuqorida u hech qanday bosimda suyuq bo'lolmaydi; bu bilan tanqidiy harorat, suyuqlik va uning orasidagi chegara (meniskus). to'yingan bug '. Kritik harorat ("mutlaq qaynash nuqtasi") mavjudligini 1860 yilda D.I.Mendeleyev o'rnatgan.
Shunday qilib, agar siz suv osti kemasining chuqurligini ikki baravar oshirsangiz, siz ham bosimni ikki baravar oshirasiz. Tushunish unchalik qiyin tushuncha bo'lmasa-da, unchalik aniq bo'lmagan narsa shundaki, suv bosimi yo'nalishdan qat'i nazar bir xil bo'ladi. Misol uchun, agar siz idishni suvga cho'ktirish orqali uning yuqori qismini bosmoqchi bo'lsangiz, lekin tank chuqurroq va chuqurroq borgan sari, idishning har tomoni va pastki qismidagi bosim bir xil bo'ladi degan fikrga e'tibor bermasangiz. tankning yuqori qismini bosganingizda, siz tank qanchalik og'irlashganiga hayron qolasiz.
Biroq, agar siz tankning pastki qismidagi valfni ochsangiz, suv oqimga oqib o'tadi, bu esa tank ichidagi va tashqaridagi umumiy bosimni pasaytiradi. Bundan tashqari, suv hozir harakatlanayotganligi sababli, u kinetik energiyaga ega. Va Torricelli printsipiga muvofiq, dan ko'proq bosim valfda, ko'proq kinetik energiya oqim va uning tezligi qanchalik katta.
7.2-jadval - Ayrim moddalarning kritik parametrlari (t k, p k, V k).
| Modda | t ga, taxminan C | p k, atm | V dan, sm 3 / mol | t eriydi o C | C haqida t bale |
| U | -267,9 | 2,26 | 57,8 | -271,4 | -268,94 |
| H2 | -239,9 | 12,8 | 65,0 | -259,2 | -252,77 |
| N 2 2 | -147,0 | 33,54 | 90,1 | -210,01 | -195,82 |
| O 2 2 | -118,4 | 50,1 | -218,76 | -182,97 | |
| CH 4 | -82,1 | 45,8 | 99,0 | -182,49 | -161,58 |
| CO2 | +31,0 | 72,9 | 94,0 | -56,16 | -78,48 (qo'shimcha) |
| NH3 | 132,3 | 111,3 | 72,5 | -77,76 | -33,43 |
| Cl2 | 144,0 | 76,1 | -101,0 | -34,06 | |
| SO2 | 157,5 | 77,8 | -75,48 | -10,02 | |
| H2O | 374,2 | 218,1 | 0,0 | 100,0 |
Bosim to'yingan bug'lar – qisman bosim, bunda bug'ning bug'lanish va kondensatsiya tezligi teng bo'ladi:
Eslatib o'tamiz, suyuqlikning asosiy xususiyatlari quyidagilardan iborat. Ular suyuqlikka o'xshash moddalar bo'lib, ular oqim qobiliyatiga ega bo'lib, deformatsiyadan keyin avvalgi shaklini qayta sozlash qobiliyatiga ega emaslar. Ular quyilgan har qanday idishning shaklini olishlari mumkin.
Rangning mustahkamligi va zichligi bo'yicha ular qattiq jismlarga o'xshash xususiyatlarga ega. Ular umumiy darajani izlashga moyildirlar. Atrofimizda ko‘rayotgan jonli yoki jonsiz narsalar materiyadan iborat. "Materiya" deganda "bo'shliqqa ega bo'lgan va egallagan har qanday modda" deb ta'riflash mumkin. Materiya turli shakllarga ega. Materiyaning uch xil shakli mavjud; qattiq, suyuqlik va gazlar. Ular har bir shaklning o'ziga xos xususiyatiga qarab bir-biridan farq qiladi, bu molekulalarga bog'liq. turli shakllar masala.
Bu erda A va B doimiylar.
Qaynatish harorati suyuqlikning to'yingan bug' bosimi atmosfera bosimiga teng bo'lgan haroratdir.
Suyuqliklar bor suyuqlik- kichik kesish kuchlari ta'sirida harakat qilish qobiliyati; suyuqlik u joylashtirilgan hajmni egallaydi.
Suyuqlikning oqimga qarshiligi deyiladi yopishqoqlik[Pa. Bilan].
Har bir moddaning xususiyatlari; qattiq, suyuq yoki bu molekulalar orasidagi turli tortishishlarga bog'liq. Ushbu maqolada biz moddalarning ikki shakli, suyuqliklar va gazlar o'rtasidagi farqlarni muhokama qilamiz. Suyuqliklar va gazlarni eng asosiy darajada farqlashimiz mumkin bo'lgan to'rtta asosiy farq bor; shakli, hajmi, qattiqligi va oqim qobiliyati.
Suyuqliklar Suyuqliklarning molekulalari o'rtacha tortishish kuchiga ega; molekulalar orasidagi kuch kamroq qattiq va ko'proq gaz. Bu suyuqliklar ichida molekulalarning osonroq va erkin harakatlanishiga olib keladi. Molekulyar harakat natijasida suyuqliklar aniq va belgilangan hajmga ega bo'ladi. Suyuqliklar molekulalar bo'shliqni to'ldirish uchun harakatlanayotganda ular saqlanadigan idish shaklini oladi. Ular aniq shaklga ega emas va oqim qobiliyatiga ega. Suyuqliklar oqishi mumkin; shuning uchun ular "suyuqlik" deb ham ataladi.
Yuzaki taranglik [J / m 2] - sirt birligini yaratish uchun zarur bo'lgan ish.
suyuq kristall holati- suyuq holatdagi moddalar, yuqori tartibli, kristallar va suyuqlik o'rtasida oraliq joyni egallaydi. Ular suyuqlikka ega, lekin ayni paytda ular uzoq muddatli tartibga ega. Masalan - jigarrang kislota hosilalari, azolitlar, steroidlar.
Suyuqliklar qattiq emas. Masalan, 0 darajadan pastda muzlaganda muz ustida qotib qoladi. Suyuqliklarga suv, yog'lar, sut, sharbatlar va boshqalar misol bo'ladi. Gazlar Gazlardagi molekulalar ular o'rtasida juda zaif tortishish kuchiga ega va juda bo'sh joylashadi. Shunday qilib, ular o'ziga xos shaklga ega emas va ular idish shaklini oladi. Molekulyar tuzilishi tufayli gazlar ham o'ziga xos hajmga ega emas va ular saqlanadigan idishning hajmiga aylanadi. Gazlar osongina oqishi mumkin; ularni shunchaki tutatqi yoqish orqali ko'rsatish mumkin.
Tozalash harorati- suyuq kristallar (LC) odatdagi suyuqlik holatiga o'tadigan harorat.
7.5 Qattiq jismlar
DA qattiq holat zarralar bir-biriga shunchalik yaqinki, ular orasida kuchli aloqalar paydo bo'ladi, yo'q oldinga harakat va uning pozitsiyasi atrofida tebranishlar saqlanib qoladi. Qattiq jismlar amorf va kristall holatda bo'lishi mumkin.
Suyuq plyonkalarning xossalari
Tutatqi hidi xonaning bir qismidan boshqasiga o'tadi. Ular osongina siqilishi mumkin, chunki ular molekulalar orasida juda ko'p bo'shliqqa ega. Suyuqliklar molekulalar o'rtasida qattiq va ko'proq gazlarga qaraganda kamroq jozibador kuchga ega; gazlar molekulalar o'rtasida juda zaif tortishish kuchiga ega, bu moddaning uchta holatidan eng kichiki. Suyuqliklar ma'lum hajmga ega; gazlar aniq hajmga ega emas. Suyuqliklarni osongina siqib bo'lmaydi; gazlar osongina siqiladi.
Erdagi hamma narsa materiyadan iborat, ammo bu materiya har doim ham bir xil emas. Materiya to'rt xil fazada mavjud bo'lishi mumkin va kinetik nazariya materiya bu fazalar orasidagi farqni tushunishimizga yordam beradi. Qattiq jismlar, suyuqliklar, gazlar va plazmalar: bu so'zlar sizga tanish bo'lishi kerak, chunki ular har xil bo'lishi mumkin bo'lgan materiyaning to'rt fazasi bo'lib, ular turli shakllar bilan shug'ullanishi mumkin. Mavjud narsa shundaki, ko'plab moddalar bir nechta faza sifatida mavjud bo'lishi mumkin. Masalan, suvni olaylik: suv qattiq, suyuq va gaz holda mavjud bo'lishi mumkin.
7.5.1 Amorf holatdagi moddalar
Amorf holatda moddalar tartiblangan tuzilishga ega bo'lmaydi.
shishasimon holat - suyuqlikning chuqur sovishi natijasida olingan moddaning qattiq amorf holati. Bu holat muvozanat emas, lekin ko'zoynaklar uzoq vaqt davomida mavjud bo'lishi mumkin. Shisha yumshatilishi ma'lum bir harorat oralig'ida sodir bo'ladi - chegaralari sovutish tezligiga bog'liq bo'lgan shisha o'tish oralig'i. Suyuqlik yoki bug'ning sovish tezligi oshishi bilan ma'lum moddani shishasimon holatda olish ehtimoli ortadi.
Bu holatlar orasidagi farq energiya miqdoridir. Qattiq zarrachalar eng kam energiyaga ega, bu ularning zarralari bir-biri bilan chambarchas bog'liqligining bir qismidir. Suyuqliklar qattiq jismlarga qaraganda ko'proq energiyaga ega, shuning uchun ular idishning shaklini oladi, lekin faqat sirtgacha.
Suyuqlikning mexanik xususiyatlari
Gazlar suyuqliklarga qaraganda ko'proq energiyaga ega. Ayniqsa, ularning zarralari idishining butun maydonini to'ldirish uchun tarqalib ketganligi sababli. Gaz zarralari shunchalik ko'p energiyaga egaki, ular bir joyda turolmaydi. Ular barcha yo'nalishlarda uchib, o'zlari va qolgan gaz zarralari o'rtasida imkon qadar ko'proq masofani qo'yishadi.
XX asrning 60-yillari oxirida amorf metallar (metall oynalar) olindi - buning uchun eritilgan metallni 10 6 - 10 8 deg / s tezlikda sovutish kerak edi. Aksariyat amorf metallar va qotishmalar 300 ° C dan yuqori qizdirilganda kristallanadi. Eng muhim ilovalardan biri bu mikroelektronika (metall-yarimo'tkazgich interfeysidagi diffuziya to'siqlari) va magnit saqlash qurilmalari (FMD boshlari). Ikkinchisi noyob magnit yumshoqlik bilan bog'liq (magnit anizotropiya an'anaviy qotishmalarga qaraganda ikki daraja kamroq).
Plazmalar ionlangan gazlar bo'lib, Yerda tabiiy ko'rinishida kam uchraydi. Siz ularni neon belgilar va lyuminestsent lampalar kabi sun'iy narsalar sifatida ko'rgansiz. Ammo koinotning qolgan qismida plazma aslida materiyaning eng keng tarqalgan bosqichidir! Ko'pgina yulduzlar plazma, xuddi qutb mintaqalarida ko'rgan qutb qutblari kabi. Plazma faqat ma'lum sharoitlarda mavjud, shuning uchun biz ushbu qo'llanma uchun bu haqdagi muhokamamizni shu erda tugatamiz.
Moddaning kinetik nazariyasi barcha moddalar tasodifiy harakatda bo'lgan va ular orasida bo'sh joy bo'lgan kichik zarrachalardan iborat ekanligini ta'kidlaydi. Bu shuni anglatadiki, fazali material qanday bo'lishidan qat'i nazar, u alohida harakatlanuvchi zarralardan iborat.
Amorf moddalar izotropik, ya'ni. barcha yo'nalishlarda bir xil xususiyatlarga ega.
7.5.2 Kristal holatidagi moddalar
Qattiq kristall moddalar takrorlanuvchi elementlarga ega tartibli tuzilishga ega bo‘lib, bu ularni diffraksiya yo‘li bilan o‘rganish imkonini beradi. rentgen nurlari(1912 yildan beri qo'llanilgan rentgen nurlanishini tahlil qilish usuli.
Bu nazariya juda oddiy ko'rinadi, lekin aslida u ko'p narsani tushuntiradi jismoniy xususiyatlar materiya va uning harakatlari. Qattiq jismning zarralari haqiqatda harakatlanayotganini bilib hayron bo'lishingiz mumkin, bu siz uchun etarli emas. Bunday tebranish harakati nima uchun qattiq jism uni qaysi idishga solsangiz ham shaklini o'zgartirmagan.
Suyuq zarralar qattiq zarrachalarga qaraganda ko'proq energiyaga ega ekanligini eslaysizmi? Bu holatdagi qo'shimcha energiya zarrachalarning erkin harakatlanishiga imkon beradi va ular qattiq zarrachalarga qaraganda ko'proq tarqaladi, bu esa bu zarralar o'rtasida ko'proq bo'shliqni yaratadi. Shuning uchun suyuqlik o'z idishining shaklini uning yuzasiga qadar oladi.
Yagona kristallar (yagona birikmalar) anizotropiya bilan tavsiflanadi - xususiyatlarning kosmosdagi yo'nalishga bog'liqligi.
Zarrachalarning muntazam joylashishi qattiq tana kristall panjara sifatida ko'rsatilgan. Kristalli moddalar deb ataladigan ma'lum bir haroratda erishi erish nuqtasi.
Va gazlar suyuqliklarga qaraganda ko'proq energiyaga ega bo'lganligi sababli, ularning zarralari ko'proq harakat qiladi. Shuning uchun gaz suyuqlik kabi uning yuzasini emas, balki butun idishni to'ldirish uchun kengayadi. Qattiq jismning zarralari nafaqat juda ko'p harakat qilmaydi, balki ular kuchli jalb qiluvchi kuchlar bilan bir-biriga juda kuchli tegadi. Bu kuchlar zarrachalarni joyida ushlab turadi va qattiq jismga ma'lum o'lcham va shaklni beradi.
Boshqa tomondan, gaz zarralari bir-biridan shunchalik uzoqdaki, ular orasidagi tortishish kuchlari ahamiyatsiz deb hisoblanadi. Gaz zarralari bir-biridan mustaqil hisoblanadi, ya'ni gaz qarama-qarshidir qattiq modda va qat'iy o'lcham va shaklga ega emas.
Kristallar energiya, kristall panjara konstantasi va koordinatsiya soni bilan tavsiflanadi.
Doimiy panjara kristalldagi tugunlarni egallagan zarrachalar markazlari orasidagi masofani xarakterli o'qlar yo'nalishi bo'yicha xarakterlaydi.
muvofiqlashtirish raqami odatda kristalldagi ma'lum bir zarrachaga to'g'ridan-to'g'ri qo'shni bo'lgan zarralar soni deb ataladi (7.2-rasmga qarang - seziy va xlor uchun sakkizinchi koordinatsiya raqami)
Suyuq zarrachalarning harakati qattiq va gaz o'rtasida bo'lgani uchun uning zarralari orasidagi tortishish kuchlari ham qolgan ikki fazaning o'rta diapazonida bo'ladi. Suyuq zarralar qattiq zarrachalarga qaraganda ko'proq erkinlikka ega, shuning uchun suyuqlik erkin oqishi mumkin. Bu shuni anglatadiki, gaz kabi suyuqlik ham qat'iy shaklga ega emas. Ammo zarrachalar gaz zarralari kabi erkin bo'lmagani uchun suyuqlik belgilangan hajmga ega.
Moddaning kinetik nazariyasi ma'lum sharoitlarda moddalar nima uchun fazani o'zgartirishi mumkinligini tushuntirishda ham foydalidir. Suv qattiq, suyuq yoki gazsimon bo'lishi mumkinligini bilasiz, lekin u qanday ishlaydi? Faza o'zgarishi moddaga energiya qo'shilganda yoki undan chiqarilganda, odatda issiqlik shaklida sodir bo'ladi.
Kristal panjaraning energiyasi kristallning bir molini yo'q qilish va zarralarni ularning o'zaro ta'siri chegarasidan tashqarida olib tashlash uchun zarur bo'lgan energiya deb ataladi.
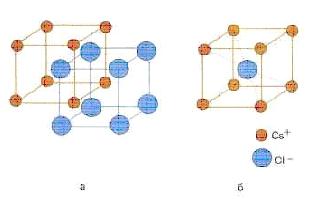
7.2-rasm - seziy xlorid CsCl kristalining tuzilishi (a) va bu kristallning tana markazlashtirilgan kub birlik hujayrasi (b)
7.5.3 Kristal tuzilmalar
Kristalning barcha simmetriya xususiyatlarini ifodalovchi eng kichik struktura birligi: elementar hujayra. Hujayraning uch o'lchamdagi takroriy takrorlanishi bilan kristall panjara olinadi.
Oltita asosiy hujayralar mavjud: kubik, tetraedral, olti burchakli, rombedral, ortoromboedral, monoklinik va triklinik. Asosiy birlik hujayralarining ettita hosilasi mavjud, masalan, tana markazli, kubik, yuz markazli.
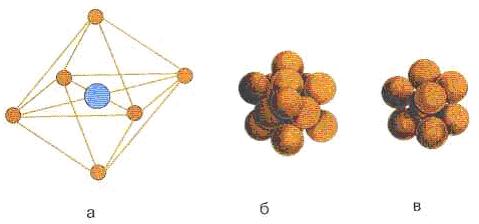
a - NaCl kristalining birlik hujayrasi; b - NaCl ning zich yuz markazli kubik qadoqlanishi; c - CsCl kristalining tanaga yo'naltirilgan kubik o'rashi 7.3-rasm - Birlik hujayra
Izomorf moddalar- bir xil kristall tuzilmalarni hosil qiluvchi o'xshash kimyoviy tabiatga ega moddalar: CaSiO 4 va MgSiO 4
Polimorfizm– ikki yoki undan ortiq tarkibida mavjud bo'lgan birikmalar kristall tuzilmalar, masalan, SiO 2 (olti burchakli kvarts, rombsimon tridimit va kubik kristoballit kabi).
Allotropik modifikatsiyalar- polimorfik modifikatsiyalar oddiy moddalar, masalan, uglerod: olmos, grafit, karbin, fulleren.
Kristal panjaraning tugunlaridagi zarrachalarning tabiati bo'yicha va kimyoviy bog'lanishlar ular orasida kristallar quyidagilarga bo'linadi:
1) molekulyar- tugunlarda molekulalar mavjud bo'lib, ular orasida van der Vaals kuchlari harakat qiladi, ular kam energiyaga ega: muz kristallari;
2) atomik- kovalent kristallar- kristallarning tugunlarida bir-biri bilan kuchli hosil bo'lgan atomlar joylashgan kovalent aloqalar, yuqori panjara energiyasiga ega, masalan, olmos (uglerod);
3) ion kristallari- ushbu turdagi kristallarning strukturaviy birliklari musbat va manfiy zaryadlangan ionlar bo'lib, ular orasida elektr o'zaro ta'siri, etarlicha yuqori energiya bilan tavsiflanadi, masalan, NaCL, KCL;
4) metall kristallari- yorug'likka nisbatan yuqori elektr o'tkazuvchanligi, issiqlik o'tkazuvchanligi, egiluvchanligi, plastikligi, metall porlashi va yuqori aks ettiruvchi moddalar; kristallardagi bog'lanish metalldir, metall bog'ning energiyasi kovalent va molekulyar kristallarning energiyalari o'rtasida oraliq;
5) aralash kristallar- zarralar o'rtasida murakkab o'zaro ta'sirlar mavjud bo'lib, ularni ikki yoki undan ortiq turdagi bog'lanishlarni bir-birining ustiga qo'yish orqali tasvirlash mumkin, masalan, klatratlar (birikmalar kiradi) - kristall bo'shlig'iga molekulalarning (mehmonlarning) qo'shilishi natijasida hosil bo'ladi. boshqa turdagi zarrachalardan tashkil topgan ramka (xostlar): gaz klatratlari CH to'rt . 6H 2 O, karbamid klatratlari.
Gazlar va kristallar o'rtasida oraliq pozitsiyani egallagan suyuqlik ushbu jismlarning ikkala turining xususiyatlarini birlashtiradi..
1. Qattiq, suyuqlik kabi biroz siqiladi molekulalarning zich joylashishi tufayli. (Ammo, agar suvni siqilishdan butunlay chiqarib yuborish mumkin bo'lsa, u holda jahon okeanidagi suv sathi 35 m ga ko'tariladi va suv 5 000 000 km 2 erni suv bosadi.)
2. Qattiq, suyuqlik kabi tovushni tejaydi lekin gaz kabi idish shaklini oladi .
3. Kristallar uchun tipik uzoq muddatli buyurtma atomlarning joylashishida (kristal panjara), gazlar uchun- to'la tartibsizlik. Suyuqlik uchun oraliq holat mavjud qisqa muddatli buyurtma , ya'ni. faqat eng yaqin molekulalarning joylashishi tartiblangan. Ushbu molekuladan 3-4 samarali molekulyar diametrli masofada uzoqlashganda, tartib xiralashadi. Shuning uchun suyuqliklar polikristal jismlarga yaqin bo'lib, juda kichik kristallardan (taxminan 10 ga yaqin) iborat. 9 m), bir-biriga nisbatan o'zboshimchalik bilan yo'naltirilgan. Shu sababli, ko'pchilik suyuqliklarning xususiyatlari barcha yo'nalishlarda bir xil bo'ladi (va kristallardagi kabi anizotropiya yo'q).
4. Ko'p suyuqliklar, qattiq moddalar kabi, ortib borayotgan harorat bilan ularning hajmini oshirish , uning zichligini kamaytirish bilan birga (kritik haroratda suyuqlikning zichligi uning bug'ining zichligiga teng). Suv boshqacha mashhur anomaliya , shundan iboratki, +4 S da suv maksimal zichlikka ega. Bu anomaliya suv molekulalari qisman bir nechta molekula (klasterlar) guruhlariga to'planib, o'ziga xos yirik molekulalarni hosil qilishi bilan izohlanadi. H 2 O, (H 2 O) 2 , (H 2 O) 3 … har xil zichlikda. Har xil haroratlarda ushbu molekulalar guruhlarining kontsentratsiyasining nisbati har xil bo'ladi.
Mavjud amorf jismlar (shisha, kehribar, qatronlar, bitum ...), ular odatda juda yuqori viskoziteli super sovutilgan suyuqliklar deb hisoblanadi. Ular barcha yo‘nalishlarda bir xil xususiyatlarga ega (izotrop), zarrachalarning joylashishida qisqa masofali tartib, ular erish nuqtasiga ega emas (qizilganda modda asta-sekin yumshab, suyuq holatga o‘tadi).
Texnologiyada qo'llaniladi magnit suyuqliklar - bu oddiy suyuqliklar (suv, kerosin, turli moylar), ularga (50% gacha) qattiq ferromagnit materialning eng kichik zarralari (bir necha mikron o'lchamdagi) kiritiladi (masalan, Fe 2 O 3). Magnit suyuqlikning harakati va uning yopishqoqligi magnit maydon tomonidan boshqarilishi mumkin. Kuchlilarda magnit maydonlar magnit suyuqlik bir zumda qattiqlashadi.
Molekulalari filamentli yoki tekis plastinkalar shakliga ega bo'lgan ba'zi organik moddalar anizotropiya va suyuqlik xususiyatlariga ega bo'lgan maxsus holatda bo'lishi mumkin. Ular chaqiriladi suyuq kristallar . Suyuq kristall molekulalarining yo'nalishini o'zgartirish uchun (bu holda uning shaffofligi o'zgaradi) taxminan 1 V kuchlanish va mikrovatt tartibidagi quvvat talab qilinadi, bu integral mikrosxemalardan signallarni to'g'ridan-to'g'ri etkazib berish orqali ta'minlanishi mumkin. qo'shimcha kuchaytirmasdan. Shuning uchun suyuq kristallar elektron soat ko'rsatkichlari, kalkulyatorlar va displeylarda keng qo'llaniladi.
Muzlaganda suv hajmi 11% ga oshadi va agar suv yopiq joyda muzlasa, 2500 atmosfera bosimiga erishish mumkin (suv quvurlari, toshlar vayron bo'ladi ...).
yechib olish eng kattalaridan biri: 1) dielektrik doimiy(shuning uchun suv yaxshi hal qiluvchi, ayniqsa ionli bog'langan tuzlar - butun davriy jadval Jahon okeanida joylashgan); 2) termoyadroviy issiqlik(bahorda qorning sekin erishi); 3) issiqlik bug'lanish; 4) sirt tarangligi; 5) issiqlik sig'imi(engil qirg'oq iqlimi).
Mavjud yorug'lik (1 g / sm 3) va og'ir (1,106 g/sm3) suv . Engil suv ("tirik") - biologik faol - bu protium oksidi H 2 O. Og'ir suv ("o'lik") - organizmlarning hayotiy faoliyatini bostiradi - bu deyteriy oksidi D 2 O. Protiy (1 amu), deyteriy (2 amu) va tritiy (3 amu) vodorodning izotoplaridir. Shuningdek, kislorodning 6 ta izotopi mavjud: 14 dan O 19 gacha O Buni suv molekulasida topish mumkin.
Suvni tozalashda magnit maydon uning xossalari o'zgaradi: namlanish o'zgaradi qattiq moddalar, ularning erishi tezlashadi, erigan gazlar konsentratsiyasi o'zgaradi, bug 'qozonlarida shkala hosil bo'lishining oldi olinadi, betonning qattiqlashishi 4 marta tezlashadi va uning mustahkamligi 45% ga oshadi, odamlarga biologik ta'sir (magnit bilaguzuklar) mavjud. va sirg'alar, magnetolights va boshqalar) va o'simliklar (nihol va ekinlarning hosildorligi oshadi).
kumush suv uzoq vaqt (taxminan olti oy) saqlanishi mumkin, chunki suv kumush ionlari bilan mikroblar va bakteriyalardan zararsizlantiriladi (u kosmonavtikada, oziq-ovqat konservalarida, hovuzlardagi suvni dezinfektsiyalashda, oshqozon-ichak kasalliklarining oldini olish va ularga qarshi kurashishda dorivor maqsadlarda foydalaniladi). yallig'lanish jarayonlari).
Ichimlik suvini dezinfeksiya qilish shahar suv quvurlarida suvni xlorlash va ozonlash orqali amalga oshiriladi. Ultraviyole nurlanish va ultratovush yordamida dezinfeksiya qilishning jismoniy usullari ham mavjud.
Gazlarning eruvchanligi suvda harorat, bosim, sho'rlanish, suvli eritmada boshqa gazlar mavjudligiga bog'liq. 0 S haroratda 1 litr suvda quyidagilarni eritish mumkin: geliy - 10 ml, karbonat angidrid - 1713 ml, vodorod sulfidi - 4630 ml, ammiak - 1300000 ml (ammiak). Katta chuqurliklarga sho'ng'ishda akvalanglar maxsus nafas olish aralashmalaridan foydalanadilar, shunda ular ko'tarilishda undagi azotning erishi tufayli "gazlangan qon" ni olmaydilar.
Hammasi tirik organizmlar 60-80% suv. Odamlar va hayvonlarning qoni tuz tarkibiga ko'ra okean suviga o'xshaydi. Inson va hayvonlar o'z tanalarida suvni sintez qilishlari, oziq-ovqat mahsulotlari va to'qimalarning yonishi paytida uni hosil qilishlari mumkin. Masalan, tuyada dumg'aza tarkibidagi yog' oksidlanish natijasida 40 litr suv berishi mumkin.
Da elektroliz ikki turdagi suvni olish mumkin: 1) antiseptik vazifasini bajaradigan kislotali suv ("o'lik") (kislotali me'da shirasida qancha patogen mikroblar o'lganiga o'xshash); 2) biologik jarayonlarni faollashtiradigan (hosildorlikni oshiradi, yaralarni tezroq davolaydi va hokazo) gidroksidi suv ("jonli").
Internetdan suvning boshqa xususiyatlari (tuzilishli, energiya-axborot va boshqalar) haqida bilib olishingiz mumkin.
TRIZ vazifasi 27. Suv ishchisi
Ko'pincha turli mexanizmlar "qattiq holatga" ega. ishchi organlar. Ishchi organ suv (suyuqlik) bo'lgan texnik qurilmalarga misollar keltiring. Bunday ishchi organ texnik tizimlar rivojlanishining qanday qonuniyatlariga mos keladi?
TRIZ vazifasi 28. Elakdagi suv
Mashhur muammoda Suvni elakda qanday tashish kerak? aniq bor jismoniy qarama-qarshilik: elakda quyma qattiq moddalarni elakdan o'tkazish uchun teshiklar bo'lishi kerak va suv to'kilmasligi uchun teshiklar bo'lmasligi kerak. Ushbu muammoning mumkin bo'lgan echimlaridan biri Ya.I. Perelman "Ko'ngilochar fizika" da, bu erda elakni erigan kerosinga tushirish taklif etiladi, shunda elak to'ri suv bilan namlanmaydi. Asosida texnik jihatdan bartaraf etish usullari va jismoniy qarama-qarshiliklar bu muammoni hal qilishning 10-20 boshqa usullarini taklif qiling.






