Ionlar zaryadlangan atomlar va atom guruhlari. Ion reaksiyalari va ionlarning zaryadi haqida tushuncha
Ko'rsatma
Har qanday moddaning atomi elektron qobiq va yadrodan iborat. Yadro ikki xil zarrachalardan - neytronlardan va protonlardan iborat. Neytronlarda elektr yo'q zaryad ha, elektr zaryad neytronlar nolga teng. Protonlar musbat zaryadlangan zarralardir va elektrga ega zaryad+1 ga teng. Protonlar soni ma'lum bir atomning atom raqamini tavsiflaydi.
Atomning elektron qobig'i elektron orbitallardan iborat bo'lib, ular turli xil elektronlarni o'z ichiga oladi. Elektron - manfiy zaryadlangan elementar zarracha. Uning elektr zaryad-1 ga teng.
Atomlar molekulalar bilan aloqalar orqali ham bog'lanishi mumkin.
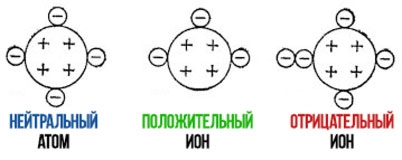
Neytral atomda protonlar soni elektronlar soniga teng. Shuning uchun u zaryad nolga teng.
Aniqlash uchun zaryad va u, uning tuzilishini, ya'ni yadrodagi protonlar sonini va elektron orbitallardagi elektronlar sonini bilish kerak.
Jami zaryad va u algebraik yig'indi natijasida olingan zaryad unga kiritilgan proton va elektronlarning s. Iondagi elektronlar soni protonlar sonidan oshib ketishi mumkin, keyin esa ion manfiy bo'ladi. Agar elektronlar soni protonlar sonidan kam bo'lsa, ion ijobiy bo'ladi.
Kimyoviy elementni bilish, davriy jadvaldan foydalanib, uning atom raqamini aniqlashimiz mumkin, bu element atomining yadrosidagi protonlar soniga teng (masalan, natriy uchun 11). Agar elektronlardan biri natriy atomini tark etgan bo'lsa, natriy atomida endi 11 emas, balki 10 ta elektron bo'ladi. Natriy atomi bilan musbat zaryadlangan ionga aylanadi zaryad ohm Z = 11+(-10) = +1.
Bunday ion yuqorida plyus bilan Na belgisi bilan belgilanadi zaryad va +2 - ikkita ortiqcha va boshqalar. Shunga ko'ra, salbiy uchun va u minus belgisi ishlatiladi.
Atom kimyoviy element dan tashkil topgan yadrolari va elektron qobiq. Yadro atomning markaziy qismi bo'lib, uning deyarli barcha massasi to'plangan. Elektron qobiqdan farqli o'laroq, yadro ijobiy xususiyatga ega zaryad.
Sizga kerak bo'ladi
- Kimyoviy elementning atom raqami, Mozeley qonuni
Ko'rsatma
Atom yadrosi ikki xil zarrachalardan - proton va neytronlardan iborat. Neytronlar elektr neytral zarralar, ya'ni ularning elektr zaryad nolga teng. Protonlar musbat zaryadlangan zarralar va ularning elektridir zaryad+1.
Shunday qilib, zaryad yadrolari protonlar soniga teng. O'z navbatida, yadrodagi protonlar soni kimyoviy elementning atom raqamiga teng. Masalan, vodorodning atom raqami 1 ga teng, ya'ni vodorod yadrosi bitta protondan iborat. zaryad+1. Natriyning atom raqami 11, zaryad uning yadrolari+11 ga teng.
Alfa parchalanishida yadrolari uning atom raqami alfa zarrachaning chiqishi bilan ikkiga kamayadi ( yadrolari geliy atomi). Shunday qilib, alfa-parchalanishga uchragan yadrodagi protonlar soni ham ikkiga kamayadi.
Beta parchalanishi uchta bo'lishi mumkin har xil turlari. Beta-minus parchalanish holatida neytron elektron va antineytrino chiqarish orqali protonga aylanadi. Keyin zaryad yadrolari birga ortadi.
Beta-plyus parchalanishida proton neytron, pozitron va neytrinoga aylanadi. zaryad yadrolari birga kamayadi.
Elektron suratga olish holatida zaryad yadrolari ham bir marta kamayadi.
Zaryadlash yadrolari chastotasi bilan ham aniqlanishi mumkin spektral chiziqlar atomning xarakterli nurlanishi. Mozeli qonuniga ko'ra: sqrt(v/R) = (Z-S)/n, bu erda v - xarakterli nurlanishning spektral chastotasi, R - Ridberg doimiysi, S - skrining doimiysi, n - bosh kvant soni.
Shunday qilib Z = n*sqrt(v/r)+s.
Tegishli videolar
Manbalar:
- Yadro zaryadi qanday o'zgaradi?
oldinda laboratoriya ishi, va kimyoviy moddalarni tanib olish uchun zarur ko'nikma va qobiliyatlar ishlab chiqilmagan. Yoki bo'lishi mumkin kimyoviy laboratoriya aralashmalarning nomlari yozilgan yorliqlar tasodifan tozalangan. Kimyoviy moddalarni o'ziga xosligi tufayli to'g'ri aniqlash qobiliyati endi bitiruvdan keyin talab qilinmasligi mumkin. ta'lim muassasalari. Ammo boshqa tomondan, bu bilim yordam uchun keladigan o'z farzandingizga kerak bo'lishi mumkin. Unga nima javob berish kerak?

Sizga kerak bo'ladi
- Probirkali stend, moddalarni aniqlash uchun reagentlar, spirtli chiroq, halqali sim, indikatorlar
Ko'rsatma
Kimyoviy moddalar musbat va manfiy zaryadlangan ionlardan iborat boʻlib, umumiy elektr neytral birikma hosil qiladi. Moddaning tarkibini aniqlash uchun turli xillarga sifatli reaktsiyalarni hisobga olish kerak ionlari. Va ularni yoddan o'rganish shart emas, lekin deyarli har qanday kimyoviy birikmani aniqlashingiz mumkin bo'lgan bunday reagentlar mavjudligini bilish kifoya.
Kislotalar. Barcha kislotalarning umumiy tomoni shundaki, ular tarkibida vodorod ioni mavjud. Uning mavjudligi kislotali xususiyatlarni belgilaydi. Ko'rsatkichlarni ushbu moddalar guruhiga sifatli reaktsiya deb hisoblash mumkin, ya'ni kislotali muhitda lakmus qizil rangga, metil apelsin esa pushti rangga aylanadi.
asoslar. Ushbu guruhning moddalari indikator yordamida ham aniqlanishi mumkin. Xarakterli reaktsiya fenolftalein tomonidan beriladi, u ishqoriy muhitda qip-qizil rangga aylanadi. Bu gidroksid ionlarining mavjudligi bilan bog'liq.
Metalllar. Aniqlash uchun ionlari metallar, buning uchun siz spirtli chiroq yoki burnerdan foydalanishingiz kerak. Mis simni oling, bir uchida 6-10 mm diametrli pastadir hosil qiling va uni olovga keltiring. Deyarli darhol uning go'zal yashil rangga ega bo'lganini ko'rasiz. Bu faqat mis ionlari tufayli sodir bo'ladi. Agar sim birinchi navbatda mis tuzlariga (mis xlorid, mis nitrat, mis sulfat) botirilsa va keyin olovga keltirilsa, xuddi shunday natija kuzatiladi.
Ionlarning mavjudligini aniqlash ishqoriy metallar(natriy va kaliy) va gidroksidi tuproq (kaltsiy va bariy), shuningdek, ruh chiroqining alangasiga tegishli tuz eritmalarini qo'shishingiz kerak. Natriy ionlari olovni yorqin sariq rangga aylantiradi, ionlari kaltsiy - g'isht qizil. Moddalarning bir qismi bo'lgan bariy ionlari sariq-yashil rang beradi va ionlari kaliy - binafsha rang.
Kislota qoldiqlarining ionlarini aniqlash uchun bir qator mavjud sifatli reaktsiyalar. Sulfat ionini reaktiv xlor ionini tanlash orqali aniqlash mumkin, bu oq cho'kma hosil qiladi. Probirkada karbonat ioni borligini bilish uchun har qanday suyultirilgan kislotani oling va oxirida siz ko'pikni ko'rasiz. Bundan tashqari, loyqalikni kuzatgan holda, hosil bo'lgan karbonat angidridni ohak suvidan o'tkazing.
Biz allaqachon qisqacha ko'rib chiqdik, bunda atomlarning elektron manfiyligidagi (0,4-2,0) bir oz farq tufayli elektron juftligi ular o'rtasida teng taqsimlanmagan. Unutganlar uchun shuni eslataman elektromanfiylik atomlarning elektronlarni o'ziga jalb qilish qobiliyatidir.

Biroq, agar elektron manfiylik jadvaliga ko'ra atomlarning elektron manfiyligi 2 dan ortiq farq qilsa, elektron juftlik to'liq elektron manfiy atomga o'tadi va natijada, ionli kimyoviy bog'lanish. Ionli kimyoviy bog'lanish faqat tipik metallarning atomlari (chunki ular tashqi elektronlarini oson yo'qotadi) va metall bo'lmaganlar (chunki ular yuqori elektronegativlikka ega) o'rtasida hosil bo'ladi.

musbat va manfiy ionlar
Ionli kimyoviy bog'lanishning yaxshi namunasi - har bir oshxonada mavjud bo'lgan oddiy osh tuzi NaCl. Natriy atomlari (va umuman barcha metallar) tashqi elektronlarni zaif ushlab turadi, xlor atomlari esa, aksincha, elektronlarni o'zlariga jalb qilish qobiliyatiga ega, ya'ni ular yuqori elektronegativlikka ega.
Shuning uchun NaCl molekulasining hosil bo'lishi jarayonida har bir Na atomi bitta elektronni (e -) yo'qotadi va ijobiy ion natriy Na + va har bir Cl atomi, aksincha, bu yo'qolgan natriy elektronini oladi va hosil bo'ladi. manfiy ion xlor Cl -. Bu ikki reaktsiya sifatida yoziladi:
- Na → Na + + e - va ½Cl 2 + e - → Cl -
½Cl 2 ni yozish kerak edi, chunki tabiatdagi gazsimon xlor erkin emas, balki ikki atomli molekulalardan iborat. yagona atomlar xlor.
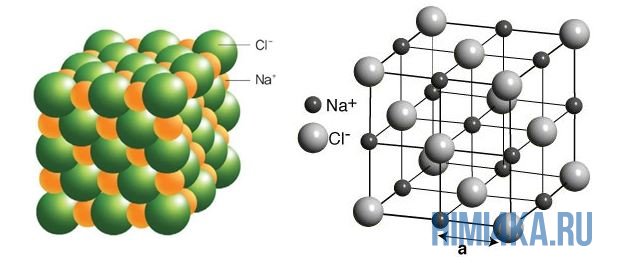
Yuqoridagi rasmda NaCl ning kristall panjarasi ko'rsatilgan, bu erda har bir xlorid ioni Cl - har tomondan qo'shni musbat natriy ionlari Na + bilan o'ralgan; natriy ionlari Na + ham eng yaqin xlorid ionlari Cl bilan o'ralgan - xuddi shu tarzda. Ionlarning bunday joylashuvi juda barqaror.
Musbat zaryadlangan ionlar deyiladi kationlar. Bular asosan metallardir, chunki ular birdan uchtagacha elektronni osongina beradi. Quyida kationlarga misollar keltirilgan:

Anionlar metall bo'lmaganlar, chunki ular mamnuniyat bilan elektronlarni o'zlariga biriktirib, manfiy zaryadlangan ionlarga aylanadi. Anion misollari:

Mg 2+ yoki F 2- kabi oddiy, bir atomli ionning zaryadi uning oksidlanish darajasi deb ataladi. Oksidlanish holati- bu ionga qo'shilishi (qaytarilishi) yoki undan neytral atomga aylanishi uchun undan olib tashlanishi (oksidlanishi) kerak bo'lgan elektronlar soni.
- Qayta tiklash reaktsiyasi: Mg 2+ + 2e - → Mg
- Oksidlanish reaksiyasi: F 2- → F + 2e -
Elektronlarni atomga biriktirish yoki ularni oddiy atomga siljitish jarayoni deyiladi tiklanish reaktsiyasi, va atomdan elektronlarni tortib olish yoki ularni to'liq olib tashlash deyiladi oksidlanish reaktsiyasi. Mana oddiy ionlarning oksidlanish darajalari ko'rsatilgan ajoyib varaq:

12-misol.
Xlor ioni hosil bo'lganda xlor oksidlanadimi yoki qaytariladimi? Ushbu ionning oksidlanish darajasi qanday?
Yechim: Xlor kamayadi, chunki xlor ionini hosil qilish uchun har bir xlor atomiga bitta elektron biriktirilishi kerak. Xlorid ioni Cl - ning oksidlanish darajasi -1 ga teng.
13-misol
Metallar ion hosil qilganda oksidlanadimi yoki qaytariladimi? Alyuminiy ionining oksidlanish darajasi qanday?
Yechim: Metall ionlari hosil bo'lganda, ikkinchisi oksidlanadi, chunki bu holda elektronlar metall atomlaridan chiqariladi. Alyuminiy ioni Al 3+ oksidlanish darajasi +3 ga teng.
Kimyoviy elementlarning valentligi
Valentlik ma'lum bir atom molekuladagi boshqa atomlar bilan hosil qiladigan kimyoviy bog'lanishlar soni deb ataladi. Biroq, gapiradigan bo'lsak oddiy so'zlar bilan aytganda, keyin valentlik bir xil oksidlanish darajasi deb tushuniladi, lekin undan farqli o'laroq, valentlik belgisi yo'q va nolga teng emas.
Ionlarning nomi
Turli (o'zgaruvchan) oksidlanish darajasiga ega bo'lgan metall ionlari quyidagicha yoziladi:
- Fe 2+ temir (II) yoki temir ioni
- Fe 3+ temir (III) yoki temir ioni
- Cu + mis (I) yoki bir valentli mis ioni
- Cu 2+ mis (II) yoki ikki valentli mis ioni
- Sn 2+ qalay(II) yoki ikki valentli qalay
- Sn 4+ qalay (IV) yoki tetravalent qalay ioni
2-misol: Temir ioni temir ioniga aylantirilganda oksidlanish yoki qaytarilish sodir bo'ladi? Ushbu jarayon uchun tenglamani yozing.
Yechim: Reaktsiya tenglamasi quyidagi ko'rinishga ega: Fe 3+ + e - → Fe 2+. Bu qaytarilish jarayonidir, chunki elektron asl ionga biriktirilgan.
Umid qilamanki, 6-dars "" siz uchun tushunarli va foydali bo'ldi. Agar sizda biron bir savol bo'lsa, ularni sharhlarda yozing. Agar savollar bo'lmasa, 7-darsga o'ting "".
Mavzu bo'yicha ma'lumot beruvchi video
"Ion" atamasi birinchi marta 1834 yilda Maykl Faraday tomonidan kiritilgan. Elektr tokining tuzlar, ishqorlar va kislotalar eritmalariga ta'sirini o'rganib, ularda ma'lum zaryadga ega bo'lgan zarralar bor degan xulosaga keldi. Faraday elektr maydonida harakatlanadigan kationlarni manfiy zaryadga ega bo'lgan katodga ionlar deb atadi. Anionlar manfiy zaryadlangan elementar bo'lmagan ion zarralari bo'lib, ular elektr maydonida ortiqcha - anod tomon harakatlanadi.
Ushbu atama bugungi kunda ham qo'llaniladi va zarralar qo'shimcha o'rganiladi, bu bizga kimyoviy reaktsiyani elektrostatik o'zaro ta'sir natijasida ko'rib chiqishga imkon beradi. Ko'pgina reaktsiyalar ushbu printsip bo'yicha davom etadi, bu ularning borishini tushunish va ularning borishini tezlashtirish va sintezni inhibe qilish uchun katalizatorlar va inhibitorlarni tanlash imkonini berdi. Ko'pgina moddalar, ayniqsa eritmalarda doimo ionlar shaklida bo'lishi ham ma'lum bo'ldi.
Ionlarning nomenklaturasi va tasnifi
Ionlar zaryadlangan atomlar yoki atomlar guruhidir, ular jarayonida kimyoviy reaksiya yo'qolgan yoki olingan elektronlar. Ular atomning tashqi qatlamlarini tashkil qiladi va yadroning past tortishish kuchi tufayli yo'qolishi mumkin. Keyin elektronning ajralishi natijasi musbat ion bo'ladi. Bundan tashqari, agar atom kuchli yadro zaryadiga va tor elektron qobig'iga ega bo'lsa, yadro qo'shimcha elektronlarni qabul qiluvchi hisoblanadi. Natijada manfiy ion zarracha hosil bo'ladi.
Ionlarning o'zi nafaqat ortiqcha yoki etarli bo'lmagan atomlardir elektron qobiq. Bu atomlar guruhi ham bo'lishi mumkin. Tabiatda ko'pincha eritmalarda, organizmlarning biologik suyuqliklarida va organizmlarda mavjud bo'lgan guruh ionlari mavjud. dengiz suvi. Ionlarning juda ko'p turlari mavjud, ularning nomlari juda an'anaviy. Kationlar musbat zaryadlangan ionlar, manfiy zaryadlangan ionlar esa anionlardir. Tarkibiga qarab, ular boshqacha nomlanadi. Masalan, natriy kationi, seziy kationi va boshqalar. Anionlar boshqacha nomlanadi, chunki ular ko'pincha ko'p atomlardan iborat: sulfat anioni, ortofosfat anioni va boshqalar.
Ion hosil bo'lish mexanizmi
Murakkablardagi kimyoviy elementlar kamdan-kam elektr neytral bo'ladi. Ya'ni, ular deyarli hech qachon atom holatida bo'lmaydi. Eng keng tarqalgan hisoblangan kovalent bog'lanish hosil bo'lishida atomlar ham ma'lum bir zaryadga ega bo'lib, elektron zichligi molekula ichidagi bog'lar bo'ylab siljiydi. Biroq, bu erda ionning zaryadi hosil bo'lmaydi, chunki energiya kovalent bog'lanish ionlanish energiyasidan kamroq. Shuning uchun, har xil elektromanfiylikka qaramay, ba'zi atomlar boshqalarning tashqi qatlamining elektronlarini to'liq o'ziga tortolmaydi.
Atomlar orasidagi elektromanfiylik farqi etarlicha katta bo'lgan ion reaktsiyalarida bir atom tashqi qatlamdan boshqa atomdan elektron olishi mumkin. Keyin yaratilgan aloqa kuchli polarizatsiya qilinadi va buziladi. Bunga sarflangan, ionning zaryadini hosil qiluvchi energiya ionlanish energiyasi deb ataladi. Har bir atom uchun u boshqacha va standart jadvallarda ko'rsatilgan.

Ionizatsiya faqat atom yoki atomlar guruhi elektronlarni berishga yoki ularni qabul qilishga qodir bo'lganda mumkin. Bu ko'pincha eritma va tuz kristallarida kuzatiladi. Kristal panjarada kinetik energiyadan mahrum bo'lgan deyarli harakatsiz zaryadlangan zarrachalar ham mavjud. Va kristallda harakatlanish imkoniyati yo'qligi sababli, ionlarning reaktsiyasi ko'pincha eritmalarda davom etadi.
Fizika va kimyoda ionlar
Fiziklar va kimyogarlar bir necha sabablarga ko'ra ionlarni faol o'rganishmoqda. Birinchidan, bu zarralar materiyaning barcha ma'lum agregat holatlarida mavjud. Ikkinchidan, elektronlarning atomdan ajralib chiqish energiyasini amaliy faoliyatda foydalanish uchun o'lchash mumkin. Uchinchidan, ionlar kristallar va eritmalarda turlicha harakat qiladi. To'rtinchidan, ionlar o'tkazish imkonini beradi elektr toki, va eritmalarning fizik-kimyoviy xossalari ionlar konsentratsiyasiga qarab o'zgaradi.
Eritmadagi ion reaksiyalari
Eritmalar va kristallarning o'zlari batafsilroq ko'rib chiqilishi kerak. Tuz kristallarida alohida joylashgan ijobiy ionlar, masalan, natriy kationlari va salbiy, xlor anionlari. Kristalning tuzilishi hayratlanarli: elektrostatik tortishish va itarilish kuchlari tufayli ionlar maxsus tarzda yo'naltirilgan. Natriy xlorid holatida ular olmos kristalli panjarasini hosil qiladi. Bu erda har bir natriy kationi 6 ta xlorid anioni bilan o'ralgan. O'z navbatida, har bir xlorid anioni 6 xlorid anionini o'rab oladi. Shu sababli, oddiy stol tuzi ham sovuqda, ham issiq suv deyarli bir xil tezlikda eriydi.

Eritmada natriy xloridning butun molekulasi ham mavjud emas. Ionlarning har biri suv dipollari bilan o'ralgan va qalinligida tasodifiy harakatlanadi. Zaryadlar va elektrostatik o'zaro ta'sirlarning mavjudligi sho'r suv eritmalarining noldan bir oz pastroq haroratda muzlashiga va 100 darajadan yuqori haroratda qaynashiga olib keladi. Bundan tashqari, agar eritmada boshqa moddalar mavjud bo'lsa, ular kirishi mumkin kimyoviy bog'lanish, keyin reaksiya molekulalarning emas, balki ionlarning ishtirokida davom etadi. Bu kimyoviy reaktsiyaning bosqichlari haqidagi ta'limotni yaratdi.
Oxirida olingan mahsulotlar o'zaro ta'sir paytida darhol hosil bo'lmaydi, lekin oraliq mahsulotlardan asta-sekin sintezlanadi. Ionlarni o'rganish reaktsiya elektrostatik o'zaro ta'sirlar tamoyillariga muvofiq aniq borishini tushunishga imkon berdi. Ularning natijasi elektrostatik ravishda boshqa ionlar bilan o'zaro ta'sir qiluvchi ionlarning sintezi bo'lib, yakuniy muvozanat reaktsiyasi mahsulotini yaratadi.
Xulosa
Ion kabi zarracha elektronlarni yo'qotish yoki olish jarayonida olinadigan elektr zaryadlangan atom yoki atomlar guruhidir. Eng oddiy ion vodoroddir: agar u bitta elektronni yo'qotsa, u faqat +1 zaryadli yadrodir. Bu biologik tizimlar va organizmlarning ishlashi uchun muhim bo'lgan eritmalar va muhitlarning kislotali muhitini keltirib chiqaradi.
Ionlar ham ijobiy, ham bo'lishi mumkin manfiy zaryadlar. Shu sababli, eritmalarda har bir zarracha suv dipollari bilan elektrostatik o'zaro ta'sirga kiradi, bu ham hujayralar tomonidan hayot va signal uzatish uchun sharoit yaratadi. Bundan tashqari, ion texnologiyalari yanada rivojlanmoqda. Masalan, ionli dvigatellar yaratildi, ular allaqachon 7 ta NASA kosmik missiyasi bilan jihozlangan.






