Šta znači g mol. Mol je jedinica za količinu supstance. Molarna masa
Čas hemije u 8. razredu na temu „Količina supstance. moljac"
Ciljevi lekcije:
- upoznati učenike sa novom fizičkom veličinom - količinom supstance, sa njenom mjernom jedinicom - molom; naučite koristiti količinu materije i mola.
Dajte pojam molarne mase, nastavite sa formiranjem pojma količine tvari, sposobnost korištenja ove vrijednosti, obogatite sadržaj hemijska formula.
Zadaci:
Formirati tokom lekcije pojmove "količina supstance", "Avogadrov broj".
Formirati sposobnost rješavanja problema koristeći koncepte "količina tvari", "Avogadro broj".
Nastaviti razvijati eksperimentalne vještine u radu sa supstancama, sposobnost promatranja, analiziranja, izvođenja zaključaka, isticanja potrebnih informacija.
Planirani rezultat:
Učenici znaju pojmove "količina supstance", "Avogadro broj", mogu rješavati računske probleme koristeći ove pojmove
Vrsta lekcije: kombinovana IKT - lekcija korištenjem interaktivnih nastavnih metoda.
Plan lekcije.
I pozornici. Organiziranje vremena
Pozdrav, stvaranje pozitivnog emocionalnog raspoloženja.
Provjeravanje učenika za čas.
Dobar dan momci!(oznaka nedostaje)
Drago mi je sto te vidim. Vidim pametna, ljubazna lica ispred sebe. Da bih shvatio kako ćemo danas raditi, želim da znam u kakvom ste raspoloženju. Ako si dobro raspoložen, nasmiješi mi se. Pogledajte jedni druge, nasmijte se!
Siguran sam da će nam današnji čas donijeti zadovoljstvo i biti plodonosan, a vaše raspoloženje se neće pogoršati do kraja časa.
II pozornici. Ažuriranje potrebnih znanja i vještina, uključujući verifikaciju zadaća(slajd 2)
Gdje se u periodnom sistemu nalaze elementi koji odgovaraju jednostavne supstance metali?
Gdje se nemetali nalaze u periodnom sistemu?
Šta su generali fizička svojstva metali?
Šta je alotropija?
Navedite primjere alotropije?
Dopuni rečenice: (slajd 3)
Poznato 22 nemetalni
Kristali joda ljubičasta boje
tečni nemetalni brom
Ugljični oblici dijamant i grafit
Nakon grmljavine u zraku se formira ozona
Iz rečenica ispod napišite brojeve koji odgovaraju metalima u jednu kolonu, a brojeve koji odgovaraju nemetalima u drugu kolonu. (slajd 4)
1. Agregatno stanje: čvrsto.
2. Imaju metalni sjaj.
3.Nemaju metalni sjaj.
5. Električno provodljiv.
6. Gasni.
7. U čvrstom stanju - krt.
8.Plastic.
9. Ne provodite toplotu.
Metali
1,2,4,5,8
nemetali
1,3, 6,7, 9
(slajd 5) Procijenite svoje stanje prije nove teme.
III pozornici. Objašnjenje novog materijala. (slajd 6)
Ljepilo se prosulo - riječi su se spojile. Odvojite riječi jednu od druge crticama.
šećer|mol|voda|količina|jedna|supstanca|
Nastavnik saopštava ciljeve i zadatke časa.
Snimanje teme lekcije (slajd 7)
Nastavnik podsjeća učenike da je hemija nauka o supstancama i njihovim transformacijama. Za dobijanje određene količine proizvoda (in hemijska laboratorija ili u fabrici) potrebno je uzeti strogo definisano količina početni supstance.
Hemičari su, provodeći eksperimente, primijetili da sastav proizvoda nekih reakcija ovisi o omjerima u kojima su reaktanti uzeti.
(slajd 8) Na primjer, ako se ugljen sagorijeva u višku kisika, proizvodi se ugljični dioksid:
C + O 2 →CO 2
A ako uzmete 2 puta manje, dobijate ugljen monoksid:
C + 0,5O 2 → CO 2
U prvom slučaju je 1 molekul kisika reagirao s 1 atomom ugljika, au drugom slučaju jedan molekul kisika reagirao je s dva atoma ugljika.
Postavlja se pitanje: kako izmjeriti određeni broj atoma ili molekula?
Lako je izmjeriti masu tvari (uz pomoć vage) ili zapreminu plina ili tekućine (uz pomoć mjernog pribora). Tako da ti treba fizička količina, koji vam omogućava da pretvorite broj atoma ili molekula u masu ili zapreminu.
Izvršimo jednostavne proračune: masa najlakšeg atoma - vodika je 1,66 10 -24 g, ova masa se uzima kao jedinica relativne atomske mase: Ar(H) = 1. Pretpostavimo sada da imamo 1 g atoma vodika. Koliko će atoma biti u ovoj masi? Da biste izračunali, morate podijeliti masu dijela vodonika s masom 1 atoma vodika: 1 g: 1,66 11 -24 g ≈ 6,02 10 23 atoma.
U masi (u gramima) bilo kojeg elementa, numerički jednaka relativnom atomska masa, će sadržavati isti broj atoma tog elementa.
Masa (u gramima) bilo koje supstance, numerički jednaka njenoj relativnoj molekulskoj težini, sadržaće isti broj molekula. Ovo je konstantna vrijednost, zove se Avogadrov broj, označen sa N A.
(slajd 9)
(slajd 10)Koje asocijacije izaziva crtež? (mol). Jedinica za mjerenje količine tvari zvala se " krtica"
Količina tvari koja sadrži 6,02 10 23 strukturne jedinice tvari naziva se molem .(slajd 11)
Na osnovu razmatranih primjera nastavnik dodaje da se u molovima mjeri i broj ostalih čestica: atoma, jona, elektrona itd.
(slajd 12/1)1 mol bilo koje supstance u bilo kojoj stanje agregacije sadrži N A = 6∙10 23 njegovih molekula.
krtica - jedinica količina supstance .
Količina supstance je fizička veličina uvedena da poveže broj strukturnih jedinica supstance i njenu masu ili zapreminu.
(slajd 12/2) Količina supstance je označena n(en) ili (nu) (zastarjelo), mjereno u molovima.
n[mol]
(slajd 13)Opšti slajd količine supstance.
(slajd 14-15) 1 mol bilo koje supstance ima masu brojčano jednaku relativnoj molekulskoj masi, ali ima jedinicu g/mol
Ova masa se zove molar , označeno sa M.
Mr = M [g/mol]
Kako možete vidjeti 1 mol tvari?
Uzmite supenu kašiku, napunite je vodom i sipajte u čašu. To će biti otprilike 1 mol vode. Sipajte još jednu kašiku vode u čašu. Sada u čaši ima 2 mola ove supstance. Dodamo još jednu kašiku. Količina vode će postati jednaka 3 mol.
(slajd 16)Pokažite razredu neke supstance u količini od 1 mol: 56 g željeznog praha ( Fe ), 58 g soli ( NaCl ), 342 g šećera ( C 12 H 22 O 11 )
(slajd 17-18)Određivanje molarne mase određenih supstanci
(slajd 19) Količina supstance i masa povezani su sledećim odnosom:
m = n M
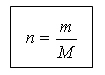
Količina supstance i broj strukturnih jedinica N povezani su sljedećom relacijom:
N = N A n
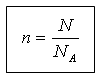
- Dakle, kako izračunati broj čestica sadržanih u tri mola vode? (slajd 20)
Potrebno je pomnožiti količinu uzete supstance (u ovom slučaju vode) sa Avogadrovom konstantom:
N(H 2 O) = 3 mol 6 10 23 molekula \u003d 18 10 23
(slajd 22) Procijenite svoje stanje na lekciji
IV pozornici. Konsolidacija. Rješavanje problema.
Pronađite masu 10 molova dušika? (slajd 23)
Rješenje:
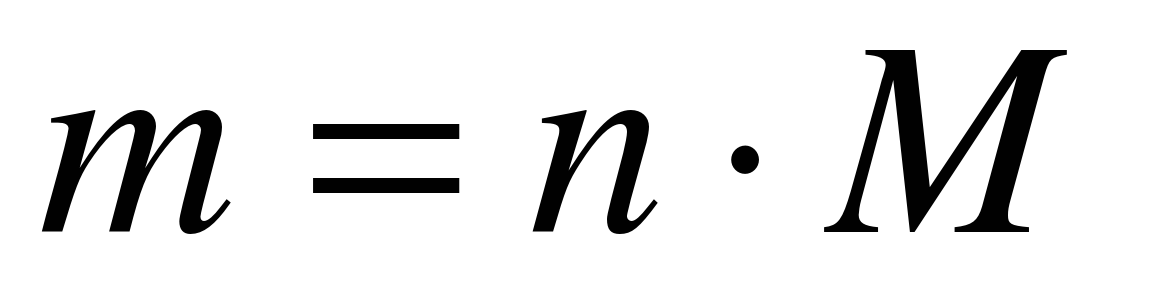
M (N 2) \u003d 28 g / mol
m (N 2) \u003d 10 mol * 28 g / mol
Odgovor: m (N 2) \u003d 280 g
Dato:
n (N 2) \u003d 10 mol
Nađi:
m (N 2) - ?
(slajd 24)V pozornici.Zadaća
§15, pr. 1-3
Odgovori na pitanje:
Koliko se molekula šećera nalazi u komadu rafiniranog šećera znajući da je masa jednog komada 1,3 g?
Mol, molarna masa
AT hemijski procesi uključene su najmanje čestice - molekule, atomi, joni, elektroni. Broj takvih čestica, čak i u malom dijelu materije, vrlo je velik. Stoga, da bi se izbjegle matematičke operacije sa veliki brojevi, da bi se okarakterisala količina supstance koja je uključena hemijska reakcija, koristi se posebna jedinica - krtica.
Mol je takva količina tvari koja sadrži određeni broj čestica (molekula, atoma, iona) jednak Avogadrovoj konstanti.
Avogadrova konstanta NA definira se kao broj atoma sadržanih u 12 g izotopa 12
OD:
Dakle, 1 mol supstance sadrži 6,02 1023
čestice ove supstance.
Na osnovu toga, bilo koja količina supstance može se izraziti određenim brojem molova ν (nu). Na primjer, uzorak tvari sadrži 12,04 1023
molekule. Dakle, količina supstance u ovom uzorku je:
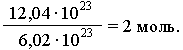
Uglavnom:
gdje je N broj čestica date supstance;
N / A- broj čestica koji sadrži 1 mol supstance (Avogadrova konstanta).
Molarna masa supstance (M)
je masa koju ima 1 mol date supstance.
Ova vrijednost, jednaka omjeru mase m tvari prema količini tvari ν, ima dimenziju kg/mol ili g/mol. Molarna masa, izražena u g/mol, numerički je jednaka relativnoj molekulskoj masi Mr (za supstance atomska struktura je relativna atomska masa Ar).
Na primjer, molarna masa metana CH 4
definira se kako slijedi:
g.(CH 4
) = Ar(C) + 4 Ar(H) = 12+4 =16
M(CH 4 )=16 g/mol, tj. 16 g CH4 sadrže 6,02 1023 molekule.
Molarna masa supstance može se izračunati ako su poznata njena masa m i količina (broj molova) ν, koristeći formulu:
Prema tome, znajući masu i molarnu masu supstance, možemo izračunati broj njenih molova:
ili pronađite masu tvari prema broju molova i molarnoj masi:
m = νM
Treba napomenuti da je vrijednost molarne mase tvari određena njenim kvalitativnim i kvantitativnim sastavom, tj. zavisi od gospodina i Ara. Dakle, različite supstance sa istim brojem molova imaju razne mase m.

Primjer
Izračunajte mase metana CH4
i etan C2
H6
uzeti u količini od ν = 2 mola svaki.
Rješenje
Molarna masa metana M(CH 4
) je jednako 16 g/mol;
molarna masa etana M(C2
H6
) = 2 12+6=30 g/mol.
Odavde:
M(CH 4
) = 2 mol 16 g/mol = 32 g;
m(C2
H6
) \u003d 2 mol 30 g / mol \u003d 60 g.
Dakle, mol je dio tvari koji sadrži isti broj čestica, ali ima različitu masu za različite tvari, jer čestice materije (atomi i molekuli) nisu iste mase.
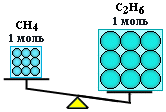
n(CH4 ) = n(S2 H6 ), ali m(CH4 ) < m(С 2 H6 )
Proračun ν se koristi u gotovo svakom računskom problemu.






