Kimyoda radius. Umumiy kimyo fanidan ma'ruza matnlari
Atom radiuslarini aniqlash ham ba'zi muammolarni o'z ichiga oladi. Birinchidan, atom qat'iy belgilangan sirt va radiusga ega bo'lgan shar emas. Eslatib o'tamiz, atom elektronlar buluti bilan o'ralgan yadrodir. Yadrodan masofada elektronni aniqlash ehtimoli asta-sekin ma'lum bir maksimal darajaga ko'tariladi va keyin asta-sekin kamayadi, lekin faqat cheksiz vaqt davomida nolga teng bo'ladi. uzoq masofa. Ikkinchidan, agar biz hali ham radiusni aniqlash uchun biron bir shartni tanlasak, bunday radiusni hali ham eksperimental o'lchash mumkin emas.
Tajriba faqat yadrolararo masofalarni, boshqacha aytganda, bog'lanish uzunliklarini aniqlash imkonini beradi (va shunga qaramay, 2.21-rasmdagi sarlavhada berilgan ma'lum shartlar bilan). Ularni aniqlash uchun rentgen nurlari difraksion tahlili yoki elektron diffraktsiya usuli (elektron difraksiyasiga asoslangan) qo'llaniladi. Atomning radiusi bir xil atomlar orasidagi eng kichik yadrolararo masofaning yarmiga teng deb hisoblanadi.
Van der Waals radiusi. Bog'lanmagan atomlar uchun yadrolararo eng kichik masofaning yarmi van der Vaals radiusi deb ataladi. Ushbu ta'rif rasmda ko'rsatilgan. 2.22.
Guruch. 2.21. Ulanish uzunligi. Molekulalar doimo tebranayotganligi sababli, yadrolararo masofa yoki bog'lanish uzunligi o'zgarmas qiymatga ega emas. Bu rasmda oddiy ikki atomli molekulaning chiziqli tebranishi sxematik tarzda tasvirlangan. Tebranishlar bog'lanish uzunligini ikkita bog'langan atom markazlari orasidagi masofa sifatida aniqlashni imkonsiz qiladi. Aniqroq ta'rif quyidagicha ko'rinadi: bog'lanish uzunligi bog'langan atomlar orasidagi masofa bo'lib, ikki atomning massa markazlari o'rtasida o'lchanadi va minimal bog'lanish energiyasiga mos keladi. Minimal energiya Morse egri chizig'ida ko'rsatilgan (2.1-rasmga qarang).
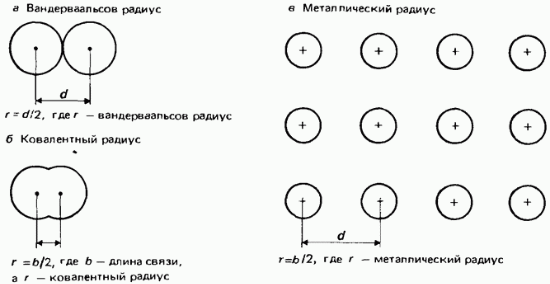
Guruch. 2.22. Atom radiuslari, a - van der Vaals radiusi; b - kovalent radius; c - metall radiusi.
kovalent radiuslar. Kovalent radius ikkita bir xil atomlar orasidagi yadrolararo masofaning yarmi (bog' uzunligi) sifatida aniqlanadi, bog'langan do'st boshqa kovalent aloqa bilan (2.22-rasm, b). Misol tariqasida bog'lanish uzunligi 0,1988 nm bo'lgan xlor molekulasini olaylik. Xlorning kovalent radiusi 0,0944 nm deb hisoblanadi.
Bir element atomining kovalent radiusini bilgan holda, boshqa element atomining kovalent radiusini hisoblash mumkin. Masalan, bog'lanish uzunligining eksperimental o'rnatilgan qiymati 0,1767 nm. Bu qiymatdan xlorning kovalent radiusini (0,0994 nm) ayirib, uglerodning kovalent radiusi 0,0773 nm ekanligini aniqlaymiz. Ushbu hisoblash usuli qo'shimchalar printsipiga asoslanadi, unga ko'ra atom radiuslari oddiy qo'shish qonuniga bo'ysunadi. Shunday qilib, bog'lanish uzunligi uglerod va xlorning kovalent radiuslarining yig'indisidir. Qo'shimchalar printsipi faqat oddiy kovalent bog'lanishlarga tegishli. Ikki va uch kovalent bog'lanish qisqaroq (2.7-jadval).
Oddiy kovalent bog'lanishning uzunligi uning molekuladagi muhitiga ham bog'liq. Masalan, bog'lanish uzunligi uch almashtirilgan uglerod atomida 0,1070 nm dan birikmada 0,115 nm gacha o'zgarib turadi.
metall radiuslari. Metall radiusi metall kristall panjarasidagi qo'shni ionlar orasidagi yadrolararo masofaning yarmiga teng deb qabul qilinadi (2.22-rasm, v). Atom radiusi atamasi odatda metall bo'lmagan elementlar atomlarining kovalent radiusini anglatadi, metall radius atamasi esa metall elementlarning atomlarini anglatadi.
Ion radiuslari. Ion radiusi - kristalli ionli birikma (tuz)dagi qo'shni monotomik (oddiy) ionlar orasidagi yadrolararo masofaning ikki qismidan biri. Ion radiusini aniqlash ham katta muammolar bilan bog'liq, chunki ion radiuslarining o'zi emas, balki ionlararo masofalar eksperimental tarzda o'lchanadi. Interionlar orasidagi masofalar kristall panjaradagi ionlarning to'planishiga bog'liq. Shaklda. 2.23 kristall panjarada ionlarni o'rashning uchta mumkin bo'lgan usulini ko'rsatadi. Afsuski, eksperimental ravishda o'lchangan interion masofalari
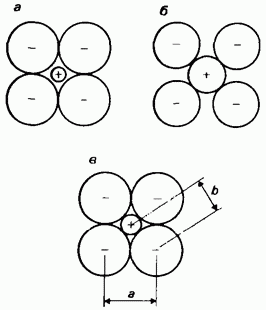
Guruch. 2.23. Ion radiuslari, a - anionlar bir-biri bilan aloqada, ammo kationlar anionlar bilan aloqa qilmaydi; b - kationlar anionlar bilan aloqada, lekin anionlar bir-biri bilan aloqada emas; c - ionlarning shartli ravishda qabul qilingan joylashuvi, bunda kationlar anionlar bilan, anionlar esa bir-biri bilan aloqada bo'ladi. A masofasi eksperimental tarzda aniqlanadi. Anionning ikki barobar radiusi sifatida qabul qilinadi. Bu anion va kation radiuslarining yig'indisi bo'lgan b interion masofasini hisoblash imkonini beradi. Interion masofasi b ni bilib, kation radiusini hisoblash mumkin.
qadoqlashning ushbu uchta usulidan qaysi biri har bir holatda aslida amalga oshirilganligini hukm qilishimizga imkon bermang. Muammo shundaki, ionlararo masofani ikki ionning radiusiga mos keladigan ikki qismga bo'lish kerak bo'lgan nisbatni topish, boshqacha aytganda, bir ionning qayerda tugashini va ikkinchisi qaerdan boshlanishini aniqlash. Ko'rsatilgandek, masalan, rasmda. 2.12, tuzlarning elektron zichligi xaritalari ham bu masalani hal qilishga imkon bermaydi. Bu qiyinchilikni yengish uchun odatda quyidagilar qabul qilinadi: 1) ionlararo masofa ikki ion radiusining yig’indisi, 2) ionlar sharsimon, 3) qo’shni sharlar bir-biri bilan aloqada. Oxirgi taxmin rasmda ko'rsatilgan ionlarni qadoqlash usuliga mos keladi. 2.23, c. Agar bitta ion radiusi ma'lum bo'lsa, boshqa ion radiuslarini qo'shimchalar printsipi asosida hisoblash mumkin.
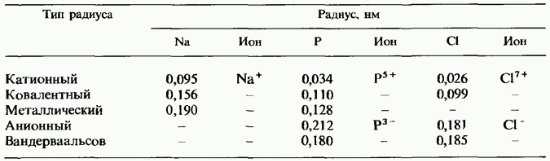
Har xil turdagi radiuslarni solishtirish. Jadvalda. 2.8 3-davrning uchta elementi uchun har xil turdagi radiuslarning qiymatlarini ko'rsatadi. Eng katta qiymatlar anion va van der Vaals radiuslariga tegishli ekanligini ko'rish oson. Shaklda. 11.9 argondan tashqari 3-davrning barcha elementlari uchun ionlar va atomlarning o'lchamlarini taqqoslaydi. Atomlarning o'lchamlari ularning kovalent radiuslari bilan belgilanadi. Shuni ta'kidlash kerakki, kationlar atomlardan kichikroq, anionlar esa katta o'lchamlar bir xil elementlarning atomlariga qaraganda. Barcha turdagi radiuslarning har bir elementi uchun eng kichik qiymat har doim katyonik radiusga tegishli.
2.8-jadval. Har xil turdagi atom radiuslarini taqqoslash
Atom va ionlarning radiuslarini aniqlash. Kristallarni o'rganish uchun rentgen nurlarini qo'llash nafaqat o'rnatishga imkon beradi ichki tuzilishi ikkinchisi, balki zarracha hajmini aniqlash uchun,kristall hosil qilish - atomlar yoki ionlar.
46-rasm. Kristaldagi kontakt zarralari
Bunday hisob-kitoblar qanday amalga oshirilganligini tushunish uchun kristallni tashkil etuvchi zarralar sharsimon va bir-biri bilan aloqada ekanligini tasavvur qiling. Bunday holda, ikkita qo'shni zarrachalarning markazlari orasidagi masofa ularning radiuslari yig'indisiga teng deb taxmin qilishimiz mumkin (46-rasm). Agar zarralar oddiy atomlar bo'lsa va ular orasidagi masofa o'lchansa, atomning radiusi ham aniqlanadi, aniqki, topilgan masofaning yarmiga teng. Masalan, metall natriy kristallari uchun panjara doimiyligini bilish d 3,84 angstromga teng, biz radius ekanligini topamiz r natriy atomiga teng.
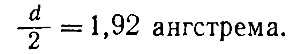
Turli ionlarning radiuslarini aniqlash biroz qiyinroq. Bu erda ionlar orasidagi masofani oddiygina ikkiga bo'lishning iloji yo'q, chunki ionlarning o'lchamlari bir xil emas. Ammo ionlardan birining radiusi bo'lsa r 1 ma'lum, ikkinchisining radiusi r 2 oddiy ayirish orqali osongina topiladi:
r2 = d - r1
Bundan kelib chiqadiki, kristall panjaralarning konstantalaridan turli ionlarning radiuslarini hisoblash uchun kamida bitta ionning radiusini bilish kerak. Keyin boshqa barcha ionlarning radiuslarini topish endi qiyinchilik tug'dirmaydi.
Optik usullar yordamida ftor ionlarining F radiuslarini aniq aniqlash mumkin edi. (1,33 A) va kislorod O - (1,32 A); bu radiuslar boshqa ionlarning radiuslarini hisoblashda boshlang'ich qiymatlar bo'lib xizmat qiladi. Shunday qilib, masalan, magniy oksidi MgO ning panjara konstantasini aniqlash uning 2,1 angstromga teng ekanligini ko'rsatdi. Bundan kislorod ionining radiusini ayirib, magniy ionining radiusini topamiz:
2,1 - 1,32 = 0,78 Å
Natriy ftoridning panjara konstantasi 2,31 Å; ftor ionining radiusi 1,33 angstrom bo'lganligi sababli, natriy ionining radiusi quyidagicha bo'lishi kerak:
2,31 -1,33 = 0,98 Å
Natriy ionining radiusini va natriy xloridning panjara konstantasini bilgan holda, xlor ionining radiusini va hokazolarni hisoblash oson.
Shu tarzda deyarli barcha atom va ionlarning radiuslari aniqlanadi.
Ushbu miqdorlarning o'lchamlari haqida umumiy tushuncha jadvalda keltirilgan ma'lumotlar bilan berilgan. 7.
Jadval 7
Ayrim elementlarning atomlari va ionlarining radiuslari
| Element | Atom radiusi | Ion radiusi | Ion belgisi |
| 1,92 | 0,98 | Na+ | |
| 2,38 | 1,33 | K+ | |
| 2,51 | 1,49 | Rb+ | |
| 2,70 | 1,65 | Cs+ | |
| 1,60 | 0,78 | Mg++ | |
| 1,97 | 1,06 | Ca++ | |
| 2,24 | 1,43 | Ba++ | |
| 0,67 | 1,33 | F- | |
| 1,07 | 1,81 | Cl- | |
| 1,19 | 1,96 | Br- | |
| 1,36 | 2,20 | J- | |
| 1,04 | 1,74 | S— |
Bu ma'lumotlardan ko'rinib turibdiki, metallarda atomlarning radiuslari ionlarning radiuslaridan, metalloidlarda, aksincha, ionlarning radiuslari atomlarning radiuslaridan kattaroqdir.
Kristallni tashkil etuvchi ionlarning nisbiy o'lchamlari fazoviy panjara tuzilishiga katta ta'sir ko'rsatadi. Shunday qilib, masalan, kimyoviy tabiatiga ko'ra ikkita juda o'xshash - CsCl va NaCl shunga qaramay, har xil turdagi panjaralarni hosil qiladi va birinchi holda har bir ijobiy ion sakkizta manfiy ion bilan, ikkinchisida esa faqat oltitasi bilan o'ralgan. Bu farq seziy ionlarining o'lchamlari bilan izohlanadi
va natriy bir xil emas. Bir qator mulohazalar bizni ionlar kristalda shunday joylashishi kerakligini qabul qilishga majbur qiladiki, har bir kichikroq ion, agar iloji bo'lsa, uni o'rab turgan katta ionlar orasidagi bo'shliqni to'liq to'ldiradi va aksincha; boshqacha aytganda, deyarli har doim ijobiy ionlardan kattaroq bo'lgan manfiy ionlar musbat ionlarni iloji boricha yaqinroq o'rab olishlari kerak, aks holda tizim beqaror bo'ladi. Cs + ionining radiusi 1,65 Å, Na + ioni esa atigi 0,98 Å bo'lgani uchun birinchisining atrofida ikkinchisiga qaraganda ko'proq Cl - ionlarini joylashtirish mumkinligi aniq.
Kristaldagi har bir musbat ionni oʻrab turgan manfiy ionlar soni berilgan panjaraning koordinatsion soni deyiladi. Turli kristallarning tuzilishini o'rganish shuni ko'rsatadiki, quyidagi koordinatsion raqamlar eng keng tarqalgan: 2, 3, 4, 6, 8 va 12.
Koordinatsion raqam radius nisbatiga bog'liq ijobiy ion manfiy ionning radiusiga: bu nisbat birlikka qanchalik yaqin bo'lsa, koordinatsiya soni shunchalik katta bo'ladi. Ionlarni eng yaqin qadoqlash usuli bo'yicha kristalda joylashgan sharlar sifatida hisobga olsak, ijobiy va manfiy ionlar radiusi o'rtasidagi u yoki bu koordinatsiya sonini qanday nisbatda olish kerakligini hisoblash mumkin.
Quyida radiuslarning berilgan nisbati uchun nazariy jihatdan eng katta koordinatsion raqamlar hisoblangan.
Ushbu jadvaldan topilgan NaCl va CsCl uchun koordinatsion raqamlar ushbu moddalar kristallaridagi ionlarning haqiqiy joylashuviga mos kelishini tekshirish oson.
Masalan, NaCl holatida natriy ioni (0,98 Å) radiusining xlor ioni radiusiga (1,81 Å) nisbati 0,98:1,81 = 0,54 ga teng. Bu nisbat 0,41-0,73 oralig'ida; shuning uchun NaCl panjarasida koordinatsion raqam olti bo'lishi kerak.
Siz "Atomlar va ionlarning radiuslarini aniqlash" mavzusidagi maqolani o'qiyapsiz
ATOM RADIUSI- molekulalar va kristallardagi atomlararo (yadrolararo) masofalarni taxminiy baholash imkonini beruvchi atomning xarakteristikasi. Atomlar aniq chegaralarga ega emasligi sababli, "A. R." tushunchasini kiritishda. 90-98% degani elektron atom bu radiusdagi sharga o'ralgan. A. r. 0,1 HM tartibiga ega, ammo ularning qiymatlaridagi kichik farqlar ham ulardan qurilgan kristallarning tuzilishini aniqlashi mumkin, molekulalarning muvozanat geometriyasiga ta'sir qiladi va hokazo. Boshqalar uchun. masalalarda molekulalardagi atomlar va kondensatsiyalangan muhitlar orasidagi eng qisqa masofalar ularning A. R. yigʻindisi sifatida koʻrib chiqilishi mumkin, ammo bunday qoʻshimchalik juda taxminiy va hamma hollarda ham qoniqtirilmaydi. Atomlar o'rtasida qanday kuchlar ta'sir qilishiga qarab (qarang. Atomlararo o'zaro ta'sir), metall, ion, kovalent va van der Waals A. p.
metall radiuslar kristalldagi atomlar orasidagi eng qisqa masofaning yarmiga teng deb hisoblanadi. metall elementning tuzilishi, ular koordinatalarga bog'liq. raqamlar Kimga. Agar siz A. p. birlik uchun K=12 da, keyin esa K=8, 6 va 4 A. p. bir xil element resp. 0,98 ga teng; 0,96; 0,88. A. p. qiymatlarining yaqinligi. turli metallar - o'zaro eruvchanlik uchun zaruriy (etarli bo'lmasa-da) shart metallar almashtirish turi. Shunday qilib, suyuq K va Li odatda aralashmaydi va ikkita suyuq qatlam hosil qiladi va Rb va Cs bilan K doimiy qattiq eritmalar seriyasini hosil qiladi (A. R. Li, K, Pb va Cs 0,155; 0,236; 0,248; 0,268 HM ga teng). . Qo'shimchalar A. r. kristallning parametrlarini taxminan taxmin qilish imkonini beradi. intermetalik panjaralar. ulanishlar.
Ion radiuslari ion kristallaridagi yadrolararo masofalarni taxminiy baholash uchun ishlatiladi. Eng yaqin kation va anion orasidagi masofa ularning ion radiuslari yig'indisiga teng deb faraz qilinadi. A.R.ning koʻrsatilgan qoʻshimchasini bajarish aniqligi quyida keltirilgan gidroksidi metall galogenid kristallaridagi eng qisqa yadrolararo masofalar asosida baholanishi mumkin:
Farqi A. r. KF va NaF da yadrolararo masofalarni solishtirish natijasida olingan ionlar 0,035 nm (NaF dagi KF kristallaridagi A. R. ionlari bir xil deb hisoblanadi), KCl va NaCl birikmalari uchun esa 0,033 HM, KBr va NaBr birikmalaridan 0,031 ni tashkil qiladi. HM va KI va NaI birikmalaridan - 0,030 HM. T. o., ion kristallaridagi yadrolararo masofalarni A. R. ~ 0,001 nm bilan aniqlashdagi tipik xato.
Bir nechta bor ionli A. p. tizimlari, A. p. qiymatlari bilan farqlanadi. individual ionlar, lekin taxminan bir xil yadrolararo masofalarga olib keladi. Birinchi marta ion A. p ni aniqlash ustida ish olib borildi. 20-yillarda amalga oshirilgan. 20-asr V. M. Goldshmidt (V. M. Goldshmidt), bir tomondan, kristallardagi yadrolararo masofalarga asoslanib, rentgen nurlari usullari bilan o'lchanadi. strukturaviy tahlil, va boshqa tomondan, A. p. qiymatlari bo'yicha. va , usul bilan aniqlanadi refraktometriya(mos ravishda 0,133 va 0,132 HM). Aksariyat boshqa tizimlar ham ma'lumlarga tayanadi. kristallarda yadrolararo masofalar usullari va ma'lum bir "mos yozuvlar" qiymati bo'yicha A. p. def. va u. Naibda. Pauling tizimiga keng ma'lum, bu mos yozuvlar qiymati A. p. (0,140HM). Eng yiriklaridan biri hisoblangan Belov va Bokiya tizimida. ishonchli, A. r. 0 2- 0,136 HM ga teng qabul qilinadi. Quyida ma'lum ionlarning radiuslarining qiymatlari keltirilgan:
|
Goldschmidt tizimida |
Pauling tizimida |
Goldschmidt tizimida |
Pauling tizimida |
||
Bir xil koordinatalarga ega bo'lgan ion kristallari uchun. raqamlar, qarang. yuqorida berilgan A. R.dan hisoblangan A. R. yigʻindisining ion kristallaridagi eng qisqa yadrolararo masofalarning eksperimental qiymatlaridan chetlanishi 0,001-0,002 NM ni tashkil qiladi.
70-80-yillarda. to'g'ridan-to'g'ri aniqlashga urinishlar A. p. usullar bilan elektron zichligini o'lchash orqali ionlar rentgen strukturaviy tahlil ionlar chegarasi sifatida yadrolarni tutashtiruvchi chiziqdagi elektron zichligining minimali olinadi. Diffraktsiya ishqoriy metallarning galogenidlari kristallari uchun oʻlchovlar A. r. olish imkonini berdi. kationlari mos ravishda Li + , Na + , K + , Rb + va Cs + teng. 0,094; 0,117; 0,149; 0,163; 0,186 nm va A. r. anionlar F - , Cl - , Br - , I - - teng resp. 0,116; 0,164; 0,180; 0,205 HM. T. o. diffraktsiya o'lchovlar A. p.ning haddan tashqari baholanishiga olib keladi (yuqorida keltirilgan an'anaviy bilan solishtirganda). kationlar va kam baholangan qiymatlarga Va. anionlar. Kristalda elektron zichligi taqsimotini oʻlchash yoʻli bilan topilgan A. R.ni bir birikmadan ikkinchi birikmaga oʻtkazib boʻlmaydi, ularning qoʻshilish qobiliyatidan chetlanishlar juda katta, shuning uchun bunday A. R. yadrolararo masofalarni bashorat qilish uchun foydalanilmaydi.
Kovalent radius bitta kimyoning yarmi uzunligi sifatida aniqlanadi. X - X bog'lari (bu erda X - metall bo'lmagan element). Galogenlar uchun kovalent A. R. X 2 molekulasidagi yadrolararo masofa X - X ning yarmi, S va Se uchun - X 8da X - X masofasining yarmi, uglerod uchun - olmos kristalidagi eng qisqa masofa C - C ning yarmi. Kovalent A. r. F, Cl, Br, I, S, Se va C resp. 0,064 ga teng; 0,099; 0,114; 0,133; 0,104; 0,117 va 0,077 nm. H atomi uchun A. r. 0,030 HM ga teng qabul qilingan (garchi H 2 molekulasidagi H - H aloqasining yarmi uzunligi 0,037 HM bo'lsa ham). Kovalent arrning qo'shimchaliligi. ko'p atomli molekulalardagi eng qisqa yadrolararo masofalarni (bog'larning uzunligi) bashorat qilish imkonini beradi. Shunday qilib, ushbu qoidaga ko'ra, C-Cl bog'lanish uzunligi 0,176 HM ga teng bo'lishi kerak va CCl 4 molekulasida bu qiymat uchun eksperimental ravishda olingan qiymat 0,177 HM ni tashkil qiladi. Quyida kovalent A. r. Yagona bog'lanishlar uzunligi asosida hisoblangan ma'lum elementlarning atomlari uchun:

Ikki yoki uch kimyoga ega bo'lgan molekulalarda. obligatsiyalar uchun kovalent A. p.ning kamaytirilgan qiymatlaridan foydalaning, chunki bir nechta bog'lanishlar bittadan qisqaroq. Quyida bir nechta bog'lanish hosil bo'lishida atomlarning kovalent radiuslari keltirilgan:
Van der Vaals radiuslari effektni aniqlaydi. asil gaz atomlarining o'lchamlari. Bundan tashqari, van der Waals A. p. kimyoviy jihatdan o'zaro bog'lanmagan bir xil nomdagi eng yaqin atomlar orasidagi yadrolararo masofaning yarmini ko'rib chiqing. bog'lanish va turli molekulalarga tegishli (masalan, molekulyar kristallarda). Atomlar bir-biriga van-der-Vaals radiuslari yig'indisidan kamroq masofada yaqinlashganda, kuchli atomlararo itarish sodir bo'ladi. Shuning uchun, van der Waals A. p. turli molekulalarga mansub atomlarning minimal ruxsat etilgan kontaktlarini tavsiflaydi. Quyida ba'zi atomlar uchun van der Vaals atom radiuslarining qiymatlari keltirilgan:

Van der Vaals A. r. chorshanba kuni. 0,08 nm ko'proq kovalent A. p. Ionik A. r. manfiy zaryadlangan ion uchun (masalan, Cl -) neytral holatdagi atomning van der Vaals radiusi bilan amalda mos keladi.
Van der Vaals haqidagi bilimlar A. p. molekulalarning shaklini, molekulalarning konformatsiyasini va ularning molekulyar kristallarda qadoqlanishini aniqlash imkonini beradi. Zich qadoqlash printsipiga ko'ra, kristall hosil qiluvchi molekulalar shunday joylashtirilganki, bir molekulaning "chiqishi" boshqasining "bo'shliqlari" ga kiradi. Ushbu printsipdan foydalanib, mavjud kristallografik ma'lumotlarni sharhlash va ba'zi hollarda molekulyar kristallarning tuzilishini taxmin qilish mumkin.
Lit.: Boki G. B., Kristallar kimyosi, 3-nashr, M., 1971; Pauling L., Umumiy kimyo, trans. ingliz tilidan, M., 1974; Kempbell J., Zamonaviy umumiy kimyo, trans. Ingliz tilidan, 1-jild, M., 1975; E. Kartmell, G. V. A. Faulz, molekulalarning valentligi va tuzilishi, trans. Ingliz tilidan, M., 1979. V. G. Dashevskiy.
Atom radiusi eng yaqin qo'shni atomlar soniga bog'liq.
Atom radiuslari metall atomlarining radiuslariga, metall bo'lmagan elementlarning kovalent radiuslariga va asil gaz atomlarining radiuslariga bo'linadi.
Kristallarda ta'sir qiluvchi o'zaro ta'sirlar yig'indisi bilan belgilanadigan atom radiusi ma'lum darajada yoki bog'lanish turiga va cn ga bog'liq.
Ushbu guruhning o'tish metallari - samariy, tuliy va plutoniyning atom radiusi / - ancha katta, shuning uchun ularga mos keladigan egri chiziq d - o'tish metallari uchun egri chiziqning chap tomonida joylashgan va xarakterli uzilishlarni ko'rsatadi. Inert gazlar, atomlarini qattiq holatda bog'laydigan juda zaif molekulyar kuchlar tufayli juda katta atom radiuslariga ega. Tegishli egri chiziqning joylashuvi asosan kuchli metall aloqaga ega bo'lgan VIII guruhning d - va / - o'tish metallari uchun egri chiziqlar bilan bog'liq emas.
Atom radiusi bu eng yuqori ishlagan asosiy kvant soni n ortishi bilan ortadi. energiya darajasi. Biroq, har bir energiya darajasi uchun o'rtacha elektron tarqatish radiusi turli atomlar bir xil emas, chunki u yadroning samarali zaryadiga bog'liq. Samarali yadro zaryadi Z3d (j) ko'rib chiqilayotgan elektronga ta'sir qiluvchi ko'rinadigan zaryaddir. 2eff qiymati yadro Z haqiqiy zaryadidan kichik, chunki har bir tashqi elektron yadro ta'siridan ichki elektronlar tomonidan qisman himoyalangan. Eng tashqi elektronlar uchun xuddi shu atom yoki iondagi boshqa elektronlar tomonidan haqiqiy yadro zaryadining himoyalanish darajasi haqiqiy va samarali yadro zaryadlari orasidagi farq sifatida aniqlanadigan ekranlovchi doimiy S bilan tavsiflanishi mumkin.
Atom radiuslari, xuddi ionlar kabi, koordinatsion sonning kattaligiga qarab, bir xil element uchun o'zgaradi. Shu munosabat bilan, biz ta'kidlaganimizdek, u ko'pincha indeks bilan belgilanadi, masalan, rv, bu koordinatsiya raqamiga berilgan radius qiymati tegishli.
Atom radiusi 156 A, Ca2 ning ion radiusi 103 A.
Atom radiusi 2 65 A, Cs ning ion radiusi 165 A. Havoda u olov bilan bir zumda oksidlanadi, peroksid va superperoksid hosil qiladi.
Atom radiusi (metall) 0 280 nm, ion radiusi Fr 0 186 nm.
Atom radiuslari S C1 Ar ketma-ketligida kamayadi, chunki S dan C1 ga va C1 dan Ar ga o'tishda yadro zaryadi bir ga ortadi. Bir muddat ichida valent elektronlar ortishi bilan yadroga kuchliroq tortiladi musbat zaryad, shuning uchun atom radiuslari mos ravishda kamayadi. Izoelektronik (bir xil miqdordagi elektronga ega) atom va ion zarralari uchun yadro zaryadi (elementning seriya raqami) ortishi bilan samarali radiuslar kamayadi, chunki bu holda ham tortishishning izchil ortishi kuzatiladi. elektronlar yadroga.
Atom radiuslari guruh sonining I dan VI gacha ko'tarilishi va sink guruhiga o'tishi bilan xuddi shunday o'zgaradi. Atomlararo aloqalar uzunligi va atom diametrlarining kamayishi bilan atomlararo aloqalarning energiyasi ortadi va shuning uchun termal kengayish koeffitsienti a va metallarning siqilishi k kamayadi.
B kichik guruhlari elementlarining atom radiuslari va siqilish qobiliyati IB - - VIIB yo'nalishi bo'yicha sezilarli darajada oshadi va inert gazlarning atom radiuslari mos keladigan davrlarda ishqoriy metallarning atom radiuslariga juda yaqin bo'ladi.
Metalllarning atom radiuslari. Atom radiuslari metall atomlarining radiuslariga, metall bo'lmagan elementlarning kovalent radiuslariga va asil gaz atomlarining radiuslariga bo'linadi.
Tenglamaga almashtiriladigan atom radiusi r d va Hz odatda Pauling ishlatgan radiuslardan farq qiladi; ular jadvalda keltirilgan. 4.2 qavs ichida. Ushbu radiuslar yordamida hisoblangan atomlararo masofalar jadvalning ikkinchi ustunida keltirilgan. 4.1 qavs ichida. Ular ko'pincha Pauling radiuslaridan olingan qiymatlarga qaraganda eksperimental qiymatlar bilan bir oz yaxshiroq rozi bo'lishadi, ammo farq kamdan-kam uchraydi. Schoemaker va Stivenson sxemasining kamchiliklari shundaki, uni ikki va uch barobar bog'lash uchun kengaytirib bo'lmaydi va shuning uchun keyingi muhokamada foydali bo'lishi uchun etarlicha keng qo'llanilishi mumkin emas.
Atom radiuslari metall atomlarining radiuslariga, metall bo'lmagan elementlarning kovalent radiuslariga va asil gaz atomlarining radiuslariga bo'linadi.
Atom radiuslari atom raqami yoki yadro zaryadiga davriy bog'liqlikka ega. Umuman olganda, elementlarning davriy tizimi eng tanish - jadval ko'rinishida taqdim etilgan bo'lsa, u holda bir xil miqdordagi kvant qatlamlari bo'lgan atom radiusi chapdan o'ngga kamayadi, elektron qobiq, go'yo qisqaradi. Yuqoridan pastga qarab, aksincha, kvant qatlamlari sonining ko'payishi bilan atom radiuslari ortadi.
Atom radiuslari metall atomlari radiuslari, kovalent radiuslar va molekulalararo (van-der-Vaals) radiuslarga bo'linadi, ular asil gaz atomlarining radiuslarini o'z ichiga oladi.
Odatda, guruhlardagi atom radiuslari yuqoridan pastgacha ortadi.
Volframning atom radiusi 1 37 A, molibden 1 36 A, vanadiy - 1 32 A va xrom-1 25 A. Tajriba shuni ko'rsatadiki, konjugatsiyalangan cho'kma qanchalik aniq bo'lsa, elementning atom radiusi atom radiusiga qanchalik yaqin bo'lsa. volframdan.
F c C1 Br I qatorida galogenlarning atom radiuslari ortadi. Xuddi shu ketma-ketlikda qaynash va erish nuqtalari ortadi, galogenlarning rangi chuqurlashadi.
Kristall sxemasi - bu operatsiyani bir necha marta takrorlash. Kremniyning atom radiusi (koordinatsion raqami 4 va kovalent aloqa bilan) 1175 A. Kremniy atomining nisbatan katta radiusi tufayli kremniy uglerodga qaraganda kattaroq metalllikka ega. Aralashmalarda kremniy asosan tetravalentdir.
Borning atom radiusi 0 97, B3 ionining radiusi esa 0 20 A ga teng.
Borning atom radiusi 0 97, B3 ionining radiusi esa 0 20 A ga teng.
Temir holat diagrammasi.| Temirning issiqlik sig'imining harorat bilan o'zgarishi [kkalKz - atom grad. Fe ning atom radiusi 1 26 A, metalldan elektronning ish funktsiyasi 4 7 ey. Shaklda ko'rsatilganidek. XIV-15, temir normal bosimda to'rtta allotropik shaklga ega. Temirning termal kengayish koeffitsienti 500 S gacha ko'tariladi, undan keyin u 769 S gacha pasayadi va keyin yana 911 S ga ko'tariladi. Taxminan 133 ming atm bosim ostida oddiy haroratda hosil bo'lgan temirning elektron shakli rf (FeFe) 2 40 A, yuqori zichlik (9 1 g / sm3) va ortgan (taxminan) bo'lgan olti burchakli yaqin o'ralgan tuzilish bilan tavsiflanadi. 25 marta) elektr qarshiligi.
Co va Ni ning standart atom radiusi 125 va 124 A, metallar uchun xarakterli elektron ish funktsiyalari mos ravishda 42 va 50 eV dir. Bu elementlarning allotropiyasi temirga qaraganda ancha kam o'rganilgan. Kobalt uchun qizdirilganda (taxminan 450 C), olti burchakli yopiq o'ram yuzlari markazlashtirilgan kubga aylanadi, nikel uchun esa (taxminan 358 C) buning aksi. Ikkala metalning bunday qarama-qarshi xatti-harakatlariga nima sabab bo'lganligi aniq emas.
Fe ning atom radiusi 1 26 A, metalldan elektronning ish funktsiyasi 4 7 eV ga teng. Shaklda ko'rsatilganidek. X1V - 15, normal bosimda temir to'rtta allotropik shaklga ega. Ulardan a, (5 va b) markazlashtirilgan kub shaklida kristallanadi, y esa markazlashgan yuzli kub shaklida kristallanadi.Temirning issiqlik kengayish koeffitsienti 500 C gacha ortadi, undan keyin u 769 C gacha kamayadi va yana ortadi. 911 C gacha.
Co va Ni ning standart atom radiuslari 125 va 124 A, metallar uchun xarakterli elektron ish funktsiyalari mos ravishda 42 va 50 ea. Bu elementlarning allotropiyasi temirga qaraganda ancha kam o'rganilgan. Kobalt uchun qizdirilganda (taxminan 450 C), olti burchakli yopiq o'ram yuzlari markazlashtirilgan kubga aylanadi, nikel uchun esa (taxminan 358 C) buning aksi. Ikkala metalning bunday qarama-qarshi xatti-harakatlariga nima sabab bo'lganligi aniq emas. Kobalt uchun yana bitta polimorfik transformatsiya qayd etildi - 1125 S da.
Li ning atom radiusi elektron hamkasblarining atom radiuslaridan sezilarli darajada farq qiladi, shuning uchun Li ular bilan evtektik qotishmalar hosil qiladi.
Vanadiyning atom radiusi niobiydan sezilarli darajada kichikroq va niobiydan tantalga o'tganda, tantalning yangi elektron qatlamiga ega bo'lishiga qaramay, atom radiusi deyarli o'zgarmaydi. Tantalning atom radiusining anomal darajada kichik qiymati, gafniydagi kabi, lantanidning qisqarishi ta'siriga bog'liq. Oksidlanish darajasi 5 dagi niobiy va tantal ham bir xil ionli radiuslarga ega, bu katta o'xshashlikka olib keladi. kimyoviy xossalari bu elementlar.
Niobiy va tantalning atom radiuslari deyarli mos keladi (33-jadval), bir xil oksidlanish darajasidagi ion radiuslari ham bir-biriga juda yaqin, shuning uchun ularning birikmalari xossalari jihatidan juda o'xshash. VB kichik guruhi metallari o'tga chidamli, yaxshi mexanik xususiyatlarga ega, vodorod, uglerod, kislorod va azot aralashmalarining tarkibiga kuchli bog'liqdir. Bu aralashmalar qattiqlikni oshiradi, metallarni mo'rt va kamroq egiluvchan qiladi. Vakuumli elektron nurlari eritilgan, niobiy va tantal juda egiluvchan va sovuqda yaxshi ishlaydi.
Molekulaning tuzilishi - kelib chiqishi sifatida. Keyin ringda S8 sherigi tasvirlangan. Oltingugurtning atom radiusi 0 104 nm ga teng deb hisoblanadi.
Atomlararo masofadan hisoblangan atom radiuslari oddiy moddalar ah, nm. Nometallarning atom radiuslari oddiy moddalarning molekulalari yoki kristallaridagi atomlararo masofaning yarmi bilan bir xil tarzda hisoblanadi.
Niobiy va tantalning atom radiuslari deyarli bir-biriga mos keladi (33-jadvalga qarang), bir xil oksidlanish darajasidagi ion radiuslari ham bir-biriga juda yaqin, shuning uchun ularning birikmalari xossalari bo'yicha juda o'xshash. VB kichik guruhi metallari o'tga chidamli, yaxshi mexanik xususiyatlarga ega, vodorod, uglerod, kislorod va azot aralashmalarining tarkibiga kuchli bog'liqdir. Bu aralashmalar qattiqlikni oshiradi, metallarni mo'rt va kamroq egiluvchan qiladi. Vakuumli elektron nurlari eritilgan, niobiy va tantal juda egiluvchan va sovuqda yaxshi ishlaydi. Oddiy sharoitlarda bu metallar passivdir, chunki ular barqaror himoya oksidi plyonkasi bilan qoplangan. Da yuqori harorat kislorod, galogenlar, azot, uglerod, vodorod, karbonat angidrid va suv bug'lari bilan o'zaro ta'sir qiladi. 600 C va undan yuqori haroratda tantal kuchli, o'tga chidamli, yomon o'tkazuvchan Ta20b oksidi bilan qoplangan, u vodorodda qaytarilmaydi.
Vanadiyning atom radiusi niobiydan sezilarli darajada kichikroq va niobiydan tantalga o'tganda, tantalning yangi elektron qatlamiga ega bo'lishiga qaramay, atom radiusi deyarli o'zgarmaydi. Oksidlanish darajasi 5 bo'lgan niobiy va tantal ham bir xil ionli radiuslarga ega, bu esa bu elementlarning kimyoviy xossalarida katta o'xshashlikni keltirib chiqaradi.
O'ta to'yingan qattiq eritmadan cho'kma turlari. Alyuminiyning atom radiusi 0 143 nm, misniki - 0 128 nm, ruxniki - 0 138 nm.
Shunga mos ravishda atom radiusi litiyda 155 A dan uglerodda 077 A gacha kamayadi. Erish va qaynash nuqtalari asta-sekin o'sib boradi; bu ko'rsatkichlar, qattiqlik va boshqa shunga o'xshash xususiyatlar kabi, ma'lum bir moddaning atomlari orasidagi bog'lanishning mustahkamligini aks ettiradi; erish nuqtasi litiy uchun 186 dan uglerod uchun 3500 gacha, qaynash nuqtasi litiy uchun 1336 dan uglerod uchun 4200 gacha oshadi.
Kristallardagi atomlar orasidagi aloqa chizig'ida elektron zichligi taqsimoti. a - novalent-nan bog'i (olmos C, nuqta chiziq - valentlik juft elektronning elektron zichligi. b - ionli bog'lanish (NaCl, nuqta chiziq - tashqi elektron orbitalari hududi. c - metall bog'lanish (A1, nuqta chiziq - elektron zichligi). atomlararo fazoda.Bir xil turdagi bog'lanishga ega bo'lgan birikmalar strukturasidagi metall atomlararo masofali oddiy moddalar (elementlar) tuzilmalarida gatning atom radiuslari kremniy karbididagi atom radiusi.Si - C yig'indisi bilan yaxshi tasvirlangan. (0 189 nm) amalda 0 194 nm ga teng gat (Si) 0 117 nm, rJT (C) 0 077 nm ko‘rsatilgan radiuslari yig‘indisiga to‘g‘ri keladi.
Uranning atom radiusi katta, 1 54 A ga, ion radiusi - 1 03 A, U4 - 0 93 A, U5 - 0 87 A va U6 - 0 83 A ga teng.
Seziyning atom radiusi 262 A ga teng.
Bor, azot va kremniyning atom radiuslari mos ravishda 0 80; 0 74 va 1 17 A - Atomlarni qattiq sharlar deb hisoblab, quyidagi hollarda ushbu elementlarning harakatini taxmin qiling va siz bashorat qilgan natijalarni eksperimental ma'lumotlar bilan solishtiring.
Vanadiy, niobiy va tantalning atom radiuslari mos ravishda 1 34; 1 46 va 1 46 A - Nima uchun niobiy va tantalning atom radiuslari mos keladi.
O'tish elementlarining atom radiuslari o'tmaydigan elementlarning atom radiuslaridan kichikroq bo'lib, o'tish elementi metallarida katta bog'lanish kuchini aks ettiradi.
Metall katalizatorlarning atom radiuslari ma'lum chegaralar ichida yotishi kerak, chunki aks holda yoki siklogeksandagi vodorod atomlari ularni o'ziga tortadigan katalizator atomidan juda uzoqda bo'ladi yoki uglerod atomlari halqasi panjara ustida yotmaydi. Siklogeksan dehidrogenlash katalizatorlari atom radiuslari 1236-1397 A ga teng.
Mis kichik guruhi elementlarining atom radiuslari kichik: gs 128 pm; / - d g Ai 1 44 rm.
Shakllanishda ishtirok etadigan kimyoviy elementlarning eng muhim xususiyatlaridan biri kimyoviy bog'lanish, atomning (ionning) kattaligi: uning ortishi bilan atomlararo bog'lanish kuchi kamayadi. Atom (ion) hajmi odatda uning radiusi yoki diametrining qiymati bilan belgilanadi. Atom (ion) aniq chegaralarga ega emasligi sababli, "atom (ion) radiusi" tushunchasi atomning (ionning) elektron zichligining 90-98% ni ushbu radius sferasida joylashganligini anglatadi. Atom (ion) radiuslarining qiymatlarini bilish kristallardagi yadrolararo masofalarni (ya'ni bu kristallarning tuzilishini) baholashga imkon beradi, chunki ko'p muammolar uchun atomlar (ionlar) yadrolari orasidagi eng qisqa masofalarni hisoblash mumkin. ularning atom (ion) radiuslarining yig'indisi, garchi bunday qo'shimchalar taxminiy bo'lsa va hamma hollarda ham bajarilmaydi.
ostida atom radiusikimyoviy element(ion radiusi haqida, pastga qarang), kimyoviy bog'lanishning shakllanishida ishtirok etgan, umumiy holda, ular elementning kristall panjarasidagi eng yaqin atomlar orasidagi muvozanat yadrolararo masofaning yarmini tushunishga kelishib oldilar. Agar atomlarni (ionlarni) qattiq sharlar deb hisoblasak, juda oddiy bo'lgan bu tushuncha aslida murakkab va ko'pincha noaniq bo'lib chiqadi. Kimyoviy elementning atom (ion) radiusi doimiy qiymat emas, lekin bir qator omillarga qarab o'zgaradi, ulardan eng muhimi kimyoviy bog'lanish turidir.
va muvofiqlashtirish raqami.
Agar turli kristallarda bir xil atom (ion) hosil bo'lsa turli xil turlari kimyoviy bog'lanish, keyin u bir necha radiusga ega bo'ladi - kovalent aloqaga ega bo'lgan kristallda kovalent; ionli aloqaga ega kristallda ion; metalldagi metall; van der Waals molekulyar kristalda. Kimyoviy bog'lanish turining ta'sirini quyidagi misolda ko'rish mumkin. Olmosda barcha to'rtta kimyoviy bog'lanish kovalent bo'lib, hosil bo'ladi sp 3-gibridlar, shuning uchun berilgan atomning barcha to'rtta qo'shnisi bir xil va ustida
undan bir xil masofada d= 1,54 A˚) va olmosdagi uglerodning kovalent radiusi bo'ladi
0,77 A˚ ga teng. Mishyak kristalida kovalent bog'lar bilan bog'langan atomlar orasidagi masofa ( d 1 = 2,52 A˚), van der Vaals kuchlari bilan bog'langan atomlar orasidagidan ancha past ( d 2 = 3,12 A˚), shuning uchun As kovalent radiusi 1,26 A˚ va van der Vaals 1,56 A˚ bo'ladi.
Atom (ion) radiusi ham koordinatsion raqamning o'zgarishi bilan juda keskin o'zgaradi (buni elementlarning polimorf o'zgarishi paytida kuzatish mumkin). Koordinatsion raqam qanchalik kichik bo'lsa, fazoni atomlar (ionlar) bilan to'ldirish darajasi shunchalik past bo'ladi va yadrolararo masofa shunchalik kichik bo'ladi. Koordinatsion raqamning ko'payishi har doim yadrolararo masofalarning oshishi bilan birga keladi.
Yuqorida aytilganlardan kelib chiqadiki, kimyoviy bog'lanish hosil bo'lishida ishtirok etuvchi turli elementlarning atom (ion) radiuslarini faqat bir xil turdagi kimyoviy bog'lanish amalga oshiriladigan kristallar hosil qilgandagina solishtirish mumkin va hosil bo'lgan kristallardagi bu elementlar bir xil muvofiqlashtirish raqamlari.
Keling, atom va ion radiuslarining asosiy xususiyatlarini batafsil ko'rib chiqaylik.
ostida elementlarning kovalent radiuslari Kovalent bog'lanish bilan bog'langan eng yaqin atomlar orasidagi muvozanat yadrolararo masofaning yarmini tushunish odatiy holdir.
Kovalent radiuslarning o'ziga xos xususiyati ularning bir xil koordinatsiya soniga ega bo'lgan turli "kovalent tuzilmalarda" doimiyligidir. Z j.Bundan tashqari, kovalent radiuslar odatda bir-biriga qoʻshimcha bogʻlanadi, yaʼni A–B masofasi kovalent bogʻlar va barchasida bir xil koordinatsion sonlar mavjud boʻlganda A–A va B–B masofalar yigʻindisining yarmiga teng. uchta tuzilma.
Oddiy, tetraedral, oktaedral, kvadratik va chiziqli kovalent radiuslar mavjud.
Atomning normal kovalent radiusi atomning davriy jadvaldagi o'rniga mos keladigan darajada kovalent bog'lanish hosil qilgan holatga to'g'ri keladi: uglerod uchun - 2, azot uchun - 3 va hokazo. Bu turli xil qiymatlarga olib keladi. ko'plik (tartib) bog'larga (bitta bog'lanish, qo'sh, uchlik) qarab normal radiuslar. Agar aloqa gibrid elektron bulutlari bir-birining ustiga chiqqanda hosil bo'lsa, ular tetraedral haqida gapiradi.
(Z k = 4, sp 3-gibrid orbitallar), oktaedral ( Z k = 6, d 2sp 3-gibrid orbitallar), kvadratik ( Z k = 4, dsp 2-gibrid orbitallar), chiziqli ( Z k = 2, sp-gibrid orbitallar) kovalent radiuslar.
Kovalent radiuslar haqida quyidagilarni bilish foydalidir (bir qator elementlar uchun kovalent radiuslarning qiymatlari berilgan).
1. Kovalent radiuslar, ionlardan farqli o'laroq, sferik shaklga ega bo'lgan atomlarning radiuslari sifatida talqin qilinishi mumkin emas. Kovalent radiuslar faqat kovalent bog'lar bilan birlashtirilgan atomlar orasidagi yadrolararo masofalarni hisoblash uchun ishlatiladi va kovalent bog'lanmagan bir xil turdagi atomlar orasidagi masofalar haqida hech narsa aytmaydi.
2. Kovalent radiusning qiymati kovalent bog'lanishning ko'pligi bilan aniqlanadi. Uchlik bog'lanish qo'sh bog'dan qisqaroq, u o'z navbatida bitta bog'dan qisqa, shuning uchun uchlik bog'lanishning kovalent radiusi qo'sh bog'ning kovalent radiusidan kichikroq, u kichikroqdir.
yagona. Shuni yodda tutish kerakki, munosabatlarning ko'pligi tartibi butun son bo'lishi shart emas. Agar bog'lanish rezonansli bo'lsa (benzol molekulasi, Mg2 Sn birikmasi, pastga qarang) u ham fraksiyonel bo'lishi mumkin. Bunday holda, kovalent radius bog'lanish ko'pligining butun tartiblariga mos keladigan qiymatlar orasidagi oraliq qiymatga ega.
3. Agar bog'lanish aralash kovalent-ionli tabiatga ega bo'lsa, lekin bog'lanishning kovalent komponentining yuqori darajasiga ega bo'lsa, u holda kovalent radius tushunchasini kiritish mumkin, lekin bog'lanishning ion komponentining ta'siri. qiymatini e'tiborsiz qoldirib bo'lmaydi. Ba'zi hollarda, bu ta'sir kovalent radiusning sezilarli darajada pasayishiga olib kelishi mumkin, ba'zan esa 0,1 A˚ gacha. Afsuski, bu ta'sirning ko'lamini oldindan aytishga urinishlar har xil
holatlar hali muvaffaqiyatli bo'lmagan.
4. Kovalent radiusning qiymati kovalent bog'lanish hosil bo'lishida ishtirok etadigan gibrid orbitallarning turiga bog'liq.
Ion radiuslari, albatta, eng yaqin ionlar yadrolari orasidagi masofalar yig'indisining yarmi sifatida belgilanishi mumkin emas, chunki, qoida tariqasida, kationlar va anionlarning o'lchamlari keskin farq qiladi. Bundan tashqari, ionlarning simmetriyasi sferik simmetriyadan biroz farq qilishi mumkin. Shunga qaramay, ostida haqiqiy ion kristallari uchun ion radiusi Ionga yaqinlashadigan to'pning radiusini tushunish odatiy holdir.
Ion radiuslari ion kristallaridagi yadrolararo masofalarni taxminiy baholash uchun ishlatiladi. Eng yaqin kation va anion orasidagi masofa ularning ion radiuslari yig'indisiga teng deb faraz qilinadi. Bunday kristallarda ion radiuslari bo'yicha yadrolararo masofalarni aniqlashda tipik xatolik ≈0,01 A˚ ni tashkil qiladi.
Ayrim ionlarning ion radiuslari qiymatlarida farq qiluvchi, ammo taxminan bir xil yadrolararo masofalarga olib keladigan bir nechta ionli radius tizimlari mavjud. Ion radiuslarini aniqlash bo'yicha birinchi ish 1920-yillarda V. M. Goldshmit tomonidan amalga oshirildi. Unda muallif, bir tomondan, rentgen strukturaviy tahlil bilan o'lchanadigan ion kristallaridagi yadrolararo masofalardan, ikkinchi tomondan, F- va O2- ion radiuslarining qiymatlaridan foydalangan.
refraktometriya usuli. Aksariyat boshqa tizimlar, shuningdek, diffraktsiya usullari bilan aniqlangan kristallardagi yadrolararo masofalarga va ma'lum bir ionning ion radiusining ba'zi "mos yozuvlar" qiymatlariga tayanadi. Eng keng tarqalgan tizimda
Pauling, bu mos yozuvlar qiymati O2− peroksid ionining ion radiusi, ga teng
1,40A˚. O2 uchun bu qiymat nazariy hisob-kitoblarga yaxshi mos keladi. G. B. Bokiya va N. V. Belovlar tizimida eng ishonchlilardan biri hisoblangan O2- ion radiusi 1,36 A˚ ga teng qabul qilingan.
1970—1980-yillarda ionlar chegarasi sifatida yadrolarni tutashtiruvchi chiziqdagi elektron zichligining minimal miqdorini olish sharti bilan rentgen strukturaviy tahlil yordamida elektron zichligini oʻlchash yoʻli bilan ionlarning radiuslarini bevosita aniqlashga urinishlar boʻldi. . Ma'lum bo'lishicha, bu to'g'ridan-to'g'ri usul kationlarning ion radiuslarining haddan tashqari baholangan qiymatlariga va anionlarning ion radiuslarining kam baholangan qiymatlariga olib keladi. Bundan tashqari, to'g'ridan-to'g'ri usul bilan aniqlangan ion radiuslarining qiymatlarini bir birikmadan boshqasiga o'tkazish mumkin emasligi va qo'shimchalardan og'ishlar juda katta ekanligi ma'lum bo'ldi. Shuning uchun bunday ion radiuslari yadrolararo masofalarni bashorat qilish uchun ishlatilmaydi.
Ion radiuslari haqida quyidagilarni bilish foydalidir (quyidagi jadvallarda Bokiy va Belov bo'yicha ion radiuslarining qiymatlari berilgan).
1. Xuddi shu elementning ionlari uchun ion radiusi uning zaryadiga qarab, bir xil ion uchun esa koordinatsion raqamga bog'liq. Koordinatsion soniga qarab tetraedral va oktaedral ionli radiuslar ajratiladi.
2. Birining ichida vertikal qator, aniqrog'i, bir guruh ichida, davriy
bilan tizim ionlari radiusi bir xil to'lov elementning atom raqamining ortishi bilan ortadi, chunki elektronlar egallagan qobiqlar soni va shuning uchun ionning o'lchami ortadi.
|
Radius, A˚ |
3. Xuddi shu davrdagi atomlarning musbat zaryadlangan ionlari uchun zaryad ortishi bilan ion radiuslari tez kamayadi. Tez pasayish ikkita asosiy omilning bir yo'nalishdagi ta'siri bilan izohlanadi: "o'z" elektronlarni kation tomonidan kuchli jalb qilish, ularning zaryadi atom sonining ortishi bilan ortadi; kation zaryadining ortishi bilan kation va uni o'rab turgan anionlar orasidagi o'zaro ta'sir kuchining oshishi.
|
Radius, A˚ |
4. Xuddi shu davrdagi atomlarning manfiy zaryadlangan ionlari uchun ion radiuslari ortishi bilan ortadi. manfiy zaryad. Oldingi paragrafda ko'rib chiqilgan ikkita omil bu holda qarama-qarshi yo'nalishda harakat qiladi va birinchi omil ustunlik qiladi (anionning manfiy zaryadining oshishi uning ion radiusining ortishi bilan birga keladi), shuning uchun ion radiuslarining ko'payishi bilan manfiy zaryadning ortishi avvalgi holatda pasayishdan ancha sekinroq sodir bo'ladi.
|
Radius, A˚ |
5. Xuddi shu element uchun, ya'ni bir xil boshlang'ich bilan elektron konfiguratsiya, kationning radiusi anionnikidan kichikroq. Bu anion yadrosiga tashqi "qo'shimcha" elektronlarning tortilishining kamayishi va ichki elektronlar tufayli skrining effektining kuchayishi (kationda elektronlar etishmasligi, anionda esa ortiqcha) bilan bog'liq.
|
Radius, A˚ |
6. Bir xil zaryadga ega bo'lgan ionlarning o'lchamlari davriy jadvalning davriyligiga mos keladi. Biroq, ion radiusining qiymati yadro zaryadiga proportsional emas Z, bu elektronlarning yadro tomonidan kuchli tortilishi bilan bog'liq. Bundan tashqari, bir xil zaryadga ega bo'lgan atomlar va ionlarning radiuslari ko'paymaydi, balki atom sonining ortishi bilan kamayib boruvchi lantanidlar va aktinidlar (lantanidlarning qisqarishi va aktinidlarning qisqarishi) istisno hisoblanadi. davriy bog'liqlik.11
11 Lantanidlarning qisqarishi va aktinid qisqarishi lantanidlar va aktinidlarda atom raqamining ortishi bilan qo'shilgan elektronlarning to'ldirilishi bilan bog'liq. ichki d va f- asosiy bilan qobiqlar kvant soni berilgan davrning asosiy kvant sonidan kam. Shu bilan birga, kvant mexanik hisob-kitoblariga ko'ra d va ayniqsa, ichida f holatlar, elektron yadroga nisbatan ancha yaqinroqdir s va p katta kvant soni bilan berilgan davr holatlari, shuning uchun d va f-elektronlar atomning ichki hududlarida joylashgan bo'lsa-da, bu holatlar elektronlar bilan to'ldirilgan ( gaplashamiz energiya makonidagi elektron darajalar haqida) boshqacha tarzda sodir bo'ladi.
metall radiuslari metall elementning kristallanish strukturasidagi atomlar yadrolari orasidagi eng qisqa masofaning yarmiga teng deb hisoblanadi. Ular muvofiqlashtirish soniga bog'liq. Har qanday elementning metall radiusini da olsak Z k \u003d birlik uchun 12, keyin qachon Z k = 8, 6 va 4 bo'lsa, bir xil elementning metall radiusi mos ravishda 0,98 bo'ladi; 0,96; 0,88. Metall radiuslar qo'shilish xususiyatiga ega. Ularning qiymatlarini bilish intermetalik birikmalarning kristall panjaralarining parametrlarini taxminan taxmin qilish imkonini beradi.
Metalllarning atom radiuslari quyidagi xususiyatlar bilan tavsiflanadi (metallarning atom radiuslarining qiymatlari to'g'risidagi ma'lumotlarni bizda topish mumkin).
1. O'tish metallarining metall atom radiuslari odatda o'tmaydigan metallarning metall atom radiuslaridan kichikroq bo'lib, o'tish metallarida katta bog'lanish kuchini aks ettiradi. Bu xususiyat, davriy tizimda o'tish guruhlari metallari va ularga eng yaqin metallar elektron d-qobiqlar va elektronlar d-davlatlar kimyoviy bog` hosil bo`lishida ishtirok etishi mumkin. Bog'lanishning mustahkamlanishi qisman bog'lanishning kovalent komponentining paydo bo'lishi va qisman ion yadrolarining van der Waals o'zaro ta'siri bilan bog'liq bo'lishi mumkin. Temir va volfram kristallarida, masalan, elektronlar d-davlatlar bog'lanish energiyasiga katta hissa qo'shadi.
2. Bir ichida vertikal guruh biz yuqoridan pastga harakat qilganimizda, metallarning atom radiuslari ortadi, bu elektronlar sonining ketma-ket ko'payishi bilan bog'liq (elektronlar egallagan qobiqlar soni ortadi).
3. Xuddi shu davr ichida, aniqrog'i dan boshlab gidroksidi metall o'tish metall guruhining o'rtasiga, chapdan o'ngga yo'nalishda, atom metall radiuslari kamayadi. Xuddi shu tartibda o'sish elektr zaryadi atom yadrosi va valentlik qavatida elektronlar sonining ortishi kuzatiladi. Bir atomga bog'lovchi elektronlar sonining ko'payishi bilan metall bog'lanish kuchayadi va shu bilan birga, yadro zaryadining ko'payishi tufayli yadro (ichki) elektronlarning yadro tomonidan tortilishi kuchayadi, shuning uchun metall atom radiusining qiymati kamayadi.
4. Birinchi yaqinlashtirishda xuddi shu davrdagi VII va VIII guruhlarning o‘tish metallari deyarli bir xil metall radiuslariga ega. Ko'rinishidan, 5 va bo'lgan elementlar haqida gap ketganda Ko'proq d-elektronlar, yadro zaryadining ortishi va atom metall radiusining pasayishiga olib keladigan yadro elektronlarini jalb qilish ta'siri atom (ion)dagi elektronlar sonining ko'payishi natijasida yuzaga keladigan ta'sirlar bilan qoplanadi. metall rishta hosil bo'lishida ishtirok etadi va metall radiusining oshishiga olib keladi (elektronlar egallagan holatlar sonining ko'payishi).
5. To'rtinchi davrdan beshinchi davrga o'tishda sodir bo'ladigan o'tish elementlari uchun radiuslarning ko'payishi (2-bandga qarang) o'tish elementlari uchun kuzatilmaydi.
beshinchi davrdan oltinchi davrga o'tish; bu oxirgi ikki davrda mos keladigan (vertikal taqqoslash) elementlarning metall atom radiuslari deyarli bir xil. Ko'rinib turibdiki, bu ular orasida joylashgan elementlarning nisbatan chuqurligi bilan yakunlanganligi bilan bog'liq f-qobiq, shuning uchun yadro zaryadining ortishi va u bilan bog'liq tortishish effektlari elektronlar sonining ko'payishi (lantanid qisqarishi) bilan bog'liq ta'sirlardan ko'ra muhimroq bo'lib chiqadi.
|
4 davr elementi |
Radius, A˚ |
5-davrdagi element |
Radius, A˚ |
6-davrdagi element |
Radius, A˚ |
6. Odatda, metall radiuslar ion radiuslaridan ancha katta, lekin ular bir xil elementlarning kovalent radiuslaridan unchalik sezilarli farq qilmaydi, garchi istisnosiz ularning barchasi kovalent radiuslardan kattaroqdir. Xuddi shu elementlarning metall atom va ion radiuslari qiymatlaridagi katta farq, kelib chiqishi deyarli erkin o'tkazuvchan elektronlarga bog'liq bo'lgan bog'lanish kuchli emasligi bilan izohlanadi (shuning uchun atomlararo nisbatan katta masofalar kuzatilgan). metall panjara). Xuddi shu elementlarning metall va kovalent radiuslari qiymatlaridagi sezilarli darajada kichikroq farqni, agar biz metall aloqani qandaydir maxsus "rezonans" deb hisoblasak, tushuntirish mumkin. kovalent bog'lanish.
ostida van der Vaals radiusi Van der Vaals bog'i bilan bog'langan eng yaqin atomlar orasidagi muvozanat yadrolararo masofasining yarmini tushunish odatiy holdir. Van der Waals radiuslari asil gaz atomlarining samarali o'lchamlarini aniqlaydi. Bundan tashqari, ta'rifdan kelib chiqqan holda, van der Vaals atom radiusini van der Vaals bog'i bilan bog'langan va turli molekulalarga tegishli bo'lgan bir xil nomdagi eng yaqin atomlar orasidagi yadrolararo masofaning yarmi deb hisoblash mumkin (masalan, molekulyar kristallar). Atomlar bir-biriga van-der-Vaals radiuslari yig'indisidan kamroq masofada yaqinlashganda, kuchli atomlararo itarish sodir bo'ladi. Shuning uchun van der Waals atom radiuslari turli molekulalarga tegishli atomlarning minimal ruxsat etilgan kontaktlarini tavsiflaydi. Ba'zi atomlar uchun van der Waals atom radiuslarining qiymatlari to'g'risidagi ma'lumotlarni topish mumkin).
Van der Vaals atom radiuslarini bilish molekulalarning shaklini va ularning molekulyar kristallarda to'planishini aniqlash imkonini beradi. Van der Vaals radiuslari yuqorida sanab o'tilgan bir xil elementlarning barcha radiuslaridan ancha katta, bu van der Vaals kuchlarining zaifligi bilan izohlanadi.






