Gazsimon, suyuq va qattiq jismlarning xossalari va tuzilishi
Barcha tirik bo'lmagan moddalar zarrachalardan iborat bo'lib, ularning xatti-harakati har xil bo'lishi mumkin. Gazsimon, suyuq va tuzilishi qattiq moddalar o‘ziga xos xususiyatlarga ega. Qattiq jismlardagi zarrachalar bir-biriga juda yaqin bo'lgani uchun birga ushlab turiladi, bu ularni juda kuchli qiladi. Bundan tashqari, ular ma'lum bir shaklni saqlab qolishi mumkin, chunki ularning eng kichik zarralari deyarli harakat qilmaydi, faqat tebranadi. Suyuqlikdagi molekulalar bir-biriga juda yaqin, lekin ular erkin harakatlana oladilar, shuning uchun ularning o'ziga xos shakli yo'q. Gazlardagi zarralar juda tez harakat qiladi va odatda ularning atrofida juda ko'p bo'sh joy mavjud bo'lib, bu ularning oson siqilganligini ko'rsatadi.
Qattiq jismlarning xossalari va tuzilishi
Qattiq jismlarning tuzilishi va tuzilishining xususiyatlari qanday? Ular bir-biriga juda yaqin bo'lgan zarralardan iborat. Ular harakatlana olmaydi va shuning uchun ularning shakli barqaror bo'lib qoladi. Qattiq jismning xususiyatlari qanday? U qisqarmaydi, lekin qizdirilsa, harorat oshishi bilan uning hajmi ortadi. Buning sababi shundaki, zarralar tebranishni va harakat qilishni boshlaydi, bu esa zichlikning pasayishiga olib keladi.

Qattiq jismlarning xususiyatlaridan biri shundaki, ular qattiq shaklga ega. Qattiq jism qizdirilganda zarrachalarning harakati kuchayadi. Tezroq harakatlanuvchi zarralar kuchliroq to‘qnashib, har bir zarracha qo‘shnilarini itarib yuborishiga sabab bo‘ladi. Shuning uchun haroratning oshishi odatda tananing kuchini oshirishga olib keladi.
Qattiq jismlarning kristall tuzilishi
Qattiq jismning qo'shni molekulalari orasidagi molekulalararo o'zaro ta'sir kuchlari ularni qattiq holatda ushlab turish uchun etarlicha kuchli. Agar bu eng kichik zarralar juda tartibli konfiguratsiyada bo'lsa, unda bunday tuzilmalar odatda kristalli deb ataladi. Element yoki birikma zarrachalarining (atomlari, ionlari, molekulalari) ichki tartiblanishi bilan maxsus fan - kristallografiya shug'ullanadi.

Qattiq jismning kimyoviy tuzilishi ham alohida qiziqish uyg'otadi. Zarrachalarning xulq-atvorini, ular qanday yaratilganligini o'rganib, kimyogarlar ma'lum turdagi materiallarning ma'lum sharoitlarda qanday harakat qilishini tushuntirishi va taxmin qilishlari mumkin. Qattiq jismning eng kichik zarralari panjara shaklida joylashgan. Bu har xil bo'lgan zarrachalarning muntazam joylashuvi deb ataladi kimyoviy bog'lanishlar ular orasida.

Qattiq jism tuzilishining tarmoqli nazariyasi uni atomlar to'plami sifatida ko'rib chiqadi, ularning har biri o'z navbatida yadro va elektronlardan iborat. DA kristall tuzilish atomlarning yadrolari kristall panjaraning tugunlarida joylashgan bo'lib, u ma'lum bir fazoviy davriylik bilan tavsiflanadi.

Suyuqlikning tuzilishi qanday?
Qattiq jismlar va suyuqliklarning tuzilishi ular tarkibidagi zarrachalar joylashganligi bilan o'xshashdir yaqin masofa. Farqi molekulalarning erkin harakatlanishidadir, chunki ular orasida u qattiq moddaga qaraganda ancha zaifdir.
Suyuqlikning xossalari qanday? Birinchidan, bu suyuqlik, ikkinchidan, suyuqlik u joylashtirilgan idishning shaklini oladi. Agar u qizdirilsa, ovoz balandligi ortadi. Zarrachalarning bir-biriga yaqinligi tufayli suyuqlikni siqib bo'lmaydi.

Gazsimon jismlarning tuzilishi va tuzilishi qanday?
Gaz zarralari tasodifiy joylashtirilgan, ular bir-biridan juda uzoqda joylashganki, ular orasida hech qanday jozibador kuch bo'lishi mumkin emas. Gaz qanday xususiyatlarga ega va gazsimon jismlarning tuzilishi qanday? Qoidaga ko'ra, gaz u joylashtirilgan butun bo'shliqni bir xilda to'ldiradi. Osonlik bilan siqiladi. Zarracha tezligi gazsimon tana harorat oshishi bilan ortadi. Shu bilan birga, bosimning oshishi ham mavjud.

Gazsimon, suyuq va qattiq jismlarning tuzilishi ushbu moddalarning eng kichik zarralari orasidagi turli masofalar bilan tavsiflanadi. Gaz zarralari qattiq yoki qattiq jismga qaraganda bir-biridan ancha uzoqda suyuqlik holati. Masalan, havoda zarralar orasidagi o'rtacha masofa har bir zarrachaning diametridan o'n baravar ko'p. Shunday qilib, molekulalarning hajmi umumiy hajmning atigi 0,1% ni egallaydi. Qolgan 99,9% bo'sh joy. Aksincha, suyuqlik zarralari umumiy suyuqlik hajmining taxminan 70% ni to'ldiradi.
Har bir gaz zarrasi boshqa zarracha (gaz, suyuqlik yoki qattiq) bilan to'qnashguncha to'g'ri yo'l bo'ylab erkin harakatlanadi. Zarrachalar odatda shunchalik tez harakat qiladiki, ikkitasi to'qnashgandan so'ng ular bir-biridan sakrab o'tadi va yolg'iz o'z yo'lida davom etadi. Ushbu to'qnashuvlar yo'nalish va tezlikni o'zgartiradi. Gaz zarralarining bu xossalari gazlarning har qanday shakl yoki hajmni to'ldirish uchun kengayishiga imkon beradi.

Davlat o'zgarishi
Gazsimon, suyuq va qattiq jismlarning tuzilishi, agar ularga ma'lum bir tashqi ta'sir ko'rsatilsa, o'zgarishi mumkin. Ular hatto ma'lum sharoitlarda, masalan, isitish yoki sovutish paytida bir-birining holatiga o'tishlari mumkin.

- Bug'lanish. Suyuq jismlarning tuzilishi va xossalari ularni ma'lum sharoitlarda butunlay boshqacha jismoniy holatga o'tishga imkon beradi. Misol uchun, agar siz mashinaga yonilg'i quyish paytida tasodifan benzin to'kib yuborsangiz, uning o'tkir hidini tezda his qilishingiz mumkin. Bu qanday sodir bo'ladi? Zarrachalar suyuqlik bo'ylab harakatlanadi, natijada ularning ma'lum bir qismi sirtga etib boradi. Ularning yo'nalishli harakati bu molekulalarni sirtdan va suyuqlik ustidagi bo'shliqqa olib chiqishi mumkin, ammo tortishish ularni orqaga tortadi. Boshqa tomondan, agar zarracha juda tez harakatlansa, u boshqalardan munosib masofaga ajralib ketishi mumkin. Shunday qilib, odatda qizdirilganda sodir bo'ladigan zarrachalar tezligining oshishi bilan bug'lanish jarayoni, ya'ni suyuqlikning gazga aylanishi sodir bo'ladi.
Turli jismoniy holatlardagi jismlarning xatti-harakati
Gazlar, suyuqliklar, qattiq jismlarning tuzilishi, asosan, bu moddalarning barchasi atomlar, molekulalar yoki ionlardan tashkil topganligi bilan bog'liq, ammo bu zarrachalarning xatti-harakati butunlay boshqacha bo'lishi mumkin. Gaz zarralari bir-biridan xaotik uzoqda, suyuqlik molekulalari bir-biriga yaqin, lekin ular qattiq jismdagi kabi qattiq tuzilgan emas. Gaz zarralari tebranadi va yuqori tezlikda harakatlanadi. Suyuqlikning atomlari va molekulalari tebranadi, harakatlanadi va bir-birining yonidan o'tadi. Qattiq jismning zarralari ham tebranishi mumkin, lekin harakat ularga xos emas.

Ichki tuzilishning xususiyatlari
Moddaning xulq-atvorini tushunish uchun avvalo uning ichki tuzilishi xususiyatlarini o'rganish kerak. Granit, zaytun moyi va geliy o'rtasidagi ichki farqlar qanday? shar? Bu savolga javob berishga materiya tuzilishining oddiy modeli yordam beradi.
 Model haqiqiy ob'ekt yoki moddaning soddalashtirilgan versiyasidir. Misol uchun, haqiqiy qurilish boshlanishidan oldin, me'morlar birinchi navbatda namunaviy qurilish loyihasini quradilar. Bunday soddalashtirilgan model aniq tavsifni anglatmaydi, lekin ayni paytda u yoki bu tuzilma qanday bo'lishi haqida taxminiy tasavvur berishi mumkin.
Model haqiqiy ob'ekt yoki moddaning soddalashtirilgan versiyasidir. Misol uchun, haqiqiy qurilish boshlanishidan oldin, me'morlar birinchi navbatda namunaviy qurilish loyihasini quradilar. Bunday soddalashtirilgan model aniq tavsifni anglatmaydi, lekin ayni paytda u yoki bu tuzilma qanday bo'lishi haqida taxminiy tasavvur berishi mumkin.
Soddalashtirilgan modellar
Ilm-fanda esa modellar har doim ham emas jismoniy jismlar. O'tgan asrda insonning jismoniy dunyo haqidagi tushunchasi sezilarli darajada o'sdi. Biroq, to'plangan bilim va tajribaning katta qismi, masalan, matematik, kimyoviy va fizik formulalar ko'rinishidagi o'ta murakkab tasvirlarga asoslanadi.  Bularning barchasini tushunish uchun siz ushbu aniq va murakkab fanlarni juda yaxshi bilishingiz kerak. Olimlar fizik hodisalarni tasavvur qilish, tushuntirish va bashorat qilish uchun soddalashtirilgan modellarni ishlab chiqdilar. Bularning barchasi nima uchun ba'zi jismlar ma'lum bir haroratda doimiy shakl va hajmga ega ekanligini tushunishni sezilarli darajada osonlashtiradi, boshqalari esa ularni o'zgartirishi mumkin va hokazo.
Bularning barchasini tushunish uchun siz ushbu aniq va murakkab fanlarni juda yaxshi bilishingiz kerak. Olimlar fizik hodisalarni tasavvur qilish, tushuntirish va bashorat qilish uchun soddalashtirilgan modellarni ishlab chiqdilar. Bularning barchasi nima uchun ba'zi jismlar ma'lum bir haroratda doimiy shakl va hajmga ega ekanligini tushunishni sezilarli darajada osonlashtiradi, boshqalari esa ularni o'zgartirishi mumkin va hokazo.
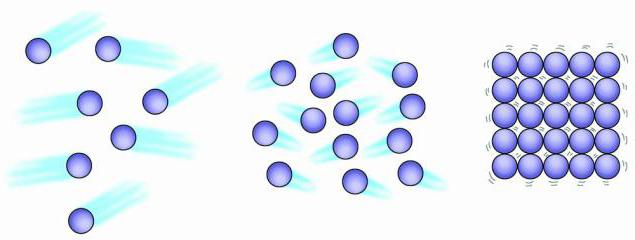
Barcha moddalar mayda zarrachalardan tashkil topgan. Bu zarralar doimiy harakatda. Harakat hajmi haroratga bog'liq. Haroratning oshishi harakat tezligining oshishini ko'rsatadi. Gazsimon, suyuq va qattiq jismlarning tuzilishi ularning zarrachalarining harakat erkinligi, shuningdek, zarrachalarning bir-biriga qanchalik kuchli tortilishi bilan farqlanadi. Jismoniy uning jismoniy holatiga bog'liq. suyuq suv va muz bir xil Kimyoviy xossalari, lekin ular jismoniy xususiyatlar sezilarli darajada farq qiladi.
>>Fizika: Gazsimon, suyuq va qattiq jismlarning tuzilishi
Molekulyar kinetik nazariya moddaning nima uchun gazsimon, suyuq va qattiq holatda bo'lishi mumkinligini tushunishga imkon beradi.
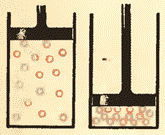
Gazlar. Gazlarda atomlar yoki molekulalar orasidagi masofa o'rtacha ko'p marta bo'ladi ko'proq o'lchamlar molekulalarning o'zlari ( 8.5-rasm). Masalan, atmosfera bosimida idishning hajmi uning tarkibidagi molekulalar hajmidan o'n minglab marta kattaroqdir.
Gazlar osongina siqiladi, molekulalar orasidagi o'rtacha masofa kamayadi, lekin molekula shakli o'zgarmaydi ( 8.6-rasm).
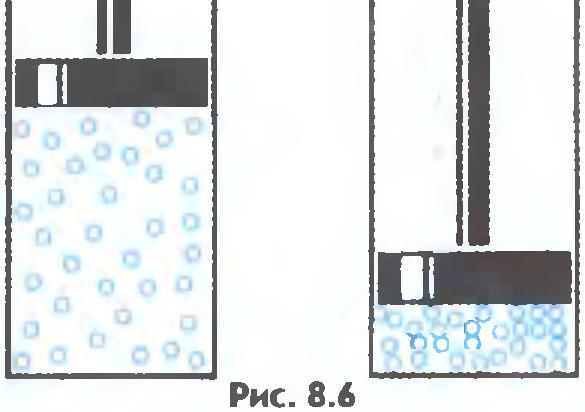
Katta tezlikka ega molekulalar - sekundiga yuzlab metrlar - kosmosda harakatlanadi. To'qnashib, ular bilyard to'plari kabi turli yo'nalishlarda bir-birlaridan sakrab tushadilar. Gaz molekulalarining kuchsiz tortishish kuchlari ularni bir-biriga yaqin tuta olmaydi. Shunung uchun gazlar cheksiz kengayishi mumkin. Ular na shaklni, na hajmni saqlamaydilar.
Idish devorlariga molekulalarning ko'plab ta'siri gaz bosimini hosil qiladi.
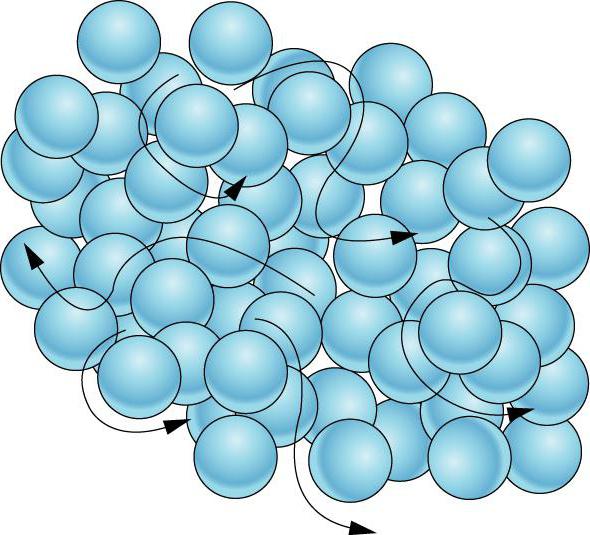
Suyuqliklar. Suyuqlik molekulalari bir-biriga deyarli yaqin joylashgan ( 8.7-rasm), shuning uchun suyuqlik molekulasi gaz molekulasidan farq qiladi. Suyuqliklarda qisqa masofali tartib deb ataladigan tartib mavjud, ya'ni molekulalarning tartibli joylashuvi bir necha molekulyar diametrlarga teng masofalarda saqlanadi. Molekula qo'shni molekulalar bilan to'qnashib, o'z muvozanat holatida tebranadi. Faqat vaqti-vaqti bilan u yangi muvozanat holatiga tushib, yana bir "sakrash" qiladi. Ushbu muvozanat holatida itaruvchi kuch jozibador kuchga teng, ya'ni molekulaning umumiy o'zaro ta'sir kuchi nolga teng. Vaqt oʻtroq hayot suv molekulalari, ya'ni xona haroratida bir o'ziga xos muvozanat holati atrofida uning tebranish vaqti o'rtacha 10 -11 s. Bir tebranish vaqti ancha kam (10 -12 -10 -13 s). Harorat ko'tarilgach, molekulalarning turg'unlik muddati qisqaradi.

Birinchi marta sovet fizigi Ya.I.Frenkel tomonidan asos solingan suyuqliklardagi molekulyar harakatning tabiati suyuqliklarning asosiy xossalarini tushunish imkonini beradi.
Suyuqlik molekulalari bir-birining yonida joylashgan. Hajmining pasayishi bilan itaruvchi kuchlar juda katta bo'ladi. Bu tushuntiradi suyuqliklarning past siqilishi.
Ma'lumki, suyuqliklar suyuq, ya'ni shaklini saqlamaydi. Buni shunday tushuntirish mumkin. Tashqi kuch sekundiga molekulyar sakrashlar sonini sezilarli darajada o'zgartirmaydi. Ammo molekulalarning bir turg'un holatdan ikkinchisiga sakrashi asosan harakat yo'nalishida sodir bo'ladi. tashqi kuch (8.8-rasm). Shuning uchun suyuqlik oqadi va idish shaklini oladi.
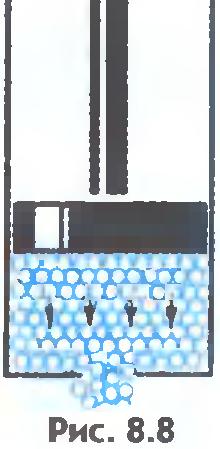
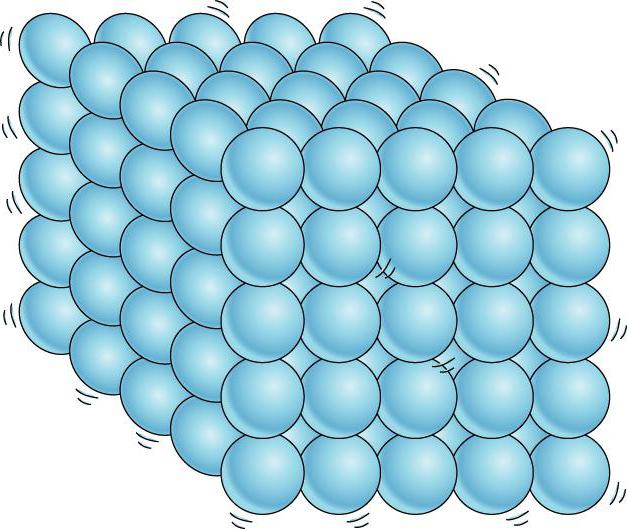
Suyuqlar va qattiq moddalar o'rtasida yana bir muhim farq bor. Suyuqlikni odamlar olomoniga qiyoslash mumkin, bu erda alohida shaxslar o'rnida bezovta bo'lib turaveradi va qattiq tanani bir xil shaxslarning mutanosib kogortasiga o'xshatish mumkin, ular diqqatni jalb qilmasalar ham, ular orasida o'rtacha masofani saqlab turadilar. o'zlari. Agar biz qattiq jismning atomlari yoki ionlarining muvozanat pozitsiyalari markazlarini bog'lasak, u holda biz to'g'ri fazoviy panjarani olamiz. kristalli.
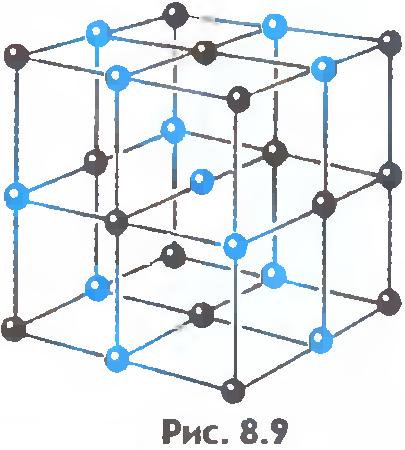
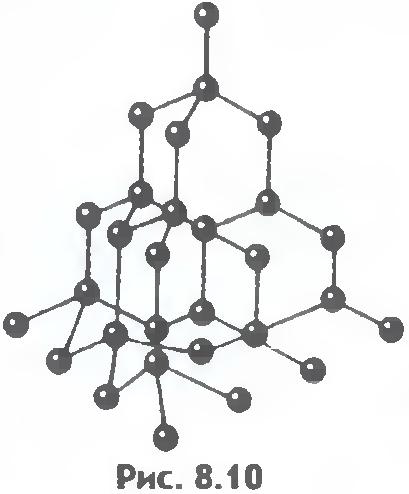
8.9 va 8.10-rasmlarda osh tuzi va olmosning kristall panjaralari ko'rsatilgan. Kristal atomlarining joylashishidagi ichki tartib muntazam tashqi geometrik shakllarga olib keladi.
8.11-rasmda Yakutiya olmoslari ko'rsatilgan.
gaz masofasi l molekulalar orasidagi masofa molekulalarning kattaligidan ancha katta r0:" l>>r 0
.
Suyuq va qattiq moddalar uchun l≈r0. Suyuqlik molekulalari tartibsiz joylashgan bo'lib, vaqti-vaqti bilan bir turg'un holatdan ikkinchisiga o'tadi.
Kristalli qattiq jismlarda molekulalar (yoki atomlar) qat'iy tartibli tarzda joylashtirilgan.
???
1. Gaz cheksiz kengayish qobiliyatiga ega. Nima uchun Yerda atmosfera mavjud?
2. Gaz, suyuqlik va qattiq molekulalarning harakat traektoriyalari o'rtasidagi farq nima? Ushbu holatlardagi moddalar molekulalarining taxminiy traektoriyalarini chizing.
G.Ya.Myakishev, B.B.Buxovtsev, N.N.Sotskiy, Fizika 10-sinf
Dars mazmuni dars xulosasi qo'llab-quvvatlash ramka dars taqdimoti tezlashtirish usullari interaktiv texnologiyalar Amaliyot topshiriq va mashqlar o'z-o'zini tekshirish seminarlar, treninglar, keyslar, kvestlar uy vazifalarini muhokama qilish savollari ritorik savollar talabalardan Tasvirlar audio, videokliplar va multimedia fotosuratlar, rasmlar grafikasi, jadvallar, sxemalar hazil, latifalar, hazillar, komikslar, masallar, krossvordlar, iqtiboslar Qo'shimchalar tezislar maqolalar, qiziquvchan varaqlar uchun chiplar darsliklar, asosiy va qo'shimcha atamalarning lug'ati Darslik va darslarni takomillashtirishdarslikdagi xatolarni tuzatish darslikdagi parchani yangilash darsdagi innovatsiya elementlari eskirgan bilimlarni yangilari bilan almashtirish Faqat o'qituvchilar uchun mukammal darslar yil uchun kalendar rejasi ko'rsatmalar muhokama dasturlari Integratsiyalashgan darslarAgar sizda ushbu dars uchun tuzatishlar yoki takliflaringiz bo'lsa,
Molekulyar kinetik nazariya moddaning nima uchun gazsimon, suyuq va qattiq holatda bo'lishi mumkinligini tushunishga imkon beradi.
Gaz. Gazlarda muhitdagi atomlar yoki molekulalar orasidagi masofa molekulalarning o'z o'lchamidan ko'p marta katta bo'ladi (10-rasm). Masalan, qachon atmosfera bosimi tomir hajmi o'nlab
idishdagi gaz molekulalari hajmidan ming marta kattaroqdir.
Gazlar oson siqiladi, chunki gaz siqilganda faqat molekulalar orasidagi o'rtacha masofa kamayadi, lekin molekulalar bir-birini "siqmaydi" (11-rasm).
Katta tezlikka ega molekulalar - sekundiga yuzlab metrlar - kosmosda harakatlanadi. To'qnashib, ular bilyard to'plari kabi turli yo'nalishlarda bir-birlaridan sakrab tushadilar.
Gaz molekulalarining kuchsiz tortishish kuchlari ularni bir-biriga yaqin tuta olmaydi. Shuning uchun gazlar cheksiz ravishda kengayishi mumkin. Ular na shaklni, na hajmni saqlamaydilar.
Idish devorlariga molekulalarning ko'plab ta'siri gaz bosimini hosil qiladi.
Suyuqliklar. Suyuqliklarda molekulalar deyarli bir-biriga yaqin joylashgan (12-rasm). Shuning uchun suyuqlikdagi molekula gazga qaraganda boshqacha harakat qiladi. Hujayradagi kabi, boshqa molekulalar tomonidan mahkamlangan holda, u "joyida yugurishni" amalga oshiradi (muvozanat holatida tebranadi, qo'shni molekulalar bilan to'qnashadi). Faqat vaqti-vaqti bilan u "qafas panjaralari" ni yorib o'tib, "sakrash" qiladi, lekin keyin u yangi qo'shnilar tomonidan tashkil etilgan yangi "qafas" ga tushadi. Suv molekulasining “oʻtroq hayoti” vaqti, yaʼni xona haroratida maʼlum bir muvozanat holati atrofidagi tebranish vaqti oʻrtacha s ni tashkil qiladi. Bir tebranish vaqti ancha kam (s). Harorat ko'tarilgach, molekulalarning "o'tiradigan hayoti" kamayadi. Birinchi marta sovet fizigi Ya.I.Frenkel tomonidan asos solingan suyuqliklardagi molekulyar harakatning tabiati suyuqliklarning asosiy xossalarini tushunish imkonini beradi.
Suyuqlik molekulalari to'g'ridan-to'g'ri bir-birining yonida joylashgan.Shuning uchun suyuqlik hajmini oz miqdorda bo'lsa ham o'zgartirmoqchi bo'lganingizda molekulalarning o'z deformatsiyasi boshlanadi (13-rasm). Va bu juda ko'p kuch talab qiladi. Bu suyuqliklarning past siqilishini tushuntiradi.
Suyuqliklar, siz bilganingizdek, suyuqlikdir, ya'ni ular o'z shakllarini saqlamaydilar. Bu quyidagicha izohlanadi. Agar suyuqlik oqmasa, u holda molekulalarning bir "o'tirgan" holatdan ikkinchisiga sakrashlari barcha yo'nalishlarda bir xil chastotada sodir bo'ladi (12-rasm). Tashqi kuch sekundiga molekulyar hoplar sonini sezilarli darajada o'zgartirmaydi, lekin molekulyar hoplar bir "o'tirgan" holatdan ikkinchisiga asosan tashqi kuch yo'nalishida sodir bo'ladi (14-rasm). Shuning uchun suyuqlik oqadi va idish shaklini oladi
Qattiq moddalar. Qattiq jismlarning atomlari yoki molekulalari suyuqliklardan farqli o'laroq, ma'lum muvozanat pozitsiyalari atrofida tebranadi. To'g'ri, ba'zida molekulalar o'zlarining muvozanat holatini o'zgartiradilar, ammo bu juda kamdan-kam hollarda sodir bo'ladi. Shuning uchun qattiq moddalar nafaqat hajmni, balki shaklini ham saqlaydi.
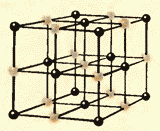
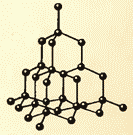
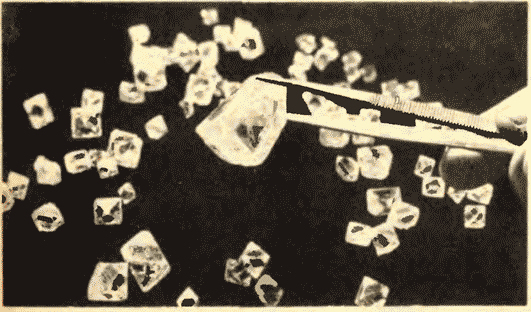
Suyuqlar va qattiq moddalar o'rtasida yana bir muhim farq bor. Suyuqlikni alohida a'zolari o'z o'rnida bemalol itarib turadigan olomonga o'xshatish mumkin, qattiq jism esa nozik kogortaga o'xshaydi, uning a'zolari e'tiborda turmasa ham (issiqlik harakati tufayli) o'zaro o'rtacha ma'lum intervallarni. Agar biz qattiq jismning atomlari yoki ionlarining muvozanat pozitsiyalarining markazlarini bog'lasak, biz kristalli deb ataladigan muntazam fazoviy panjarani olamiz. 15 va 16-rasmlarda osh tuzi va olmosning kristall panjaralari ko'rsatilgan. Kristallarning atomlarini joylashtirishdagi ichki tartib geometrik jihatdan to'g'ri tashqi shakllarga olib keladi. 17-rasmda Yoqut olmoslari ko'rsatilgan.
Molekulyar kinetik nazariya asosida moddaning asosiy xossalarini sifatli tushuntirish, siz ko'rganingizdek, unchalik qiyin emas. Biroq, eksperimental tarzda o'lchangan kattaliklar (bosim, harorat va boshqalar) va molekulalarning o'z xususiyatlari, ularning soni va harakat tezligi o'rtasidagi miqdoriy munosabatlarni o'rnatuvchi nazariya juda murakkab. Biz gazlar nazariyasini ko'rib chiqish bilan cheklanamiz.
1. Molekulalarning issiqlik harakati mavjudligiga dalil keltiring.
2. Nima uchun Braun harakati faqat kichik massa zarralari uchun seziladi?
3. Molekulyar kuchlarning tabiati qanday? 4. Molekulalar orasidagi o'zaro ta'sir kuchlari ular orasidagi masofaga qanday bog'liq? 5. Nima uchun silliq, toza kesikli ikkita qo'rg'oshin panjarasi bir-biriga bosilganda bir-biriga yopishadi? 6. Gazlar, suyuqliklar va qattiq jismlar molekulalarining issiqlik harakati o'rtasidagi farq nima?







