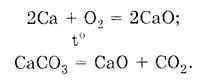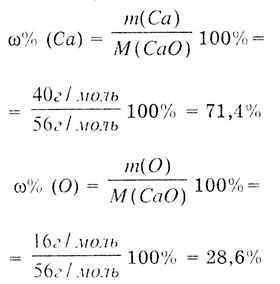Zakon održanja mase u hemijskoj formulaciji. Zakon održanja mase i energije. Najveće dostignuće svjetske nauke
Zakon održanja mase.
Masa tvari koje ulaze u kemijsku reakciju jednaka je masi tvari koje nastaju kao rezultat reakcije.
Zakon održanja mase je poseban slučaj opšteg zakona prirode - zakona održanja materije i energije. Na osnovu ovog zakona, hemijske reakcije se mogu prikazati korišćenjem hemijskih jednačina, korišćenjem hemijskih formula supstanci i stehiometrijskih koeficijenata koji odražavaju relativne količine (broj molova) supstanci uključenih u reakciju.
Na primjer, reakcija sagorijevanja metana se piše na sljedeći način:
Zakon održanja mase supstanci
(M.V. Lomonosov, 1748; A. Lavoisier, 1789)
Masa svih supstanci uključenih u hemijsku reakciju jednaka je masi svih produkata reakcije.
Atomsko-molekularna teorija objašnjava ovaj zakon na sljedeći način: kao rezultat kemijskih reakcija, atomi ne nestaju i ne nastaju, već se preuređuju (tj. kemijska transformacija je proces prekida nekih veza između atoma i formiranja drugi, kao rezultat kojih se iz molekula izvornih tvari dobivaju molekuli produkta reakcije). Budući da broj atoma prije i nakon reakcije ostaje nepromijenjen, njihova ukupna masa također se ne bi trebala mijenjati. Masa je shvaćena kao veličina koja karakteriše količinu materije.
Početkom 20. vijeka formulacija zakona održanja mase je revidirana u vezi sa pojavom teorije relativnosti (A. Einstein, 1905), prema kojoj masa tijela zavisi od njegove brzine i , dakle, karakteriše ne samo količinu materije, već i njeno kretanje. Energija E koju primi tijelo povezana je sa povećanjem njegove mase m relacijom E = m c 2 , gdje je c brzina svjetlosti. Ovaj odnos se ne koristi u hemijskim reakcijama, jer 1 kJ energije odgovara promjeni mase od ~10 -11 g i m se teško može izmjeriti. AT nuklearne reakcije, pri čemu je E ~10 6 puta veći nego u hemijskim reakcijama, treba uzeti u obzir m.
Na osnovu zakona održanja mase moguće je sastaviti jednadžbe za hemijske reakcije i koristiti ih za proračune. To je osnova kvantitativne hemijske analize.
Zakon konstantnosti kompozicije
Zakon o postojanosti kompozicije ( J.L. Prust, 1801 -1808.) - bilo koje specifično hemijski čisto jedinjenje, bez obzira na način njegove pripreme, sastoji se od istog hemijski elementi, a omjeri njihovih masa su konstantni, i relativni brojevi njima atomi izražene kao celi brojevi. Ovo je jedan od osnovnih zakona hemija.
Zakon konstantnosti kompozicije ne važi berthollids(jedinjenja promjenjivog sastava). Međutim, konvencionalno, radi jednostavnosti, sastav mnogih bertolida se bilježi kao konstantan. Na primjer, kompozicija gvožđe(II) oksid zapisuje se kao FeO (umjesto preciznije formule Fe 1-x O).
|
ZAKON KONSTANTNOG SASTAVA |
|
Prema zakonu konstantnosti sastava, svaka čista supstanca ima stalan sastav, bez obzira na način njene pripreme. Dakle, kalcijum oksid se može dobiti na sljedeće načine:
Bez obzira na to kako je CaO supstanca dobijena, ona ima stalan sastav: jedan atom kalcija i jedan atom kiseonika formiraju molekul CaO kalcijum oksida. Odredite molarnu masu CaO:
Određujemo maseni udio Ca po formuli:
Zaključak: U hemijski čistom oksidu maseni udeo kalcijuma je uvek 71,4%, a kiseonika 28,6%. |
Zakon višestrukih odnosa
Zakon višestrukih odnosa je jedan od stehiometrijski zakoni hemija: ako dva supstance (jednostavno ili kompleks) tvore više od jednog jedinjenja međusobno, tada su mase jedne supstance po istoj masi druge supstance povezane kao cijeli brojevi, obično mali.
Primjeri
1) Sastav dušikovih oksida (u procentima mase) izražava se sljedećim brojevima:
|
Dušikov oksid N 2 O |
Dušikov oksid NO |
Dušikov anhidrid N 2 O 3 |
Dušikov dioksid NO 2 |
Anhidrid azota N 2 O 5 |
|
|
Privatni O/N |
Ako podijelimo brojeve donjeg reda sa 0,57, vidimo da su povezani kao 1:2:3:4:5.
2) Kalcijum hlorid formira se sa vodom 4 kristalni hidrat, čiji je sastav izražen formulama: CaCl 2 H 2 O, CaCl 2 2H 2 O, CaCl 2 4H 2 O, CaCl 2 6H 2 O, odnosno u svim ovim jedinjenjima mase vode po molekulu CaCl 2 su vezano kao 1:2:4:6.
Zakon zapreminskih odnosa
(Gay-Lussac, 1808.)
"Volume gasova koji ulaze u hemijske reakcije i zapremine gasova nastalih kao rezultat reakcije međusobno se odnose kao mali celi brojevi."
Posljedica. Stehiometrijski koeficijenti u jednadžbama kemijskih reakcija za molekule plinovitih tvari pokazuju u kojim volumnim odnosima plinovite tvari reagiraju ili nastaju.
2CO + O 2 2CO 2
Kada se dvije zapremine ugljičnog monoksida (II) oksidiraju jednom zapreminom kisika, nastaju 2 volumena ugljičnog dioksida, tj. zapremina početne reakcione smeše se smanjuje za 1 zapreminu.
b) U sintezi amonijaka iz elemenata:
n 2 + 3h 2 2nh 3
Jedna zapremina azota reaguje sa tri zapremine vodonika; u ovom slučaju nastaju 2 volumena amonijaka - volumen početne plinovite reakcijske mase će se smanjiti za 2 puta.
Klajperon-Mendeljejeva jednadžba
Ako napišemo kombinovani zakon o plinu za bilo koju masu bilo kojeg plina, onda ćemo dobiti Claiperon-Mendelejevovu jednačinu:
gdje je m masa plina; M je molekulska težina; p - pritisak; V - zapremina; T - apsolutna temperatura (°K); R je univerzalna plinska konstanta (8,314 J / (mol K) ili 0,082 l atm / (mol K)).
Za datu masu određenog gasa, odnos m/M je konstantan, tako da je kombinovani gasni zakon izveden iz Claiperon-Mendeljejevske jednačine.
Koliku zapreminu će zauzeti pri temperaturi od 17 °C i pritisku od 250 kPa ugljen monoksida (II) težine 84 g?
Broj molova CO je:
(CO) \u003d m (CO) / M (CO) = 84 / 28 \u003d 3 mol
Volumen CO na n.c. je
3 22,4 l = 67,2 l
Iz kombinovanog zakona o plinu Boyle-Mariottea i Gay-Lussaca:
(P V) / T = (P 0 V 0) / T 2
V (CO) \u003d (P 0 T V 0) / (P T 0) = (101,3 (273 + 17) 67,2) / (250 273) = 28,93 l
Relativna gustina gasova pokazuje koliko je puta 1 mol jednog gasa teži (ili lakši) od 1 mola drugog gasa.
D A(B) = (B) (A) = M (B) / M (A)
Prosječna molekulska težina mješavine plinova jednaka je ukupnoj masi smjese podijeljenoj s ukupnim brojem molova:
M cf \u003d (m 1 + .... + m n) / ( 1 + .... + n) \u003d (M 1 V 1 + .... M n V n) / ( 1 + .. .. + n)
ZAKON O OČUVANJU ENERGIJE : u izolaciji. energija sistema ostaje konstantna, mogući su samo prelazi jedne vrste energije u drugu. U termodinamici očuvanja energije, zakon odgovara prvom zakonu termodinamike, koji je izražen jednadžbom Q \u003d DU + W, gdje je Q broj topline prenesene sistemu, DU je promjena ekst. energija sistema, W je rad sistema. Poseban slučaj zakona održanja energije je Hessian zakon.
Koncept energije je revidiran u vezi s pojavom teorije relativnosti (A. Einstein, 1905): ukupna energija E je proporcionalna masi m i povezana je s njom relacijom E = mc2, gdje je c brzina svetlosti. Stoga se masa može izraziti u jedinicama energije i formulisati opštiji zakon održanja mase i energije: u izoliri. U sistemu je zbir masa i energije konstantan, a moguće su samo transformacije u strogo ekvivalentnim omjerima nekih oblika energije u druge i ekvivalentno povezane promjene mase i energije.
Zakon ekvivalenata
tvari međusobno djeluju u količinama proporcionalnim njihovim ekvivalentima. Prilikom rješavanja nekih problema, prikladnije je koristiti drugačiju formulaciju ovog zakona: mase (volumen) tvari koje reagiraju jedna s drugom proporcionalne su njihovim ekvivalentnim masama (volumenima).
ekvivalenti: hemijski elementi se međusobno kombinuju u strogo definisanim količinama koje odgovaraju njihovim ekvivalentima. Matematički izraz zakona ekvivalenata je sljedeći: gdje su m1 i m2 mase reagujućih ili formiranih supstanci, m eq (1) i m eq (2) su ekvivalentne mase ovih supstanci.
Na primjer: određena količina metala, čija je ekvivalentna masa 28 g/mol, istiskuje 0,7 litara vodonika mjereno u normalnim uvjetima iz kiseline. Odredite masu metala. Rešenje: znajući da je ekvivalentna zapremina vodonika 11,2 l/mol, to je proporcija: 28 g metala je ekvivalentno 11,2 l vodonika x g metala je ekvivalentno 0,7 l vodonika. Tada je x = 0,7 * 28 / 11,2 = 1,75 g.
Da bi se odredila ekvivalentna ili ekvivalentna masa, nije potrebno polaziti od njene kombinacije s vodikom. Mogu se odrediti prema sastavu spoja datog elementa sa bilo kojim drugim, čiji je ekvivalent poznat.
Na primjer: kada je 5,6 g željeza spojeno sa sumporom, nastalo je 8,8 g željeznog sulfida. Potrebno je pronaći ekvivalentnu masu željeza i njegov ekvivalent, ako je poznato da je ekvivalentna masa sumpora 16 g/mol. Rešenje: iz uslova zadatka sledi da u gvožđem sulfidu 5,6 g gvožđa čini 8,8-5,6 = 3,2 g sumpora. Prema zakonu ekvivalenata, mase supstanci u interakciji su proporcionalne njihovim ekvivalentnim masama, odnosno 5,6 g gvožđa je ekvivalentno 3,2 g sumpora meq (Fe) ekvivalentno je 16 g/mol sumpora. Odavde sledi da je m3KB(Fe) = 5,6*16/3,2=28 g/mol. Ekvivalent gvožđa je: 3=meq(Fe)/M(Fe)=28 g/mol:56 g/mol=1/2. Dakle, ekvivalent gvožđa je 1/2 mola, odnosno 1 mol gvožđa sadrži 2 ekvivalenta.
Avogadrov zakon
Posljedice zakona
Prva posledica Avogadrovog zakona: jedan mol bilo kog gasa pod istim uslovima zauzima istu zapreminu.
Konkretno, u normalnim uslovima, tj. na 0 °C (273 K) i 101,3 kPa, zapremina 1 mola gasa je 22,4 litara. Ova zapremina se naziva molarna zapremina gasa V m . Ovu vrijednost možete preračunati na druge temperature i pritiske koristeći Mendelejev-Clapeyronovu jednadžbu:
![]() .
.
Druga posledica Avogadrovog zakona: molarna masa prvog gasa jednaka je proizvodu molarna masa drugog gasa relativnom gustinom prvog gasa prema drugom.
Ova pozicija je bila od velike važnosti za razvoj hemije, jer omogućava određivanje parcijalne težine tela koja mogu da pređu u gasovito ili parno stanje. Ako prođe m označavamo parcijalnu težinu tijela, i kroz d je njegova specifična težina u stanju pare, zatim omjer m / d treba da bude konstantan za sva tela. Iskustvo je pokazalo da je za sva proučavana tijela, koja prelaze u paru bez raspadanja, ova konstanta jednaka 28,9, ako pri određivanju parcijalne težine polazimo od specifične težine zraka, uzete kao jedinice, ali će ova konstanta biti jednako 2, ako uzmemo specifičnu težinu vodonika kao jedinicu. Označavajući ovu konstantu, ili, što je isto, parcijalni volumen zajednički svim parama i plinovima kroz OD, imamo iz formule s druge strane m = dC. Budući da se specifična težina pare lako određuje, onda se vrijednost zamjenjuje d u formuli je prikazana i nepoznata parcijalna težina datog tijela.
Termohemija
termalni efekat hemijska reakcija
Iz Wikipedije, slobodne enciklopedije
Toplotni efekat hemijske reakcije ili promene entalpija sistem usled pojave hemijske reakcije - količina toplote koja se odnosi na promenu hemijske varijable koju je primio sistem u kojem se odvijala hemijska reakcija i produkti reakcije su poprimili temperaturu reaktanata.
Da bi toplotni efekat bio veličina koja zavisi samo od prirode hemijske reakcije koja je u toku, moraju biti ispunjeni sledeći uslovi:
Reakcija se mora odvijati ili pri konstantnoj zapremini Q v (izohorni proces), ili pri konstantnom pritisku Q p( izobarni proces).
U sistemu se ne radi nikakav rad, osim rada na proširenju koji je moguć sa P = const.
Ako se reakcija provodi u standardnim uvjetima pri T = 298,15 K = 25 ° C i P = 1 atm = 101325 Pa, toplinski učinak naziva se standardnim toplinskim efektom reakcije ili standardna entalpija reakcije Δ H r O . U termohemiji, standardni toplotni efekat reakcije se izračunava korišćenjem standardnih entalpija formiranja.
Standardna entalpija formiranja (standardna toplota formiranja)
Standardna toplota formiranja se shvata kao toplotni efekat reakcije formiranja jednog mola supstance jednostavne supstance, njegove komponente, koje su stabilne standardna stanja.
Na primjer, standardna entalpija formiranja je 1 mol metan od ugljenik i vodonik jednaka toplini reakcije:
C (tv) + 2H 2 (g) \u003d CH 4 (g) + 76 kJ / mol.
Standardna entalpija formiranja označava se Δ H fO . Ovdje indeks f označava formiranje (obrazovanje), a precrtani krug, koji podsjeća na Plimsol disk - na koju se vrijednost odnosi standardno stanje supstance. U literaturi se često nalazi druga oznaka za standardnu entalpiju - ΔH 298,15 0 , gdje 0 označava da je pritisak jednak jednoj atmosferi (ili, nešto preciznije, prema standardnim uslovima ), a 298,15 je temperatura. Ponekad se indeks 0 koristi za količine koje se odnose na čista supstanca, propisujući da je s njim moguće označiti standardne termodinamičke veličine samo kada se radi o čistoj tvari koja je odabrana kao standardno stanje . Standard se također može uzeti, na primjer, stanje materije izuzetno razblažen rješenje. "Plimsol disk" u ovom slučaju znači stvarno standardno stanje materije, bez obzira na njegov izbor.
Pretpostavlja se da je entalpija formiranja jednostavnih supstanci nula, a nula vrijednost entalpije formiranja se odnosi na agregacijsko stanje, koje je stabilno pri T = 298 K. Na primjer, za jod u kristalnom stanju Δ H I2(tv) 0 = 0 kJ/mol, a za tečnost jod Δ H I2(l) 0 = 22 kJ/mol. Entalpije formiranja jednostavnih supstanci u standardnim uslovima su njihove glavne energetske karakteristike.
Toplinski efekat bilo koje reakcije nalazi se kao razlika između zbira toplota stvaranja svih proizvoda i zbira toplota stvaranja svih reaktanata u ovoj reakciji (korolar Hesov zakon):
Δ H reakcije O = ΣΔ H f O (proizvodi) - ΣΔ H f O (reagensi)
Termohemijski efekti mogu biti uključeni u hemijske reakcije. Chemical Equations u kojima je naznačena količina oslobođene ili apsorbirane topline, nazivaju se termohemijske jednačine. Reakcije praćene oslobađanjem toplote u okolinu imaju negativan toplotni efekat i nazivaju se egzotermna. Reakcije praćene apsorpcijom toplote imaju pozitivan toplotni efekat i nazivaju se endotermni. Toplotni efekat se obično odnosi na jedan mol izreagovanog početnog materijala, čiji je stehiometrijski koeficijent maksimalan.
Temperaturna zavisnost termičkog efekta (entalpije) reakcije
Za izračunavanje temperaturne zavisnosti entalpije reakcije potrebno je poznavati molar toplotni kapacitet supstance uključene u reakciju. Promjena entalpije reakcije s porastom temperature od T 1 do T 2 izračunava se prema Kirchhoffovom zakonu (pretpostavlja se da u ovom temperaturnom rasponu molarni toplinski kapaciteti ne zavise od temperature i nema fazne transformacije):
![]()
Ako se fazne transformacije dešavaju u datom temperaturnom rasponu, tada je u proračunu potrebno uzeti u obzir topline odgovarajućih transformacija, kao i promjenu temperaturne ovisnosti toplinskog kapaciteta tvari koje su pretrpjele takve transformacije:
gdje je ΔC p (T 1 ,T f) promjena toplinskog kapaciteta u temperaturnom rasponu od T 1 do temperature faznog prijelaza; ΔC p (T f ,T 2 ) je promjena toplinskog kapaciteta u temperaturnom rasponu od temperature faznog prijelaza do konačne temperature, a T f je temperatura faznog prijelaza.
Standardna entalpija sagorevanja
Standardna entalpija sagorevanja - Δ H Gor o, toplotni efekat reakcije sagorevanja jednog mola supstance u kiseoniku do stvaranja oksida u najvećem stepenu oksidacije. Pretpostavlja se da je toplina sagorijevanja negorivih tvari nula.
Standardna entalpija rastvaranja
Standardna entalpija rastvaranja - Δ H rastvor, toplotni efekat procesa rastvaranja 1 mola supstance u beskonačno velikoj količini rastvarača. Sastoji se od toplote razaranja kristalna rešetka i toplinu hidratacija(ili toplota rješenje za nevodene otopine), koji se oslobađaju kao rezultat interakcije molekula otapala s molekulima ili ionima otopljene tvari uz stvaranje spojeva promjenjivog sastava - hidrata (solvata). Uništavanje kristalne rešetke, u pravilu, je endotermni proces - Δ H resh > 0, a hidratacija jona je egzotermna, Δ H hydra< 0. В зависимости от соотношения значений ΔH resh i Δ H hidro entalpija rastvaranja može imati i pozitivne i negativne vrijednosti. Dakle, rastvaranje kristala kalijum hidroksida praćeno oslobađanjem toplote
Δ H otopina KOH o \u003d Δ H resh o + Δ H hydrK + o + Δ H hydroOH −o = −59 kJ/mol
Pod entalpijom hidratacije - Δ H hydr, odnosi se na toplinu koja se oslobađa tokom prijelaza 1 mola jona iz vakuuma u otopinu.
Standardna entalpija neutralizacije
Standardna entalpija neutralizacije - Δ H neutralno u odnosu na entalpiju reakcije interakcije jakih kiselina i baza sa stvaranjem 1 mola vode pod standardnim uslovima:
HCl + NaOH = NaCl + H2O
H + + OH - \u003d H 2 O, ΔH neutral ° \u003d -55,9 kJ / mol
Standardna entalpija neutralizacije za koncentrovane rastvore jaki elektroliti ovisi o koncentraciji jona, zbog promjene vrijednosti ΔH hidratacije ° jona kada se razrijedi.
Entalpija
Entalpija je svojstvo materije koje ukazuje na količinu energije koja se može pretvoriti u toplinu.
Entalpija je termodinamičko svojstvo tvari koje ukazuje na razinu energije pohranjene u njenoj molekularnoj strukturi. To znači da dok materija može imati energiju na osnovu temperature i pritiska, ne može se sva pretvoriti u toplotu. Dio unutrašnje energije uvijek ostaje u tvari i održava njenu molekularnu strukturu. dio kinetička energija supstanca nije dostupna kada se njena temperatura približi temperaturi okoline. Dakle, entalpija je količina energije koja je dostupna za pretvorbu u toplinu pri određenoj temperaturi i pritisku. Entalpijske jedinice- Britanska termalna jedinica ili džul za energiju i Btu/lbm ili J/kg za specifičnu energiju.
Količina entalpije
Količina entalpija supstance na osnovu njene zadate temperature. Zadata temperatura je vrijednost koju su naučnici i inženjeri odabrali kao osnovu za proračune. Ovo je temperatura na kojoj je entalpija supstance nula J. Drugim riječima, supstanca nema raspoloživu energiju koja se može pretvoriti u toplinu. Ova temperatura na razne supstance drugačije. Na primjer, ova temperatura vode je trostruka tačka (0°C), dušika je -150°C, a rashladnih sredstava na bazi metana i etana su -40°C.
Ako je temperatura tvari iznad zadane temperature ili promijeni stanje u plinovito na datoj temperaturi, entalpija se izražava kao pozitivan broj. Suprotno tome, na temperaturi ispod date entalpije tvari izražava se kao negativan broj. Entalpija se koristi u proračunima za određivanje razlike u nivoima energije između dva stanja. Ovo je neophodno za postavljanje opreme i određivanje koeficijent korisnost procesa.
Entalpija se često definiše kao ukupna energija materije, budući da je jednak zbiru njegove unutrašnje energije (u) u datom stanju, zajedno sa njegovom sposobnošću da obavlja rad (pv). Ali u stvarnosti, entalpija ne pokazuje puna energija supstance na datoj temperaturi iznad apsolutne nule (-273°C). Stoga, umjesto definiranja entalpije kao ukupne topline tvari, tačnije je definirati je kao ukupnu količinu raspoložive energije tvari koja se može pretvoriti u toplinu. H=U+pV
Unutrašnja energija
Unutrašnja energija tijela (označena kao E ili U) je zbir energija molekularnih interakcija i toplinskih kretanja molekula. Unutrašnja energija je jednoznačna funkcija stanja sistema. To znači da kad god je sistem u datom stanju, njegov unutrašnja energija poprima vrijednost svojstvenu ovom stanju, bez obzira na historiju sistema. Shodno tome, promjena unutrašnje energije tokom prijelaza iz jednog stanja u drugo uvijek će biti jednaka razlici između njenih vrijednosti u konačnom i početnom stanju, bez obzira na put kojim je napravljen prijelaz.
Unutrašnja energija tijela ne može se izmjeriti direktno. Može se odrediti samo promjena unutrašnje energije:
Zakačen za tijelo toplota, mjereno u džula
- Posao, koje tijelo izvodi protiv vanjskih sila, mjereno u džulima
Ova formula je matematički izraz prvi zakon termodinamike
Za kvazi-statički procesi važi sljedeća relacija:
-temperatura, mjereno u kelvins
-entropija, mjereno u džulima/kelvinima
-pritisak, mjereno u Pascals
-hemijski potencijal
Broj čestica u sistemu
Idealni gasovi
Prema Jouleovom zakonu, izvedenom empirijski, unutrašnja energija idealan gas nezavisno od pritiska ili zapremine. Na osnovu ove činjenice možemo dobiti izraz za promjenu unutrašnje energije idealan gas. Po definiciji molarni toplotni kapacitet pri konstantnoj zapremini 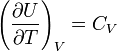 . Pošto je unutrašnja energija idealnog gasa funkcija samo temperature, onda
. Pošto je unutrašnja energija idealnog gasa funkcija samo temperature, onda
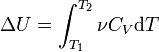 .
.
Ista formula vrijedi i za izračunavanje promjene unutrašnje energije bilo kojeg tijela, ali samo u procesima s konstantnom zapreminom ( izohorni procesi); Uglavnom C V (T,V) je funkcija i temperature i zapremine.
Ako zanemarimo promjenu molarnog toplinskog kapaciteta s promjenom temperature, dobivamo:
Δ U = ν C V Δ T,
gdje je ν količina supstance, Δ T- promjena temperature.
UNUTRAŠNJA ENERGIJA SUPSTANCE, TIJELA, SISTEMA
(grčki: ένέργια - aktivnost, energije). Unutrašnja energija je dio ukupna energija tela (sistemima tel): E = E k + E str + U, gdje E k - kinetička energija makroskopski pokreta sistemi, E str - potencijalna energija, zbog prisustva vanjske sile polja(gravitacijski, električni, itd.), U- unutrašnja energija. Unutrašnja energija supstance, tijela, sistemi tijela - funkcija države, definisan kao ukupna rezerva energije unutrašnjeg stanja supstance, tela, sistema, koja se menja (oslobađa) u proces hemijski reakcije, prijenos topline i performanse rad. Komponente unutrašnje energije: (a) kinetička energija toplote vjerovatnoća kretanje čestica (atoma, molekula, joni itd.), koji čine supstancu (tijelo, sistem); (b) potencijalna energija čestica zbog njihove intermolekularne interakcija; (c) energija elektrona u elektronskim omotačima, atoma i jona; (d) intranuklearna energija. Unutrašnja energija nije povezana sa procesom promene stanja sistema. Sa bilo kakvim promjenama u sistemu, unutrašnja energija sistema, zajedno sa okolinom, ostaje konstantna. Odnosno, unutrašnja energija se ne gubi niti dobija. Istovremeno, energija se može kretati iz jednog dijela sistema u drugi ili se transformirati iz jednog forme drugome. Ovo je jedan od izraza zakon očuvanje energije - prvi zakon termodinamike. Dio unutrašnje energije može se pretvoriti u rad. Ovaj dio unutrašnje energije naziva se slobodna energija - G. (U hemijskim jedinjenjima to se naziva hemijskim potencijal). Ostatak unutrašnje energije, koji se ne može pretvoriti u rad, naziva se vezana energija - W b .
Entropija
Entropija (od grčkiἐντροπία - pretvaranje, pretvaranje) u prirodne nauke- mjera nereda sistemima, koji se sastoji od mnogih elementi. Konkretno, u statistička fizika - mjera vjerovatnoće realizacija bilo kojeg makroskopskog stanja; in teorija informacija- mjera neizvjesnosti bilo kojeg iskustva (test), koje može imati različite ishode, a samim tim i broj informacije; in istorijska nauka, za objašnjenja fenomen alternativna istorija (invarijantnost i varijabilnost istorijski proces).
Nakon dokazivanja postojanja atoma i molekula veliko otkriće atomsko-molekularna teorija je bio zakon održanja mase, koji je u formi filozofskog koncepta formulisao veliki ruski naučnik Mihail Vasiljevič Lomonosov (1711-1765) 1748. godine, a eksperimentalno potvrdio sam 1756. i nezavisno od francuskog hemičara. A. L. Lavoisier 1789
Masa svih supstanci koje ulaze u hemijsku reakciju jednaka je masi svih produkata reakcije.
Eksperimenti sagorevanja supstanci, koji su izvedeni pre Lomonosova, sugerisali su da masa supstanci u procesu reakcije nije očuvana. Kada se zagrije na zraku, živa se pretvorila u crvenu ljusku, čija je masa bila veća od mase metala. Naprotiv, masa pepela nastala tokom sagorevanja drveta je uvek manja od mase izvorne supstance.
Lomonosov je proveo jednostavan eksperiment, koji je pokazao da je izgaranje metala reakcija adicije, a povećanje mase metala nastaje zbog dodavanja dijela zraka. Kalcinirao je metale u zatvorenoj staklenoj posudi i otkrio da se masa posude nije promijenila, iako se odvijala kemijska reakcija. Nakon otvaranja posude, zrak je ušao u nju, a masa posude se povećala. Dakle, preciznim mjerenjem mase svih sudionika u reakciji, ispada da je masa tvari u kemijskoj reakciji očuvana. Zakon održanja mase bio je od velike važnosti za atomsku i molekularnu teoriju. Potvrdio je da su atomi nedjeljivi i da se ne mijenjaju tokom hemijskih reakcija. Molekuli izmjenjuju atome tokom reakcije, ali ukupan broj atoma svake vrste se ne mijenja, pa je stoga ukupna masa tvari u procesu reakcije očuvana.
Zakon održanja mase je poseban slučaj opšteg zakona prirode - zakona održanja energije, koji kaže da je energija izolovanog sistema konstantna. Energija je mjera kretanja i interakcije razne vrste stvar. Za bilo koji proces u izolovani sistem energija se ne proizvodi niti uništava, može se samo mijenjati iz jednog oblika u drugi.
Jedan oblik energije je takozvana energija mirovanja, koja je povezana s masom Ajnštajnovom relacijom
E 0 = m 0 s 2,
gdje je c brzina svjetlosti u vakuumu (c = 3 10 8 m/s). Ovaj odnos pokazuje da se masa može pretvoriti u energiju i obrnuto. Upravo to se događa u svim nuklearnim reakcijama, pa se stoga krši zakon održanja mase u nuklearnim procesima. Međutim, zakon održanja energije u ovom slučaju ostaje važeći, ako uzmemo u obzir energiju mirovanja.
U kemijskim reakcijama, promjena mase uzrokovana oslobađanjem ili apsorpcijom energije je vrlo mala. Tipični termički efekat hemijske reakcije je, po redu veličine, 100 kJ/mol. Izračunajmo kako se masa mijenja u ovom slučaju:
∆m = ∆E/s 2 = 10 5 / (3 10 8) 2 ~ 10 -12 kg/mol = 10 -9 g/mol.
Tema: Početne hemijske ideje
Lekcija: Suština hemijske reakcije. Zakon održanja mase supstanci
Pitanje suštine hemijska transformacija dugo je ostao misterija za prirodnjake. Tek razvojem atomsko-molekularne teorije postalo je moguće pretpostaviti kako se kemijske reakcije odvijaju na razini atoma i molekula.
U skladu s atomsko-molekularnom teorijom, tvari se sastoje od molekula, a molekule od atoma. U toku kemijske reakcije, atomi koji čine izvorne tvari ne nestaju i ne pojavljuju se novi atomi.
Tada možemo pretpostaviti da se kao rezultat kemijske reakcije formiraju produkti reakcije od atoma koji su prethodno bili dio izvornih tvari. Evo modela hemijske reakcije:
Rice. 1. Model hemijske reakcije sa stanovišta AMT
Nakon analize ovog modela, možemo postaviti hipotezu (naučno utemeljenu pretpostavku):
Ukupna masa produkta reakcije mora biti jednaka ukupnoj masi polaznih materijala.
Čak je i Leonardo da Vinci rekao: "Znanje, neprovjereno iskustvom, majka svake sigurnosti, je beskorisno i puno grešaka." To znači da hipoteza nikada neće postati zakon ako se ne potvrdi eksperimentalno.
Eksperimentalna metoda u hemiji počela je da se široko koristi nakon istraživanja R. Boylea u 17. veku. Engleski prirodnjak kalcinirao je metale u nezatvorenim posudama - retortama i otkrio da je nakon kalcinacije masa metala postala veća.
Na osnovu ovih eksperimenata nije uzeo u obzir ulogu vazduha i napravio je pogrešan zaključak da se masa supstanci menja tokom hemijskih reakcija.
M.V. Lomonosov je, za razliku od R. Boylea, kalcinirao metale ne na otvorenom, već u zatvorenim retortama i vagao ih prije i poslije kalcinacije. On je dokazao da masa supstanci prije i poslije reakcije ostaje nepromijenjena i da se pri kalcinaciji metalu dodaje zrak (kiseonik tada još nije bio otkriven). Ali Lomonosov nije objavio rezultate svog istraživanja.
Godine 1774. eksperimente R. Boylea ponovio je A. Lavoisier sa potpuno istim rezultatima kao i Lomonosov. Ali on je napravio novo, vrlo važno zapažanje, naime, da je samo dio zraka u zatvorenoj retorti spojen s metalom i da je povećanje težine metala koji je prešao u vagu jednako smanjenju u težini vazduha u retorti. Međutim, dio metala je ostao u slobodnom obliku.
Dakle, nezavisno jedan od drugog, M.V. Lomonosov i A. Lavoisier potvrdili su valjanost pretpostavke o očuvanju mase tvari kao rezultat kemijske reakcije.
Ova pretpostavka je postala zakon tek nakon desetogodišnjeg istraživanja njemačkog hemičara G. Landolta početkom 20. vijeka. Danas zakon održanja mase je formulisan ovako:
Masa supstanci koje učestvuju u reakciji jednaka je masi produkta reakcije.
Ispravnost zakona održanja mase tvari može se potvrditi korištenjem sljedećeg eksperimenta. U prvoj Landolt posudi pripremiti rastvore kalijum jodida i olovnog nitrata. U drugoj posudi će se odvijati reakcija željeznog hlorida sa kalijum tiocijanatom. Čvrsto zatvorite čepove. Balansiramo vagu. Hoće li se ravnoteža održati nakon završetka reakcija? U prvoj posudi se taloži žuti precipitat olovnog jodida, a u drugom nastaje tamnocrveni željezni tiocijanat. U Landoltovim posudama odvijale su se kemijske reakcije: nastale su nove tvari. Ali ravnoteža nije poremećena (slika 2). Masa polaznih materijala je uvijek jednaka masi produkta reakcije.

Rice. 2. Eksperiment koji potvrđuje ispravnost zakona održanja mase tvari
Navedimo primjer još jednog eksperimenta koji dokazuje ispravnost zakona održanja mase tvari u kemijskim reakcijama. Unutar tikve, kada se čep zatvori, gorjet će svijeća. Uravnotežimo vagu. Zapalimo svijeću i spustimo je u tikvicu. Tikvu dobro zatvoriti čepom. Paljenje svijeće je hemijski proces. Nakon što se potroši kisik u tikvici, svijeća se gasi, hemijska reakcija je završena. Ali ravnoteža utega nije poremećena: masa produkta reakcije ostaje ista kao i masa početnih supstanci (slika 3).

Rice. 3. Eksperimentirajte sa zapaljenom svijećom u tikvici
Otkriće zakona održanja mase supstanci bilo je od velikog značaja za dalji razvoj hemije. Na osnovu zakona održanja mase supstanci vrše se najvažniji proračuni i sastavljaju jednačine hemijskih reakcija.
1. Zbirka zadataka i vježbi iz hemije: 8. razred: do udžbenika P.A. Orzhekovsky i dr. "Hemija, 8. razred" / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel. – M.: AST: Astrel, 2006.
2. Ushakova O.V. Radna sveska iz hemije: 8. razred: do udžbenika P.A. Oržekovski i dr. „Hemija. Razred 8” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; ispod. ed. prof. P.A. Oržekovski - M.: AST: Astrel: Profizdat, 2006. (str. 15-16)
3. Hemija: 8. razred: udžbenik. za generala institucije / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak. M.: AST: Astrel, 2005. (§6)
4. Hemija: inorg. hemija: udžbenik. za 8 ćelija. general institucije / G.E. Rudzitis, FuGyu Feldman. - M.: Obrazovanje, JSC "Moskovski udžbenici", 2009.
5. Enciklopedija za djecu. Tom 17. Hemija / Pogl. uredio V.A. Volodin, vodeći. naučnim ed. I. Leenson. – M.: Avanta+, 2003.
Dodatni web resursi
1. Jedinstvena zbirka digitalnih obrazovnih resursa ().
2. Elektronska verzija časopisa "Hemija i život" ().
Zadaća
With . 16 №№ 3,5 od Radna sveska iz hemije: 8. razred: do udžbenika P.A. Oržekovski i dr. „Hemija. Razred 8” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; ispod. ed. prof. P.A. Oržekovski - M.: AST: Astrel: Profizdat, 2006.
1. Zakon održanja mase i energije.
Ovo je kombinovani zakon. Uključuje dva zakona.
I. Zakon održanja mase : Masa tvari uključenih u reakciju jednaka je masi produkta reakcije.
Ovaj zakon je otkrio M. V. Lomonosov 1748. godine, a dopunio ga je A. L. Lavoisier 1789. godine.
Tokom reakcije, masa svakog 1 element.
Ovaj zakon vam omogućava da napravite jednadžbe hemijskih reakcija i izvršite proračune na osnovu njih. Nije apsolutno (vidi dolje). Zakon održanja energije je apsolutan.
2. Zakon održanja energije: Energija ne nastaje ni iz čega i ne nestaje, već samo prelazi iz jednog oblika u drugi.
Ovaj zakon je rezultat rada A. Einsteina. Ustanovio je vezu između energije i mase materije (1905.):
E \u003d ts 2,(6)
gdje With- brzina svjetlosti u vakuumu, jednaka -300.000 km/s. Budući da se energija oslobađa ili apsorbira kao rezultat kemijske reakcije, tada se, u skladu s Einsteinovom jednadžbom, mijenja i masa tvari. Međutim, ova promjena je toliko mala da se u praksi ne uzima u obzir (tzv. defekt mase).
Formiranje jednog mola klorovodika iz jednostavnih supstanci je praćeno toplinskim efektom od 92,3 kJ / mol, što odgovara gubitku mase tvari ("maseni defekt") od oko 10 -9 g.
Sljedeći zakoni vrijede samo za spojeve s konstantnim molekularnim sastavom- daltonida. Razlikuju se od jedinjenja koja imaju promjenjiv sastav molekula - berthollids.
Metalne legure sadrže spojeve ovog tipa M t M l, gdje t i n- varijable.
2. Zakon konstantnosti kompozicije (J. L. Prust, 1801).
Odnos između masa hemijski elementi, koji su dio ovog jedinjenja, je konstantna vrijednost, neovisno o načinu njegove pripreme.
3. Zakon višestrukih odnosa (J. Dalton, 1803).
Ako dva elementa čine nekoliko hemijska jedinjenja, tada su mase jednog od elemenata po određenoj masi drugog povezane jedna s drugom kao mali cijeli brojevi.
U ugljičnom monoksidu (II) CO: M (C) / M (O) \u003d 12/16 = 3/4, u ugljičnom monoksidu (IV) CO 2: M (C) / M (2 O) = 12 /32 \u003d 3 /osam. Stoga su mase ugljika po određenoj masi kisika u ovim spojevima povezane kao:
3 / 4: 3 / 8 =2:1
4. Zakon jednostavnih zapreminskih odnosa (J. L. Gay-Lussac, 1808).
Zapremine reagovanih gasova povezane su jedna s drugom i sa zapreminama gasova nastalih kao mali celi brojevi.
U reakciji stvaranja amonijaka u skladu sa stehiometrijskim koeficijentima u jednadžbi reakcije:
H 2 + 3N 2 = 2NH 3 dobijamo da je V (N 2) : V (H 2) : V (NH 3) = 1:3:2.
5. Avogadrov zakon (1811). Jednake zapremine različitih gasova pod istim uslovima (p i T) sadrže isti broj molekula.
Ovaj zakon slijedi iz analize Mendeljejev-Klapejronove jednačine stanja idealnog gasa:
pV = nRT.
Ova jednačina se može napisati za dva gasa: p 1 V 1= V 1 RT 1, p 2 V 2= V 2 RT 2 .
Ako je jednako p 1 = p 2, T 1 = T 2 i V i = V 2 količine tvari plinova će biti jednake: n 1= n 2 ili, s obzirom na Avogadro broj:
n 1 N A \u003d n 2 N A,
tj. broj molekula ovih gasova će takođe biti jednak.
Avogadrov zakon ima posljedice:
1. Isti broj molekula bilo kog gasa pod istim uslovima zauzima isti volumen.
2. Mase gasova uzetih u jednakim zapreminama pod istim uslovima (p, T) povezane su jedna s drugom kao njihove molarne mase:
t 1 / t 2 \u003d M 1 / M 2.(7)
Ova posljedica proizlazi iz jednakosti količina tvari ovih plinova (vidi gore): ν 1 = ν 2 .
Zamjenom umjesto količine tvari omjerom njene mase i molarne mase (jednačina 2) dobijamo:
t 1 / M 1 \u003d t 2 / M 2
t 1 / t 2 \u003d M g / M 2.
Drugi zaključak nam omogućava da izvedemo jednačinu za određivanje molarne mase nepoznatog gasa iz poznate vrednosti relativne gustine ovog gasa iz drugog poznatog gasa.
Nakon zamjene u brojnik i nazivnik lijeve strane jednačine 7 zapremina prvog i drugog plina, koji su jednaki, dobivamo:
t 1· V 2 / t 2 V 1 \u003d M 1 / M 2.
Omjer mase tvari i njenog volumena zamjenjuje se gustinom (vidi jednačinu 5):
R 1 / R 2 \u003d M 1 / M 2
i dobijamo jednačinu za izračunavanje molekulske težine prvog gasa iz drugog:
M 1= (ρ 1 / ρ 2) M 2 = D 1/2 M 2(8)
Ili u opšti pogled:
M=D G M g(9)
gdje D G- relativna gustina prvog gasa u odnosu na drugi.
Ako je poznata gustina vodonika datog gasa, onda se koristi sljedeća jednadžba:
M \u003d 2DH 2.(10)
Ako je poznata gustina gasa u vazduhu, onda se koristi jednačina:
M = 29D vazduh. (11)