Transformacija hemijskih elemenata. Kul, hemija
Od 26 trenutno poznatih transuranijumskih elemenata, 24 se ne nalaze na našoj planeti. Stvorio ih je čovjek. Kako se sintetišu teški i superteški elementi?
Prva lista od trideset i tri pretpostavljena elementa, "Tabela supstanci koje pripadaju svim kraljevstvima prirode, koja se može smatrati najjednostavnijim sastavni dijelovi tel", koju je objavio Antoine Laurent Lavoisier 1789. Zajedno sa kiseonikom, dušikom, vodonikom, sedamnaest metala i još nekoliko stvarnih elemenata, u njemu su figurirali svjetlost, kalorija i neki oksidi. A kada je Mendeljejev smislio periodni sistem 80 godina kasnije, hemičari su poznavali 62 elementa. Do početka 20. stoljeća vjerovalo se da u prirodi postoje 92 elementa - od vodonika do uranijuma, iako neki od njih još nisu otkriveni.
Međutim, već u kasno XIX Vekovima su naučnici pretpostavljali postojanje elemenata koji prate uranijum (transurane) u periodnom sistemu, ali oni nisu mogli biti otkriveni. Sada je poznato da zemljina kora sadrži u tragovima 93. i 94. element - neptunijum i plutonijum. Ali povijesno gledano, ovi elementi su prvo dobiveni umjetno, a tek onda otkriveni u sastavu minerala.
Od 94 prva elementa, 83 imaju ili stabilne ili dugovječne izotope, čiji je period poluraspada uporediv sa starošću Sunčevog sistema (na našu planetu su došli iz protoplanetarnog oblaka). Život preostalih 11 prirodnih elemenata je znatno kraći, te stoga nastaju u zemljinoj kori samo kao rezultat radioaktivnih raspada u kratko vrijeme. Ali šta je sa svim ostalim elementima, od 95. do 118.? Nema ih na našoj planeti. Svi su dobijeni vještačkim putem.
Prvo veštačko
Stvaranje vještačkih elemenata ima dugu istoriju. Osnovna mogućnost ovoga postala je jasna 1932. godine, kada su Werner Heisenberg i Dmitri Ivanenko došli do zaključka da atomska jezgra sastoje se od protona i neutrona. Dvije godine kasnije, grupa Enrica Fermija pokušala je proizvesti transuran zračenjem uranijuma sporim neutronima. Pretpostavljalo se da će jezgro uranijuma uhvatiti jedan ili dva neutrona, nakon čega će doći do beta raspada sa rođenjem 93. ili 94. elementa. Čak su brzo najavili otkriće transurana, koje je Fermi nazvao ausonijum i hesperijum u svom Nobelovom govoru 1938. godine. Međutim, njemački radiohemičari Otto Hahn i Fritz Strassmann, zajedno s austrijskom fizičarkom Lise Meitner, ubrzo su pokazali da Fermi nije bio u pravu: ovi nuklidi su već bili izotopi. poznatih elemenata, koji nastaje cijepanjem jezgri uranijuma na parove fragmenata približno iste mase. Upravo je ovo otkriće, napravljeno u decembru 1938. godine, omogućilo stvaranje nuklearnog reaktora i atomska bomba.Prvi sintetizovani element uopšte nije bio transuranijum, već ekamargan koji je predvideo Mendeljejev. Tražilo se u raznim rudama, ali bezuspješno. A 1937. godine, ekamargan, kasnije nazvan tehnecijum (od grčkog ??? - veštački) dobijen je granatiranjem mete molibdena sa jezgrima deuterijuma ubrzanim u ciklotronu u Nacionalnoj laboratoriji Lawrence Berkeley.
Laki projektili
Elementi od 93. do 101. dobijeni su interakcijom jezgara uranijuma ili transuranija koje ga prate sa neutronima, deuteronima (jezgra deuterijuma) ili alfa česticama (jezgra helijuma). Prvi uspjeh ovdje su postigli Amerikanci Edwin Macmillan i Philip Abelson, koji su 1940. sintetizirali neptunijum-239, razradivši Fermijevu ideju: hvatanje sporih neutrona uranijumom-238 i kasnijim beta raspadom uranijuma-239.Sljedeći, 94. element, plutonij, prvi put je otkriven prilikom proučavanja beta raspada neptunija-238, dobijenog deuteronskim bombardiranjem uranijuma na ciklotronu UC Berkeley početkom 1941. I ubrzo je postalo jasno da se plutonijum-239, pod dejstvom sporih neutrona, fisije ništa gore od uranijuma-235 i može poslužiti kao punjenje atomske bombe. Stoga su svi podaci o prijemu i svojstvima ovog elementa povjerljivi, a članak Macmillan, Glenn Seaborg (za svoja otkrića podijelili su nobelova nagrada 1951) i njihove kolege s porukom o drugom transuranijumu pojavili su se u štampi tek 1946. godine.
Američke vlasti su skoro šest godina odlagale i objavljivanje otkrića 95. elementa, americijuma, koji je krajem 1944. godine grupa Seaborg izolovala od proizvoda neutronskog bombardovanja plutonijuma u nuklearnom reaktoru. Nekoliko mjeseci ranije, fizičari iz istog tima dobili su prvi izotop elementa 96, atomske težine 242, sintetiziran bombardiranjem uranijuma-239 ubrzanim alfa česticama. Nazvan je curium u znak priznanja naučne zasluge Pjera i Marije Kiri, čime je otvorena tradicija nazivanja transuranija u čast klasika fizike i hemije.
60-inčni ciklotron na Univerzitetu u Kaliforniji bio je mjesto stvaranja još tri elementa, 97., 98. i 101. Prva dva su dobila imena po mjestu rođenja - berkelium i california. Berkelijum je sintetizovan u decembru 1949. tokom bombardovanja americijuma alfa česticama, a kalifornijum dva meseca kasnije istim bombardovanjem kurijuma. Elementi 99 i 100, einsteinium i fermium, otkriveni su tokom radiohemijske analize uzoraka prikupljenih na području atola Eniwetok, gdje su 1. novembra 1952. Amerikanci detonirali Mikeov termonuklearni naboj od deset megatona, čija je školjka napravljena od uranijuma. 238. Tokom eksplozije, jezgra uranijuma su apsorbovala do petnaest neutrona, nakon čega su pretrpjele lance beta raspada, što je dovelo do stvaranja ovih elemenata. Element 101, mendelevijum, dobijen je početkom 1955. Seaborg, Albert Ghiorso, Bernard Harvey, Gregory Choppin i Stanley Thomson alfa-čestica bombardirali su oko milijardu (vrlo malo, ali jednostavno nije bilo više) atoma einsteiniuma elektrolitički nanesenih na zlatnu foliju. Uprkos izuzetno velikoj gustini snopa (60 triliona alfa čestica u sekundi), dobijeno je samo 17 atoma mendelevija, ali je u isto vreme bilo moguće utvrditi njihovu radijaciju i Hemijska svojstva.
teški joni
Mendelevijum je bio poslednji transuranijum proizveden korišćenjem neutrona, deuterona ili alfa čestica. Za dobijanje sledećih elemenata bile su potrebne mete iz elementa broj 100 - fermijum, koji se tada nije mogao napraviti (čak ni sada u nuklearnih reaktora fermijum se dobija u nanogramskim količinama).Naučnici su krenuli drugim putem: koristili su jonizovane atome za bombardovanje ciljeva, čija jezgra sadrže više od dva protona (oni se zovu teški joni). Da bi se ubrzali snopovi jona, bili su potrebni specijalizirani akceleratori. Prva takva HILAC mašina (Heavy Ion Linear Accelerator) lansirana je na Berkliju 1957. godine, druga, U-300 ciklotron, lansirana je u Laboratoriju nuklearne reakcije Zajednički institut za nuklearna istraživanja u Dubni 1960. Kasnije su u Dubni lansirane snažnije instalacije U-400 i U-400M. Još jedan akcelerator UNILAC (Universal Linear Accelerator) radi od kraja 1975. godine u njemačkom Helmholtz centru za istraživanje teških jona u Vixhausenu, jednom od okruga Darmstadta.
Bombardiranje teškim ionima olovnih, bizmutnih, uranijskih ili transuranijskih ciljeva proizvodi visoko pobuđene (vruće) jezgre koje se ili raspadaju ili oslobađaju višak energije emitirajući (isparavajući) neutrone. Ponekad ove jezgre emituju jedan ili dva neutrona, nakon čega prolaze kroz druge transformacije, kao što je alfa raspad. Ova vrsta sinteze naziva se hladna. U Darmstadtu su uz njegovu pomoć dobijeni elementi sa brojevima od 107 (borijum) do 112 (kopernicijum). Na isti način su japanski fizičari 2004. godine stvorili jedan atom 113. elementa (godinu ranije dobiven je u Dubni). Tokom vruće fuzije, novorođena jezgra gube više neutrona- od tri do pet. Na ovaj način sintetizirani su elementi od 102 (nobelijum) do 106 (seaborgium, u čast Glena Seaborga, pod čijim je vodstvom nastalo devet novih elemenata) u Berkeleyu i Dubni. Kasnije je u Dubni na ovaj način napravljeno šest najmasovnijih superteškaša - od 113. do 118. Međunarodna unija čiste i primijenjene hemije (IUPAC, International Union of Pure and Applied Chemistry) do sada je odobrila samo nazive 114. (flerovium) i 116. (livermorijum) elemenata.
Samo tri atoma
118. element s privremenim imenom ununoctia i simbolom Uuo (prema IUPAC pravilima, privremeni nazivi elemenata formirani su od latinskog i grčkog korijena imena cifara njihovog atomskog broja, un-un-oct (ium ) - 118) nastao je zajedničkim naporima dvije naučne grupe: Dubninskaya pod vodstvom Yurija Oganesyana i Livermore National Laboratory pod vodstvom Kentona Moodyja, studenta Seaborga. Ununoktijum u periodnom sistemu nalazi se ispod radona i stoga može biti plemeniti gas. Međutim, njegova hemijska svojstva još nisu razjašnjena, jer su fizičari stvorili samo tri atoma ovog elementa sa maseni broj 294 (118 protona, 176 neutrona) i poluživot od oko milisekunde: dva 2002. i jedan 2005. godine. Dobiveni su bombardiranjem mete kalifornij-249 (98 protona, 151 neutron) jonima teškog izotopa kalcijuma atomske mase 48 (20 protona i 28 neutrona), raspršenim na akceleratoru U-400. Ukupan broj kalcijumski "metci" iznosili su 4,1x1019, tako da su performanse Dubna "ununoctium generatora" izuzetno niske. Međutim, prema Kentonu Moodyju, U-400 je jedina mašina na svijetu koja može sintetizirati 118. element.“Svaka serija eksperimenata o sintezi transuranija dodaje nove informacije o strukturi nuklearne materije, koje se koriste za modeliranje svojstava superteških jezgara. Konkretno, rad na sintezi 118. elementa omogućio je odbacivanje nekoliko prethodnih modela, podsjeća Kenton Moody. „Metu smo napravili od kalifornija, jer teži elementi nisu bili dostupni u potrebnim količinama. Kalcijum-48 sadrži osam dodatnih neutrona u odnosu na njegov glavni izotop kalcijum-40. Kada se njegovo jezgro spojilo s kalifornijskim jezgrom, formirale su se jezgre sa 179 neutrona. Bili su u jako pobuđenim i stoga posebno nestabilnim stanjima iz kojih su brzo izlazili, ispuštajući neutrone. Kao rezultat, dobili smo izotop 118. elementa sa 176 neutrona. A to su bili pravi neutralni atomi sa punim setom elektrona! Da su živjeli malo duže, moglo bi se suditi i o njihovim hemijskim svojstvima.
Metuzalem broj 117
Element 117, poznat i kao ununseptium, dobijen je kasnije - u martu 2010. godine. Ovaj element je proizveden na istoj mašini U-400, gde su, kao i ranije, joni kalcijuma-48 ispaljeni na metu iz berkelijuma-249, sintetizovanog u Nacionalnoj laboratoriji Oak Ridž. Sudar jezgara berkelijuma i kalcijuma proizveo je visoko pobuđena jezgra ununseptium-297 (117 protona i 180 neutrona). Eksperimentatori su uspjeli dobiti šest jezgara, od kojih je pet isparilo po četiri neutrona i pretvorilo se u ununseptium-293, a preostale su emitovale tri neutrona i dale su povod za ununseptium-294.U usporedbi s ununoctiusom, ununseptius se pokazao kao pravi Metuzalem. Vrijeme poluraspada lakšeg izotopa je 14 milisekundi, a težeg čak 78 milisekundi! Godine 2012. fizičari iz Dubne su dobili još pet atoma ununseptiuma-293, a kasnije i nekoliko atoma oba izotopa. U proljeće 2014. godine, naučnici iz Darmstadta izvijestili su o fuziji četiri jezgra 117. elementa, od kojih su dva imala atomsku masu od 294. Vrijeme poluraspada ovog "teškog" ununseptijuma, koje su izmjerili njemački naučnici, iznosilo je oko 51 milisekundu. (ovo se dobro slaže sa procjenama naučnika iz Dubne) .
Sada u Darmstadtu pripremaju projekat za novi linearni akcelerator teških jona na supravodljivim magnetima, koji će omogućiti sintezu 119. i 120. elementa. Slični planovi se provode u Dubni, gdje se gradi novi ciklotron DS-280. Moguće je da će za samo nekoliko godina biti moguća sinteza novih superteških transuranija. A stvaranje 120. ili čak 126. elementa sa 184 neutrona i otkriće ostrva stabilnosti postaće stvarnost.
Dug život na ostrvu stabilnosti
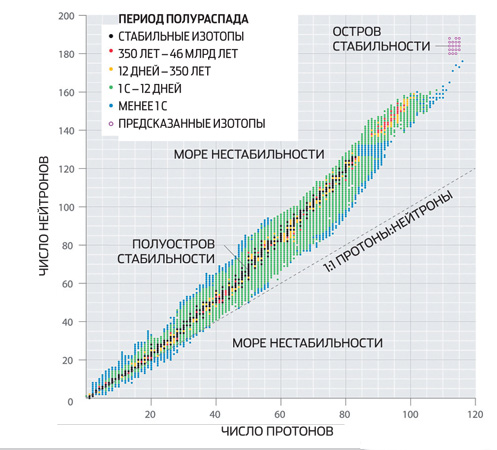 Unutar jezgara nalaze se protonske i neutronske ljuske, donekle slične elektronskim omotačima atoma. Na spontane transformacije posebno su otporna jezgra sa potpuno ispunjenim ljuskama. Broj neutrona i protona koji odgovaraju takvim školjkama nazivaju se magični brojevi. Neki od njih su određeni eksperimentalno - to su 2, 8, 20 i 28.
Unutar jezgara nalaze se protonske i neutronske ljuske, donekle slične elektronskim omotačima atoma. Na spontane transformacije posebno su otporna jezgra sa potpuno ispunjenim ljuskama. Broj neutrona i protona koji odgovaraju takvim školjkama nazivaju se magični brojevi. Neki od njih su određeni eksperimentalno - to su 2, 8, 20 i 28.
Shell modeli omogućavaju da se teoretski izračunaju "magični brojevi" superteških jezgara, iako bez potpune garancije. Postoje razlozi za očekivati da će neutron broj 184 biti magičan. Njemu mogu odgovarati protonski brojevi 114, 120 i 126, a ovaj drugi, opet, mora biti magičan. Ako je tako, onda će izotopi 114., 120. i 126. elementa, koji sadrže po 184 neutrona, živjeti mnogo duže od svojih susjeda u periodnom sistemu - minutima, satima ili čak godinama (ova oblast tablice se obično naziva ostrvo stabilnosti). Naučnici svoje najveće nade polažu u posljednji izotop s dvostruko magičnim jezgrom.
Dubna metoda
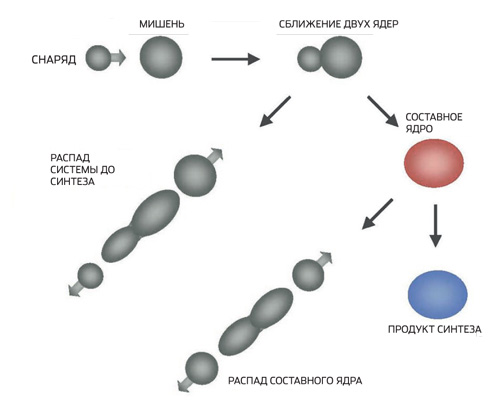
„Elementi od 113 do 118 stvoreni su na osnovu divne metode razvijene u Dubni pod vodstvom Jurija Oganesijana“, objašnjava Alexander Yakushev, član tima iz Darmstadta. — Umesto nikla i cinka, koji su korišćeni za granatiranje ciljeva u Darmštatu, Oganesjan je uzeo izotop sa mnogo manjom atomskom masom — kalcijum-48. Poenta je da upotreba lakih jezgara povećava vjerovatnoću njihove fuzije sa ciljnim jezgrama. Jezgro kalcijuma-48 je takođe dvostruko magično, jer se sastoji od 20 protona i 28 neutrona. Stoga je izbor Oganesyana uvelike doprinio opstanku složenih jezgara koje nastaju prilikom granatiranja mete. Na kraju krajeva, jezgro može izbaciti nekoliko neutrona i dovesti do novog transuranija samo ako se ne raspadne na fragmente odmah nakon rođenja. Da bi na ovaj način sintetizirali superteške elemente, fizičari iz Dubninska su od transuranija proizvedenih u SAD-u pravili mete - prvo plutonijum, zatim americij, kurij, kalifornijski i na kraju berkelijum. Kalcijum-48 u prirodi je samo 0,7%. Ekstrahira se na elektromagnetnim separatorima, to je skupa procedura. Jedan miligram ovog izotopa košta oko 200 dolara. Ova količina je dovoljna za sat-dva granatiranja mete, a eksperimenti traju mjesecima. Same mete su još skuplje i dostižu milion dolara. Plaćanje računa za struju takođe košta prilično peni - akceleratori teških jona troše megavate energije. Generalno, sinteza superteških elemenata nije jeftino zadovoljstvo.”
I. Položaj vodonika u periodnom sistemu
Vodonik - najčešći hemijski element, pored toga je i najlakši. Njegov serijski broj je 1. U periodnom sistemu nalazi se u prvoj periodi. S obzirom na svojstva, svrstava se u 1A i 7A grupu. Postavlja se pitanje – zašto?
Jezgro vodika sastoji se od jednog protona, oko kojeg se okreće jedan elektron. Elektronska formula 1s 1 . Molekul vodonika sastoji se od dva atoma povezana nepolarnom kovalentnom vezom. H 2 je najlakši gas. Bez boje je i mirisa.
Vodik je hemijski aktivna supstanca. On može glumiti redukciono sredstvo i oksidaciono sredstvo.
1) sa nekim metalima stvara hidride
2Na+H 2 =2NaH, ovdje vodonik - oksidant
H
0
+ 1
e
-
→
H
-1
Sličan proces se događa prilikom interakcije halogena - nemetala grupe 7A
2Na + Cl 2 \u003d 2NaCl
Stoga je vodonik stavljen u 7A grupu
2) sa nemetalima koji pokazuju jača oksidaciona svojstva od vodonika
H 2 + Cl 2 = 2HCl ovdje vodonik - redukciono sredstvo H 0 - 1 e - → H +1
Sličan proces se događa prilikom interakcije alkalni metali-metali grupe 1A
2K + Cl 2 \u003d 2KCl
Stoga je vodonik stavljen u 1A grupu
II. Položaj u periodičnom sistemu hemijski elementi D. I. Mendeljejev lantanidi i aktinidi
Edukativni film: “Svojstva lantanida i aktinida”
AT šesti period nakon lantana ima 14 elemenata sa serijskim brojevima 58-71, tzv lantanidi (Reč "lantanid" znači "poput lantana", a "aktinidi" znači "kao aktinijum"). Ponekad se nazivaju lantanidi i aktinidi, što znači pored lantana; nakon aktinijuma) . Lantanoidi su odvojeno postavljeni na dnu tabele, au ćeliji zvjezdica označava redoslijed njihove lokacije u sistemu: La-Lu. Hemijska svojstva lantanida su vrlo slična. Na primjer, svi su to reaktivni metali koji reagiraju s vodom i stvaraju hidroksid i vodik. U lantanu (Z = 57) jedan elektron ulazi u 5d podnivo, nakon čega prestaje punjenje ovog podnivoa, a počinje se puniti nivo 4f, od kojih sedam orbitala može biti zauzeto sa 14 elektrona. Ovo se dešava za atome svih lantanida sa Z = 58 - 71. Pošto ovi elementi ispunjavaju duboki 4f podnivo treći spoljni nivo, imaju vrlo slična hemijska svojstva.
Iz ovoga proizilazi da su lantanidi jako izraženi horizontalna analogija.
AT sedmi period 14 elemenata sa serijskim brojevima 90-103 čine porodicu aktinidi. Također su smješteni odvojeno - ispod lantanoida, au odgovarajućoj ćeliji dvije zvjezdice označavaju redoslijed njihove lokacije u sistemu: Ac-Lr. U aktinijumu i aktinidima, punjenje nivoa elektronima je slično kao kod lantana i lantanida. Međutim, za razliku od lantanida, horizontalna analogija za aktinide je slabo izražena. Oni pokazuju više različitih oksidacijskih stanja u svojim spojevima. Na primjer, oksidacijsko stanje aktinija je +3, a uranijuma +3, +4, +5 i +6. Proučavanje hemijskih svojstava aktinida je izuzetno teško zbog nestabilnosti njihovih jezgara.
Svi aktinidi su radioaktivni. Postoje dvije grupe aktinida koje se preklapaju: "transuranijumski elementi"- svi sljedeći elementi u periodnom sistemu za uranijum i "transplutonijumski elementi"- svi prateći plutonijum. Obje grupe nisu ograničene na naznačeni okvir i, kada je naveden prefiks "trans-", mogu uključivati elemente koji slijede Lawrencium - Rutherfordium, itd. To je zbog činjenice da se takvi elementi sintetiziraju u izuzetno malim količinama. U poređenju sa lantanidima, koji se (osim prometija) nalaze u prirodi u značajnim količinama, aktinide je teže sintetizirati. Ali postoje izuzeci, na primjer, uran i torijum se najlakše sintetiziraju ili pronađu u prirodi, a slijede plutonijum, americij, aktinijum, protaktinijum i neptunijum.
III. Položaj u periodičnom sistemu hemijskih elemenata D. I. Mendeljejeva veštački dobijenih elemenata
Do 2008. poznato je 117 hemijskih elemenata (sa serijskim brojevima od 1 do 116 i 118), od kojih se 94 nalaze u prirodi (neki su samo u tragovima), preostala 23 su dobijena umjetno kao rezultat nuklearnih reakcija (vidi Prilozi). Prvih 112 elemenata imaju stalna imena, ostali su privremeni.
Stranica 1
Vještački dobijeni elementi koji prate uranijum nazivaju se transuranijumom.
Umjetno dobijeni elementi su označeni superskriptom; za njih vrijednosti relativne atomske mase(bez specifikacije preciznosti) ili masenih brojeva najdugovječnijih izotopa. Donji indeks lijevo od simbola elementa pokazuje njegov serijski broj u periodičnom sistemu. Simboli neuobičajenih elemenata nalaze se u zagradama. Elementi sa serijskim brojevima 106 i 107, koji još nemaju simbole, nalaze se na kraju tabele.
Vještački dobijeni elementi: Astatin - br. 85, tehnecijum - br. 43, francijum - br. 87 (vidi str.
Svi ovi vještački dobijeni elementi još nisu pronađeni u prirodi, ali su od velikog naučnog interesa. Neki od njih se već koriste u tehnologiji.
| Energetski nivoi 5 / i. |
Imenujte umjetno dobijene elemente koji su vam poznati, naznačite njihovo mjesto u tabeli periodnog sistema hemijskih elemenata D. I. Mendeljejeva i nacrtajte dijagrame koji odražavaju raspored elektrona u orbitalama u atomima ovih elemenata.
Primljeni su novi umjetno dobiveni elementi koji im odgovaraju uobičajeno ime transuranski elementi.
U tabeli. 1 prikazuje nazive (ruski i latinski) elemenata, hemijske znakove, njihove serijske brojeve u periodičnom sistemu elemenata D. I. Mendeljejeva, relativnu atomsku masu i godinu otkrića. Atomske mase su date prema Međunarodnoj tabeli iz 1981. Vještački dobijeni elementi označeni su zvjezdicom; drevni Maseni brojevi izotopa sa najdužim poluraspadom za dati radioaktivni element dati su u uglastim zagradama. Nazivi i hemijski simboli elemenata dati u zagradama nisu općenito prihvaćeni.
U tabeli. 1 daje nazive (ruski i latinski) elemenata, njihove serijske brojeve u periodičnom sistemu elemenata D. I. Mendeljejeva, relativnu atomsku masu i godinu otkrića. Atomske mase (sa četiri značajne brojke) date su prema Međunarodnoj tabeli iz 1977. Zvjezdica označava umjetno dobivene elemente, drevne.
vještačkih elemenata
Kada se uranijum bombarduje termalnim neutronima, iz njega se formiraju lakši elementi sa serijskim brojevima 35-65: to nas je dalo nadu da će se među krhotinama naći i izotopi elemenata 43 i 61. Ako se prisjetimo stanja pitanja dobijanja elemenata 43, 61, kao i 85 i 87 1930. godine, bilo je moguće uhvatiti primjetan napredak. Prije svega, potvrđena je sumnja da su elementi 43 i 61 nestabilne supstance koje su "izumrle". Što se tiče elemenata 85 i 87, oni su odavno prepoznati kao raspadnute radioaktivne supstance.
Godine 1934., fizičar Josef Mattauch pronašao je pravilo koje omogućava procjenu stabilnosti jezgri izotopa. Prema Mattauchovom pravilu, drugi stabilni izotop ne može postojati ako se njegov nuklearni naboj razlikuje samo za jedan od naboja poznatog stabilnog izotopa s istim masenim brojem. Ovaj obrazac nadopunjuje Harkinsovo pravilo, prema kojem su elementi s neparnim atomskim brojem (tj. neparnim brojem protona i elektrona) mnogo rjeđi na Zemlji, jer je stabilnost njihovih jezgara niska.
Što se tiče elemenata 43 i 61, Mattauchovo pravilo se može reći na sljedeći način. Na osnovu njihovog položaja u periodnom sistemu, maseni broj elementa 43 bi trebao biti oko 98, a elementa 61 oko 147. Međutim, stabilni izotopi su već bili poznati za elemente 42 i 44, kao i za elemente 60 i 62 sa masama. od 94 do 102, odnosno od 142 do 150. Pošto drugi stabilni izotop sa istim masenim brojem ne može postojati, elementi 43 i 61 moraju imati samo nestabilne predstavnike. Nema sumnje da su nekada elementi 43 i 61 bili na Zemlji u dovoljnim količinama.
Kada je naš Solarni sistem, tada su svi elementi nastali kombinovanjem protona i neutrona. Međutim, tokom postojanja Zemlje - 4,6 milijardi godina - njihovi nestabilni predstavnici postepeno su potpuno nestali. Jedini izuzeci su oni radioaktivnih elemenata, koji bi se mogli stalno nadopunjavati u granicama prirodnog radioaktivnog niza, jer su njihove početne supstance Uran ili torijum- i dalje postoje na Zemlji, zahvaljujući svom poluživotu, koji broji milijarde godina. Elementi 43 i 61 ne pripadaju ovim prirodnim radioaktivnim serijama. Samo ako postoji dugovječni izotop ovih elemenata, mogli bismo se nadati da ćemo pronaći njegove radiohemijske tragove.
Dok su neki učenjaci još bili lažni transurani, drugi istraživači su uspjeli pronaći željene elemente 43 i 87. Evo priče o njihovom otkriću...
Emilio je 1936 Segre nakon braka, napustio je Fermija i njegove kolege i otišao u Palermo, nekadašnji glavni grad Sicilije. Na tamošnjem univerzitetu su mu ponudili katedru za fiziku. U Palermu, na njegovu veliku žalost, Segre nije mogao da nastavi istraživanje započeto sa Fermijem. Univerzitet nije imao nikakvu opremu za radioaktivna istraživanja. Donijevši brzu odluku, italijanski naučnik je otišao u Ameriku da se upozna sa Kalifornijskim univerzitetom u Berkliju, koji je bio poznat po najboljoj opremi. U to vrijeme postojao je jedini na svijetu ciklotron. "Ti izvori radioaktivnosti koje sam vidio bili su zaista nevjerovatni za osobu koja je ranije radila samo sa Ra-Be izvorima.“, prisjetio se fizičar.
Segre je bio posebno zainteresovan otklona ploča ciklotrona. Morala je usmjeriti tok ubrzanih čestica u željenom smjeru. Zbog sudara sa česticama visoke energije - ubrzano deuteroni Ova ploča se jako zagrijala. Stoga je morao biti napravljen od vatrostalnog metala - molibden. Upravo je na ovaj metalni molibden bombardovan deuteronima skrenuo pažnju gost iz Italije. Segre je sugerirao da bi iz molibdena, elementa 42, kao rezultat bombardiranja deuteronima, mogli nastati izotopi još uvijek nepoznatog elementa 43. Možda, prema jednačini:
96 Mo + D = 97 X + n
Prirodno molibden je mješavina šest stabilnih izotopa. Segre je sugerirao da se možda jedan od šest mogućih radioaktivnih izotopa elementa 43 u koje bi se molibden teoretski mogao pretvoriti - barem jedan - pokazao dovoljno dugovječnim da izdrži pomorsku plovidbu do Sicilije. Jer, italijanski fizičar je nameravao da traži element 43 samo na institutu u svojoj domovini.
Istraživač je krenuo na povratni put, držeći u džepu komad molibdenske ploče sa ciklotrona Berkeley. Krajem januara 1937. započeo je istraživanje uz podršku mineraloga i analitičkog hemičara Perriera. Oni su zaista pronašli radioaktivne atome koji se po svojim hemijskim svojstvima mogu smjestiti između mangana i renijuma. Količine ekamargana, koje su ponovo umjetno preporođene na Zemlji zahvaljujući istraživačkom geniju čovjeka, bile su nezamislivo male: od 10 -10 do 10 -12 g 43. elementa!
Kada su u julu 1937. Segre i Perrier izvijestili o sintezi prvog vještačkog elementa, koji je odavno nestao na Zemlji, bio je to dan koji je otišao u istoriju. Za element 43 kasnije je pronađen vrlo tačan naziv: tehnecijum, izvedeno iz grčkog technetos- veštački. Hoće li ga ikada biti moguće nabaviti u značajnim količinama i držati ga u rukama? Ubrzo je bilo moguće potvrdno odgovoriti na ovo pitanje, kada je otkriveno da fisijom uranijuma nastaju 43 izotopa s relativno visokim prinosom. Posebnu pažnju privukao je izotop masenog broja 101 i poluraspada od 14 minuta. Pretpostavljalo se da je Fermijeva supstanca sa poluživotom od 13 minuta, imaginarni element 93, trebala biti izotop elementa 43.
Prirodne radioaktivne serije imaju konačan oblik- niko se više nije usudio sumnjati u to, posebno nakon masovne spektrografske identifikacije uranijuma-235 od strane Dempstera. Međutim, postojala je slaba tačka u seriji uranijum-aktinijum. Prošlo je više od dvadeset godina od kada je uočena "netačnost" u ovoj seriji, koja je skoro predana zaboravu.
Još 1913/1914. godine, na ovu neskladu naišli su engleski hemičar Cranston i austrijski istraživači radioaktivnosti Mayer, Hess i Panet dok su proučavali aktinijum. Kao beta emiter aktinijum poznato je da se pretvara u radioaktinijum, odnosno na izotop torijum. Kada su naučnici proučavali proces transformacije, uvek su primećivali slabo alfa zračenje. Ovu zaostalu aktivnost (oko 1%) otkrio je i Otto Hahn u eksperimentima za dobivanje čistog aktinijuma. " Nisam se mogao natjerati da pridajem važnost ovoj maloj količini.“, kasnije je izvijestio Khan. Vjerovao je da je to najvjerovatnije nečistoća.
Mnogo godina kasnije. Francuska naučnica Marguerite perey, uposlenik čuvenog Instituta za radijum u Parizu, ponovo je krenuo ovim tragom, vrlo pažljivo očistivši razlomke anemone a u septembru 1939. mogla je izvesti o uspješnoj izolaciji novog radioaktivnog izotopa. Bio je to element 87 koji je dugo nedostajao, taj nusproizvod koji emituje alfa i koji daje zaostalu aktivnost aktinijuma od 1%. Madame Perey je pronašla viljušku u već popunjenom redu, jer se izotop elementa 87 pretvara u aktinijum X na potpuno isti način kao i poznati radio aktinijum. Na Pereyjev prijedlog, element 87 je imenovan Francuska u čast svoje domovine.
Istina, hemičari do danas nisu postigli veliki uspjeh u proučavanju elementa 87. Uostalom, svi izotopi francijuma su kratkog vijeka i raspadaju se za milisekunde, sekunde ili minute. Iz tog razloga, element je do sada ostao "nezanimljiv" za mnoge hemijske studije i praktičnu upotrebu. Po potrebi se dobiva umjetno. Naravno, francijum se može "dobiti" i iz prirodnih izvora, ali ovo je sumnjiv poduhvat: 1 g prirodnog uranijuma sadrži samo 10 -18 g francijuma!
Kada je periodični sistem otkriven, nedostajala su 23 elementa, sada samo dva: 61 i 85. Kako je tekao lov na elemente? U ljeto 1938. Emilio Segre ponovo odlazi u Berkeley. Namjeravao je da proučava kratkovječne izotope elementa 43. Naravno, takve studije je trebalo preduzeti na licu mjesta. Izotopi s kratkim poluraspadom ne bi "preživjeli" put do Italije. Čim je stigao u Berkeley, Segre je saznao da mu je povratak u fašističku Italiju postao nemoguć zbog rasnog terora. Segré je ostao na Berkliju i tamo nastavio svoj rad.
U Berkeleyju, sa snažnijim ciklotronom, alfa čestice bi se mogle ubrzati do visokih energija. Nakon prevazilaženja takozvanog Kulonovog praga interakcije, ove alfa čestice su uspjele prodrijeti čak i u jezgra teških atoma. Sada je Segre ugledao priliku da se okrene bizmuta, element 83, u nepoznati element 85. Zajedno sa Amerikancima Corsonom i Mackenziejem bombardirao je jezgra bizmuta sa 29 MeV alfa česticama kako bi izvršio sljedeći proces:
209 Bi + 4 He = 211 X + 2 n
Reakcija se desila. Kada su istraživači završili svoj prvi zajednički rad, 1. marta 1940. godine, samo su oprezno izrazili ideju " o mogućoj proizvodnji radioaktivnog izotopa elementa 85"Ubrzo nakon toga, već su bili sigurni da je element 85 veštački dobijen pre nego što je pronađen u prirodi. Potonji su imali sreću da samo nekoliko godina kasnije urade Engleskinja Ley-Smith i Švajcarac Minder sa instituta u Bernu. uspio pokazati da se element 85 formira u radioaktivnom nizu torija kao rezultat sporednog procesa. otvoreni element izabrali su naziv Anglo-Helvetium, koji je kritikovan kao verbalna glupost. Austrijska istraživačica Karlik i njen saradnik Bernert ubrzo su pronašli element 85 u drugim serijama prirodne radioaktivnosti, takođe kao nusproizvod. Međutim, pravo na davanje imena ovom elementu, pronađenom samo u tragovima, ostalo je Segreu i njegovim saradnicima: sada se zove astatin, što na grčkom znači nestalan. Uostalom, najstabilniji izotop ovog elementa ima poluživot od samo 8,3 sata.
U to vrijeme, profesor Segre je također pokušavao sintetizirati element 61. U međuvremenu je postalo jasno da su oba susjeda ovog elementa u periodičnom sistemu, neodimijum i samarijum, slabo radioaktivna. U početku je to izgledalo iznenađujuće, jer se u to vrijeme vjerovalo da je radioaktivnost svojstvena najtežim elementima. Neodimijum, 60. element, emitovao je beta zrake, pa je morao da se pretvori u element 61. Činjenica da ovaj nepoznati hemijski element do sada nije mogao biti izolovan verovatno je posledica njegovog brzog radioaktivnog raspada. sta da radim? I ovdje je izlaz bio da se vještački dobije željeni element. Budući da se element 61 nije mogao naći u prirodi, fizičari su pokušali da ga sintetiziraju.
Godine 1941/42 naučnici Lowe, Poole, Quill i Kurbatov iz Državni univerzitet rijetke zemlje bombardirane u Ohaju neodimijum deuteroni ubrzani u ciklotronu. Oni su otkrili radioaktivnih izotopa novi element, koji je nazvan ciklonijum. Međutim, na filmu je ostao samo trag.
Koji su uspjesi Emilija Segrea? Ozračio je alfa zracima praseodymium- element 59. Međutim, obrada izotopa elementa 61 koje je on bezuslovno sintetizirao pokazala se previše kompliciranom. Njihova izolacija od drugih rijetkih zemljanih elemenata nije uspjela.
Jedna neuvjerljiva studija objavljena je iz Finske. Davne 1935. godine, hemičar Eremetse počeo je analizirati koncentrate mješavine oksida. samarijum i neodimijum o prirodnom sadržaju 61. elementa u njima. U tu svrhu prerađeno je nekoliko tona apatita.
Prva faza borbe za 61. elemenat bila je neriješena. Nisam mogao ni da prihvatim predloženi naslov" ciklonija".
SISTEMATIZACIJA, GENERALIZACIJA I PRODUBLJIVANJE ZNANJA IZ KURSA HEMIJE
Poglavlje II. Periodični zakon i periodični sistem D.I. Mendeljejev na osnovu učenja
o strukturi atoma
Zadaci za §§1-3 (str. 70)
Pitanje 1
Uporedite formulaciju periodičnog zakona koju je dao D.I. Mendeljejeva, sa modernom formulacijom. Objasnite zašto je ova promjena formulacije bila neophodna.
Formulacija periodičnog zakona koju je dao D.I. Mendeljejev je rekao: svojstva hemijskih elemenata su u periodičnoj zavisnosti od atomskih masa ovih elemenata. Moderna formulacija kaže: svojstva hemijskih elemenata su u periodičnoj zavisnosti od naelektrisanja jezgra ovih elemenata. Takvo pojašnjenje je bilo potrebno, jer do trenutka kada je Mendeljejev uspostavio periodični zakon, struktura atoma još nije bila poznata. Nakon razjašnjenja strukture atoma i uspostavljanja zakona koji upravljaju distribucijom elektrona po elektronskim nivoima, postalo je jasno da je periodično ponavljanje svojstava elemenata povezano sa ponavljanjem strukture elektronskih ljuski.
Pitanje #2
Zašto broj elemenata u periodima odgovara nizu brojeva 2 - 8 - 18 - 32? Objasnite ovaj obrazac, uzimajući u obzir raspored elektrona duž nivoi energije.
Elektroni u atomu mogu zauzeti s-, p-, d- i f-orbitale. Jedan elektronski nivo može imati jednu s-orbitalu, tri p-orbitale, pet d-orbitala, sedam f-orbitala. u jednoj orbitali
ne može biti više od dva elektrona. Dakle, ako su popunjene samo s-orbitale, na nivou elektrona postoje 2 elektrona. Ako su s- i p-orbitale popunjene, na jednom elektronskom nivou ima 2 + 6 = 8 elektrona. Ako su s-, p- i d-orbitale popunjene, na elektronskom nivou ima 2 + 6 + 10 = 18 elektrona. Konačno, ako su s-, p-, d- i f-orbitale popunjene, na nivou elektrona ima 2 + 6 + 10 + 14 = 32 elektrona. Dakle, broj elemenata u periodima odgovara maksimalnom mogućem broju elektrona na elektronskom nivou.
Pitanje #3
Na osnovu teorije strukture atoma objasniti zašto se grupe elemenata dijele na glavne i sekundarne.
U elementima glavnih podgrupa periodnog sistema elemenata, orbitale vanjskog elektronskog nivoa su ispunjene elektronima. U elementima bočnih podgrupa, orbitale pretposljednjeg elektronskog nivoa su ispunjene elektronima.
Pitanje #4
Po kojim kriterijumima se razlikuju s-, p-, d- i f-momenti?
U atomima s-elemenata ispunjene su s-orbitale; u atomima p-elemenata popunjene su p-orbitale; u atomima d-elemenata
– d-orbitale i u atomima f-elemenata – f-orbitale.
Pitanje #5
Koristeći tablicu periodnog sistema hemijskih elemenata D.I. Mendeljejev, nacrtati dijagram rasporeda elektrona u orbitalama i energetskih nivoa u atomima elemenata vanadijuma V, nikla Ni i arsena As. Koji su od njih p-elementi, a koji d-elementi i zašto?
atom vanadijuma:
1s2 2s2 2p6 3s2 3p6 3d3 4s2
Atom nikla: 1s2 2s2 2p6 3s2 3p6 3d8 4s2
Atom arsena: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3
U atomima vanadijuma i nikla ispunjen je 3d podnivo, pa se nazivaju d elementi. U atomu arsena, 4p podnivo je ispunjen, odnosno arsen je p-element.
Pitanje #6
Objasni zašto hemijski znak vodonik se obično stavlja u glavnu podgrupu grupe I iu glavnu podgrupu grupe VII.
Atom vodonika ima jedan s-elektron u vanjskoj (i jedinoj) elektronskoj ljusci, kao kod atoma alkalnih metala. Stoga je vodonik stavljen u prvu grupu periodnog sistema. S druge strane, da bi popunio spoljašnju elektronsku ljusku, atomu vodonika nedostaje jedan elektron, kao i atomima halogena, pa se vodonik takođe nalazi u glavnoj podgrupi VII grupe periodnog sistema.
Pitanje #7
Na osnovu obrazaca distribucije elektrona u orbitalama objasnite zašto lantanidi i aktinidi imaju slična hemijska svojstva.
U atomima lantanida i aktinida ispunjen je treći elektronski nivo izvana. Budući da hemijska svojstva uglavnom zavise od elektrona vanjske ljuske, lantanidi i aktinidi su vrlo slični po svojstvima.
Pitanje #8
Imenujte umjetno dobivene elemente koji su vam poznati, navedite njihovo mjesto u tabeli periodnog sistema hemijskih elemenata D.I. Mendeljejeva i nacrtajte dijagrame, od
koji odražava raspored elektrona u orbitalama u atomima ovih elemenata.
Oni se ne javljaju u prirodi i mogu se dobiti samo veštački tehnecijum (br. 43), prometijum (br. 61), astatin (br. 85), francijum (br. 87) i transuranijumski elementi, odnosno elementi koji se nalaze u periodični sistem nakon uranijuma (sa brojevima 93 i više).
Elektronska kola tehnecij, prometijum, astat i francij:
43 Tc 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d5 5s2
61 Pm 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f5 5s2 5p6 6s2
85 Na 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p5
Elektronsko kolo prvog od transuranijumskih elemenata - neptunija:
93Np
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f4 6s2 6p6 6d1 7s2
Pitanje #9
Objasnite suštinu koncepta "valencije" sa stanovišta modernih ideja o strukturi atoma i formiranju hemijske veze.
Valencija je jednaka broju hemijske veze da se atom nekog elementa može formirati sa atomima drugih elemenata. Elektroni spoljašnjeg elektronskog nivoa učestvuju u formiranju hemijskih veza. Valencija se takođe može definisati kao broj elektrona koje atom datog hemijskog elementa može da obezbedi da formira hemijske veze sa atomima drugih elemenata.
Pitanje #10
Zašto se numerička vrijednost valencije ne poklapa uvijek s brojem elektrona na vanjskim energetskim nivoima?
Formiranje hemijskih veza moguće je u prisustvu nesparenih elektrona u atomu. U mnogim elementima nisu svi elektroni na vanjskom elektronskom nivou neupareni.
Na primjer, atomi kisika i sumpora imaju šest elektrona na vanjskom nivou, ali samo dva od njih nisu uparena:
16S↓ | ||||||||||||||
Međutim, u atomu sumpora na vanjskom elektronskom nivou još uvijek postoje prazne 3d orbitale, na koje mogu proći elektroni sa 3s i 3p orbitala, kao rezultat toga, šest nesparenih elektrona postaje u atomu sumpora:
16S↓ | ||||||||||||||
Dakle, maksimalna valencija sumpora je šest, odnosno poklapa se sa brojem elektrona na vanjskom elektronskom nivou. U atomu kiseonika na drugom nivou nema d-orbitala, stoga ne postoji mogućnost uparivanja elektrona, a valencija kiseonika ne može biti veća od dva, odnosno nije jednaka broju elektrona na spoljašnjem nivou .
Pitanje #11
Zašto maksimalna valencija elemenata 2. perioda ne može preći broj 4?

U atomima elemenata drugog perioda ne može biti više od 4 nesparena elektrona, budući da drugi elektronski nivo ima jednu s-orbitalu i tri p-orbitale. Valencija je jednaka broju nesparenih elektrona, tako da valencija elemenata drugog perioda ne može biti veća od 4.
Pitanje #12
Napravite elektronska kola koja odražavaju valenciju dušika u dušičnoj kiselini i valenciju ugljika i kisika u ugljičnom monoksidu (II).
a) Molekul ugljen monoksida. Struktura elektronske ljuske atoma ugljika i kisika:
U molekuli ugljičnog monoksida dvije veze formiraju dva nesparena elektrona na atomu ugljika i dva nesparena elektrona na atomu kisika. Atom kisika ima još jedan par elektrona u 2p orbitali, a atom ugljika ima slobodnu 2p orbitu. Par elektrona prelazi s atoma kisika na atom ugljika, formirajući vezu donor-akceptor. Elektronska formula ugljičnog monoksida (II) može se predstaviti na sljedeći način:
(strelica pokazuje vezu donor-akceptor).
b) Molekul dušične kiseline. Elektronska kola atoma vodika, kiseonika i azota:
Atom vodika stvara vezu s atomom kisika zbog jednog elektrona. Drugi elektron atoma kisika je uključen u formiranje veze s atomom dušika:
Atomu dušika ostala su dva nesparena elektrona i on formira dvije veze sa drugim atomom kisika:
HONO
At atom dušika još uvijek ima uključen elektronski par 2s orbitale.
AT Na trećem atomu kiseonika dolazi do uparivanja elektrona i formira se slobodna orbitala:
Par elektrona iz atoma dušika prelazi na ispražnjenu orbitalu atoma kisika i formira se veza donor-akceptor:
Pitanje #13
Zašto, prema modernim konceptima, koncept valencije nije primjenjiv na jonska jedinjenja?
Valencija je jednaka broju veza koje formira atom i zavisi od broja elektrona na vanjskom elektronskom nivou. Jonska jedinjenja se sastoje od pozitivno i negativno nabijenih jona koji se drže zajedno električnom privlačnošću. U jonskim jedinjenjima, broj veza između jona zavisi
sita na strukturu kristalne rešetke, mogu biti različiti i nisu povezani s brojem elektrona na vanjskom elektronskom nivou.
Pitanje #14
Koji se obrasci primjećuju u promjeni atomskog polumjera u periodima s lijeva na desno i u prijelazu iz jednog perioda u drugi?
U periodima se atomski radijusi smanjuju s lijeva na desno. To je zbog činjenice da se naboj jezgra povećava i da se elektroni jače privlače jezgrom, elektronska školjka kao da se smanjuje. U grupama se radijusi atoma povećavaju od vrha do dna, kako se povećava broj elektronskih ljuski.
Pitanje #15
Sjetite se formulacije periodičnog zakona koju je dao D.I. Mendeljejeva i moderne formulacije ovog zakona. Na konkretnim primjerima potvrdite da se periodično mijenjaju ne samo svojstva kemijskih elemenata, već i oblici i svojstva njihovih spojeva.
Formulacija periodičnog zakona koju je dao D.I. Mendeljejev je rekao: svojstva hemijskih elemenata su u periodičnoj zavisnosti od atomskih masa ovih elemenata. Moderna formulacija kaže: svojstva hemijskih elemenata su u periodičnoj zavisnosti od naelektrisanja jezgra ovih elemenata. Osobine jedinjenja hemijskih elemenata takođe se periodično menjaju. Na primjer, oksidi svih metala glavne podgrupe grupe I (Li2 O, Na2 O, K2 O, Rb2 O, Cs2 O) pokazuju osnovna svojstva, a oksidi svih elemenata glavne podgrupe grupe IV (CO2, SiO2 , GeO2 SnO2, PbO2) - kisela svojstva .
3 zadatak broj 1
Potpunim sagorevanjem 0,68 g nepoznate supstance dobijeno je 1,28 g sumpor-oksida (IV) i 0,36 g vode. Nađi hemijska formula spaljena supstanca.
Izračunajte molarne mase vode i sumpor-oksida (IV):
M (H2O) = 1 2 + 16 = 18 g / mol
M(SO2) = 32 + 16 2 = 64 g / mol
Izračunajmo količinu vodene tvari i sumpornog oksida (IV) nastalih tokom sagorijevanja tvari:
ν(H2O) = | m(H2O) | ||||||||
M(H2O) | |||||||||
ν(SO2) = | |||||||||
M(SO2) | |||||||||
Jer u reakciji se dobijaju SO2 i H2O, tada se u početnoj supstanci mogu nalaziti samo S, H i O. Tada se početna supstanca može shematski prikazati formulom Sx Hy Oz. Tada će se napisati jednačina reakcije
x+y | |||||||||
0,02 mola vode sadrži 0,02 2 = 0,04 mola atoma vodika. 0,02 mola sumpor-oksida sadrži 0,02 mola atoma vodika. Izračunajte masu vodika i sumpora u tvari:
m (H) \u003d n (H) M (H) = 0,04 mol 1 g / mol = 0,04 g.
m(S) = n(S) M(S) = 0,02 mol 32 g/mol = 0,64 g
Masa sumpora i vodonika je 0,64 + 0,04 = 0,68 g, odnosno jednaka je masi supstance, što znači da supstanca ne sadrži druge elemente osim sumpora i vodonika. Na 0,04 mola vodika ima 0,02 mola sumpora, odnosno 1 atom sumpora na 2 atoma vodika, najjednostavnija formula supstance H2S je sumporovodik.
Odgovor: vodonik sulfid H2S.
3 zadatak broj 2
20 g vodonik sulfida je propušteno kroz rastvor koji sadrži 10 g natrijum hidroksida. Koja je sol nastala u ovom slučaju? Odredite njegovu masu i količinu.
Moguće je stvaranje dvije soli - natrijum sulfida prema jednačini (1) i natrijum hidrosulfida prema jednačini (2).
2NaOH + H2S = Na2S + 2H2O | |
NaOH + H3 8 \u003d NaHS + H2 O |
Izračunajte molarne mase natrijum hidroksida i vodonik sulfida:
M(NaOH) = 23 + 16 + 1 = 40 g/mol
M(H2S) = 1 2 + 32 = 34 g/mol
Izračunajte količinu supstance natrijum hidroksida i vodonik sulfida:
Prema jednačini (2), 1 mol natrijum hidroksida reaguje sa 1 molom sumporovodika, što znači da je za reakciju sa 0,59 mola sumporovodika potrebno 0,59 mola natrijum hidroksida, a prema uslovu je bilo samo 0,25 mola. uzeti. Posljedično, sumporovodik se uzima u suvišku i formira se natrijum hidrosulfid, a proračun se vrši pomoću natrijum hidroksida. Od 1 mola natrijum hidroksida, prema jednadžbi, nastaje 1 mol natrijum hidrosulfida, dakle, iz 0,25 mola natrijum hidroksida dobije se 0,25 mola natrijum hidrosulfida.
Compute molarna masa natrijum hidrosulfid:
M(NaHS) = 23 + 1 + 32 = 56 g/mol
Izračunajte masu natrijum hidrosulfida:
m(NaHS) = ν (NaHS) M(NaHS) = 0,25 mol 56 g/mol = 14 g.
Odgovor: Dobiće se 0,25 mol (14 g) natrijum hidrosulfida.
3 zadatak broj 3
Koliko se aluminijum oksida u gramima može dobiti iz 100 g hidratisanog aluminijum hlorida AlCl3 6H2 O?






