Tečno stanje materije je svojstvo tečnosti. Pojmovi, definicije i parametri. Ako kapilare imaju kružni poprečni presjek, onda
U tekućem stanju razmak između čestica je mnogo manji nego u plinovitom stanju. Čestice zauzimaju najveći dio volumena, stalno su u kontaktu jedna s drugom i međusobno se privlače. Uočeno je određeno sređivanje čestica (poredak kratkog dometa). Čestice se kreću relativno jedna u odnosu na drugu.
U tekućinama, van der Waalsove interakcije nastaju između čestica: disperzija, orijentacija i indukcija. Male grupe čestica koje su ujedinjene određenim silama nazivaju se klasteri. U slučaju identičnih čestica nazivaju se klasteri u tečnosti saradnici
Kada se uroni u stijenu, zapremina vode jednaka zapremini stijene se istiskuje. Za usporedbu, blok drveta djeluje na suptilniji način, tonući u vodu pod silom gravitacije sve dok ne istisne zapreminu vode jednaku njegovoj vlastitoj težini.
Isparavanje i kondenzacija tečnosti
Kada se sve sile stabilizuju, drvo prestaje da se spušta. To se tada naziva Arhimedov princip kako ga je zamislio starogrčki matematičar, fizičar, astronom i filozof Arhimed. Arhimed. Princip dalje kaže da će se sile koje podržavaju drveni blok fokusirati prema gore i prema unutra na njega, kulminirajući u tački koja se zove centar uzgona. Uvijek iznad centra mase plutajućeg objekta, lokacija centra uzgona može pokazati stabilnost objekta.
U tečnostima, formiranje vodoničnih veza povećava redosled čestica. Međutim, vodonične veze i van der Waalsove sile su krhke – molekule u tekućem stanju su u neprekidnom haotičnom kretanju, što se naziva braunovsko kretanje.
Za tečno stanje vrijedi raspodjela molekula prema brzinama i energijama Maxwell-Boltzmanna.
Što je veća udaljenost između centra uzgona i centra mase, to je objekt stabilniji, odnosno manja je vjerovatnoća da će se prevrnuti. Drugi karakteristična karakteristika tečnosti je da ako se gušća tečnost ulije u manje gustu tečnost i ove dvije se ne pomiješaju, one će se razdvojiti, ostavljajući manje gustu tečnost na vrhu, a gušću tečnost na dnu. Klasičan primjer za to je odvajanje koje se događa s uljem i vodom.
Podmornice su odličan primjer plovnosti na poslu. Dok putuje po površini okeana, podmornica ima prosječnu gustoću nešto manju od gustoće vode. Međutim, kada on krene na ronjenje, podmornica treba da preuzme vodu. To onda povećava njegovu gustoću izvan vode, što rezultira njenom sposobnošću da teče.
Teorija tečnosti je mnogo manje razvijena od teorije gasova, jer svojstva tečnosti zavise od geometrije i polariteta blisko raspoređenih molekula. Osim toga, nedostatak određene strukture tekućina otežava formaliziranje njihovog opisa - u većini udžbenika tekućinama je dato mnogo manje prostora nego plinovima i kristalnim čvrstim tvarima.
Da bi se ponovo podigla na površinu, podmornica mora probiti rezervoare za vodu. Taj zadatak ostvaruje tako što u njih ubacuje zrak, što zauzvrat istiskuje vodu i smanjuje gustoću podmornice. Pritisak tečnosti i površinski napon.
Iako nije nužno očigledna činjenica, bez obzira na dubinu s koje pada, stvarna uzgona podmornice nije promijenjena ni na koji način. To je zato što je voda u suštini nestišljiva i njena gustina je praktično ista na bilo kojoj dubini. Ali iako se gustina ne može promijeniti, postoji krajnja tačka koju nameće pritisak vode, masa vode iznad objekta koja se linearno povećava sa dodatnom dubinom.
Ne postoji oštra granica između tekućina i plinova - potpuno nestaje kritične tačke . Za svaki gas je poznata temperatura iznad koje ne može biti tečan ni pri jednom pritisku; s ovim kritičan temperatura, granica (meniskus) između tečnosti i njenog zasićena para. Postojanje kritične temperature ("apsolutne tačke ključanja") ustanovio je D.I. Mendeljejev 1860.
Dakle, ako udvostručite dubinu podmornice, udvostručite i pritisak. Iako to nije tako težak koncept za razumjeti, ono što nije sasvim očigledno je da je pritisak vode isti bez obzira na smjer. Na primjer, ako biste pritisnuli vrh spremnika s vodom tako što ste ga potopili, ali zanemarili ideju da kako spremnik ide sve dublje i dublje, pritisak koji djeluje na sve strane i na dno rezervoara je isti kada pritisnete gornji deo rezervoara, iznenadili biste se koliko rezervoar postaje težak.
Međutim, ako biste otvorili ventil na dnu rezervoara, voda bi iscurila u mlaz, smanjujući ukupni pritisak i unutar i izvan rezervoara. Osim toga, pošto se voda sada kreće, ima kinetičku energiju. I, kao u skladu sa Toričelijevim principom, onda veći pritisak na ventilu, što više kinetička energija protoka i veća je njegova brzina.
Tabela 7.2 - Kritični parametri (t k, p k, V k) nekih supstanci
| Supstanca | t do, oko C | p k, atm | V to, cm 3 / mol | t rastopiti o C | t bale o C |
| On | -267,9 | 2,26 | 57,8 | -271,4 | -268,94 |
| H2 | -239,9 | 12,8 | 65,0 | -259,2 | -252,77 |
| N 2 2 | -147,0 | 33,54 | 90,1 | -210,01 | -195,82 |
| O 2 2 | -118,4 | 50,1 | -218,76 | -182,97 | |
| CH 4 | -82,1 | 45,8 | 99,0 | -182,49 | -161,58 |
| CO2 | +31,0 | 72,9 | 94,0 | -56,16 | -78,48 (subl) |
| NH3 | 132,3 | 111,3 | 72,5 | -77,76 | -33,43 |
| Cl2 | 144,0 | 76,1 | -101,0 | -34,06 | |
| SO2 | 157,5 | 77,8 | -75,48 | -10,02 | |
| H2O | 374,2 | 218,1 | 0,0 | 100,0 |
Pritisak zasićene pare – parcijalni pritisak, pri čemu su brzine isparavanja i kondenzacije pare jednake:
Podsjetimo da su glavne karakteristike tečnosti sljedeće. To su tvari slične tekućinama koje imaju sposobnost da teče i nemaju mogućnost rekonfiguracije svog prijašnjeg oblika nakon deformacije. Mogu imati oblik bilo koje posude u koju se sipaju.
Imaju slična svojstva kao čvrste materije u pogledu konzistencije boje i gustine. Oni imaju tendenciju da traže zajednički nivo. Ono što vidimo oko sebe, živo ili neživo, sastoji se od materije. "Materija" se može definisati kao "svaka supstanca koja ima i zauzima prostor". Materija ima različite oblike. Postoje tri različita oblika materije; čvrste materije, tečnosti i gasovi. Razlikuju se jedni od drugih ovisno o specifičnoj osobini karakterističnoj za svaki oblik, koja ovisi o molekulima u njima različite forme stvar.
gdje su A i B konstante.
Temperatura ključanja je temperatura na kojoj je pritisak zasićene pare tečnosti jednak atmosferskom pritisku.
Tečnosti imaju fluidnost- sposobnost kretanja pod djelovanjem malih posmičnih sila; tečnost zauzima zapreminu u kojoj je smeštena.
Otpor fluida protoku naziva se viskozitet[Pa. With].
Karakteristike svake supstance; čvrsta, tečna ili ovisi o različitoj privlačnosti između ovih molekula. U ovom članku ćemo raspravljati o razlikama između dva oblika materije, tekućina i plinova. Postoje četiri glavne tačke razlike po kojima možemo razlikovati tečnosti i gasove na najosnovnijem nivou; oblik, zapreminu, tvrdoću i sposobnost tečenja.
Tečnosti Molekuli tečnosti imaju umerenu silu privlačenja; sila između molekula je manje čvrstih materija a više gasova. To rezultira lakšim i slobodnijim kretanjem molekula unutar tekućina. Molekularno kretanje dovodi do toga da tečnosti imaju definisanu i fiksnu zapreminu. Tečnosti poprimaju oblik posude u kojoj su pohranjene dok se molekule kreću okolo da bi ispunile prostor. Nemaju određen oblik i imaju sposobnost da teku. Tečnosti mogu teći; stoga se nazivaju i "tečnim".
Površinski napon [J / m 2] - rad potreban za stvaranje jedinice površine.
stanje tečnih kristala- supstance u tečnom stanju, sa visokim stepenom uređenosti, zauzimaju međupoložaj između kristala i tečnosti. Imaju fluidnost, ali u isto vrijeme imaju i dalekosežni poredak. Na primjer - derivati smeđe kiseline, azoliti, steroidi.
Tečnosti nisu tvrde. Na primjer, kada se zamrzne ispod 0 stepeni Celzijusa, stvrdne se na ledu. Neki primjeri tekućina su voda, ulja, mlijeko, sokovi itd. Gasovi Molekuli u plinovima imaju vrlo slabu privlačnu silu između sebe i vrlo su labavo zbijeni. Dakle, nemaju određeni oblik, već imaju oblik posude. Zbog svoje molekularne strukture, plinovi također nemaju određenu zapreminu i postaju zapremina posude u kojoj se skladište. Gasovi mogu lako teći; mogu se prikazati jednostavno paljenjem tamjana.
Temperatura klirensa- temperatura na kojoj tečni kristali (LC) prelaze u uobičajeno tečno stanje.
7.5 Čvrste materije
AT čvrsto stanječestice su toliko blizu jedna drugoj da između njih nastaju jake veze, nema kretanje napred a fluktuacije se nastavljaju oko njegove pozicije. Čvrste tvari mogu biti u amorfnom i kristalnom stanju.
Svojstva tečnih filmova
Miris tamjana prenosi se iz jednog dijela prostorije u drugi. Lako se mogu komprimirati jer imaju puno prostora između molekula. Tečnosti imaju manju privlačnu silu između molekula od čvrstih materija i više gasova; gasovi imaju vrlo slabu silu privlačenja između molekula, što je najmanje od tri stanja materije. Tečnosti imaju određenu zapreminu; gasovi nemaju određenu zapreminu. Tečnosti se ne mogu lako komprimovati; plinovi se mogu lako komprimirati.
Sve na Zemlji je napravljeno od materije, ali ova materija nije uvijek ista. Materija može postojati u četiri različite faze, i kinetička teorija materija nam pomaže da shvatimo razlike između ovih faza. Čvrste tvari, tekućine, plinovi i plazme: ove riječi bi vam trebale biti poznate jer su to četiri faze materije koje mogu biti različite, koje se mogu nositi s različitim oblicima. Ono što postoji je da mnoge supstance mogu postojati kao više od jedne faze. Uzmimo za primjer vodu: voda može postojati kao čvrsta, tečna i plinovita.
7.5.1 Supstance u amorfnom stanju
U amorfnom stanju, supstance nemaju uređenu strukturu.
staklasto tijelo stanje - čvrsto amorfno stanje supstance, koje se dobija kao rezultat dubokog prehlađenja tečnosti. Ovo stanje je neravnotežno, ali naočale mogu postojati dugo vremena. Omekšavanje stakla događa se u određenom temperaturnom rasponu - rasponu staklastog prijelaza, čije granice zavise od brzine hlađenja. Sa povećanjem brzine hlađenja tečnosti ili pare, povećava se verovatnoća dobijanja date supstance u staklastom stanju.
Razlika između ovih stanja je količina energije. Čvrste čestice imaju najmanju količinu energije, što je dio zašto su njihove čestice tako blisko povezane. Tečnosti imaju više energije od čvrstih, pa će poprimiti oblik svoje posude, ali samo do površine.
Mehanička svojstva tečnosti
Gasovi imaju čak i više energije od tečnosti. Pogotovo jer se njihove čestice šire kako bi ispunile cijeli prostor njihovog kontejnera. Čestice plina imaju toliko energije da jednostavno ne mogu ostati mirne. Oni lete u svim smjerovima, postavljajući što je moguće veću udaljenost između sebe i ostalih čestica plina.
Krajem 60-ih godina XX vijeka dobijeni su amorfni metali (metalna stakla) - za to je bilo potrebno rastopljeni metal ohladiti brzinom od 10 6 - 10 8 stepeni / s. Većina amorfnih metala i legura kristalizira kada se zagrije iznad 300°C. Jedna od najvažnijih primjena je mikroelektronika (difuzijske barijere na sučelju metal-poluvodič) i uređaji za magnetno skladištenje (FMD glave). Ovo posljednje je zbog jedinstvene magnetske mekoće (magnetna anizotropija je dva reda veličine manja nego kod konvencionalnih legura).
Plazme su jonizovani gasovi i neuobičajeni su u svom prirodnom obliku na Zemlji. Vi ste ih vidjeli kao umjetne stvari poput neonskih reklama i fluorescentnih sijalica. Ali u ostatku svemira, plazma je zapravo najčešća faza materije! Većina zvijezda je plazma, poput aurore borealis koju vidite oko polarnih područja. Plazma postoji samo pod određenim uslovima, tako da ćemo završiti našu raspravu o tome ovde za ovaj tutorijal.
Kinetička teorija materije kaže da se sva materija sastoji od malih čestica koje se kreću nasumično i imaju razmak između njih. To znači da bez obzira koji je fazni materijal, on se sastoji od pojedinačnih pokretnih čestica.
Amorfne supstance izotropna, tj. imaju ista svojstva u svim smjerovima.
7.5.2 Supstance u kristalnom stanju
Čvrsta kristalna supstance imaju uređenu strukturu sa elementima koji se ponavljaju, što im omogućava da se proučavaju difrakcijom x-zrake(metoda analize rendgenske difrakcije, koristi se od 1912.
Ova teorija zvuči prilično jednostavno, ali zapravo mnogo toga objašnjava fizička svojstva materija i njena dejstva. Možda ćete biti iznenađeni kada saznate da se čestice čvrste tvari zapravo kreću, ali to vam jednostavno nije dovoljno. Ova vrsta vibracijskog kretanja je razlog zašto čvrsta materija nije promijenila oblik bez obzira u koju posudu je stavili.
Sjećate se kako tekuće čestice imaju više energije od čvrstih čestica? Dodatna energija u ovom stanju omogućava česticama da se kreću slobodnije i šire se više od čvrstih čestica, što stvara više prostora između ovih čestica. Zbog toga će tečnost poprimiti oblik svoje posude do površine.
Monokristale (pojedinačna jedinjenja) karakterizira anizotropija - ovisnost svojstava o smjeru u prostoru.
Pravilan raspored čestica u čvrsto telo prikazano kao kristalna rešetka. Kristalne supstance rastopiti se na određenoj temperaturi tzv tačka topljenja.
A budući da plinovi imaju još više energije od tekućina, njihove se čestice kreću mnogo više. Zbog toga će se plin proširiti i ispuniti cijeli spremnik, a ne samo njegovu površinu kao tekućina. Ne samo da se čestice čvrstog tijela ne pomiču mnogo, već se i jako snažno dodiruju jedna drugu jakim silama privlačenja. Ove sile drže čestice na mjestu i one su ono što daje čvrstoj čvrstoći fiksnu veličinu i oblik.
S druge strane, čestice plina su toliko udaljene da se sile privlačenja između njih smatraju zanemarivim. Čestice gasa se smatraju nezavisnim jedna od druge, što znači da je gas suprotan čvrsta materija i nema fiksnu veličinu ili oblik.
Kristale karakterizira energija, konstanta kristalne rešetke i koordinacijski broj.
Trajna rešetka karakterizira udaljenost između centara čestica koje zauzimaju čvorove u kristalu u smjeru karakterističnih osa.
koordinacijski broj obično se naziva brojem čestica koje su direktno uz datu česticu u kristalu (vidi sliku 7.2 - koordinacijski broj osam za cezijum i klor)
Budući da je kretanje tekućih čestica između čvrste tvari i plina, sile privlačenja između njegovih čestica su također u srednjem rasponu druge dvije faze. Tečne čestice imaju više slobode od čvrstih čestica, tako da tečnost može slobodno teći. To znači da, kao i gas, tečnost nema fiksni oblik. Ali pošto čestice nisu tako slobodne kao čestice gasa, tečnost ima fiksnu zapreminu.
Kinetička teorija materije je takođe korisna u objašnjavanju zašto supstance mogu menjati fazu pod određenim uslovima. Znate da voda može biti čvrsta, tečna ili gasovita, ali kako ona funkcioniše? Promjena faze nastaje kada se energija doda ili ukloni iz tvari, obično u obliku topline.
Energija kristalne rešetke naziva se energija potrebna za uništavanje jednog mola kristala i uklanjanje čestica izvan granica njihove interakcije.
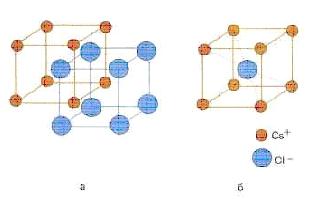
Slika 7.2 - Struktura kristala cezijum hlorida CsCl (a) i kubične jedinične ćelije u centru tela ovog kristala (b)
7.5.3 Kristalne strukture
Najmanja strukturna jedinica kristala, koja izražava sva svojstva njegove simetrije, je elementarna ćelija. Ponovljenim ponavljanjem ćelije u tri dimenzije dobija se kristalna rešetka.
Postoji sedam osnovnih ćelija: kubne, tetraedarske, heksagonalne, romboedarske, ortoromboedarske, monokliničke i trikliničke. Postoji sedam derivata osnovnih jediničnih ćelija, na primjer, centrirana na tijelo, kubična, centrirana na lice.
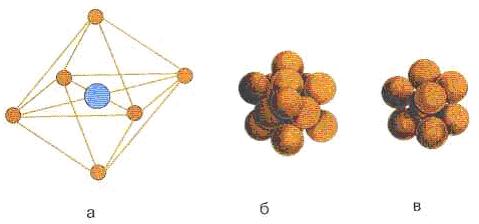
a - jedinična ćelija kristala NaCl; b - gusto lice-centrirano kubno pakovanje NaCl; c - kubično pakovanje CsCl kristala u centru tijela Slika Slika 7.3 - Jedinična ćelija
Izomorfne supstance- supstance slične hemijske prirode, koje formiraju iste kristalne strukture: CaSiO 4 i MgSiO 4
Polimorfizam– jedinjenja koja postoje u dva ili više kristalne strukture, kao što je SiO 2 (kao heksagonalni kvarc, rombični tridimit i kubni kristobalit.)
Alotropske modifikacije- polimorfne modifikacije jednostavne supstance, na primjer, ugljenik: dijamant, grafit, karabin, fuleren.
Po prirodi čestica u čvorovima kristalne rešetke i hemijske veze između njih, kristali su podijeljeni na:
1) molekularni- na čvorovima se nalaze molekuli između kojih djeluju van der Waalsove sile, koji imaju nisku energiju: kristali leda;
2) atomski- kovalentni kristali- na čvorovima kristala nalaze se atomi koji se međusobno snažno formiraju kovalentne veze, imaju visoku energiju rešetke, na primjer, dijamant (ugljik);
3) jonski kristali- strukturne jedinice kristala ovog tipa su pozitivno i negativno nabijeni joni, između kojih električna interakcija, karakteriziran dovoljno visokom energijom, na primjer NaCL, KCL;
4) metalni kristali- materije koje imaju visoku električnu provodljivost, toplotnu provodljivost, savitljivost, plastičnost, metalni odsjaj i visoku refleksivnost u odnosu na svetlost; veza u kristalima je metalna, energija metalne veze je srednja između energija kovalentnih i molekularnih kristala;
5) kristali mješovite veze– postoje složene interakcije između čestica koje se mogu opisati superpozicijom dvije ili više vrsta veza jedna na drugu, na primjer, klatrati (uključeni su spojevi) – formirani uključivanjem molekula (gostiju) u šupljinu kristalni okvir koji se sastoji od čestica različite vrste (domaćina): gasni klatrati CH4 . 6H 2 O, urea klatrati.
Tečnost, koja zauzima srednji položaj između gasova i kristala, kombinuje svojstva oba tipa ovih tela..
1. Kao čvrsta, tečnost blago stisljivo zbog gustog rasporeda molekula. (Međutim, kada bi se voda mogla potpuno osloboditi kompresije, tada bi se nivo vode u svjetskom oceanu popeo za 35 m i voda bi poplavila 5.000.000 km 2 kopna.)
2. Kao čvrsta, tečna štedi volumen ali kao gas poprima oblik posude .
3. Za kristale tipično narudžba na daljinu u rasporedu atoma (kristalna rešetka), za gasove- pun haos. Za tečnost postoji srednje stanje nalog kratkog dometa , tj. uređen je raspored samo najbližih molekula. Na udaljenosti od 3-4 efektivna prečnika molekula od ovog molekula, poredak je zamagljen. Stoga su tečnosti bliske polikristalnim tijelima, koja se sastoje od vrlo malih kristala (oko 10 9 m), proizvoljno orijentisane jedna prema drugoj. Zbog toga su svojstva većine tekućina ista u svim smjerovima (i nema anizotropije, kao u kristalima).
4. Većina tečnosti, poput čvrstih materija, sa porastom temperature povećati njihov volumen , dok smanjuje njenu gustinu (na kritičnoj temperaturi, gustina tečnosti je jednaka gustini njene pare). Voda je drugačije poznati anomalija , koji se sastoji u činjenici da na +4 S voda ima maksimalnu gustinu. Ova anomalija se objašnjava činjenicom da se molekuli vode djelimično sklapaju u grupe od nekoliko molekula (klastera), formirajući posebne velike molekule. H 2 O, (H 2 O) 2 , (H 2 O) 3 … sa različitom gustinom. Na različitim temperaturama, odnos koncentracija ovih grupa molekula je različit.
Postoji amorfna tela (staklo, ćilibar, smole, bitumen...), koje se obično smatraju prehlađenim tečnostima sa veoma visokim koeficijentom viskoznosti. Imaju ista svojstva u svim smjerovima (izotropni), kratkog dometa u rasporedu čestica, nemaju tačku topljenja (pri zagrijavanju tvar postepeno omekšava i prelazi u tekuće stanje).
Koristi se u tehnologiji magnetne tečnosti - to su obične tekućine (voda, kerozin, razna ulja), u koje se (do 50%) unose najsitnije čestice (veličine nekoliko mikrona) čvrstog feromagnetnog materijala (npr. Fe 2 O 3). Kretanje magnetnog fluida i njegov viskozitet mogu se kontrolisati pomoću magnetnog polja. U jakim magnetna polja magnetna tečnost se odmah stvrdne.
Neke organske tvari, čije molekule imaju filamentni oblik ili oblik ravnih ploča, mogu biti u posebnom stanju, posjedujući i svojstva anizotropije i fluidnosti. Zovu se tečni kristali . Za promjenu orijentacije molekula tekućeg kristala (u ovom slučaju mijenja se njegova prozirnost), potreban je napon od oko 1 V i snaga reda mikrovati, što se može osigurati direktnim dovodom signala iz integriranih kola. bez dodatnog pojačanja. Stoga se tečni kristali široko koriste u elektronskim indikatorima sata, kalkulatorima i displejima.
Prilikom smrzavanja voda se povećava u volumenu za 11%, a ako se voda zamrzne u zatvorenom prostoru može se postići pritisak od 2500 atmosfera (razorene su vodovodne cijevi, stijene...).
povlačenja jedan od najvećih: 1) dielektrična konstanta(dakle, voda je dobar rastvarač, posebno soli sa jonskim vezama - čitav periodni sistem se nalazi u Svetskom okeanu); 2) toplota fuzije(sporo otapanje snijega u proljeće); 3) toplota isparavanje; 4) površinski napon; 5) toplotni kapacitet(blaga primorska klima).
Postoji svjetlo (1 g/cm 3) i težak (1,106 g/cm3) vode . Laka voda ("živa") - biološki aktivna - to je protijev oksid H 2 O. Teška voda ("mrtva") - potiskuje vitalnu aktivnost organizama - ovo je deuterijum oksid D 2 O. Protij (1 amu), deuterijum (2 amu) i tricijum (3 amu) su izotopi vodonika. Postoji i 6 izotopa kiseonika: od 14 O do 19 O koji se može naći u molekulu vode.
U tretmanu vode magnetsko polje mijenjaju se njegova svojstva: mijenja se vlaženje čvrste materije, ubrzava se njihovo otapanje, mijenja se koncentracija otopljenih plinova, sprječava se stvaranje kamenca u parnim kotlovima, stvrdnjavanje betona se ubrzava 4 puta i povećava mu se čvrstoća za 45%, dolazi do biološkog djelovanja na čovjeka (magnetne narukvice i minđuše, magnetosijalice, itd.) i biljke (klijavost i prinosi se povećavaju).
srebrna voda može dugo da se čuva (oko šest meseci), jer se voda neutrališe od mikroba i bakterija jonima srebra (koristi se u astronautici, za konzerviranje hrane, dezinfekciju vode u bazenima, u medicinske svrhe za prevenciju i suzbijanje gastrointestinalnih bolesti i upalni procesi).
Dezinfekcija vode za piće u gradskim vodovodima vrši se hlorisanjem i ozoniranjem vode. Postoje i fizičke metode dezinfekcije ultraljubičastim zračenjem i ultrazvukom.
Rastvorljivost gasova u vodi zavisi od temperature, pritiska, saliniteta, prisustva drugih gasova u vodenom rastvoru. U 1 litru vode na 0 S može se rastvoriti: helijum - 10 ml, ugljen dioksid - 1713 ml, sumporovodik - 4630 ml, amonijak - 1300000 ml (amonijak). Prilikom ronjenja na velike dubine ronioci koriste posebne mješavine za disanje kako prilikom uspona ne bi dobili "gaziranu krv" zbog rastvaranja dušika u njoj.
Sve živi organizmi 60-80% vode. Krv ljudi i životinja je po sastavu soli slična okeanskoj vodi. Čovjek i životinje mogu sintetizirati vodu u svojim tijelima, formirati je tokom sagorijevanja prehrambenih proizvoda i samih tkiva. Kod deve, na primjer, mast sadržana u grbi može, kao rezultat oksidacije, dati 40 litara vode.
At elektroliza mogu se dobiti dvije vrste vode: 1) kisela voda („mrtva“), koja djeluje kao antiseptik (slično koliko patogenih mikroba umire u kiselom želučanom soku); 2) alkalna voda („živa“), koja aktivira biološke procese (povećava produktivnost, brže zacjeljuje rane itd.).
O drugim karakteristikama vode (strukturiranim, energetsko-informacionim, itd.) možete saznati sa interneta.
TRIZ zadatak 27. Vodovod
Najčešće različiti mehanizmi imaju "solid-state" radna tijela. Navedite primjere tehničkih uređaja u kojima je radno tijelo voda (tečnost). Kojim zakonima razvoja tehničkih sistema odgovara takvo radno tijelo?
TRIZ zadatak 28. Voda u sito
U poznatom problemu Kako nositi vodu u sito? postoji eksplicitno fizička kontradikcija: sito treba da ima rupe kako bi se kroz njega prosejale rasute materije i ne bi trebalo da ima rupa da voda ne bi izlivala. Jedno od mogućih rješenja ovog problema nalazi se u Ya.I. Perelmana u "Zabavnoj fizici", gdje se predlaže spuštanje sita u rastopljeni parafin tako da mreža sita ne bude navlažena vodom. Na osnovu tehnike za eliminisanje tehničkih i fizičke kontradikcije predložiti 10-20 drugih načina za rješavanje ovog problema.






