Jonet janë atome të ngarkuara dhe grupe atomike. Koncepti i reaksioneve jonike dhe ngarkesa e joneve
Udhëzim
Një atom i çdo substance përbëhet nga një shtresë elektronike dhe një bërthamë. Bërthama përbëhet nga dy lloje grimcash - neutrone dhe protone. Neutronet nuk kanë energji elektrike ngarkuar po, elektrike ngarkuar neutronet janë zero. Protonet janë grimca të ngarkuara pozitivisht dhe kanë një elektricitet ngarkuar e barabartë me +1. Numri i protoneve karakterizon numrin atomik të një atomi të caktuar.
Predha elektronike e një atomi përbëhet nga orbitale elektronike, të cilat përmbajnë një numër të ndryshëm elektronesh. Elektroni - i ngarkuar negativisht grimcë elementare. Elektrike e saj ngarkuarështë e barabartë me -1.
Atomet gjithashtu mund të lidhen me molekulat përmes lidhjeve.
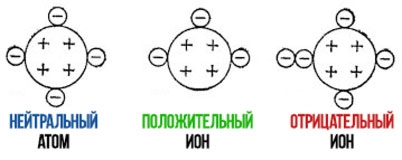
Në një atom neutral, numri i protoneve është i barabartë me numrin e elektroneve. Prandaj ajo ngarkuar barazohet me zero.
Për të përcaktuar ngarkuar dhe ajo, është e nevojshme të dihet struktura e tij, përkatësisht numri i protoneve në bërthamë dhe numri i elektroneve në orbitalet e elektroneve.
Total ngarkuar dhe ajo të përftuara si rezultat i përmbledhjes algjebrike ngarkuar s të protoneve dhe elektroneve të përfshira në të. Numri i elektroneve në një jon mund të tejkalojë numrin e protoneve, dhe atëherë joni do të jetë negativ. Nëse numri i elektroneve është më i vogël se numri i protoneve, atëherë joni do të jetë pozitiv.
Duke ditur një element kimik, duke përdorur tabelën periodike, mund të përcaktojmë numrin atomik të tij, i cili është i barabartë me numrin e protoneve në bërthamën e një atomi të këtij elementi (për shembull, 11 për natriumin). Nëse njëri prej elektroneve ka lënë atomin e natriumit, atëherë atomi i natriumit nuk do të ketë më 11, por 10 elektrone. Atomi i natriumit bëhet një jon i ngarkuar pozitivisht me ngarkuar ohm Z = 11+(-10) = +1.
Një jon i tillë do të shënohet me simbolin Na me një plus në krye, në rast ngarkuar dhe +2 - dy pluse, etj. Prandaj, për negative dhe ajo përdoret shenja minus.
Atomi element kimik përfshin bërthamat dhe guaskë elektronike. Bërthama është pjesa qendrore e atomit, në të cilën është përqendruar pothuajse e gjithë masa e tij. Ndryshe nga guaska elektronike, bërthama ka një pozitiv ngarkuar.
Do t'ju duhet
- Numri atomik i një elementi kimik, ligji i Moseley
Udhëzim
Bërthama e një atomi përbëhet nga dy lloje grimcash - protone dhe neutrone. Neutronet janë grimca elektrike neutrale, domethënë elektrike e tyre ngarkuar barazohet me zero. Protonet janë grimca të ngarkuara pozitivisht dhe elektriciteti i tyre ngarkuarështë +1.
Në këtë mënyrë, ngarkuar bërthamat e barabartë me numrin e protoneve. Nga ana tjetër, numri i protoneve në bërthamë është i barabartë me numrin atomik të elementit kimik. Për shembull, numri atomik i hidrogjenit është 1, domethënë, bërthama e hidrogjenit përbëhet nga një proton që ka ngarkuar+1. Numri atomik i natriumit është 11, ngarkuar e tij bërthamatështë e barabartë me +11.
Në kalbjen alfa bërthamat numri i tij atomik zvogëlohet me dy nga emetimi i një grimce alfa ( bërthamat atomi i heliumit). Kështu, numri i protoneve në një bërthamë që ka pësuar kalbje alfa është gjithashtu reduktuar me dy.
Prishja beta mund të ndodhë në tre lloje të ndryshme. Në rastin e zbërthimit beta-minus, neutroni shndërrohet në një proton duke emetuar një elektron dhe një antineutrino. Pastaj ngarkuar bërthamat rritet me një.
Në rastin e zbërthimit beta-plus, protoni shndërrohet në një neutron, një pozitron dhe një neutrino, ngarkuar bërthamat zvogëlohet me një.
Në rast të kapjes elektronike ngarkuar bërthamat gjithashtu zvogëlohet me një.
Ngarkimi bërthamat mund të përcaktohet edhe nga frekuenca vijat spektrale rrezatimi karakteristik i një atomi. Sipas ligjit të Moseley-t: sqrt(v/R) = (Z-S)/n, ku v është frekuenca spektrale e rrezatimit karakteristik, R është konstanta Rydberg, S është konstanta e ekranit, n është numri kuantik kryesor.
Kështu Z = n*sqrt(v/r)+s.
Video të ngjashme
Burimet:
- Si ndryshon ngarkesa bërthamore?
përpara punë laboratorike, dhe nuk janë zhvilluar aftësitë dhe aftësitë e nevojshme për të njohur kimikatet. Ose ndoshta në laborator kimik etiketat me emrat e përbërjeve janë hequr aksidentalisht. Aftësia për të identifikuar saktë kimikatet për shkak të specifikës së tyre mund të mos kërkohet më pas diplomimit. institucionet arsimore. Por nga ana tjetër, kjo njohuri mund të jetë e nevojshme nga vetë fëmija juaj, i cili do të vijë për ndihmë. Atëherë çfarë t'i përgjigjesh atij?

Do t'ju duhet
- Raft me provëza, reagentë për përcaktimin e substancave, llambë shpirtërore, tel me lak, tregues
Udhëzim
Substancat kimike përbëhet nga jone të ngarkuar pozitivisht dhe negativisht, duke formuar një përbërje përgjithësisht neutrale elektrike. Për të përcaktuar përbërjen e një substance, është e nevojshme të udhëhiqet nga reagimet cilësore ndaj të ndryshmeve jonet. Dhe nuk është e nevojshme t'i mësoni përmendësh, por mjafton të dini se ekzistojnë reagentë të tillë me të cilët mund të përcaktoni pothuajse çdo përbërje kimike.
Acidet. Të gjitha acidet kanë të përbashkët se ato përmbajnë një jon hidrogjeni. Është prania e tij që përcakton vetitë acidike. Treguesit mund të konsiderohen si një reagim cilësor ndaj këtij grupi substancash, domethënë, në një mjedis acid, lakmusi bëhet i kuq, dhe portokallia metil kthehet në rozë.
themelet. Substancat e këtij grupi mund të përcaktohen gjithashtu duke përdorur një tregues. Një reagim karakteristik jep fenolftaleina, e cila bëhet e kuqërremtë në një mjedis alkalik. Kjo është për shkak të pranisë së joneve hidroksid.
Metalet. Për të përcaktuar jonet metale, për këtë ju duhet të përdorni një llambë alkooli ose një djegës. Merrni një tel bakri, bëni një lak me diametër 6-10 mm në njërin skaj dhe vendoseni në flakë. Pothuajse menjëherë do të shihni se ka marrë një ngjyrë të bukur jeshile. Kjo ndodh vetëm për shkak të joneve të bakrit. I njëjti rezultat do të vërehet nëse teli fillimisht zhytet në kripëra bakri (klorur bakri, nitrat bakri, sulfat bakri), dhe më pas futet në flakë.
Për të përcaktuar praninë e joneve metale alkali(natriumi dhe kaliumi) dhe toka alkaline (kalcium dhe barium), gjithashtu duhet të shtoni tretësirat e duhura të kripës në flakën e llambës shpirtërore. Jonet e natriumit do ta ngjyrosin flakën në të verdhë të ndezur, jonet kalcium - tulla e kuqe. Jonet e bariumit, të cilat janë pjesë e substancave, do të japin një ngjyrë të verdhë-jeshile, dhe jonet kalium - vjollcë.
Për të përcaktuar jonet e mbetjeve acide, ekzistojnë një numër i reagimet cilësore. Joni i sulfatit mund të përcaktohet duke zgjedhur jonin e klorit të reagentit, i cili do të rezultojë në një precipitat të bardhë. Për të zbuluar se ka një jon karbonat në një epruvetë, merrni ndonjë acid të holluar dhe në fund do të shihni një shkumë. Për më tepër, dioksidi i karbonit që rezulton kaloni përmes ujit të gëlqeres, duke vëzhguar turbullirën.
Ne kemi shqyrtuar tashmë shkurtimisht, në të cilat, për shkak të një ndryshimi të vogël në elektronegativitetin e atomeve (0.4-2.0), çifti elektronik nuk shpërndahet në mënyrë të barabartë midis tyre. Për ata që kanë harruar, ju kujtoj këtë elektronegativitetiështë aftësia e atomeve për të tërhequr elektrone drejt vetes.

Sidoqoftë, nëse elektronegativiteti i atomeve ndryshon me më shumë se 2 sipas tabelës së elektronegativitetit, atëherë çifti elektronik kalon plotësisht në atomin më elektronegativ, dhe si rezultat, lidhje kimike jonike. Një lidhje kimike jonike formohet vetëm midis atomeve të metaleve tipike (sepse ato humbasin lehtësisht elektronet e jashtme) dhe jometaleve (sepse kanë elektronegativitet të lartë).

jonet pozitive dhe negative
Një shembull i mirë i një lidhjeje kimike jonike është kripa e zakonshme e tryezës NaCl, e cila është e pranishme në çdo kuzhinë. Atomet e natriumit (dhe në përgjithësi të gjitha metalet) mbajnë dobët elektronet e jashtme, ndërsa atomet e klorit, përkundrazi, kanë një aftësi shumë të lartë për të tërhequr elektrone drejt vetes, d.m.th. kanë elektronegativitet të lartë.
Prandaj, gjatë formimit të molekulës NaCl, çdo atom Na humbet një elektron (e -), duke formuar jon pozitiv natriumi Na + , dhe çdo atom Cl, përkundrazi, fiton këtë elektron të humbur të natriumit, duke formuar jon negativ klor Cl - . Kjo shkruhet si dy reagime:
- Na → Na + + e - dhe ½Cl 2 + e - → Cl -
Ishte e nevojshme të shënohej ½Cl 2 sepse klori i gaztë në natyrë përbëhet nga molekula diatomike dhe jo nga të lira. atome të vetme klorit.
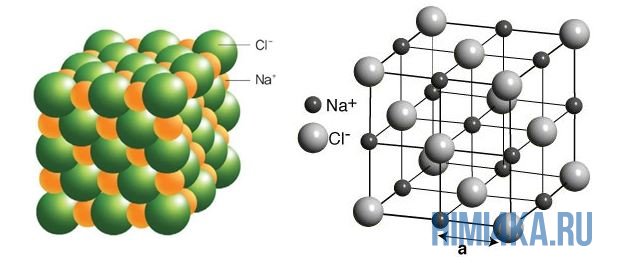
Në figurën e mësipërme është paraqitur rrjeta kristalore e NaCl, ku çdo jon klorur Cl - është i rrethuar nga të gjitha anët nga jonet pozitive fqinje të natriumit Na + ; jonet e natriumit Na + janë gjithashtu të rrethuar nga jonet më të afërt të klorurit Cl - në të njëjtën mënyrë. Ky rregullim i joneve është shumë i qëndrueshëm.
Jonet e ngarkuara pozitivisht quhen kationet. Këto janë kryesisht metale, pasi dhurojnë lehtësisht nga një deri në tre elektrone. Më poshtë janë shembuj të kationeve:

Anionet janë jometale, sepse me kënaqësi i lidhin elektronet me vete, duke u shndërruar në jone të ngarkuar negativisht. Shembuj të anionit:

Ngarkesa e një joni të thjeshtë monotomik, si Mg 2+ ose F 2-, quhet gjendja e tij e oksidimit. Gjendja e oksidimit- ky është numri i elektroneve që duhet t'i shtohen (reduktohen) jonit ose të hiqen (oksidohen) prej tij në mënyrë që të kthehet në një atom neutral.
- Reaksioni i rikuperimit: Mg 2+ + 2e - → Mg
- Reaksioni i oksidimit: F 2- → F + 2e -
Procesi i lidhjes së elektroneve në një atom ose thjesht zhvendosja e tyre drejt një atomi të caktuar quhet reagimi i rimëkëmbjes, dhe quhet tërheqja e elektroneve nga një atom ose heqja e plotë e tyre reaksion oksidimi. Këtu është një fletë e shkëlqyer mashtrimi me gjendjet e oksidimit të joneve të thjeshta:

Shembulli 12.
A oksidohet apo reduktohet klori kur formohet joni i klorurit? Cila është gjendja e oksidimit të këtij joni?
Zgjidhja: Klori reduktohet sepse një elektron duhet të lidhet me çdo atom klori për të formuar një jon klorur. Joni i klorurit, Cl-, ka një gjendje oksidimi prej -1.
Shembulli 13
A oksidohen apo reduktohen metalet kur formojnë jone? Cila është gjendja e oksidimit të jonit të aluminit?
Zgjidhja: Kur formohen jonet metalike, këta të fundit oksidohen, pasi në këtë rast elektronet hiqen nga atomet e metalit. Joni i aluminit, Al 3+, ka një gjendje oksidimi prej +3.
Valenca e elementeve kimike
Valenca quhet numri i lidhjeve kimike që një atom i caktuar formon me atome të tjera në një molekulë. Megjithatë, nëse flet në terma të thjeshtë, atëherë valenca kuptohet se është e njëjta gjendje oksidimi, por ndryshe nga ajo, valenca nuk ka shenjë dhe nuk është e barabartë me zero.
Emri i joneve
Jonet e metaleve që kanë gjendje të ndryshme (të ndryshueshme) oksidimi shkruhen si më poshtë:
- Fe 2+ hekur (II) ose jon hekuri
- Fe 3+ hekur (III) ose jon hekuri
- Cu + bakër(I) ose jon bakri monovalent
- Cu 2+ bakër (II) ose jon bakri dyvalent
- Sn 2+ kallaj (II) ose kallaj dyvalent
- Sn 4+ kallaj (IV) ose jon kallaji katërvalent
Shembulli 2: Oksidimi ose reduktimi ndodh kur një jon ferrik shndërrohet në një jon hekuri? Shkruani ekuacionin për këtë proces.
Zgjidhja: Ekuacioni i reaksionit ka këtë formë: Fe 3+ + e - → Fe 2+. Është një proces reduktimi, pasi një elektron është i lidhur me jonin origjinal.
Shpresoj se mësimi 6 "" doli të jetë i kuptueshëm dhe i dobishëm për ju. Nëse keni ndonjë pyetje, shkruani ato në komente. Nëse nuk ka pyetje, atëherë shkoni në mësimin 7 "".
Video informuese mbi këtë temë
Termi "jon" u prezantua për herë të parë në 1834, me kreditimin e Michael Faraday. Pasi studioi efektin e rrymës elektrike në tretësirat e kripërave, alkaleve dhe acideve, ai arriti në përfundimin se ato përmbajnë grimca që kanë një ngarkesë të caktuar. Faraday i quajti kationet që lëviznin në një fushë elektrike në katodë, e cila ka një ngarkesë negative. Anionet janë grimca jonike jo elementare të ngarkuara negativisht që lëvizin në një fushë elektrike drejt plusit - anodës.
Kjo terminologji përdoret edhe sot, dhe grimcat studiohen më tej, gjë që na lejon të konsiderojmë një reaksion kimik si rezultat i një ndërveprimi elektrostatik. Shumë reaksione zhvillohen sipas këtij parimi, i cili bëri të mundur kuptimin e rrjedhës së tyre dhe përzgjedhjen e katalizatorëve dhe frenuesve për të shpejtuar rrjedhën e tyre dhe për të penguar sintezën. Gjithashtu u bë e ditur se shumë substanca, veçanërisht në tretësira, janë gjithmonë në formën e joneve.
Nomenklatura dhe klasifikimi i joneve
Jonet janë atome të ngarkuara ose një grup atomesh që, në rrjedhën e reaksion kimik elektrone të humbura ose të fituara. Ato përbëjnë shtresat e jashtme të atomit dhe mund të humbasin për shkak të forcës së ulët tërheqëse të bërthamës. Atëherë rezultati i shkëputjes së një elektroni është një jon pozitiv. Gjithashtu, nëse një atom ka një ngarkesë të fortë bërthamore dhe një shtresë të ngushtë elektronike, bërthama është një pranues i elektroneve shtesë. Si rezultat, formohet një grimcë jonike negative.
Jonet në vetvete nuk janë vetëm atome me tepricë ose të pamjaftueshme shtresë elektronike. Mund të jetë gjithashtu një grup atomesh. Në natyrë, janë jonet grupore që ekzistojnë më shpesh, të cilët janë të pranishëm në tretësirat, lëngjet biologjike të trupave të organizmave dhe në uji i detit. Ekziston një numër i madh i llojeve të joneve, emrat e të cilëve janë mjaft tradicionalë. Kationet janë jone të ngarkuar pozitivisht, dhe jonet e ngarkuar negativisht janë anione. Në varësi të përbërjes, ato quhen ndryshe. Për shembull, kation natriumi, kation cezium dhe të tjerët. Anionet quhen ndryshe, pasi ato më së shpeshti përbëhen nga shumë atome: anion sulfat, anion ortofosfat dhe të tjerë.
Mekanizmi i formimit të joneve
Elementet kimike në komponimet janë rrallë elektrikisht neutrale. Kjo do të thotë, ata nuk janë pothuajse kurrë në gjendjen e atomeve. Në formimin e një lidhje kovalente, e cila konsiderohet më e zakonshme, atomet gjithashtu kanë një ngarkesë të caktuar, dhe dendësia e elektroneve zhvendoset përgjatë lidhjeve brenda molekulës. Megjithatë, ngarkesa e jonit nuk është formuar këtu, sepse energjia lidhje kovalente më pak se energjia e jonizimit. Prandaj, megjithë elektronegativitetin e ndryshëm, disa atome nuk mund të tërheqin plotësisht elektronet e shtresës së jashtme të të tjerëve.
Në reaksionet jonike, ku ndryshimi në elektronegativitetin midis atomeve është mjaft i madh, një atom mund të marrë elektrone nga shtresa e jashtme nga një atom tjetër. Pastaj lidhja e krijuar polarizohet fort dhe prishet. Energjia e shpenzuar për këtë, e cila krijon ngarkesën e jonit, quhet energji jonizuese. Për secilin atom, ai është i ndryshëm dhe tregohet në tabelat standarde.

Jonizimi është i mundur vetëm kur një atom ose një grup atomesh është i aftë ose të dhurojë elektrone ose t'i pranojë ato. Kjo vërehet më shpesh në kristalet e tretësirës dhe kripës. Rrjeta kristalore përmban gjithashtu grimca të ngarkuara pothuajse të palëvizshme, pa energji kinetike. Dhe meqenëse nuk ka mundësi për lëvizje në kristal, reaksioni i joneve zhvillohet më shpesh në tretësirë.
Jonet në fizikë dhe kimi
Fizikanët dhe kimistët po studiojnë në mënyrë aktive jonet për disa arsye. Së pari, këto grimca janë të pranishme në të gjitha gjendjet e njohura agregate të materies. Së dyti, energjia e shkëputjes së elektroneve nga një atom mund të matet për ta përdorur atë në aktivitete praktike. Së treti, jonet sillen ndryshe në kristale dhe tretësirë. Dhe së katërti, jonet bëjnë të mundur përcjelljen elektricitet, dhe vetitë fiziko-kimike të tretësirave ndryshojnë në varësi të përqendrimit të joneve.
Reaksionet jonike në tretësirë
Vetë zgjidhjet dhe kristalet duhet të konsiderohen më në detaje. Në kristalet e kripës, gjenden veçmas jone pozitive, për shembull, kationet e natriumit dhe anionet negative të klorit. Struktura e kristalit është e mahnitshme: për shkak të forcave të tërheqjes dhe zmbrapsjes elektrostatike, jonet orientohen në një mënyrë të veçantë. Në rastin e klorurit të natriumit, ato formojnë të ashtuquajturën rrjetë kristalore të diamantit. Këtu, çdo kation natriumi është i rrethuar nga 6 anione kloride. Nga ana tjetër, çdo anion klorur rrethon 6 anione kloride. Për shkak të kësaj, kripë e thjeshtë e tryezës si në të ftohtë ashtu edhe në ujë i nxehtë tretet pothuajse me të njëjtën shpejtësi.

Në tretësirë, nuk ka gjithashtu asnjë molekulë të tërë të klorurit të natriumit. Secili prej joneve është i rrethuar nga dipole uji dhe lëviz rastësisht në trashësinë e tij. Prania e ngarkesave dhe ndërveprimeve elektrostatike çon në faktin se zgjidhjet e kripura të ujit ngrijnë në një temperaturë pak më të vogël se zero dhe ziejnë në një temperaturë mbi 100 gradë. Për më tepër, nëse substanca të tjera janë të pranishme në tretësirë që mund të hyjnë në lidhje kimike, atëherë reaksioni vazhdon jo me pjesëmarrjen e molekulave, por të joneve. Kjo krijoi doktrinën e skenës së një reaksioni kimik.
Ato produkte që përftohen në fund nuk formohen menjëherë gjatë ndërveprimit, por sintetizohen gradualisht nga produktet e ndërmjetme. Studimi i joneve bëri të mundur të kuptohet se reaksioni vazhdon pikërisht sipas parimeve të ndërveprimeve elektrostatike. Rezultati i tyre është sinteza e joneve që ndërveprojnë elektrostatikisht me jonet e tjera, duke krijuar produktin përfundimtar të reaksionit të ekuilibrit.
Përmbledhje
Një grimcë e tillë si një jon është një atom i ngarkuar elektrik ose grup atomesh, i cili përftohet gjatë humbjes ose marrjes së elektroneve. Joni më i thjeshtë është hidrogjeni: nëse humbet një elektron, atëherë është vetëm një bërthamë me ngarkesë +1. Shkakton mjedisin acid të tretësirave dhe mediave, i cili është i rëndësishëm për funksionimin e sistemeve dhe organizmave biologjikë.
Jonet mund të jenë ose pozitive ose ngarkesa negative. Për shkak të kësaj, në tretësira, secila grimcë hyn në ndërveprim elektrostatik me dipolet e ujit, gjë që krijon kushte për jetën dhe transmetimin e sinjalit nga qelizat. Për më tepër, teknologjitë jonike po zhvillohen më tej. Për shembull, janë krijuar motorë jonikë, të cilët tashmë janë pajisur me 7 misione hapësinore të NASA-s.






