Šta se topi u fizici. Velika enciklopedija nafte i gasa. Taline prema vrsti hemijskih jedinjenja su
Svi znamo iz školski kurs fizike, da kada supstanca promeni svoju stanje agregacije dolazi do faznog prelaza. Supstanca in čvrsto stanje može ići direktno u gasovito. Na primjer, kada temperatura suhog leda (čvrsti ugljični dioksid, CO 2 ) poraste, on se pretvara u plin. Ovaj proces se naziva sublimacija ili sublimacija.
Većina ljudi kupuje i jede svoje bombone itd. u roku od nekoliko dana ili sati nakon kupovine. Jedna od zanimljivijih metoda uključuje zračenje rastopljenog kakao putera rendgenskim zracima niskog nivoa. Ovo se ne radi da bi se dobila rendgenska slika, kao kod doktora, već da bi se dobila slika smetnje. Ova tehnika se zove difrakcija rendgenskih zraka i o njoj će se govoriti u drugom poglavlju. Stručni tehničar može protumačiti sliku i zaključiti konfiguraciju atoma ili molekula u čvrstoj rešetki.
Ali češće se javljaju drugi procesi. Na primjer, kada se voda smrzne, tečno stanje postaje čvrsta (kristalizacija). Kada se kamenje topi u lavi, prelazi iz čvrstog u tečno (otopljenje). Kada voda ključa u kotlu, prelazi iz tečnosti u gas (isparavanje i ključanje). Dok predmetna tvar pri dodavanju ili uklanjanju dodatne topline prelazi u novo stanje - tekuće, čvrsto ili plinovito, temperatura se ne mijenja. Zašto se ovo dešava?
Testiraju se različiti načini grijanja, hlađenja i miješanja dok se ne postigne optimalan proces. Ovo je jedan od razloga zašto se čokolada tako dobro topi u ustima. Ovo svojstvo koriste i farmaceutske kompanije u pripremi supozitorija. Supozitorija je sistem za isporuku lijeka u obliku metka koji se sastoji od kakao putera pomiješanog s lijekom, koji se zatim ubacuje u otvor koji nije u usta. Kako se kakao puter topi, lijek se postepeno oslobađa.
Lijekovi mogu ostati blizu površine, ili mogu difundirati u kapilare i proširiti se na ostatak tijela kroz cirkulatorni sistem. Tri faze su definisane malim grčkim slovima, gama i delta. Alfa i delta faze se također nazivaju ferit ili feritno željezo, koje se dobiva iz latinska reč za gvožđe gvožđe. Gama faza se takođe naziva austenit ili austenitno gvožđe po engleskom metalurgu Williamu Chandleru Roberts-Austinu. Austenitno gvožđe je složenije od ova dva.
Detaljno objašnjenje zašto se temperatura ne mijenja pri topljenju
Zamislite da mirno pijete limunadu (koja ima otprilike isti toplinski kapacitet kao obična voda). Komadići leda plutaju u ovoj limunadi. Temperatura ove mešavine pola limunade, pola leda je blizu nula stepeni Celzijusa. Dok držite čašu u dlanovima i posmatrate proces koji se u njoj odvija, led počinje da se topi, ali se sadržaj posude ne zagreva dok se sav led u njoj ne otopi.
Budući da željezo mijenja svoja magnetna svojstva u temperaturnom rasponu u kojem je čvrsto, alfa faza je prvobitno bila podijeljena na alfa magnetnu fazu i nemagnetnu beta fazu. Pošto ovaj magnetni prelaz nema nikakve veze sa polimorfizmom, beta faza je tako postavljena.
Kristalna struktura od dvije feritne faze je kubična sa centrom u centru, a γ-austenitna faza je gušće zbijena kubna sa središtem zrna. Kristalna struktura ove gusto zbijene faze odgovara imenovanom heksagonalnom bliskom pakovanju. Vjeruje se da je jezgro Zemlje sastavljeno od vrlo velikog monokristala epsilon faze, legure željeza i nikla.
Pitanje. Zašto se temperatura ne menja tokom topljenja? Toplotna energija dolazi iz okruženje, topi led bez zagrijavanja mješavine u cjelini. Da li je ova jednadžba za izračunavanje količine topline (gdje je količina topline, da li je masa uzorka, da li je promjena temperature) beskorisna? Nikako - to samo znači da nije primjenjivo na fazni prijelaz.
Čelik je legura željeza - mješavina željeza sa drugim elementima u metalnoj matrici. Prvi čelici su vjerovatno nastali slučajno, kada su blankovi željeznog mača zagrijani u kovačnicama uglja i neke od čestica ugljika ušle su u željeznu matricu. Sa ugljikom, čelik je tvrđi i ima veću vlačnu čvrstoću od željeza, ali je i krhkiji. Čelik se savija pod naprezanjima koja savijaju željezo, ali je vjerojatnije da će čelik puknuti do željeza.
Oba imena podsjećaju na čvrstu, krhku i izrazito nemetalnu prirodu ovog spoja. Kao i svi rastvarači, željezo ima ograničenu sposobnost rastvaranja ugljika. Pri visokoj do vrlo visokoj koncentraciji, kristali cementita će se početi formirati u matrici α-ferita. Slična mješavina s okruglim kristalima naziva se sferoidit. Za više informacija obratite se metalurgu. Klasični čelici su mješavina velikih količina željeza s malom količinom ugljika, ali moderni čelici mogu sadržavati i druge metale kao što su krom, nikl, mangan, molibden ili vanadij.
Moguće je konstruisati graf zavisnosti temperature neke supstance od količine prenete toplote. Na primjer, na sl. 1 prikazuje grafikon faznih prelaza leda uzetih iz zamrzivača. Odsjek odgovara zagrijavanju leda, dio odgovara topljenju leda, odjeljak odgovara zagrijavanju rezultirajuće vode, dio odgovara ključanju vode, odjeljak odgovara zagrijavanju nastale pare.
Krom se dodaje za proizvodnju nehrđajućeg čelika. Dobivena legura otporna je na oksidaciju i koroziju. Nikl i mangan se dodaju kako bi se povećala tvrdoća održavajući željezo u fazi koja ne bi trebala postojati. Na sobnoj temperaturi, prirodno stanje gvožđa je relativno meka, centrirana, kubična α-feritna faza. Dodavanje prosječne količine ugljika u željezo zajedno sa zdravu dozu crtica nikla i molibdena daje nam mješavinu sa posebnim svojstvima. Kada se temperatura zagrije iznad prijelazne temperature i ostavi da se normalno ohladi, γ-austenitna kubična struktura sa središtem centra ostaje zaključana.

Rice. jedan. Grafikon faznih prelaza H 2 0.
Kao što vidite, kriva se obično povećava, odnosno povećanje topline dovodi do povećanja temperature. Međutim, kriva ide horizontalno tokom faznih prelaza (na temperaturama i ), budući da promena stanja materije zahteva energiju. Nakon što je tranzicija završena, temperatura ponovo počinje rasti.
U određenom smislu, atomi nikla i molibdena djeluju kao zaštita. Oni sprečavaju atome gvožđa da postignu svoje ciljeve u kubičnoj rešetki sa središtem. Dodajte krom za otpornost na koroziju i imat ćete najrašireniju grupu nehrđajućih čelika na svijetu.
Austenitni nehrđajući čelici mogu se naći u posuđu, priboru za jelo, sudoperima, opremi za preradu hrane, nakitu za pirsing, hirurškoj opremi i floppy disk kapcima. Austenitni nerđajući čelici se često nazivaju proporcijama hroma i nikla koji se dodaju gvožđu.
Zamislimo da ste uzeli vrećicu leda i stavili je na šporet. Prije toga je temperatura leda bila ispod tačke smrzavanja vode, recimo -5 °C. Ali na šporetu se počela presvlačiti. Sve dok se fazni prelaz ne dogodi, temperatura leda raste linearno sa povećanjem količine dovedene toplote, pri čemu c= 2100 J/(kg⋅°C) — specifična toplota led.
Austenitni čelici su prepoznatljivi po svojoj tvrdoći, ali nisu najsloženija porodica čelika. Ova razlika pripada martenzitnom čeliku, nazvanom po njemačkom metalurgu Adolfu Martensu. Martenzitni čelik se koristi u priboru za jelo, skalpelima, ključevima, turbinama i bilo kojoj drugoj primjeni gdje je tvrdoća važna.
Recept za pripremu martenzita počinje činjenicom da se glavna mješavina željeza, ugljika, hroma zagrijava sve dok željezo ne uđe u γ-austenitnu fazu. Nakon toga slijedi brzi proces hlađenja koji se naziva kaljenje, gdje se vrući čelik uranja u vodu, slanu vodu ili ulje. Pad temperature je toliko strm da kristal prelazi iz centralno centriranog kubičnog tijela do tetragonalnog centra. Atomi ugljika u čvrstoj tvari pri normalnim pritiscima žele postojati u jednom od dva rasporeda: kubičnom ili kubnom s kubičnim centrom.
Kada led dostigne temperaturu od t 1 = 0 °C, postaje previše toplo da ostane u čvrstom stanju i počinje da se topi, doživljavajući fazni prijelaz (kriva se izravnava na grafikonu). Za ovaj proces - uništavanje kristalne rešetke leda - potrebna je energija koju proizvodi izvor topline. Zbog toga se temperatura ne menja tokom topljenja.
Tetragonalni raspored je neprirodan i postoji samo zato što se materijal prebrzo ohladio da bi omogućio atomima da se pomaknu u svoje "ispravne" položaje. Nastali uređaj je nestabilan, ali izdržljiv – metastabilan je. Martenzitna struktura može se lako uništiti dodavanjem topline. Kada se ovo kontroliše, proces se naziva otvrdnjavanjem. Nekontrolirano dodavanje topline može biti pogubno.
Provođenje čelika kroz njegove različite faze do one koja ima tražena svojstva u velikoj se mjeri postiže odgovarajućim količinama grijanja i hlađenja. Slične promjene se javljaju i u čeliku. Udar svake letjelice izazvao je ozbiljna strukturna oštećenja koja su bila ozbiljna, ali ne i katastrofalna. Svaki mlaznjak je bio napunjen s dovoljno mlaznog goriva za poletanje s jedne obale na drugu. Kada se zapalio, bio je vruć, ali nedovoljno vruć da bi rastopio čelične grede iznutra.
Nakon što ste neko vrijeme gledali vreću na peći, primijetili ste da se sav led konačno otopio. Kako peć nastavlja da proizvodi toplotnu energiju, temperatura vode raste. Konačno se u njemu pojavljuju mjehurići. "Da", pomislite, "još jedna fazna tranzicija." Da, jeste. Voda postaje vruća i na temperaturi t 2 = 100 °C ključa. Torba počinje da bubri.
Kule su nastavile da opstaju kako su se razvijale. Obje letjelice su toliko oštećene da vatrogasci nisu uspjeli ugasiti ili čak smanjiti požar. Horizontalne čelične grede postajale su sve toplije i toplije, ali se nisu istopile. Umjesto toga, pretvorili su se u plastiku i popustili. To ih je odgurnulo od vertikalnih potpornih greda, što je dovelo do urušavanja poda. Nakon što su se sve te grede pocijepale, došlo je do katastrofalnog urušavanja, jedan sprat se šuljao na drugi ispod dok se cijela kula nije srušila.
Ovo je ponovljeno dva puta, jednom za svaki od 110 spratnih tornjeva, nakon otprilike sat vremena izlaganja sagorevanju mlaznog goriva. Vatra se potom proširila kroz zajednički podrum na zgradu od 40 spratova. Ovo je oslabilo nekoliko unutrašnjih vertikalnih stubova. Kada je jedan pokvario, drugi u blizini nisu bili u stanju da kompenzuju, a treći katastrofalni udes je počeo oko 7 sati kasnije.
Mjerite temperaturu vode. Iznenađujuće, dok voda ključa, njena temperatura se takođe ne menja. Opet, potrebna je određena količina topline da bi se završio prijelaz - iz tekućine u plinovito.
Detalji Kategorija: Molekularno-kinetička teorija Objavljeno 06.11.2014. 13:52 Pregleda: 8274Ista supstanca pod određenim uslovima može biti u različitim agregacionim stanjima – čvrstom, tečnom ili gasovitom. Prilikom prijelaza iz jednog stanja u drugo, sastav molekula ove tvari se ne mijenja. Mijenjaju se samo njihova lokacija, priroda toplinskog kretanja i sile međumolekularnog djelovanja.
Omekšavanje čeličnih greda u konstrukcijskim požarima je uobičajeno. Fotografija ispod prikazuje napušteni teretni pristanište nekadašnjih centralnih željezničkih stanica u New Yorku na Upper West Sideu Manhattana. Kositar metalni lim, kalajne limenke, "kalajna bolest" ili "kalajna guba". Crveni fosfor je polimerna čvrsta supstanca Beli fosfor je kristalna čvrsta supstanca Crni fosfor je poluprovodnik sličan grafitu.
- U čistom titanijumu alfa faza postoji od sobne temperature do 882℃.
- Na 400 km: olivin se mijenja u polimorfizam spinele.
- Na 700 km: Spinel je zamijenjen još gušćom strukturom perovskita.
- Kalcit aragonit, školjke mekušaca.
Od čvrsto stanje materija postaje tečna, a iz tečne u gasovita. Takav prelaz se zove fazni prelaz .
Topljenje

Na niskim temperaturama sve tvari se smrzavaju i pretvaraju u čvrste tvari, čiji su atomi i molekuli tako čvrsto zbijeni da im sile međusobnog privlačenja omogućavaju samo oscilatorna kretanja oko ravnotežnog položaja. Stoga, u normalnim uvjetima, čvrste tvari zadržavaju volumen i oblik.
Satelit se toliko intenzivno zagrijava nekoliko minuta tokom spuštanja da se svaki molekul koji okružuje svemirsku kapsulu ionizira, skrivajući astronaute u vremenskoj barijeri plazme u koju nijedan od naših komunikacijskih signala ne može prodrijeti. Kako temperatura pada, zrak postaje gušći i stanje plazme više ne može biti stabilno.
- Munje i druge varnice.
- Brod nastavlja da usporava dok plove kroz atmosferu.
Zvijezde Ovaj brak plazme i magnetsko polje je važna karakteristika godišnjeg ciklusa sunčeve aktivnosti. Plazma u blizini Sunčevog ekvatora rotira nešto brže od plazme blizu njegovih polova. Kada se Sunčevo magnetsko polje zamrzne u njegovoj plazmi, polje se rasteže i uvija. Sunčeve pjege, baklje, prominencije i druge sunčeve pjege dolaze i odlaze dok se magnetno polje gnara probija kroz površinu Sunca, noseći sa sobom solarnu plazmu. magline. Neonske cijevi "plazma sfere" tokamak i drugi kvark-gluonski generatori fuzije plazme. Relativno je mekan, a indeks loma mu daje sjaj koji se može koristiti pri rezanju. Nešto je skuplje od natrijum-kalc stakla i poželjnije je za električne primjene zbog svoje izvrsnosti električna svojstva izolacija. Cijevi termometra i umjetničko staklo također su napravljene od olovno-alkalnog stakla, koje se obično naziva olovno staklo. Koristi se za posuđe, a za optičke instrumente kao prizme, njegova gustina daje visok stepen snage rasejanja; - tzv., jer se ranije silicijum dobijao iz usitnjenih kremena. Ima visoku otpornost na temperaturne promjene i hemijsku koroziju. Nije tako zgodno za izradu kao krečno ili olovno staklo, a nije ni jeftino kao kreč, cijena borosilikata je umjerena u smislu njegove korisnosti. Cjevovodi, sijalice, fotohromna stakla, zapečaćene prednje svjetiljke, laboratorijski proizvodi i pekarski proizvodi su primjeri borosilikatnih proizvoda. Boraks takođe ima pentahidrat i bezvodni oblik. Opšti naziv za jedinjenja bora koja sadrže kiseonik. Opšti termin koji se odnosi na niz stakala koja sadrže silicijum dioksid i bor oksid. U većini aplikacija koriste se dva specijalna stakla: fiberglas sa visoki nivo stakleni prijelaz i "neutralno" staklo visoke čvrstoće. U poređenju s borosilikatom, aluminosilikat je teže proizvesti. Kada je presvučeno elektroprovodljivom folijom, aluminosilikatno staklo se koristi kao otpornici za elektronska kola. Prema britanskom staklu: Za tekstil se preferira alumino-borosilikatno staklo sa vrlo niskim sadržajem natrijum oksida zbog njegove dobre hemijske otpornosti i visoke tačke omekšavanja. je također vrsta stakloplastike koja se koristi u ojačanoj plastici za izradu kaciga, čamaca, cjevovoda, šasija automobila, užadi, automobilskih auspuha i mnogih drugih predmeta. Mala, ali važna vrsta stakla, aluminosilikat, sadrži 20% aluminijevog oksida, uključujući kalcijev oksid, magnezijev oksid i borov oksid u relativno malim količinama, ali sa vrlo malo sode ili kalijuma. Ovo staklo je otporno na termalni udar do 900℃. Veoma je teško napraviti, tako da je najskuplja od svih čaša. Televizija proizvodi rendgenske zrake koje se moraju apsorbirati ili na kraju mogu uzrokovati zdravstvene probleme. X-zrake apsorbira staklo s minimalnom količinom teških oksida. Ovaj diferencijal je loše vijesti za boju sunca. . Čiste kristalne čvrste materije imaju karakterističnu tačku topljenja, temperaturu na kojoj se čvrsta materija topi da bi postala tečnost.
Proces kojim supstanca prelazi iz čvrstog u tečno stanje naziva se topljenje . Ovaj proces se dešava kada temperatura raste.
U proljeće, kada sunce zagrije, snježni nanosi počinju da se otapaju. Sićušni kristali leda koji čine snijeg pretvaraju se u vodu. Ali, uprkos činjenici da se zrak zagrijava i njegova temperatura postaje iznad nule, temperatura snijega koji se otapa i temperatura otopljene vode ostaju jednake 0 0 C dok se snijeg potpuno ne otopi. Stvar je u tome što se topljenje odvija postepeno. Prilikom topljenja tvar apsorbira toplinu koju prima izvana, te je neko vrijeme i u čvrstom i u tekućem stanju. A njegova temperatura se ne mijenja dok se sve ne otopi i ne postane tečno.
Šta se dešava kada se čvrsta materija zagreje? Kako temperatura raste, brzina oscilacija čestica unutar tvari raste. Stoga se i povećava unutrašnja energija. Na određenoj temperaturi, koja se tzv tačka topljenja , kristalna ćelija čvrsto telo počinje da se kvari. Molekuli dobijaju više slobode. Mogu skakati i zauzimati druge položaje. Supstanca se pretvara u tečnost.
To solidan počinje da se topi, mora se zagrijati do tačke topljenja. Kada počne primati toplinu izvana, neko vrijeme će njegova temperatura rasti direktno proporcionalno vremenu grijanja. Tako ostaje dok se ne počne topiti. Ali čim njegova temperatura postane jednaka tački topljenja, prestaće da se menja i biće konstantna sve dok se sva tvar ne pretvori u tečnost. Nakon toga, temperatura tečnosti će ponovo početi da raste.
Ali ako tečnost prestane da prima toplotu, počeće da se hladi. I čim mu temperatura padne na vrijednost, jednaka temperaturi otapanjem počinje proces kristalizacije.
Svaka supstanca ima svoju tačku topljenja. Pri normalnom pritisku (760 mm Hg), led počinje da se topi na 0 o C. Najviše visoke temperature topljenje među metalima ima volfram - 3422°C. Jednostavna tvar ugljenik se topi na temperaturi od 3500 - 4500 ° C. A tačka topljenja alkohola je minus 114 o C.
Kristalizacija
Kako temperatura tekućine opada, njeni molekuli postaju manje pokretni. I povećavaju se privlačne sile koje drže molekule u određenom strogom redu, karakterističnom za čvrsto tijelo.
Ako a tečna supstanca ohladiti na određenu temperaturu, stvrdnut će se. Proces fazni prelaz iz tečnog u čvrsto se naziva kristalizacija . Za razliku od topljenja, kada supstanca dobije toplotu, tokom kristalizacije ona je odaje, a temperatura joj se smanjuje.
Temperatura na kojoj se odvija ovaj proces naziva se temperatura kristalizacije . Za čistu supstancu, tačka topljenja je jednaka temperaturi kristalizacije.
Poput topljenja, kristalizacija se također odvija postepeno. Slično, tečnost i čvrsta supstanca imaće istu temperaturu dok se cela supstanca ne očvrsne.
Tečni kalaj otopljen lemilom stvrdnjava se i postaje čvrst kada izvadimo lemilo. Rastopljeni tečni metal koji se sipa u kalupe stvrdnjava se kako temperatura pada.
Kristalizaciju u prirodi opažamo svake godine, kada se voda u akumulacijama smrzava na niskim temperaturama, pahulje padaju na tlo umjesto kapi kiše.
Grafikon promjena agregatnog stanja materije
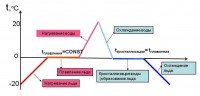
Procesi topljenja i kristalizacije jasno su vidljivi na grafikonu koji pokazuje kako se agregacijsko stanje tvari mijenja ovisno o temperaturi.
Izmjerimo temperaturu komada leda. Termometar pokazuje -20 o C. Stavite led u kantu i unesite ga u prostoriju. Postepeno će se početi topiti, a temperatura će mu rasti. Kada termometar očita 0 o C, neće biti daljeg povećanja temperature dok se sav led ne otopi. Kada se sve pretvori u vodu, voda u kanti će se početi zagrijavati dok ne dostigne sobnu temperaturu.
Iznesemo kantu vode na hladno. Voda će se nastaviti hladiti. Kada mu temperatura padne na 0 o C, počeće da se pretvara u led. I temperatura se neće promijeniti dok se sva voda ne očvrsne. I tek nakon toga će se ponovo početi postepeno smanjivati na vrijednost jednaku temperaturi zraka.
Uz pomoć takvog grafikona možete prikazati promjene u stanju agregacije bilo koje tvari.






