Atomning tuzilishi. Ruterford tajribasi. O'rta asrlarda tabiiy fanlarning rivojlanish tarixi
Atomning sayyoraviy modeli 1910 yilda E. Rezerford tomonidan taklif qilingan. Atomning tuzilishini birinchi bo'lib o'rganish u tomonidan alfa zarralari yordamida amalga oshirildi. Ularning tarqalishi bo'yicha tajribalarda olingan natijalarga asoslanib, Ruterford butunligini taklif qildi musbat zaryad atom uning markazida kichik yadroda to'plangan. Boshqa tomondan, manfiy zaryadlangan elektronlar uning qolgan hajmi bo'ylab taqsimlanadi.
Bir oz fon
Atomlarning mavjudligi haqidagi birinchi ajoyib taxminni qadimgi yunon olimi Demokrit aytgan. O'shandan beri atomlarning mavjudligi haqidagi g'oya, ularning birikmalari atrofimizdagi barcha moddalarni beradi, fan odamlarining tasavvurini tark etmadi. Vaqti-vaqti bilan unga turli xil vakillari murojaat qilishdi, lekin bundan oldin XIX boshi Ularning ko'p asrlik qurilishi eksperimental ma'lumotlar bilan tasdiqlanmagan gipotezalar edi.
Nihoyat, 1804 yilda, atomning sayyoraviy modeli paydo bo'lishidan yuz yildan ko'proq vaqt oldin, ingliz olimi Jon Dalton uning mavjudligiga dalil keltirdi va atom og'irligi tushunchasini kiritdi, bu uning birinchi miqdoriy xarakteristikasi. O‘zidan oldingilar singari u ham atomlarni materiyaning eng mayda bo‘laklari, hatto undan ham kichikroq zarrachalarga bo‘linib bo‘lmaydigan qattiq sharlardek tasavvur qilgan.
Elektronning kashf etilishi va atomning birinchi modeli
Nihoyat, deyarli bir asr o'tdi kech XIX asrda ingliz J. J. Tomson ham birinchi subatomik zarrachani - manfiy zaryadlangan elektronni kashf etdi. Atomlar elektr jihatdan neytral bo'lganligi sababli, Tomson ular butun hajmi bo'ylab tarqalgan elektronlar bilan musbat zaryadlangan yadrodan iborat bo'lishi kerak deb o'yladi. Turli eksperimental natijalarga asoslanib, 1898 yilda u ba'zan "puddingdagi olxo'ri" deb ataladigan o'zining atom modelini taklif qildi, chunki undagi atom musbat zaryadlangan suyuqlik bilan to'ldirilgan, ichiga elektronlar kiritilgan shar shaklida tasvirlangan. pudingga olxo'ri. Bunday sharsimon modelning radiusi taxminan 10 -8 sm edi.Suyuqlikning umumiy musbat zaryadi quyidagi rasmda ko'rsatilganidek, elektronlarning manfiy zaryadlari bilan simmetrik va bir xilda muvozanatlangan.
Ushbu model modda qizdirilganda yorug'lik chiqarishni boshlashini qoniqarli tarzda tushuntirdi. Garchi bu atom nima ekanligini tushunishga birinchi urinish bo'lsa ham, keyinchalik Ruterford va boshqalar tomonidan o'tkazilgan tajribalar natijalarini qondira olmadi. Tomson 1911 yilda uning modeli tajribalarda kuzatilgan a-nurlarining tarqalishi qanday va nima uchun sodir bo'lishiga oddiygina javob bera olmasligiga rozi bo'ldi. Shuning uchun u tashlab ketildi va u atomning yanada mukammal sayyoraviy modeli bilan almashtirildi.
Atom qanday joylashgan?
Ernest Ruterford unga olib kelgan radioaktivlik hodisasiga izoh berdi Nobel mukofoti, lekin uning fanga eng muhim hissasi keyinroq, Quyosh sayyoralar orbitalari bilan o'ralgani kabi, atom ham elektronlar orbitalari bilan o'ralgan zich yadrodan iborat ekanligini aniqlaganida keldi. 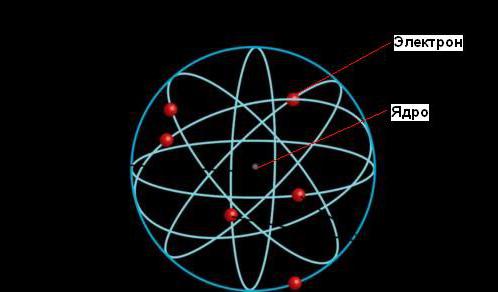
Atomning sayyoraviy modeliga ko'ra, uning massasining katta qismi kichik (butun atom hajmiga nisbatan) yadroda to'plangan. Elektronlar yadro atrofida aql bovar qilmaydigan tezlikda harakatlanadi, ammo atomlar hajmining katta qismi bo'sh joydir.
Yadroning kattaligi shunchalik kichikki, uning diametri atomnikidan 100 000 marta kichikdir. Yadroning diametrini Rezerford 10 -13 sm, atomning o'lchamidan farqli o'laroq - 10 -8 sm deb baholagan.Yadrodan tashqarida elektronlar uning atrofida yuqori tezlikda aylanadi, natijada elektrostatik kuchlarni muvozanatlashtiradigan markazdan qochma kuchlar paydo bo'ladi. protonlar va elektronlar o'rtasidagi tortishish.
Ruterford tajribalari
Atomning sayyoraviy modeli 1911 yilda oltin folga bilan mashhur tajribadan so'ng paydo bo'ldi, bu uning tuzilishi haqida ba'zi fundamental ma'lumotlarni olish imkonini berdi. Rezerfordning atom yadrosini kashf qilish yo'li yaxshi misol fanda ijodkorlikning roli. Uning izlanishlari 1899 yilda ba'zi elementlar har qanday narsaga kirib keta oladigan musbat zaryadlangan zarrachalar chiqarishini aniqlagandan so'ng boshlangan. U bu zarralarni alfa (a) zarrachalar deb atadi (endi bilamizki, ular geliy yadrolari edi). Barcha yaxshi olimlar singari, Ruterford ham qiziquvchan edi. U atomning tuzilishini aniqlash uchun alfa zarralaridan foydalanish mumkinmi, deb o'yladi. Ruterford juda yupqa oltin folga varag'iga alfa zarralari nurini yo'naltirishga qaror qildi. U oltinni tanladi, chunki u 0,00004 sm gacha yupqa choyshablarni ishlab chiqarishi mumkin edi.Oltin folga varag'i orqasiga alfa zarralari urilganda porlab turadigan ekran qo'ydi. U folga orqali o'tgandan keyin alfa zarralarini aniqlash uchun ishlatilgan. Ekrandagi kichik tirqish manbadan chiqqandan keyin alfa zarracha nurlarining folga yetib borishiga imkon berdi. Ulardan ba'zilari folga orqali o'tishi va bir xil yo'nalishda harakat qilishda davom etishi kerak, boshqa qismi folga sakrab tushishi va ostida aks etishi kerak. o'tkir burchaklar. Quyidagi rasmda tajriba sxemasini ko'rishingiz mumkin. 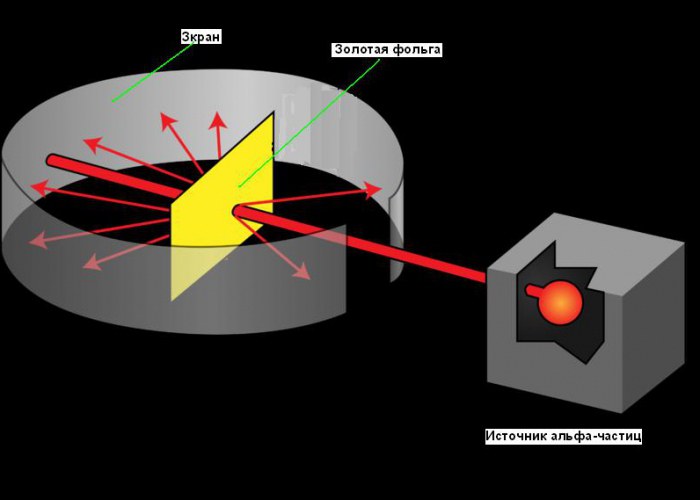
Ruterford tajribasida nima sodir bo'ldi?
J. J. Tomsonning atom modeliga asoslanib, Rezerford oltin atomlarining butun hajmini to'ldiruvchi musbat zaryadli qattiq hududlar folga orqali o'tayotganda barcha alfa zarrachalarining traektoriyalaridan chetga chiqishi yoki egilishini taxmin qildi.
Biroq, alfa zarralarining katta qismi oltin folga ichidan xuddi u erda bo'lmagandek o'tib ketdi. Ular bo'sh joydan o'tayotganga o'xshardi. Ulardan faqat bir nechtasi boshida taxmin qilinganidek, to'g'ri yo'ldan og'ishdi. Quyida tegishli yo'nalishda tarqalgan zarrachalar sonining tarqalish burchagiga nisbatan grafigi berilgan. 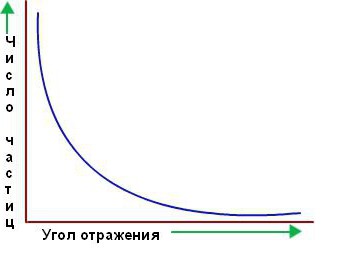
Ajablanarlisi shundaki, zarrachalarning kichik bir qismi folgadan orqaga qaytdi, xuddi basketbol to'pi orqa taxtadan sakrab tushdi. Ruterford bu og'ishlar alfa zarralari va atomning musbat zaryadlangan komponentlari o'rtasidagi to'g'ridan-to'g'ri to'qnashuv natijasi ekanligini tushundi.
Yadro markaziy o'rinni egallaydi
Folgadan aks ettirilgan alfa zarralarining ahamiyatsiz foiziga asoslanib, biz atomning barcha musbat zaryadi va deyarli barcha massasi bitta kichik maydonda to'plangan va atomning qolgan qismi asosan bo'sh bo'shliqdir, degan xulosaga kelishimiz mumkin. Rezerford konsentrlangan musbat zaryad maydonini yadro deb atadi. U bashorat qilgan va tez orada uning tarkibida musbat zaryadlangan zarralar borligini aniqlagan va ularni protonlar deb atagan. Ruterford neytralning mavjudligini bashorat qilgan atom zarralari, neytronlar deb ataladi, lekin u ularni aniqlay olmadi. Biroq, uning shogirdi Jeyms Chadvik ularni bir necha yil o'tgach kashf etdi. Quyidagi rasmda uran atomi yadrosining tuzilishi ko'rsatilgan. 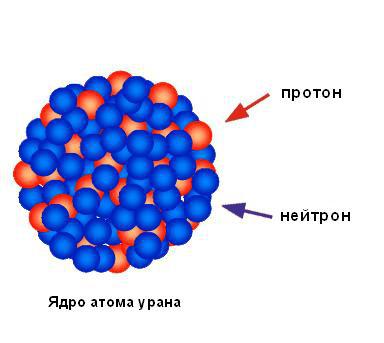
Atomlar musbat zaryadlangan og'ir yadrolardan iborat bo'lib, ular atrofida aylanadigan manfiy zaryadlangan o'ta engil zarrachalar - elektronlar va shunday tezlikda mexanik markazdan qochma kuchlar yadroga elektrostatik tortishishlarini shunchaki muvozanatlashtiradi va shu munosabat bilan atomning barqarorligi ta'minlanadi.
Ushbu modelning kamchiliklari
Ruterfordning asosiy g'oyasi kichik atom yadrosi g'oyasi bilan bog'liq edi. Elektronlarning orbitalari haqidagi faraz sof faraz edi. U elektronlar yadro atrofida qayerda va qanday aylanishini aniq bilmas edi. Shuning uchun Rezerfordning sayyoraviy modeli elektronlarning orbitalarda taqsimlanishini tushuntirmaydi.
Bundan tashqari, Rezerford atomining barqarorligi faqat kinetik energiyani yo'qotmasdan, orbitalarda elektronlarning uzluksiz harakati bilan mumkin edi. Ammo elektrodinamik hisoblar shuni ko'rsatdiki, elektronlarning har qanday egri chiziqli traektoriyalar bo'ylab harakatlanishi tezlik vektori yo'nalishining o'zgarishi va mos keladigan tezlanishning paydo bo'lishi bilan muqarrar ravishda elektromagnit energiya emissiyasi bilan birga keladi. Bunday holda, energiyaning saqlanish qonuniga ko'ra, elektronning kinetik energiyasi nurlanishga juda tez sarflanishi kerak va u quyidagi rasmda sxematik ko'rsatilgandek yadroga tushishi kerak. 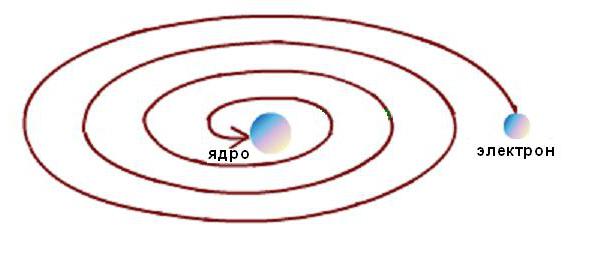 Ammo bu sodir bo'lmaydi, chunki atomlar barqaror shakllanishdir. Hodisa modeli va eksperimental ma'lumotlar o'rtasida tipik ilmiy qarama-qarshilik paydo bo'ldi.
Ammo bu sodir bo'lmaydi, chunki atomlar barqaror shakllanishdir. Hodisa modeli va eksperimental ma'lumotlar o'rtasida tipik ilmiy qarama-qarshilik paydo bo'ldi.
Ruterforddan Nils Borgacha
Atom tarixidagi navbatdagi katta qadam 1913 yilda daniyalik olim Nils Bor atomning batafsil modeli tavsifini e'lon qilganida sodir bo'ldi. U elektronlar bo'lishi mumkin bo'lgan joylarni aniqroq aniqladi. Garchi keyinchalik olimlar yanada murakkab atom konstruksiyalarini ishlab chiqishsa-da, Borning atomning sayyoraviy modeli asosan to'g'ri edi va uning ko'p qismi bugungi kunda ham qabul qilinmoqda. U juda ko'p foydali ilovalarga ega edi, masalan, u turli xil kimyoviy elementlarning xususiyatlarini, ularning nurlanish spektrining tabiatini va atomning tuzilishini tushuntirish uchun ishlatiladi. Sayyoraviy model va Bor modeli fizikada yangi yo'nalish - mikrodunyo fizikasining paydo bo'lishini belgilovchi eng muhim bosqichlar edi. Bor atom tuzilishini tushunishimizga qo'shgan hissasi uchun 1922 yilda fizika bo'yicha Nobel mukofotiga sazovor bo'ldi.
Bor atom modeliga qanday yangilik keltirdi?
Bor hali yoshligida Angliyadagi Ruterford laboratoriyasida ishlagan. Elektron tushunchasi Rezerford modelida yaxshi rivojlanmaganligi sababli, Bor diqqatini ularga qaratdi. Natijada atomning sayyoraviy modeli sezilarli darajada yaxshilandi. Borning 1913 yilda nashr etilgan "Atomlar va molekulalarning tuzilishi to'g'risida" maqolasida shakllantirgan postulatlarida shunday deyilgan:
1. Elektronlar yadro atrofida faqat undan belgilangan masofalarda harakatlana oladi, ular ega bo’lgan energiya miqdori bilan aniqlanadi. U bu sobit darajalarni energiya darajalari yoki elektron qobiqlar deb atadi. Bor ularni konsentrik sharlar sifatida tasavvur qildi, ularning har birining markazida yadro bor. Bunday holda, energiya kamroq bo'lgan elektronlar yadroga yaqinroq bo'lgan pastki darajalarda topiladi. Ko'proq energiyaga ega bo'lganlar ko'proq topiladi yuqori darajalar, yadrodan uzoqda.
2. Agar elektron ba'zi (ma'lum daraja uchun juda aniq) energiyani o'zlashtirsa, u keyingi, yuqori energiya darajasiga o'tadi. Aksincha, agar u bir xil miqdordagi energiyani yo'qotsa, u o'zining dastlabki darajasiga qaytadi. Biroq, elektron ikki energiya darajasida mavjud bo'lolmaydi.
Bu fikr rasm bilan tasvirlangan. 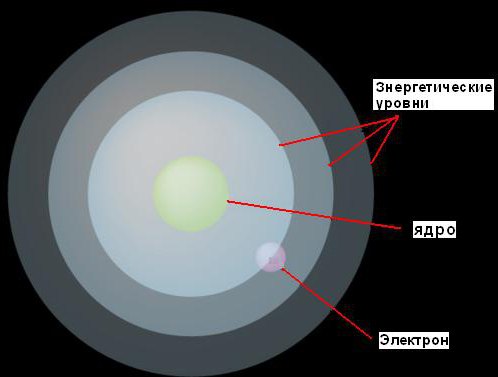
Elektronlar uchun energiya qismlari
Atomning Bor modeli aslida ikki xil g'oyaning kombinatsiyasi: yadro atrofida aylanadigan elektronlar bilan Rezerfordning atom modeli (asosan atomning sayyoraviy Bor-Ruterford modeli) va Maks Plankning materiya energiyasini kvantlash g'oyasi, 1901 yilda nashr etilgan. Kvant (ko'plik - kvant) - modda tomonidan so'rilishi yoki chiqarilishi mumkin bo'lgan minimal energiya miqdori. Bu energiya miqdori uchun diskretizatsiya bosqichining bir turi.
Agar energiya suv bilan taqqoslansa va siz uni stakan shaklida materiyaga qo'shmoqchi bo'lsangiz, siz shunchaki doimiy oqimga suv quya olmaysiz. Buning o'rniga, uni choy qoshiq kabi oz miqdorda qo'shishingiz mumkin. Bor, agar elektronlar faqat ma'lum miqdordagi energiyani o'zlashtira olsa yoki yo'qotsa, ular o'z energiyasini faqat ma'lum miqdorda o'zgartirishi kerak deb hisoblardi. Shunday qilib, ular faqat qattiq joyni egallashlari mumkin energiya darajalari yadro atrofida, bu ularning energiyasining kvantlangan o'sishiga mos keladi.
Shunday qilib, Bor modelidan atom tuzilishi nima ekanligini tushuntirish uchun kvant yondashuvi o'sadi. Sayyora modeli va Bor modeli klassik fizikadan mikrodunyo fizikasida, jumladan atom fizikasida asosiy vosita bo‘lgan kvant fizikasiga o‘ziga xos qadamlar edi.
1903 yilda ingliz olimi Tomson atom modelini taklif qildi, uni hazil bilan "mayizli bulochka" deb atashgan. Uning fikricha, atom bir xil musbat zaryadga ega bo'lgan shar bo'lib, unda manfiy zaryadlangan elektronlar mayiz kabi kesishgan.
Biroq, atomning keyingi tadqiqotlari bu nazariyani asoslab bo'lmasligini ko'rsatdi. Va bir necha yil o'tgach, yana bir ingliz fizigi Ruterford bir qator tajribalar o'tkazdi. Natijalarga asoslanib, u atomning tuzilishi haqidagi farazni yaratdi, bu hali ham butun dunyoda tan olingan.
Ruterford tajribasi: uning atom modelining taklifi
Rezerford o'z tajribalarida alfa zarralari nurini yupqa oltin folga orqali o'tkazdi. Oltin o'zining plastikligi uchun tanlangan, bu juda nozik folga, qalinligi deyarli bir molekula qatlamini yaratishga imkon berdi. Folga ortida alfa zarrachalari tomonidan bombardimon qilinganida yoritilgan maxsus ekran bor edi. Tomson nazariyasiga ko'ra, alfa zarralari folga orqali to'siqsiz o'tib, tomonlarga biroz og'ishgan bo'lishi kerak edi. Biroq, ma'lum bo'lishicha, ba'zi zarralar shunday yo'l tutgan va juda kichik bir qismi orqaga qaytgan, go'yo biror narsaga urilgandek.
Ya'ni, atomning ichida qattiq va kichik narsa borligi aniqlandi, undan alfa zarralari sakrab chiqdi. Aynan o'sha paytda Ruterford atom tuzilishining sayyoraviy modelini taklif qildi. Rezerfordning atomning sayyoraviy modeli uning ham, hamkasblarining ham tajribalari natijalarini tushuntirib berdi. Bugungi kunga qadar yaxshiroq model taklif qilinmagan, garchi bu nazariyaning ba'zi jihatlari hali ham fanning juda tor sohalarida amaliyotga mos kelmasa ham. Ammo, asosan, atomning sayyoraviy modeli eng foydali hisoblanadi. Bu model nima?
Atom tuzilishining sayyoraviy modeli
Nomidan ko'rinib turibdiki, atom sayyoraga qiyoslanadi. Bunday holda, sayyora atomning yadrosidir. Va elektronlar yadro atrofida juda katta masofada aylanadi, xuddi sun'iy yo'ldoshlar sayyora atrofida aylanadi. Faqat elektronlarning aylanish tezligi eng tez sun'iy yo'ldoshning aylanish tezligidan yuz minglab marta katta. Shuning uchun, elektron o'z aylanish jarayonida, xuddi yadro yuzasida bulut hosil qiladi. Va elektronlarning mavjud zaryadlari boshqa yadrolar atrofida boshqa elektronlar tomonidan hosil qilingan bir xil zaryadlarni qaytaradi. Shuning uchun atomlar "bir-biriga yopishmaydi", balki bir-biridan ma'lum masofada joylashgan.
Va zarrachalarning to'qnashuvi haqida gapirganda, biz ularning bir-biriga etarlicha yaqinlashishini nazarda tutamiz uzoq masofa va o'z zaryadlarining maydonlari bilan qaytariladi. To'g'ridan-to'g'ri aloqa yo'q. Moddadagi zarralar odatda bir-biridan juda uzoqda joylashgan. Agar biron bir usul bilan har qanday jismning zarralarini bir-biriga portlatish mumkin bo'lsa, u milliard marta qisqargan bo'lar edi. Yer olmadan kichikroq bo'lardi. Shunday qilib, har qanday moddaning asosiy hajmi, qanchalik g'alati bo'lmasin, zaryadlangan zarralar joylashgan bo'shliq bilan band bo'lib, ular masofadan elektron ta'sir kuchlari tomonidan ushlab turiladi.
O'qishda yordam kerakmi?
Oldingi mavzu: Radioaktivlik: alfa, beta, gamma nurlanishKeyingi mavzu: Atom yadrosi: Yadro zaryadi
2.5. Ruterford tajribalari. Atomning Rezerford modeli
A. Rezerfordning tajribalari
1911 yilda Ruterford atom yadrosining mavjudligini isbotlovchi favqulodda ahamiyatga ega bo'lgan tajribalarni o'tkazdi. Atomni o'rganish uchun Rezerford radiy, poloniy va boshqa ba'zi elementlarning parchalanishi paytida paydo bo'ladigan a-zarralar yordamida uni zondlash (bombardimon qilish) dan foydalangan. Ruterford va uning hamkorlari, hatto 1909 yilda o'tkazilgan tajribalarda ham, a-zarralar moduli bo'yicha elektron zaryadining ikki barobariga teng musbat zaryadga ega ekanligini aniqladilar. q =+2e, va geliy atomining massasiga to'g'ri keladigan massa, ya'ni.
m a\u003d 6,62 10 -27 kg,
Bu elektron massasidan taxminan 7300 marta. Keyinchalik a-zarralar geliy atomlarining yadrolari ekanligi aniqlandi. Ushbu zarralar bilan Rezerford og'ir elementlarning atomlarini bombardimon qildi. Elektronlar kichik massalari tufayli a-zarrachaning traektoriyasini o'zgartira olmaydi. Ularning tarqalishi (harakat yo'nalishini o'zgartirish) faqat atomning musbat zaryadlangan qismi tomonidan sodir bo'lishi mumkin. Shunday qilib, a-zarrachalarning tarqalishidan musbat zaryadning taqsimlanish xarakterini, demak, atom ichidagi massani aniqlash mumkin.
Poloniy chiqaradigan a-zarralar 1,6-107 m/s tezlikda uchishi ma'lum edi. Poloniy qo'rg'oshin qutisiga joylashtirildi, uning bo'ylab tor kanal burg'ulashdi. Kanal va teshikdan o'tgan a-zarracha nurlari folga tushdi. Oltin folga nihoyatda yupqa - 4-10 -7 m qalinlikda yasalishi mumkin (400 ta oltin atomi; bu raqamni oltinning massasi, zichligi va molyar massasini bilish orqali aniqlash mumkin). Folga so'ng, a-zarralar sink sulfid bilan qoplangan yarim shaffof ekranga urildi. Har bir zarrachaning ekran bilan toʻqnashuvi mikroskop ostida kuzatilgan floresans taʼsirida yorugʻlik chaqnashi (ssintillyatsiya) bilan birga boʻlgan.
Qurilma ichidagi yaxshi vakuum bilan (havo molekulalaridan zarrachalar tarqalmasligi uchun), folga bo'lmaganda, a-zarrachalarning yupqa nurlari natijasida paydo bo'lgan sintilatsiyalardan ekranda yorqin doira paydo bo'ldi. Nurning yo'liga folga qo'yilganda, a-zarralarning katta qismi hali ham dastlabki yo'nalishidan chetga chiqmagan, ya'ni ular folga bo'sh joy kabi o'tgan. Biroq, o'z yo'lini o'zgartirgan va hatto orqaga qaytgan alfa zarralari bor edi.
Ruterfordning shogirdlari va hamkorlari Marsden va Geyger milliondan ortiq ssintilatsiyani hisoblab chiqdilar va taxminan 2000 ta alfa zarralaridan biri 90° dan katta burchaklar orqali, 8000 dan 180° gacha burilishini aniqladilar. Bu natijani atomning boshqa modellari, xususan Tomson asosida tushuntirish mumkin emas edi.
Hisob-kitoblar shuni ko'rsatadiki, atom bo'ylab taqsimlanganda, musbat zaryad (hatto elektronlarni hisobga olmasa ham) a-zarrachani orqaga tashlashga qodir bo'lgan etarlicha kuchli elektr maydonini yarata olmaydi. Bir tekis zaryadlangan to'pning elektr maydon kuchi to'p yuzasida maksimal bo'lib, markazga yaqinlashganda nolga kamayadi. A-zarralarning katta burchak ostida tarqalishi go'yo atomning butun musbat zaryadi uning yadrosida to'plangandek sodir bo'ladi - bu atomning butun hajmiga nisbatan juda kichik hajmni egallagan mintaqa.
a-zarrachalarning yadroga urilib, ularni katta burchaklar orqali burish ehtimoli juda kichik, shuning uchun a-zarralarning aksariyati uchun folga mavjud emasdek tuyulardi.
Rezerford yadroning Kulon elektr maydonida a-zarrachalarning tarqalishi muammosini nazariy jihatdan ko'rib chiqdi va sonini aniqlash imkonini beradigan formulani oldi. N Berilgan sochuvchi folga atomlari yadrosida joylashgan elementar musbat zaryadlar +e. Tajribalar shuni ko'rsatdiki, bu raqam N D. I. Mendeleyev davriy sistemasidagi elementning tartib raqamiga teng, ya’ni N=Z(oltin uchun Z= 79).
Shunday qilib, Rezerfordning atom yadrosidagi musbat zaryad kontsentratsiyasi haqidagi gipotezasi elementlarning davriy tizimidagi element tartib raqamining fizik ma'nosini aniqlash imkonini berdi. Neytral atom ham o'z ichiga olishi kerak Z elektronlar. Turli usullar bilan aniqlangan atomdagi elektronlar soni yadrodagi elementar musbat zaryadlar soniga to'g'ri kelishi juda muhimdir. Bu atomning yadro modelining haqiqiyligini tekshirish bo'lib xizmat qildi.
B. Rezerfordning atomning yadro modeli
Rezerford a-zarrachalarni oltin folga bilan sochish bo'yicha o'tkazilgan tajribalar natijalarini umumlashtirib, quyidagilarni aniqladi:
♦ tabiatan atomlar a-zarrachalar uchun asosan shaffofdir;
♦ a-zarrachalarning katta burchaklardagi og'ishlari faqat atom ichida juda kichik hajmda to'plangan katta massa bilan bog'langan musbat zaryad tomonidan yaratilgan juda kuchli elektr maydoni mavjud bo'lganda mumkin.
Ushbu tajribalarni tushuntirish uchun Rezerford atomning yadroviy modelini taklif qildi: atom yadrosida (chiziqli o'lchamlari 10 -15 -10 -14 m bo'lgan hududlar) uning barcha musbat zaryadi va atomning deyarli butun massasi (99,9%). jamlangan. Chiziqli o'lchamlari ~10 -10 m bo'lgan mintaqadagi yadro atrofida (atomning o'lchamlari molekulyar-kinetik nazariyada taxmin qilinadi) manfiy zaryadlangan elektronlar yopiq orbitalarda harakatlanadi, ularning massasi massaning atigi 0,1% ni tashkil qiladi. yadrodan. Binobarin, elektronlar yadrodan 10 000 dan 100 000 diametrgacha bo'lgan masofada joylashgan, ya'ni atomning asosiy qismini bo'sh joy tashkil qiladi.
Rezerfordning atomlarning yadro modeli quyosh tizimiga o'xshaydi: tizimning markazida "quyosh" - yadro va uning atrofida "sayyoralar" - elektronlar orbita bo'ylab harakatlanadi, shuning uchun bu model deyiladi. sayyoraviy. Elektronlar yadroga tushmaydi, chunki yadro va elektronlar orasidagi elektr tortishish kuchlari elektronlarning yadro atrofida aylanishi tufayli markazdan qochma kuchlar tomonidan muvozanatlanadi.
1914 yilda, atomning sayyoraviy modeli yaratilganidan uch yil o'tgach, Rezerford yadrodagi musbat zaryadlarni tekshirdi. Vodorod atomlarini elektronlar bilan bombardimon qilish orqali u neytral atomlarning musbat zaryadlangan zarrachalarga aylanishini aniqladi. Vodorod atomi bitta elektronga ega bo'lganligi sababli, Rezerford atom yadrosi elementar musbat zaryadga ega +e zarracha deb qaror qildi. U bu zarrachani chaqirdi proton.
Sayyora modeli a-zarrachalarning tarqalishi bo'yicha tajribalar bilan yaxshi mos keladi, lekin u atomning barqarorligini tushuntira olmaydi. Masalan, proton yadrosi va bitta elektrondan iborat bo'lgan vodorod atomi modelini ko'rib chiqaylik. v radiusli dumaloq orbita bo'ylab yadro atrofida r. Elektron yadro ichiga spiral aylanishi kerak va uning yadro atrofida aylanish chastotasi (shuning uchun u chiqaradigan elektromagnit to'lqinlarning chastotasi) doimiy ravishda o'zgarishi kerak, ya'ni atom beqaror va uning elektromagnit nurlanishi doimiy bo'lishi kerak. spektr.
Aslida, shunday bo'ladi:
a) atom barqaror;
b) atom faqat ma'lum sharoitlarda energiya chiqaradi;
v) atomning nurlanishi uning tuzilishi bilan aniqlangan chiziqli spektrga ega.
Shunday qilib, klassik elektrodinamikaning atomning sayyoraviy modeliga tatbiq etilishi eksperimental faktlar bilan to'liq ziddiyatga olib keldi. Tugallangan qiyinchiliklarni bartaraf etish sifat jihatidan yangisini yaratishni taqozo etdi kvant- atom nazariyasi. Biroq, uning nomuvofiqligiga qaramay, sayyora modeli hali ham atomning taxminiy va soddalashtirilgan rasmi sifatida qabul qilinadi.
Atomning sayyoraviy modeli
Atomning sayyoraviy modeli: yadro (qizil) va elektronlar (yashil)
Atomning sayyoraviy modeli, yoki Ruterford modeli, - atom tuzilishining tarixiy modeli, Ernest Rezerford tomonidan alfa zarrachalarning tarqalishi bilan tajriba o'tkazish natijasida taklif qilingan. Ushbu modelga ko'ra, atom kichik musbat zaryadlangan yadrodan iborat bo'lib, unda atomning deyarli butun massasi to'plangan bo'lib, uning atrofida elektronlar xuddi sayyoralar quyosh atrofida harakat qiladi. Atomning sayyoraviy modeli elektronlar harakati kvant xarakteriga ega ekanligini va klassik mexanika qonunlari bilan tavsiflanmaganligini hisobga olgan holda atom tuzilishi haqidagi zamonaviy g'oyalarga mos keladi. Tarixiy jihatdan, Ruterfordning sayyoraviy modeli Jozef Jon Tomsonning "olxo'ri puding modeli" dan o'rnini bosdi, bu manfiy zaryadlangan elektronlar musbat zaryadlangan atom ichida joylashganligini ta'kidlaydi.
Ruterford 1911 yilda uning rahbarligida o'tkazilgan oltin folga ustidagi alfa zarralarini sochish bo'yicha tajribadan xulosa sifatida atom tuzilishining yangi modelini taklif qildi. Ushbu tarqalish paytida kutilmagan darajada ko'p miqdordagi alfa zarralari katta burchaklarda tarqaldi, bu tarqalish markazining kichik o'lchamlari va unda katta miqdordagi energiya to'planganligini ko'rsatdi. elektr zaryadi. Ruterfordning hisob-kitoblari shuni ko'rsatdiki, musbat yoki manfiy zaryadlangan tarqalish markazi o'sha paytda ma'lum bo'lgan va taxminan 10-10 m bo'lgan atom hajmidan kamida 3000 marta kichik bo'lishi kerak. o'sha vaqt va ularning massasi va zaryadi aniqlangan bo'lsa, keyinchalik yadro deb ataladigan tarqalish markazi elektronlarga qarama-qarshi zaryadga ega bo'lishi kerak. Ruterford zaryad miqdorini atom raqamiga bog'lamadi. Bu xulosa keyinroq qilingan. Va Ruterfordning o'zi zaryad atom massasiga proportsional ekanligini aytdi.
Sayyoraviy modelning kamchiligi uning klassik fizika qonunlariga mos kelmasligi edi. Agar elektronlar Quyosh atrofida sayyora kabi yadro atrofida harakat qilsa, u holda ularning harakati tezlashadi va shuning uchun klassik elektrodinamika qonunlariga ko'ra, ular elektromagnit to'lqinlarni chiqarishi, energiyasini yo'qotishi va yadroga tushishi kerak. Sayyoraviy modelni ishlab chiqishning navbatdagi bosqichi elektron harakatining klassik qonunlaridan farqli boshqa qonunlarini qo'ygan Bor modeli edi. Elektrodinamikaning ziddiyatlari kvant mexanikasini to'liq hal qila oldi.
Wikimedia fondi. 2010 yil.
Boshqa lug'atlarda "Atomning sayyoraviy modeli" nima ekanligini ko'ring:
atomning sayyoraviy modeli- planetinis atomo models statusas T sritis fizika atitikmenys: angl. sayyoraviy atom modeli vok. Planetenmodell des Atoms, rus. atomning sayyoraviy modeli, f pranc. modele planétaire de l'atome, m … Fizikos terminų žodynas
Vodorodga o'xshash atomning Bor modeli (Z - yadro zaryadi), bu erda manfiy zaryadlangan elektron o'ralgan. atom qobig'i, atrofida kichik, musbat zaryadlangan atom yadrosi... Vikipediya
Model (frantsuzcha modèle, italyancha modello, lotincha modulus oʻlchov, oʻlchov, namuna, meʼyordan), 1) seriyali yoki ommaviy koʻpaytirish uchun standart (standart) boʻlib xizmat qiluvchi namuna (avtomobil M., kiyim-kechak M. va boshqalar) .). ), shuningdek har qanday ... ... turi, markasi.
I Model (Model) Valter (1891 yil 24 yanvar, Gentin, Sharqiy Prussiya, 1945 yil 21 aprel, Duysburg yaqinida), fashistlar nemis generali feldmarshali (1944). 1909 yildan armiyada, 1914 yil 1-jahon urushida qatnashgan 18. 1940 yil noyabrdan 3-tankni boshqargan ... ... Buyuk Sovet Entsiklopediyasi
Atom musbat zaryadlangan yadro va uning atrofida aylanadigan manfiy zaryadlangan zarrachalar - uning elektron qobig'ini tashkil etuvchi elektronlardan iborat.
Elektron zaryadlarining yig'indisi mutlaq qiymatda yadroning musbat zaryadiga teng, shuning uchun atom butun sifatida elektr neytral tizimdir. Atomning kattaligi uning kattaligi bilan belgilanadi elektron qobiq va 10-8 sm gacha bo'lgan qiymatni tashkil qiladi.
Atom qobig'idagi elektronlar qatlamlarda joylashgan. Elektron qatlamlar soni seriya raqamiga teng kimyoviy element elementlarning davriy tizimida D.I. Mendeleev.
Yadroga eng yaqin bo'lgan birinchi K qatlamda ikkitadan ortiq elektron aylanmaydi. Keyingi qatlamda L - 8 dan ko'p bo'lmagan, M qatlamda - 18 dan ko'p bo'lmagan va to'rtinchi N qatlamda - 32 elektrondan ko'p emas. Shunday qilib, eng katta raqam bu qatlamlarning elektronlari qatlam soni Z = 2n2 kvadratining ikki barobariga teng. Keyingi qatlamlarda bu qoida buziladi va elektronlar soni quyidagicha bo'lishi mumkin: beshinchi qatlamda O - 1 dan 29 gacha, oltinchi qatlamda P - 1 dan 9 gacha va qo'shimcha (oxirgi) Q qatlamida - ortiq emas. 2 elektrondan ortiq.
Har bir atom faqat energiyaning qat'iy belgilangan qiymatiga mos keladigan ma'lum diskret energiya holatlarida mavjud.
Atomning bir energiya holatidan ikkinchisiga o'tishi energiyaning yutilishi yoki emissiyasi bilan birga keladi. Oddiy holatda atom nurlanmaydi.
Agar elektronlardan biri tashqi tomondan biron bir zarracha bilan to'qnashganda, qo'shimcha energiya olsa, u o'zining yangi energiyasi mos keladigan qatlamning uzoqroq orbitasiga o'tadi. Bunday holda, atom qo'zg'aluvchan holatga o'tadi va keyin tashqi qatlam elektronlaridan biri bo'sh joyga sakrab chiqadi. Qisqa vaqtdan so'ng (10-8 sekundgacha) atom o'zining normal holatiga qaytadi, shu bilan birga ko'rinadigan yorug'lik, ultrabinafsha yoki rentgen nurlanishi.
Agar atomning elektroni katta energiya olsa, u atomdan butunlay chiqarib yuboriladi (olib tashlanadi). Bu jarayon ionlanish deb ataladi.
Atom yadrosi musbat zaryadlangan zarrachalar (protonlar) va zaryadsiz neytral zarrachalardan (neytronlar) iborat. Bu ikkala zarracha odatda nuklonlar deb ataladi.
Proton - bu mr = 1,6726 massaga ega bo'lgan moddiy zarracha. 10-24 yosh = 1,007275 amu Musbat zaryad 1e+ ga teng. Neytronning massasi (mn = 1,008665 amu) proton massasidan atigi 0,14% katta bo'lganligi sababli, bu farq odatda hisob-kitoblarda hisobga olinmaydi va neytronning massasi amalda proton massasiga teng deb hisoblanadi. .
Yadroning o'lchamlari juda kichik: 10-12-10-13 sm (yadro atomdan 100 000 marta kichik). Yadroning kichik hajmiga qaramay, atom massasining 99,95% unda to'plangan. Shuni hisobga olgan holda yadro moddasining zichligi juda yuqori va taxminan 1017 kg/m3 ni tashkil qiladi.
Yadroning elementar birliklarda ifodalangan zaryadi son jihatdan D.I davriy sistemasidagi elementning tartib raqamiga teng. Mendeleev. Bu Z elementning tartib raqami orqali berilgan atom yadrosidagi protonlar sonini aniqlash imkonini beradi.
Atom yadrosidagi nuklonlarning umumiy sonini A deb ataladigan massa soni bilan aniqlash mumkin. Massa soni butun birliklarga yaxlitlangan elementning atom og'irligidir. Yadrodagi protonlar soni son jihatdan Z elementning tartib raqamiga teng bo'lgani uchun neytronlar soni farqiga teng bo'ladi. massa raqami A va seriya raqami Z, ya'ni. N \u003d A - Z. Masalan, geliy Z \u003d 2 va A \u003d 4 ga ega, ya'ni geliy atomining yadrosida ikkita proton va ikkita neytron mavjud.
Shunday qilib, D.I elementlarning davriy tizimidagi elementning o'rni. Mendeleev va uning atom og'irligi nafaqat atomning tuzilishini, balki yadrosining tuzilishini ham ochib beradi.
Proton va neytronlar soni berilgan atomlar turi nuklid deyiladi.
Elementlar jadvalidagi atom og'irligining qiymati deyarli har doim kasr son sifatida ifodalanadi. Buning sababi shundaki, deyarli har bir element aslida bir xil elektr zaryadiga ega bo'lgan ushbu elementning bir nechta navlaridan iborat, ammo har xil massa, ya'ni. yadrodagi protonlar soni bir xil, ammo neytronlar soni boshqacha. Kimyoviy elementning atom yadrosida protonlar soni bir xil, ammo neytronlari turlicha bo'lgan navlari izotoplar deyiladi.
Berilgan elementning barcha izotoplari davriy tizim elementlari jadvalining bitta katagiga joylashtirilgan. Elementning atom og'irligining kasr qiymati bu holda ushbu elementning barcha izotoplarining atom og'irligining o'rtacha qiymatini aks ettiradi. Hozirgi vaqtda 1500 dan ortiq izotoplar ma'lum, ulardan 300 dan ortig'i barqaror (yadrolari uzoq vaqt davomida o'zgarmaydi), qolganlari radioaktivdir (yadrolari vaqt o'tishi bilan parchalanadi).
Atom tuzilishining sayyoraviy modeli birinchi marta J. Perren tomonidan taklif qilingan bo'lib, kuzatilgan xususiyatlarni elektronlarning orbital harakati bilan tushuntirishga harakat qilgan. Ammo V. Vin buni chidab bo'lmas deb hisobladi. Birinchidan, klassik elektrodinamikaga ko'ra, aylanish paytida elektron doimiy ravishda energiya chiqarishi va oxir-oqibat yadroga tushishi kerak. Ikkinchidan, energiyaning uzluksiz yo'qolishi tufayli atomning nurlanishi uzluksiz spektrga ega bo'lishi kerak va chiziqli spektr kuzatiladi.
A - zarrachalarning yupqa oltin va boshqa metallar plastinkalaridan oʻtishi boʻyicha tajribalar E.Rezerfordning xodimlari E.Marsden va X.Geyger (1908) tomonidan amalga oshirilgan.
Ular deyarli barcha zarrachalar plastinka orqali erkin o'tishini va ularning atigi 1/10 000 qismi kuchli burilishni boshdan kechirishini aniqladilar - 150 ° gacha. Tomson modeli buni tushuntirib bera olmadi, lekin uning sobiq yordamchisi Ruterford og'ishlar ulushini hisoblab chiqdi va sayyoraviy modelga keldi: musbat zaryad 10-15 ga teng hajmda to'plangan. sezilarli og'irlik bilan.
Atomdagi elektronlarning orbitalarini aniqlanishini hisobga olib, Tomson 1913 yilda atom tuzilishining sayyoraviy modeliga ham keldi.
Ammo Coulomb qonunidan foydalangan holda bunday atomning barqarorligi muammosini hal qilib, u faqat bitta elektron uchun barqaror orbita topdi. Tomson ham, Rezerford ham radioaktiv parchalanish paytida a - zarrachalarning emissiyasini tushuntira olmadilar - elektronlar ham atom markazida bo'lishi kerakligi ma'lum bo'ldi ?!
M.Sklodovska-Kyuri ham bu haqda gapirdi. Ruterford buni qabul qildi, lekin u yadrolarni bir-biriga yopishtirish funktsiyasini elektronlarga berishi kerak edi, shunda Kulon itilishi yadroni parchalamaydi. Ushbu modellar tajribaga mos keladigan miqdoriy natijalarni olishga imkon bermadi. 1913 yilda Ruterford modeli bo'yicha ba'zi eksperimental ma'lumotlarga ahamiyat berildi. radioaktiv hodisalar. Uning yordamchisi G. Moseley chastotani o'lchadi spektral chiziqlar Davriy tizimning bir qator atomlari va “atomga xos bo'lgan ma'lum bir xarakterli qiymat atomdan atomga o'tish paytida muntazam ravishda ortib borishini aniqladi. Bu miqdor ichki yadro zaryadidan boshqa narsa bo'lishi mumkin emas” [Mat. bo'yicha: 5, p. 194].
Sayyoraviy model asosida atom tuzilishi nazariyasini qurish juda ko'p qarama-qarshiliklarga duch keldi.
Dastlab daniyalik fizigi N. Bor materiya bo‘ylab harakatlanayotganda zaryadlangan zarrachalarning sekinlashuvi muammosiga klassik mexanika va elektrodinamikani qo‘llashga harakat qildi, ammo elektron energiyasining berilgan qiymati uchun orbitaning ixtiyoriy parametrlarini belgilash mumkin bo‘ldi. (yoki chastotasi) paradokslarga olib keldi.
Rezerfordning atom tuzilishining sayyoraviy modeli Maksvell elektrodinamikasiga mos kelmasligi aniqlandi.
1913 yil fevral oyida yulduzlar spektrlarini talqin qilish bo'yicha J. Nikolson tomonidan maqolalar paydo bo'ldi. U Plank g'oyasini atomlarga kengaytirib, elektron impulsining proyeksiyalarini kvantlashni taklif qildi. Diskret orbitalarga ega atom shunday paydo bo'ldi, ular bo'ylab elektronlar guruhlari aylanib, aylanish chastotasiga teng chastotali elektromagnit to'lqinlarni chiqaradilar. Bunday model juda hayajonlangan atomlar uchun mos edi va Nikolson yulduzlar va tumanliklar spektrlaridagi ba'zi xususiyatlarni atom modeliga asoslanib tushuntirdi - musbat zaryadlangan yadro atrofida aylanadigan elektron halqa g'oyasi.
Atom, birinchi navbatda, emissiya spektri bilan tavsiflangan. U halqa tekisligiga perpendikulyar bo'lgan elektronlarning maxsus postulatsiyalangan mexanik tebranishlarining chastotalarini spektral chastotalar bilan bog'ladi.






