Relativna atomska masa hemijskih elemenata
Lekcija 4. Hemijski elementi. Znakovi hemijskih elemenata. Relativna atomska masa.
Hemijski element- skup atoma iste vrste.
Zašto su identični atomi nazvani na taj način?Reč „element“ (lat. elementum) koristila se u antici (od Cicerona, Ovidija, Horacija) kao deo nečega (element govora, element obrazovanja, itd.). U davna vremena bila je široko rasprostranjena izreka: “Kao što se riječi sastoje od slova, tako se i tijela sastoje od elemenata.” Otuda vjerovatno porijeklo ove riječi: po nazivu niza suglasničkih slova u latiničnoj abecedi: l, m, n, t ("el" - "em" - "en" - "tum").
HEMIJSKI JEZIK
Čovječanstvo koristi mnogo različitih jezika. Osim prirodnih jezika (japanski, engleski, ruski - više od 2,5 hiljada ukupno), postoje i umjetni jezici, na primjer, esperanto. Među umjetnim jezicima ističu se jezici raznih nauka. Dakle, hemija koristi sopstveni, hemijski jezik. hemijski jezik- sistem simbola i koncepata dizajniranih za koncizno, sažeto i vizuelno snimanje i prenošenje hemijskih informacija. Poruka napisana na većini prirodnih jezika podijeljena je na rečenice, rečenice na riječi, a riječi na slova.
S vama ćemo razgovarati na posebnom, hemijskom jeziku. U njemu, kao i na našem maternjem ruskom, prvo ćemo naučiti slova - hemijske simbole, zatim naučiti kako pisati riječi - formule na temelju njih, a zatim, uz pomoć potonjih - rečenice - jednadžbe kemijskih reakcija:
Bugarski prosvetitelji Ćirilo i Metodije su autori slovenskog pisma-abecede. Ali otac hemijskog pisanja je švedski naučnik J. Ya. Berzelius, koji je predložio kao slova - simbole hemijski elementi koristiti početna slova njihovih latiničnih imena, ili, ako imena nekoliko elemenata počinju ovim slovom, dodati još jedno od sljedećih slova imena na početno slovo.
Hemijski znakovi (hemijski simboli) - slovne oznake hemijskih elemenata. Sastoje se od prvog ili prvog i jednog od sljedećih slova latinskog naziva elementa, na primjer, ugljik - C (Carboeum), kalcij - Ca (Kalcij), kadmijum - Cd ...
Simbol hemijskog elementaje simbol za hemijski element.
Istorijat: Hemičari antički svijet i srednjem vijeku, simbolične slike, slovne skraćenice, kao i kombinacije oba, korištene su za označavanje supstanci, hemijskih operacija i uređaja. Sedam metala antike bilo je prikazano astronomskim znakovima sedam nebeskih tijela: Sunca ( ☉ , zlatni), Mjeseci (☽ , srebro), Jupiter (♃ , kalaj), Venera (♀, bakar), Saturn (♄ , olovo), Merkur (☿ , živa), Mars (♁, gvožđe).
Metali otkriveni u 15.-18. stoljeću - bizmut, cink, kobalt - označavani su prvim slovima njihovih imena. Znak vinskog žestokog pića (lat. spiritus vini) sastoji se od slova S i V. Znakovi jake votke (lat. aqua fortis, dušična kiselina) i zlatne votke (lat. aqua regis, aqua regia, mješavina hlorovodonične i azotne kiseline) sastoje se od znaka vodeÑ i velikih slova F i R, respektivno. Znak stakla (lat. vitrum) formiran je od dva slova V – pravog i obrnutog.
Pokušaji da se modernizuju drevni hemijski znakovi nastavili su se do kraja 18. veka. AT početkom XIX stoljeća, engleski hemičar J. Dalton je predložio da se atomi hemijskih elemenata označavaju krugovima, unutar kojih su bile postavljene tačke, crtice, početna slova engleskih naziva metala itd.
Daltonovi hemijski znakovi dobili su određenu distribuciju u Velikoj Britaniji i zapadnoj Evropi, ali su ubrzo zamijenjeni čisto abecednim znakovima, koje je švedski hemičar J. J. Berzelius predložio 1814. Principi koje je izrazio za sastavljanje hemijskih znakova zadržali su svoju snagu do danas. U Rusiji je prvi štampani izveštaj o hemijskim znacima Berzeliusa sačinio 1824. moskovski lekar I. Ja. Zacepin.
RELATIVNA ATOMSKA MASA
Istorijat: Engleski naučnik Džon Dalton (1766–1844) je u svojim predavanjima pokazao studentima modele atoma izrezbarenih od drveta, pokazujući kako se oni mogu kombinovati i formirati razne supstance. Kada su jednog od učenika upitali šta su atomi, on je odgovorio: "Atomi su drvene kocke obojene u različite boje, koje je izmislio gospodin Dalton."
Naravno, Dalton je postao poznat ne po svojim "kockicama", pa čak ni po tome što je sa dvanaest godina postao školski učitelj. Pojava moderne atomističke teorije povezana je s imenom Daltona. Po prvi put u istoriji nauke, razmišljao je o mogućnosti merenja masa atoma i predložio specifične metode za to. Jasno je da je nemoguće direktno izvagati atome. Dalton je govorio samo o "omjeru težina najmanjih čestica gasovitih i drugih tijela", odnosno o njihovim relativnim masama. Čak i danas, iako se tačno zna masa bilo kojeg atoma, ona se nikada ne izražava u gramima, jer je to krajnje nezgodno. Na primjer, masa atoma uranijuma - najtežeg od elemenata koji postoji na Zemlji - je samo 3,952 10 –22 d. Dakle, masa atoma se izražava u relativnim jedinicama, pokazujući koliko je puta masa atoma datog elementa veća od mase atoma drugog elementa, uzeta kao standard. Zapravo, ovo je „omjer težine“ prema Daltonu, tj. relativno atomska masa. Mase atoma su veoma male.
Apsolutne mase nekih atoma:
m(C) \u003d 1,99268 ∙ 10 -23 g
m(H) \u003d 1,67375 ∙ 10 -24 g
m(O) \u003d 2,656812 ∙ 10 -23 g
Trenutno je u fizici i hemiji usvojen jedinstveni mjerni sistem. Uvedena jedinica atomske mase (a.m.u.)
m (a.m.u.) = 1/12 m (12C) = 1,66057 ∙ 10 -24 g.
Ar(H) = m(atom) / m (a.m.u.) = 1,67375 ∙ 10 -24 g / 1,66057 ∙ 10 -24 g = 1,0079 amu
Ar - pokazuje koliko je puta dati atom teži od 1/12 atoma 12C, ovo je bezdimenzionalna veličina.
Relativna atomska masa
je 1/12 mase atoma ugljika čija je masa 12 a.m.u.
Relativna atomska masa je bezdimenzionalna veličina!!!
Na primjer, relativna atomska masa atoma kiseonika je 15,994. Nije uvijek potrebno uzeti u obzir relativne vrijednosti atomske mase. Možete koristiti vrijednosti koje je D. I. Mendeljejev dao u periodičnom sistemu hemijskih elemenata. Trebalo bi da bude napisano ovako:
Ar(O) = 16 .
Uvijek koristimo zaokruženu vrijednost.
Izuzetak predstavlja relativnu atomsku masu atoma hlora: Ar(Cl) = 35,5.
Odnos između apsolutne i relativne mase atoma predstavljen je formulom:
Rasprostranjenost elemenata u prirodi. Glavna masa kosmičke materije su H i He (99,9%).
Od 107 hemijskih elemenata, samo 89 se nalazi u prirodi; nuklearne reakcije(zanemarljive količine Te, Pm, Np, Fr nastaju prilikom spontane fisije uranijuma i prisutne su u rudama uranijuma). U pristupačnom dijelu Zemlje najčešće je 10 elemenata sa atomskim brojevima od 8 do 26. U zemljinoj kori se nalaze u sljedećim relativnim količinama:
Navedenih 10 elemenata čine 99,92% mase zemljine kore.
Element |
atomski broj |
|
47,00 |
||
29,50 |
||
8,05 |
||
4,65 |
||
U ovom članku ćemo razmotriti različite mogućnosti za izražavanje mase hemijskih elemenata.
Atomi se međusobno razlikuju: po masi, veličini i strukturi.
Mase i veličine atoma.
Današnja nauka ima sposobnost da odredi masu i veličinu atoma. Najmanji atom je He (helijum), čija je veličina približno 0,00000000098m. (98 * 10 -10). A najlakši atom je H (vodonik) atom i njegova masa je 0,00000000000000000000000000016735kg. (1,6735 * 10 −27).
Većina atoma hemijskih elemenata obično je mnogo veća od atoma helija.
A najveći atom je atom Fr (francij) i njegova veličina je približno 0,00000000686m. Što je 7 puta veće od He (helijum) atoma.
Još više atoma različitih hemijskih elemenata se razlikuje po masi, masa atoma se označava slovom m a i izražava se u SI.
I jedinica zapremine mase
Tokom formiranja atomsko - molekularnog učenja u 19. veku. ljudi još nisu znali za tačne veličine i mase atoma, pa su naučnici počeli koristiti njihove relativne vrijednosti. Relativne vrijednosti su izračunate iz omjera mase jednostavne supstance u međusobnim reakcijama. Naučnici hemičari sugerišu da su oni proporcionalni masama atoma. John Dalton je usvojio jedinicu poređenja najlakšeg atoma - H (vodik)
Kao poređenje, koristi se 1/12 mase ugljenika a.e.m (jedinica atomske mase). Međunarodna oznaka - u (jedinica - jedinica).
Jedinica za atomsku masu- ovo je 1/12 mase atoma ugljika i jednako je 1,66 10 −27 kg.
O relativnoj atomskoj masi.
Upoređujući prosječne mase različitih elemenata sa a.e.m (u), mogu se dobiti vrijednosti relativnih atomskih masa kemikalije. elementi. Relativna atomska masa je fizička količina, koji pokazuje koliko je puta masa atoma hemijskog elementa veća od 1/12 atoma ugljika.
Oznaka: A r Formula.
Iz materijala za lekciju naučit ćete da se atomi nekih kemijskih elemenata razlikuju po masi od atoma drugih kemijskih elemenata. Učitelj će vam reći kako su hemičari mjerili masu atoma, koji su toliko mali da ih ne možete vidjeti ni elektronskim mikroskopom.
Tema: Početne hemijske ideje
Lekcija: Relativna atomska masa hemijskih elemenata
Početkom 19. vijeka (150 godina nakon rada Roberta Boylea), engleski naučnik John Dalton predložio je metodu za određivanje mase atoma hemijskih elemenata. Razmotrimo suštinu ove metode.
Dalton je predložio model prema kojem je molekul kompleksna supstanca uključuje samo jedan atom različitih hemijskih elemenata. Na primjer, vjerovao je da se molekul vode sastoji od 1 atoma vodika i 1 atoma kisika. Sastav jednostavnih tvari prema Daltonu također uključuje samo jedan atom kemijskog elementa. One. Molekul kiseonika se mora sastojati od jednog atoma kiseonika.
A onda, znajući masene udjele elemenata u tvari, lako je odrediti koliko se puta masa atoma jednog elementa razlikuje od mase atoma drugog elementa. Tako je Dalton vjerovao da je maseni udio elementa u supstanciji određen masom njegovog atoma.
Poznato je da je maseni udio magnezijuma u magnezijum oksidu 60%, a maseni udio kiseonika 40%. Prateći put Daltonovog rezonovanja, možemo reći da je masa atoma magnezija 1,5 puta veća od mase atoma kiseonika (60/40 = 1,5):
Naučnik je primetio da je masa atoma vodonika najmanja, jer. ne postoji složena tvar u kojoj bi maseni udio vodonika bio veći od masenog udjela drugog elementa. Stoga je predložio da se uporede mase atoma elemenata sa masom atoma vodika. I na taj način izračunao je prve vrijednosti relativnih (u odnosu na atom vodika) atomskih masa kemijskih elemenata.
Atomska masa vodonika uzeta je kao jedinica. I značenje relativna masa ispostavilo se da je sumpor 17. Ali sve dobivene vrijednosti su ili približne ili netačne, jer. tehnika eksperimenta tog vremena bila je daleko od savršene, a Daltonova instalacija o sastavu materije bila je netačna.
Godine 1807 - 1817. Švedski hemičar Jöns Jakob Berzelius napravio je mnogo istraživanja kako bi precizirao relativne atomske mase elemenata. Uspio je postići rezultate bliske modernim.
Mnogo kasnije od Berzeliusovog rada, mase atoma hemijskih elemenata počele su da se porede sa 1/12 mase atoma ugljenika (slika 2).
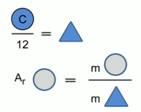
Rice. 1. Model za izračunavanje relativne atomske mase hemijskog elementa
Relativna atomska masa hemijskog elementa pokazuje koliko je puta masa atoma hemijskog elementa veća od 1/12 mase atoma ugljenika.
Relativna atomska masa se označava A r , nema mjernih jedinica, jer pokazuje omjer masa atoma.
Na primjer: A r (S) = 32, tj. atom sumpora je 32 puta teži od 1/12 mase atoma ugljika.
Apsolutna masa 1/12 atoma ugljika je referentna jedinica, čija se vrijednost izračunava s velikom preciznošću i iznosi 1,66 * 10 -24 g ili 1,66 * 10 -27 kg. Ova referentna masa se zove jedinica atomske mase (a.u.m.).
Vrijednosti relativnih atomskih masa kemijskih elemenata ne moraju se pamtiti, one su date u bilo kojem udžbeniku ili priručniku iz hemije, kao i u periodnom sistemu D.I. Mendeljejev.
Prilikom izračunavanja vrijednosti relativnih atomskih masa uobičajeno je zaokruživanje na cijele brojeve.
Izuzetak je relativna atomska masa hlora - za hlor se koristi vrijednost od 35,5.
1. Zbirka zadataka i vježbi iz hemije: 8. razred: do udžbenika P.A. Orzhekovsky i dr. "Hemija, 8. razred" / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel. – M.: AST: Astrel, 2006.
2. Ushakova O.V. Radna sveska iz hemije: 8. razred: do udžbenika P.A. Oržekovski i dr. „Hemija. Razred 8” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; ispod. ed. prof. P.A. Oržekovski - M.: AST: Astrel: Profizdat, 2006. (str. 24-25)
3. Hemija: 8. razred: udžbenik. za generala institucije / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak. M.: AST: Astrel, 2005. (§10)
4. Hemija: inorg. hemija: udžbenik. za 8 ćelija. general institucije / G.E. Rudzitis, FuGyu Feldman. - M.: Obrazovanje, JSC "Moskovski udžbenici", 2009. (§§8,9)
5. Enciklopedija za djecu. Tom 17. Hemija / Pogl. uredio V.A. Volodin, vodeći. naučnim ed. I. Leenson. – M.: Avanta+, 2003.
Dodatni web resursi
1. Jedinstvena zbirka digitalnih obrazovnih resursa ().
2. Elektronska verzija časopisa "Hemija i život" ().
Zadaća
str.24-25 br. 1-7 od Radna sveska iz hemije: 8. razred: do udžbenika P.A. Oržekovski i dr. „Hemija. Razred 8” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; ispod. ed. prof. P.A. Oržekovski - M.: AST: Astrel: Profizdat, 2006.