Kimyoviy elementlarning transformatsiyasi. Ajoyib! Kimyo
Hozirda ma'lum bo'lgan 26 ta transuran elementidan 24 tasi sayyoramizda uchramaydi. Ular inson tomonidan yaratilgan. Og'ir va o'ta og'ir elementlar qanday sintezlanadi?
O'ttiz uchta taxminiy elementlarning birinchi ro'yxati, "Eng oddiy deb hisoblanishi mumkin bo'lgan barcha tabiat shohliklariga tegishli moddalar jadvali. tarkibiy qismlar tel", 1789 yilda Antuan Loran Lavuazye tomonidan nashr etilgan. Kislorod, azot, vodorod, o'n etti metallar va boshqa bir nechta haqiqiy elementlar bilan birgalikda unda yorug'lik, kaloriya va ba'zi oksidlar mavjud. Va 80 yil o'tgach, Mendeleev davriy jadvalni ishlab chiqqanida, kimyogarlar 62 ta elementni bilishgan. 20-asrning boshlariga kelib, tabiatda 92 ta element - vodoroddan urangacha borligiga ishonishgan, ammo ularning ba'zilari hali kashf etilmagan.
Biroq, allaqachon kiritilgan kech XIX Asrlar davomida olimlar davriy jadvalda urandan (transurandan) keyin keladigan elementlar mavjudligini taxmin qilishdi, ammo ularni aniqlab bo'lmadi. Hozir ma'lumki, er qobig'ida 93 va 94-elementlarning iz miqdori - neptuniy va plutoniy mavjud. Ammo tarixan bu elementlar dastlab sun'iy yo'l bilan olingan va shundan keyingina minerallar tarkibida kashf etilgan.
94 ta birinchi elementdan 83 tasi barqaror yoki uzoq umr ko'radigan izotoplarga ega bo'lib, ularning yarim yemirilish davri Quyosh tizimining yoshiga teng (ular sayyoramizga protoplanetar bulutdan kelgan). Qolgan 11 ta tabiiy elementning umri ancha qisqa va shuning uchun ular er qobig'ida faqat radioaktiv parchalanish natijasida paydo bo'ladi. Qisqa vaqt. Ammo 95-dan 118-gacha bo'lgan barcha boshqa elementlar haqida nima deyish mumkin? Bizning sayyoramizda ular yo'q. Ularning barchasi sun'iy ravishda olingan.
Birinchi sun'iy
Sun'iy elementlarning yaratilishi uzoq tarixga ega. Buning asosiy imkoniyati 1932 yilda, Verner Geyzenberg va Dmitriy Ivanenko shunday xulosaga kelganlarida aniq bo'ldi. atom yadrolari proton va neytronlardan tashkil topgan. Ikki yil o'tgach, Enriko Fermi guruhi uranni sekin neytronlar bilan nurlantirish orqali transuran ishlab chiqarishga harakat qildi. Uran yadrosi bir yoki ikkita neytronni ushlaydi, shundan so'ng u 93 yoki 94-chi elementlarning tug'ilishi bilan beta-parchalanadi, deb taxmin qilingan. Ular hatto 1938 yilgi Nobel nutqida Fermi ausoniy va gesperiy deb atagan transuranlarning kashf etilishini e'lon qilishga shoshildilar. Biroq, nemis radiokimyogarlari Otto Xan va Frits Strassmann avstriyalik fizik Liza Meytner bilan birgalikda tez orada Fermi noto'g'ri ekanligini ko'rsatdilar: bu nuklidlar allaqachon izotoplar edi. ma'lum elementlar, uran yadrolarining taxminan bir xil massadagi juft bo'laklarga bo'linishi natijasida. Aynan shu kashfiyot 1938 yil dekabr oyida yadro reaktorini yaratishga imkon berdi va atom bombasi.Birinchi sintezlangan element umuman transuran emas, balki Mendeleyev bashorat qilgan ekamarganez edi. U turli rudalarda qidirildi, ammo muvaffaqiyatga erishmadi. Va 1937 yilda ekamarganes, keyinchalik texnetiy (yunoncha ??? - sun'iy) deb nomlangan, Lorens Berkli milliy laboratoriyasida siklotronda tarqalgan deyteriy yadrolari bilan molibden nishonini o'qqa tutish yo'li bilan olingan.
Yengil raketalar
93 dan 101 gacha bo'lgan elementlar uran yadrolari yoki undan keyingi transuranlarning neytronlar, deytronlar (deyteriy yadrolari) yoki alfa zarralari (geliy yadrolari) bilan o'zaro ta'siri natijasida olingan. Bu erda birinchi muvaffaqiyatga amerikaliklar Edvin Makmillan va Filipp Abelson erishdilar, ular 1940 yilda neptuniy-239 ni sintez qilib, Fermi g'oyasini ishlab chiqdilar: uran-238 tomonidan sekin neytronlarni tutib olish va uran-239 ning keyingi beta-parchalanishi.Keyingi, 94-element, plutoniy birinchi marta 1941 yil boshida Berkli siklotronida uranni deytron bombardimon qilish natijasida olingan neptuniy-238 ning beta-parchalanishini o'rganishda topilgan. Va tez orada ma'lum bo'ldiki, plutoniy-239, sekin neytronlar ta'sirida, uran-235 dan yomonroq bo'linmaydi va atom bombasini to'ldirishi mumkin. Shu sababli, ushbu elementning kelib chiqishi va xususiyatlari haqidagi barcha ma'lumotlar tasniflangan va Makmillan, Glenn Seaborgning maqolasi (o'z kashfiyotlari uchun ular o'rtoqlashgan. Nobel mukofoti 1951) va ularning hamkasblari ikkinchi transuran haqidagi xabar bilan faqat 1946 yilda bosma nashrlarda paydo bo'ldi.
Amerika rasmiylari, shuningdek, 1944 yil oxirida Seaborg guruhi tomonidan yadroviy reaktorda plutoniyning neytron bombardimon qilish mahsulotlaridan ajratilgan 95-element - ameritsiyning kashfiyoti nashr etilishini deyarli olti yilga kechiktirdi. Bir necha oy oldin, xuddi shu jamoaning fiziklari uran-239 ni tezlashtirilgan alfa zarralari bilan bombardimon qilish natijasida sintez qilingan, atom og'irligi 242 bo'lgan 96 elementning birinchi izotopini olishdi. U Per va Mari Kyurining ilmiy xizmatlarini e'tirof etish uchun kurium nomini oldi va shu bilan fizika va kimyo klassiklari sharafiga transuranlarni nomlash an'anasini ochdi.
Kaliforniya universitetidagi 60 dyuymli siklotron yana uchta element, 97-, 98- va 101-chi elementni yaratish joyi bo'ldi. Birinchi ikkitasi tug'ilgan joyi - berkelium va kaliforniya nomi bilan atalgan. Berkeliy 1949 yil dekabr oyida ameritsiyni alfa zarralari bilan bombardimon qilish paytida, ikki oydan so'ng esa xuddi shu kurium bombardimonida kaliforniy sintez qilingan. 99 va 100 elementlari, eynshteyn va fermiy, Eniwetok atolli hududida to'plangan namunalarni radiokimyoviy tahlil qilish paytida topilgan, u erda 1952 yil 1 noyabrda amerikaliklar Mayk o'n megatonlik termoyadro zaryadini portlatgan, qobig'i urandan qilingan. 238. Portlash paytida uran yadrolari o'n beshtagacha neytronni o'zlashtirdi, shundan so'ng ular beta-parchalanish zanjirlarini boshdan kechirdilar, bu esa bu elementlarning shakllanishiga olib keldi. 101-element, mendelevium, 1955 yil boshida olingan. Seaborg, Albert Ghiorso, Bernard Xarvi, Gregori Choppin va Stenli Tomson alfa-tanasi oltin folga elektrolitik tarzda yotqizilgan bir milliardga yaqin (juda kam, ammo ular yo'q edi) eynshteynium atomlarini bombardimon qildi. Nurning juda yuqori zichligiga qaramay (sekundiga 60 trillion alfa zarralari), bor-yo'g'i 17 ta mendeleviy atomi olingan, ammo ayni paytda ularning radiatsiyaviy va radiatsiyaviyligini aniqlash mumkin edi. Kimyoviy xossalari.
og'ir ionlar
Mendelevium neytronlar, deytronlar yoki alfa zarralari yordamida ishlab chiqarilgan oxirgi transuran edi. Quyidagi elementlarni olish uchun 100-sonli fermiyum elementidan nishonlar kerak edi, ular o'sha paytda amalga oshirilmagan (hatto hozir ham yadro reaktorlari fermiy nanogramm miqdorida olinadi).Olimlar boshqacha yo'l tutishdi: yadrolarida ikkitadan ortiq proton (ular og'ir ionlar deb ataladi) bo'lgan nishonlarni bombardimon qilish uchun ionlashtirilgan atomlardan foydalanishdi. Ion nurlarini tezlashtirish uchun maxsus tezlatgichlar kerak edi. Birinchi HILAC mashinasi (Og'ir Ion Linear Accelerator) 1957 yilda Berklida, ikkinchisi U-300 siklotroni laboratoriyada ishga tushirilgan. yadro reaksiyalari 1960 yilda Dubnadagi Birlashgan Yadro tadqiqotlari instituti. Keyinchalik Dubnada yanada kuchli U-400 va U-400M qurilmalari ishga tushirildi. Yana bir tezlatkich UNILAC (Universal Linear Accelerator) 1975 yil oxiridan beri Darmshtadt tumanlaridan biri bo'lgan Vikxauzen shahridagi Germaniyaning Helmgolts nomidagi og'ir ionlarni tadqiq qilish markazida ishlamoqda.
Qo'rg'oshin, vismut, uran yoki transuran nishonlarini kuchli ionli bombardimon qilish natijasida juda qo'zg'aluvchan (issiq) yadrolar ajralib chiqadi yoki neytronlarni chiqarish (bug'lanish) orqali ortiqcha energiyasini chiqaradi. Ba'zan bu yadrolar bir yoki ikkita neytron chiqaradi, shundan so'ng ular boshqa o'zgarishlarga uchraydi, masalan, alfa parchalanishi. Ushbu turdagi sintez sovuq deb ataladi. Darmshtadtda uning yordami bilan 107 (boriy) dan 112 (kopernicium) gacha raqamlarga ega elementlar olindi. Xuddi shu tarzda, 2004 yilda yapon fiziklari 113-elementning bitta atomini yaratdilar (bir yil oldin u Dubnada olingan). Issiq sintez paytida yangi tug'ilgan yadrolar yo'qoladi ko'proq neytronlar- uchdan beshgacha. Shu tariqa Berkli va Dubnada 102 (nobeliy) dan 106 gacha boʻlgan elementlar (seaborgium, Glenn Siborg sharafiga, uning rahbarligida toʻqqizta yangi element yaratilgan) sintez qilingan. Keyinchalik, Dubnada oltita eng katta og'ir vazn toifasi shu tarzda - 113-dan 118-gacha bo'lgan. Xalqaro toza va amaliy kimyo ittifoqi (IUPAC, Xalqaro sof va amaliy kimyo ittifoqi) hozirgacha faqat 114 (flerovium) va 116 (livermorium) elementlarning nomlarini tasdiqlagan.
Faqat uchta atom
ununoctia vaqtinchalik nomi va Uuo belgisi bo'lgan 118-element (IUPAC qoidalariga ko'ra elementlarning vaqtinchalik nomlari ularning atom raqami raqamlari nomlarining lotin va yunon ildizlaridan hosil bo'ladi, un-un-okt (ium). ) - 118) ikkita ilmiy guruhning birgalikdagi sa'y-harakatlari bilan yaratilgan: Yuriy Oganesyan rahbarligidagi Dubninskaya va Seaborg talabasi Kenton Mudi rahbarligidagi Livermor milliy laboratoriyasi. Davriy jadvaldagi ununoktiy radon ostida joylashgan va shuning uchun olijanob gaz bo'lishi mumkin. Biroq, uning kimyoviy xossalari hali aniqlanmagan, chunki fiziklar ushbu elementning faqat uchta atomini yaratgan. massa raqami 294 (118 proton, 176 neytron) va yarimparchalanish davri taxminan bir millisekund: 2002 yilda ikkita va 2005 yilda bitta. Ular kaliforniy-249 nishonini (98 proton, 151 neytron) U-400 tezlatgichida tarqalgan atom massasi 48 (20 proton va 28 neytron) bo'lgan og'ir kaltsiy izotopining ionlari bilan bombardimon qilish orqali olingan. Umumiy soni kaltsiy "o'qlari" 4,1x1019 ni tashkil etdi, shuning uchun Dubna "ununoktiy generatori" ning ishlashi juda past. Biroq, Kenton Mudining fikricha, U-400 dunyodagi 118-elementni sintez qila oladigan yagona mashinadir.“Transuranlarni sintez qilish bo‘yicha o‘tkazilgan har bir tajriba seriyasi o‘ta og‘ir yadrolarning xususiyatlarini modellashtirishda foydalaniladigan yadro moddasining tuzilishi haqida yangi ma’lumotlarni qo‘shadi. Xususan, 118-element sintezi ustidagi ishlar bir qancha oldingi modellardan voz kechishga imkon berdi, deb eslaydi Kenton Mudi. “Biz maqsadni kaliforniydan qildik, chunki og'irroq elementlar kerakli miqdorda mavjud emas edi. Kaltsiy-48 asosiy izotopi kaltsiy-40 bilan solishtirganda sakkizta qo'shimcha neytronni o'z ichiga oladi. Uning yadrosi kaliforniy yadrosi bilan birlashganda 179 neytronli yadrolar hosil bo'lgan. Ular juda hayajonlangan va shuning uchun ayniqsa beqaror holatda edilar, ular tezda neytronlarni tashlab chiqib ketishdi. Natijada, biz 176 neytronli 118-elementning izotopini oldik. Va bular to'liq elektronlar to'plamiga ega haqiqiy neytral atomlar edi! Agar ular bir oz ko'proq yashasalar, ularning kimyoviy xususiyatlarini ham baholash mumkin edi.
Metuselah raqami 117
Unseptium nomi bilan ham tanilgan 117-element keyinroq - 2010 yil mart oyida olingan. Ushbu element xuddi shu U-400 mashinasida ishlab chiqarilgan, u erda avvalgidek, Oak Ridge milliy laboratoriyasida sintez qilingan berkeliy-249 dan nishonga kaltsiy-48 ionlari otilgan. Berkeliy va kaltsiy yadrolarining to'qnashuvi natijasida juda hayajonlangan ununseptium-297 yadrolari (117 proton va 180 neytron) hosil bo'ldi. Tajribachilar oltita yadro olishga muvaffaq bo'lishdi, ulardan beshtasi har birida to'rtta neytron bug'lanib, ununseptiy-293 ga aylandi, qolganlari esa uchta neytronni chiqarib, ununseptiy-294 ni hosil qildi.Ununoktius bilan solishtirganda, ununseptius haqiqiy Metusela bo'lib chiqdi. Engilroq izotopning yarim yemirilish davri 14 millisekund, og‘irroq izotop esa 78 millisekundga teng! 2012 yilda Dubna fiziklari ununseptium-293 ning yana beshta atomini, keyinroq esa ikkala izotopning bir nechta atomlarini olishdi. 2014 yilning bahorida Darmshtadtlik olimlar 117-elementning to'rtta yadrosining birlashishi haqida xabar berishdi, ulardan ikkitasining atom massasi 294. Nemis olimlari tomonidan o'lchangan bu "og'ir" ununseptiumning yarimparchalanish davri taxminan 51 millisekundni tashkil etdi. (bu Dubnalik olimlarning taxminlari bilan yaxshi mos keladi).
Hozir Darmshtadtda ular 119 va 120 elementlarni sintez qilish imkonini beruvchi o‘ta o‘tkazuvchan magnitlarda og‘ir ionlarning yangi chiziqli tezlatgichi loyihasini tayyorlamoqda. Xuddi shunday rejalar Dubna shahrida ham amalga oshirilmoqda, u yerda yangi DS-280 siklotroni qurilmoqda. Bir necha yil ichida yangi o'ta og'ir transuranlarni sintez qilish mumkin bo'lishi mumkin. Va 184 neytronli 120 yoki hatto 126-elementning yaratilishi va barqarorlik orolining ochilishi haqiqatga aylanadi.
Barqarorlik orolida uzoq umr
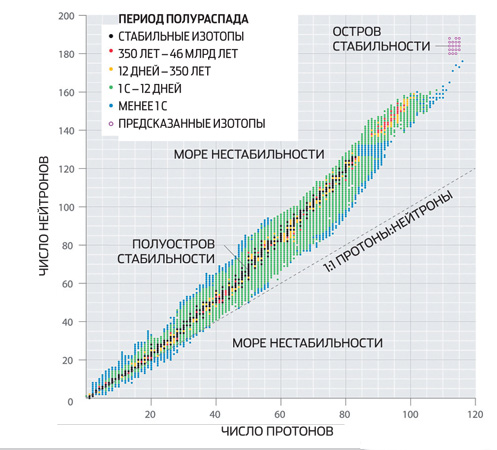 Yadrolar ichida proton va neytron qobiqlari mavjud bo'lib, ular atomlarning elektron qobig'iga o'xshaydi. To'liq to'ldirilgan qobiqli yadrolar, ayniqsa, spontan transformatsiyalarga chidamli. Bunday qobiqlarga mos keladigan neytron va protonlar soni sehrli sonlar deb ataladi. Ulardan ba'zilari eksperimental tarzda aniqlanadi - bular 2, 8, 20 va 28.
Yadrolar ichida proton va neytron qobiqlari mavjud bo'lib, ular atomlarning elektron qobig'iga o'xshaydi. To'liq to'ldirilgan qobiqli yadrolar, ayniqsa, spontan transformatsiyalarga chidamli. Bunday qobiqlarga mos keladigan neytron va protonlar soni sehrli sonlar deb ataladi. Ulardan ba'zilari eksperimental tarzda aniqlanadi - bular 2, 8, 20 va 28.
Shell modellari o'ta og'ir yadrolarning "sehrli raqamlarini" nazariy jihatdan hisoblash imkonini beradi, garchi to'liq kafolatsiz. Neytron raqami 184 sehrli bo'lib chiqishini kutish uchun sabablar bor. 114, 120 va 126 proton raqamlari unga mos kelishi mumkin va ikkinchisi, yana sehrli bo'lishi kerak. Agar shunday bo'lsa, har birida 184 ta neytron bo'lgan 114, 120 va 126 elementlarning izotoplari davriy jadvaldagi qo'shnilariga qaraganda ancha uzoqroq yashaydi - daqiqalar, soatlar va hatto yillar (bu maydon u200bjadval odatda barqarorlik oroli deb ataladi). Olimlar eng katta umidlarini ikki baravar sehrli yadroga ega so'nggi izotopga bog'laydilar.
Dubna usuli
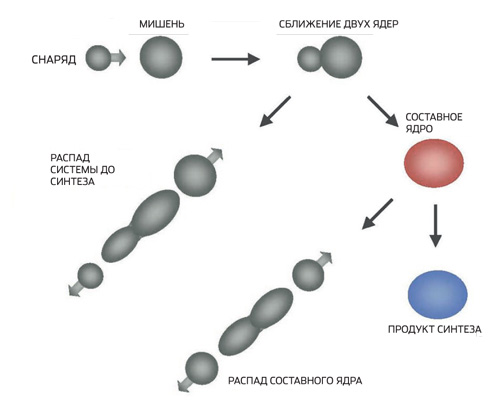
"113 dan 118 gacha elementlar Yuriy Oganesyan rahbarligida Dubnada ishlab chiqilgan ajoyib usul asosida yaratilgan", deb tushuntiradi Darmshtadt jamoasi a'zosi Aleksandr Yakushev. - Darmshtadtdagi nishonlarni o'qqa tutish uchun ishlatilgan nikel va sink o'rniga Oganesyan atom massasi ancha past bo'lgan izotop - kaltsiy-48 ni oldi. Gap shundaki, engil yadrolardan foydalanish ularning maqsadli yadrolar bilan birlashishi ehtimolini oshiradi. Kaltsiy-48 yadrosi ham ikki baravar sehrli, chunki u 20 proton va 28 neytrondan iborat. Shu sababli, Oganesyanning tanlovi nishonni o'qqa tutish paytida paydo bo'ladigan murakkab yadrolarning omon qolishiga katta hissa qo'shdi. Axir, yadro tug'ilgandan keyin darhol bo'laklarga bo'linmasa, bir nechta neytronlarni tashlab, yangi transuranni keltirib chiqarishi mumkin. O'ta og'ir elementlarni shu tarzda sintez qilish uchun Dubninsk fiziklari AQShda ishlab chiqarilgan transuranlardan nishonlar yasadilar - avval plutoniy, keyin ameritiy, kuriy, Kaliforniya va nihoyat berkeliy. Tabiatda kaltsiy-48 atigi 0,7% ni tashkil qiladi. U elektromagnit separatorlarda olinadi, bu qimmat protsedura. Ushbu izotopning bir milligrami taxminan 200 dollar turadi. Bu miqdor nishonni o'qqa tutish uchun bir yoki ikki soat kifoya qiladi va tajribalar bir necha oy davom etadi. Maqsadlarning o'zi ham qimmatroq, million dollarga etadi. Elektr to'lovlarini to'lash ham juda qimmatga tushadi - og'ir ion tezlatgichlar megavatt quvvat sarflaydi. Umuman olganda, o'ta og'ir elementlarning sintezi arzon zavq emas ".
I. Vodorodning davriy sistemadagi holati
Vodorod - eng keng tarqalgan kimyoviy element, bundan tashqari u eng engildir. Uning seriya raqami 1. Davriy jadvalda u birinchi davrda joylashgan. Uning xususiyatlarini hisobga olgan holda, u 1A va 7A guruhlariga joylashtiriladi. Savol tug'iladi - nima uchun?
Vodorod yadrosi bitta protondan iborat bo'lib, uning atrofida bitta elektron aylanadi. Elektron formula 1s 1. Vodorod molekulasi qutbsiz kovalent aloqa bilan bog'langan ikkita atomdan iborat. H 2 eng engil gazdir. Rangsiz va hidsizdir.
Vodorod kimyoviy faol moddadir. U rolini bajarishi mumkin qaytaruvchi va oksidlovchi.
1) ba'zi metallar bilan gidridlar hosil qiladi
2Na+H 2 =2NaH, bu yerda vodorod - oksidlovchi
H
0
+ 1
e
-
→
H
-1
Shunga o'xshash jarayon galogenlarning o'zaro ta'sirida sodir bo'ladi - 7A guruhidagi metall bo'lmaganlar
2Na + Cl 2 \u003d 2NaCl
Shuning uchun vodorod 7A guruhiga joylashtiriladi
2) vodorodga qaraganda kuchli oksidlovchi xossaga ega metall bo'lmaganlar bilan
Bu erda H 2 + Cl 2 = 2HCl vodorodni kamaytiruvchi vosita H 0 - 1 e - → H +1
Shunga o'xshash jarayon o'zaro ta'sirlashganda sodir bo'ladi ishqoriy metallar-1A guruh metallari
2K + Cl 2 \u003d 2KCl
Shuning uchun vodorod 1A guruhiga joylashtiriladi
II. Davriy tizimdagi o'rni kimyoviy elementlar D. I. Mendeleyev lantanidlari va aktinidlari
O'quv filmi: "Lantanidlar va aktinidlarning xususiyatlari"
DA lantandan keyingi oltinchi davr deb nomlangan 58-71 seriya raqamlari bo'lgan 14 ta element mavjud lantanidlar ("Lantanidlar" so'zi "lantan kabi", "aktinidlar" "aktiniy kabi" degan ma'noni anglatadi). Ba'zan ular lantanidlar va aktinidlar deb ataladi, bu lantanning yonida degan ma'noni anglatadi; quyidagi aktiniy) . Lantanidlar jadvalning pastki qismida alohida joylashtiriladi va hujayradagi yulduzcha ularning tizimdagi joylashuvi ketma-ketligini ko'rsatadi: La-Lu. Lantanidlarning kimyoviy xossalari juda o'xshash. Masalan, ularning barchasi gidroksid va vodorod hosil qilish uchun suv bilan reaksiyaga kirishadigan reaktiv metallardir. Lantanda (Z = 57) bitta elektron 5d pastki sathiga kiradi, shundan so'ng bu pastki sathning to'ldirilishi to'xtaydi va 4f darajasi to'la boshlaydi, ularning etti orbitalini 14 ta elektron egallashi mumkin. Bu Z = 58 - 71 bo'lgan barcha lantanidlarning atomlari uchun sodir bo'ladi. Chunki bu elementlar chuqur 4f pastki darajasini to'ldiradi. uchinchi tashqi daraja, ular juda o'xshash kimyoviy xususiyatlarga ega.
Bundan kelib chiqadiki, lantanidlar kuchli talaffuzga ega gorizontal analogiya.
DA ettinchi davr 14 element 90-103 seriya raqamlari bilan oilani tashkil qiladi aktinidlar. Ular, shuningdek, alohida-alohida - lantanidlar ostida joylashtiriladi va tegishli katakchada ikkita yulduzcha ularning tizimdagi joylashuvi ketma-ketligini ko'rsatadi: Ac-Lr. Aktiniy va aktinidlarda sathlarni elektronlar bilan to'ldirish lantan va lantanidlarga o'xshaydi. Biroq, lantanidlardan farqli o'laroq, aktinidlar uchun gorizontal analogiya zaif ifodalangan. Ular o'z birikmalarida ko'proq turli oksidlanish darajalarini namoyish etadilar. Masalan, aktiniyning oksidlanish darajasi +3, uran esa +3, +4, +5 va +6 ga teng. Aktinidlarning kimyoviy xossalarini o'rganish ularning yadrolarining beqarorligi tufayli juda qiyin.
Barcha aktinidlar radioaktivdir. Aktinidlarning bir-biriga o'xshash ikkita guruhi mavjud: "transuran elementlari"- uran uchun davriy jadvaldagi barcha quyidagi elementlar va "transplutonium elementlari"- plutoniydan keyingi barcha. Ikkala guruh ham ko'rsatilgan ramka bilan cheklanmaydi va "trans-" prefiksi ko'rsatilganda, ular qonunrensiydan keyingi elementlarni - ruterfordiyni va boshqalarni o'z ichiga olishi mumkin. Bu bunday elementlarning juda oz miqdorda sintezlanishi bilan bog'liq. Tabiatda sezilarli miqdorda bo'lgan lantanidlar bilan solishtirganda (prometiydan tashqari) aktinidlarni sintez qilish qiyinroq. Ammo istisnolar mavjud, masalan, uran va toriy eng oson sintezlanadi yoki tabiatda topiladi, undan keyin plutoniy, ameritiy, aktiniy, protaktiniy va neptunyum mavjud.
III. D.I.Mendeleyevning kimyoviy elementlar davriy sistemasidagi oʻrni. Sunʼiy ravishda olingan elementlar.
2008 yilga kelib, 117 ta kimyoviy element ma'lum (1 dan 116 gacha va 118 seriya raqamlari bilan), ulardan 94 tasi tabiatda topilgan (ba'zilari faqat iz miqdorida), qolgan 23 tasi yadroviy reaktsiyalar natijasida sun'iy ravishda olingan (qarang. Qo'shimchalar). Birinchi 112 element doimiy nomlarga ega, qolganlari vaqtinchalik.
1-sahifa
Urandan keyin sun'iy ravishda olingan elementlar transuran deb ataladi.
Sun'iy ravishda olingan elementlar yuqori chiziq bilan belgilanadi; ular uchun nisbiy qadriyatlar atom massalari(aniqlik spetsifikatsiyasisiz) yoki eng uzoq umr ko'radigan izotoplarning massa raqamlari. Element belgisining chap tomonidagi pastki indeks davriy tizimda uning seriya raqamini ko'rsatadi. Umumiy bo'lmagan element belgilari qavs ichiga olingan. 106 va 107 seriya raqamlari bo'lgan, hali belgilarga ega bo'lmagan elementlar jadval oxirida joylashtirilgan.
Sun'iy ravishda olingan elementlar: Astatin - № 85, texnetiy - № 43, fransiy - № 87 (qarang.
Bu sun'iy yo'l bilan olingan elementlarning barchasi hali tabiatda topilmagan, ammo katta ilmiy qiziqish uyg'otadi. Ulardan ba'zilari allaqachon texnologiyada qo'llanilgan.
| Energiya darajalari 5 / va. |
Sizga ma'lum bo'lgan sun'iy yo'l bilan olingan elementlarni nomlang, ularning D. I. Mendeleyev kimyoviy elementlar davriy jadvali jadvalidagi o'rnini ko'rsating va bu elementlar atomlaridagi orbitallardagi elektronlarning joylashishini aks ettiruvchi diagrammalarni tuzing.
Yangi sun'iy ravishda olingan ularga mos keladigan elementlar olindi umumiy ism transuranik elementlar.
Jadvalda. 1-rasmda elementlarning nomlari (rus va lotincha), kimyoviy belgilari, D. I. Mendeleyev davriy elementlar tizimidagi ularning tartib nomerlari, nisbiy atom massasi va kashf qilingan yili ko‘rsatilgan. Atom massalari 1981 yildagi Xalqaro jadval bo'yicha berilgan. Sun'iy ravishda olingan elementlar yulduzcha bilan belgilangan; qadimiy Berilgan radioaktiv element uchun yarim yemirilish davri eng uzun bo'lgan izotoplarning massa raqamlari kvadrat qavs ichida berilgan. Qavslar ichida keltirilgan elementlarning nomlari va kimyoviy belgilari umuman qabul qilinmaydi.
Jadvalda. 1-rasmda elementlarning nomlari (ruscha va lotincha), D. I. Mendeleyev davriy elementlar tizimidagi ularning seriya raqamlari, nisbiy atom massasi va kashf qilingan yil ko'rsatilgan. Atom massalari (to'rtta muhim raqam bilan) 1977 yildagi Xalqaro jadvalga muvofiq berilgan. Yulduzcha sun'iy ravishda olingan qadimgi elementlarni bildiradi.
sun'iy elementlar
Uran termal neytronlar bilan bombardimon qilinganda undan seriya raqamlari 35-65 bo'lgan engilroq elementlar hosil bo'ladi: bu bizni parchalar orasida 43 va 61 elementlarning izotoplari ham topilishiga umid qildi.Agar olish masalasi holatini eslasak. 1930 yilda 43, 61, shuningdek 85 va 87 elementlarda sezilarli taraqqiyotga erishish mumkin edi. Avvalambor, 43 va 61-elementlarning “no‘lib qolgan” beqaror moddalar ekanligi haqidagi gumon tasdiqlandi. 85 va 87 elementlarga kelsak, ular uzoq vaqt davomida parchalangan radioaktiv moddalar sifatida tan olingan.
1934 yilda fizik Jozef Mattauch izotop yadrolarining barqarorligini baholashga imkon beruvchi asosiy qoidani topdi. Mattouch qoidasiga ko'ra, agar uning yadrosining zaryadi bir xil massa soniga ega bo'lgan ma'lum barqaror izotop yadrosining zaryadidan faqat bitta bilan farq qilsa, ikkinchi barqaror izotop mavjud bo'lmaydi. Ushbu naqsh Harkins qoidasini to'ldiradi, unga ko'ra toq atom raqamiga ega bo'lgan elementlar (ya'ni, proton va elektronlarning toq soni) Yerda kamroq tarqalgan, chunki ularning yadrolarining barqarorligi past.
43 va 61 elementlarga kelsak, Mattauch qoidasini quyidagicha ifodalash mumkin. Davriy tizimdagi oʻrnidan kelib chiqqan holda, 43-elementning massa soni taxminan 98, 61-element uchun esa 147-ga yaqin boʻlishi kerak. Biroq barqaror izotoplar 42 va 44-elementlar, shuningdek massali 60 va 62-elementlar uchun allaqachon maʼlum boʻlgan. 94 dan 102 gacha va mos ravishda 142 dan 150 gacha. Massa soni bir xil bo'lgan ikkinchi barqaror izotop mavjud bo'lmagani uchun 43 va 61 elementlarda faqat beqaror vakillar bo'lishi kerak. Hech shubha yo'qki, bir vaqtlar 43 va 61 elementlar Yerda etarli miqdorda bo'lgan.
Qachon bizning quyosh tizimi, keyin barcha elementlar proton va neytronlarni birlashtirib hosil bo'ldi. Biroq, Yerning mavjudligi davomida - 4,6 milliard yil - ularning beqaror vakillari asta-sekin butunlay yo'q bo'lib ketdi. Faqatgina istisnolar - bular radioaktiv elementlar, ular tabiiy radioaktiv qatorlar doirasida doimiy ravishda to'ldirilishi mumkin edi, chunki ularning boshlang'ich moddalari Uran yoki toriy- milliardlab yillarni tashkil etadigan yarim umri tufayli Yerda hali ham mavjud. 43 va 61-elementlar ushbu tabiiy radioaktiv qatorlarga tegishli emas. Agar bu elementlarning uzoq umr ko'radigan izotopi mavjud bo'lsa, uning radiokimyoviy izlarini topishga umid qilish mumkin.
Ba'zi olimlar hali ham edi soxta transuranlar, boshqa tadqiqotchilar orzu qilingan 43 va 87 elementlarni topishga muvaffaq bo'lishdi. Mana, ularning kashfiyot tarixi...
1936 yilda Emilio Segre turmush qurgach, u Fermi va uning hamkasblarini tashlab, Sitsiliyaning sobiq poytaxti Palermoga jo'nadi. U yerdagi universitetda unga fizika kafedrasi taklif qilindi. Palermoda, katta afsusda, Segre Fermi bilan boshlangan tadqiqotni davom ettira olmadi. Universitetda radioaktiv tadqiqotlar uchun asbob-uskunalar yo'q edi. Tez qaror qabul qilib, italiyalik olim eng yaxshi jihozlari bilan mashhur bo'lgan Berklidagi Kaliforniya universiteti bilan tanishish uchun Amerikaga yo'l oldi. O'sha paytda dunyoda yagona bor edi siklotron. "Men ko'rgan radioaktivlik manbalari ilgari faqat Ra-Be manbalari bilan ishlagan odam uchun chindan ham hayratlanarli edi.", deb esladi fizik.
Segre ayniqsa qiziqdi siklotronning burilish plitasi. U tezlashtirilgan zarralar oqimini kerakli yo'nalishga yo'naltirishi kerak edi. Yuqori energiyali zarralar bilan to'qnashuvlar tufayli - tezlashtirilgan deytronlar Bu plastinka juda qizib ketdi. Shuning uchun u o'tga chidamli metalldan yasalgan bo'lishi kerak edi - molibden. Italiyalik mehmon e'tiborini deytronlar tomonidan bombardimon qilingan ana shu metall molibdenga qaratdi. Segre molibden 42-elementdan deytronlar bilan bombardimon qilish natijasida hali noma'lum 43-elementning izotoplari hosil bo'lishi mumkinligini taxmin qildi.Ehtimol, tenglamaga ko'ra:
96 Mo + D = 97 X + n
Tabiiy molibden oltita barqaror izotoplarning aralashmasidir. Segre, ehtimol molibden nazariy jihatdan aylanishi mumkin bo'lgan 43-elementning oltita mumkin bo'lgan radioaktiv izotoplaridan biri - kamida bittasi - Sitsiliyaga dengiz sayohatiga bardosh bera oladigan darajada uzoq umr ko'rishini taklif qildi. Chunki italiyalik fizik 43-elementni faqat o'z vatanidagi institutda qidirishni maqsad qilgan.
Tadqiqotchi cho'ntagida Berkli siklotronidan olingan bir parcha molibden plastinkasini olib, qaytish safariga yo'l oldi. 1937 yil yanvar oyining oxirida u mineralog va analitik kimyogar Perrier ko'magida tadqiqot ishlarini boshladi. Ular haqiqatan ham kimyoviy xossalariga ko'ra marganets va reniy o'rtasida joylashishi mumkin bo'lgan radioaktiv atomlarni topdilar. Insonning tadqiqot dahosi tufayli yana sun'iy ravishda er yuzida qayta tug'ilgan ekamarganes miqdori tasavvur qilib bo'lmaydigan darajada kichik edi: 43-elementning 10 -10 dan 10 -12 g gacha!
1937 yil iyul oyida Segre va Perrier Yerda uzoq vaqt yo'q bo'lib ketgan birinchi sun'iy elementning sintezi haqida xabar berganlarida, bu tarixga kirgan kun edi. 43-element uchun keyinchalik juda aniq nom topildi: texnetiy, yunon tilidan olingan texnetos- sun'iy. Uni ko'p miqdorda olish va uni qo'lingizda ushlab turish mumkin bo'ladimi? Tez orada bu savolga ijobiy javob berish mumkin bo'ldi, uranning bo'linishi natijasida nisbatan yuqori rentabellikga ega 43 ta izotop paydo bo'lishi aniqlandi. Massa soni 101 va yarim yemirilish davri 14 minut bo‘lgan izotop alohida e’tiborni tortdi. Yarim yemirilish davri 13 minut bo‘lgan Fermi moddasi, xayoliy element 93 43-elementning izotopi bo‘lishi kerak edi, deb faraz qilingan edi.
Tabiiy radioaktiv qatorlar yakuniy shaklga ega- hech kim bunga shubha qilishga jur'at eta olmadi, ayniqsa Dempster tomonidan uran-235 ning massa spektrografik identifikatsiyasidan keyin. Biroq, uran-aktiniy seriyasida zaif nuqta bor edi. Ushbu seriyadagi "noaniqlik" qayd etilganidan beri yigirma yildan ko'proq vaqt o'tdi, bu deyarli unutilib ketdi.
1913/1914 yillarda bu nomuvofiqlikka ingliz kimyogari Krenston va avstriyalik radioaktivlik tadqiqotchilari Mayer, Xess va Panet aktiniyni o'rganayotganda qoqilib ketishgan. Beta-emitter sifatida aktiniy ga aylanishi ma’lum radioaktiniy, ya'ni izotopga toriy. Olimlar transformatsiya jarayonini o'rganganlarida, ular doimo zaif alfa nurlanishini kuzatdilar. Ushbu qoldiq faollik (taxminan 1%) Otto Xan tomonidan sof aktiniyni olish bo'yicha tajribalarda ham topilgan. " Men bu kichik miqdorga ahamiyat berishga o'zimni topa olmadim.", Xon keyinroq xabar berdi. Uning fikricha, bu nopoklikdir.
Ko'p yillar o'tib. Frantsuz olimi Marguerite Perey, Parijdagi mashhur Radium instituti xodimi yana bu izni kuzatib, kasrlarni juda ehtiyotkorlik bilan tozaladi. anemon va 1939 yil sentyabr oyida u yangi radioaktiv izotopning muvaffaqiyatli izolyatsiyasi haqida xabar berishga muvaffaq bo'ldi. Bu uzoq vaqt davomida etishmayotgan element 87 bo'lib, 1% aktiniy faolligini ta'minlaydigan alfa-parchalovchi qo'shimcha mahsulot edi. Madam Perey allaqachon to'ldirilgan qatorda vilka topdi, chunki 87-elementning izotopi ma'lum radio aktiniy kabi aktiniy X ga aylanadi. Pereyning taklifi bilan 87-element nomi berildi Fransiya vatani sharafiga.
To'g'ri, kimyogarlar shu kungacha 87-elementni o'rganishda katta muvaffaqiyatlarga erisha olishmadi. Axir, barcha fransiy izotoplari qisqa umr ko'radi va millisekundlar, soniyalar yoki daqiqalar ichida parchalanadi. Shu sababli, element ko'plab kimyoviy tadqiqotlar va amaliy foydalanish uchun hozirgacha "qiziqsiz" bo'lib qoldi. Agar kerak bo'lsa, u sun'iy ravishda olinadi. Albatta, fransiyni tabiiy manbalardan ham "olish" mumkin, ammo bu shubhali korxona: 1 g tabiiy uranda atigi 10 -18 g fransiy bor!
Davriy tizim kashf etilganda, 23 ta element yo'q edi, endi faqat ikkitasi: 61 va 85. Elementlarni qidirish qanday davom etdi? 1938 yilning yozida Emilio Segre yana Berkliga jo'nadi. U 43-elementning qisqa umr ko'radigan izotoplarini o'rganish niyatida edi. Albatta, bunday tadqiqotlar joyida amalga oshirilishi kerak edi. Qisqa yarimparchalanish davriga ega bo'lgan izotoplar Italiyaga sayohatda "omon qololmaydi". Segre Berkliga kelishi bilanoq fashistik Italiyaga qaytish irqiy terror tufayli imkonsiz bo'lib qolganini bildi. Segre Berklida qoldi va u yerda ishini davom ettirdi.
Berklida kuchliroq siklotron bilan alfa zarralari yuqori energiyaga tezlashishi mumkin edi. Coulomb o'zaro ta'sir chegarasini engib o'tgandan so'ng, bu alfa zarralari hatto og'ir atomlarning yadrolariga ham kira oldi. Endi Segre burilish imkoniyatini ko'rdi vismut, element 83, noma'lum elementga 85. Amerikaliklar Korson va Makkenzi bilan birgalikda u quyidagi jarayonni amalga oshirish uchun vismut yadrolarini 29 MeV alfa zarralari bilan bombardimon qildi:
209 Bi + 4 He = 211 X + 2 n
Reaktsiya sodir bo'ldi. Tadqiqotchilar o'zlarining birinchi qo'shma ishlarini 1940 yil 1 martda tugatgandan so'ng, ular faqat ehtiyotkorlik bilan fikr bildirishdi. 85-elementning radioaktiv izotopini ishlab chiqarish mumkinligi haqida"Ko'p o'tmay, ular allaqachon ishonch hosil qilishdi: 85-element tabiatda topilgunga qadar sun'iy ravishda olingan. Ikkinchisini faqat bir necha yil o'tgach, ingliz ayol Ley-Smit va Berndagi institutdan Shveytsariya Minder qilish baxtiga muyassar bo'ldi. Ular 85-element toriyning radioaktiv qatorida yon jarayon natijasida hosil boʻlishini koʻrsatishga muvaffaq boʻldi. ochiq element og'zaki bema'nilik sifatida tanqid qilingan Anglo-Helvetium nomini tanladilar. Avstriyalik tadqiqotchi Karlik va uning hamkori Bernert tez orada 85-elementni tabiiy radioaktivlikning boshqa qatorlarida, shuningdek, yon mahsulot sifatida topdilar. Biroq, faqat izlarda topilgan ushbu elementga nom berish huquqi Segre va uning hamkorlarida qoldi: endi u astatin deb ataladi, bu yunoncha o'zgarmas degan ma'noni anglatadi. Axir bu elementning eng barqaror izotopi yarim yemirilish davri atigi 8,3 soatni tashkil qiladi.
Bu vaqtga kelib professor Segre 61-elementni ham sintez qilishga urinib ko'rdi.Ayni paytda bu elementning davriy tizimdagi ikkala qo'shnisi neodimiy va samariy ham zaif radioaktiv ekanligi ayon bo'ldi. Avvaliga bu hayratlanarli tuyuldi, chunki o'sha paytda radioaktivlik eng og'ir elementlarga xosdir, deb ishonilgan. 60-element bo'lgan neodimiy beta nurlarini chiqaradi va shuning uchun 61-elementga aylanishi kerak edi. Bu noma'lum kimyoviy elementni hozirgacha ajratib bo'lmasligi, ehtimol, uning tez radioaktiv parchalanishi bilan bog'liqdir. Nima qilsa bo'ladi? Bu erda yana chiqish yo'li kerakli elementni sun'iy ravishda olish edi. 61-element tabiatda topilmagani uchun fiziklar uni sintez qilishga harakat qilishdi.
1941/42 yillarda Lou, Poul, Quill va Kurbatov olimlari Davlat universiteti Ogayo shtatida noyob tuproq bombardimon qilindi neodimiy deytronlar siklotronda tezlashgan. Ular kashf qilishdi radioaktiv izotoplar sikloniy deb atalgan yangi element. Biroq, bu filmda faqat iz qoldi.
Emilio Segre qanday muvaffaqiyatlarga erishdi? U alfa nurlari bilan nurlantirdi praseodimiy- element 59. Biroq, u tomonidan so'zsiz sintez qilingan 61 element izotoplarini qayta ishlash juda murakkab bo'lib chiqdi. Ularni boshqa noyob yer elementlaridan ajratib olish muvaffaqiyatsiz tugadi.
Finlyandiyadan bir noaniq tadqiqot xabar qilindi. 1935 yilda kimyogar Eremetse oksidlar aralashmasi kontsentratlarini tahlil qilishni boshladi. samariy va neodimiy ulardagi 61-elementning tabiiy tarkibi bo'yicha. Buning uchun bir necha tonna apatit qayta ishlandi.
61-element uchun kurashning birinchi bosqichida durang qayd etildi. Taklif etilgan unvonni ham qabul qila olmadim” sikloniya".
KIMYO KURSI BO'YICHA BILIMLARNI TIZIMLASHTIRISH, UMUMIYLASHTIRISH VA CHUQORLASH.
II bob. Davriy qonun va davriy tizim D.I. Mendeleyev ta’limotiga asoslanadi
atomning tuzilishi haqida
§§1-3 uchun topshiriqlar (70-bet)
Savol 1
D.I tomonidan berilgan davriy qonun formulasini solishtiring. Mendeleev, zamonaviy formulasi bilan. Nima uchun so'z birikmasini o'zgartirish zarurligini tushuntiring.
D.I tomonidan berilgan davriy qonunning formulasi. Mendeleev, kimyoviy elementlarning xossalari ushbu elementlarning atom massalariga davriy bog'liqligini aytdi. Zamonaviy formulada aytilishicha, kimyoviy elementlarning xususiyatlari davriy ravishda ushbu elementlar yadrosining zaryadiga bog'liq. Mendeleev davriy qonunni o'rnatgan paytda, atomning tuzilishi hali ma'lum emas edi, chunki bunday tushuntirish talab qilindi. Atom tuzilishini yoritib, elektronlarning elektron sathlar boʻyicha taqsimlanishi qonuniyatlarini oʻrnatgandan soʻng, elementlar xossalarining davriy takrorlanishi elektron qobiqlar tuzilishining takrorlanishi bilan bogʻliqligi maʼlum boʻldi.
Savol №2
Nima uchun davrlardagi elementlar soni 2 - 8 - 18 - 32 raqamlar qatoriga mos keladi? Elektronlarning bo'ylab joylashishini hisobga olgan holda ushbu naqshni tushuntiring energiya darajalari.
Atomdagi elektronlar s-, p-, d- va f-orbitallarni egallashi mumkin. Bitta elektron sathda bitta s-orbital, uchta p-orbital, beshta d-orbital, etti f-orbital bo'lishi mumkin. bitta orbitalda
ikkitadan ortiq elektron bo'lishi mumkin emas. Shunday qilib, agar faqat s-orbitallar to'ldirilgan bo'lsa, elektron sathida 2 ta elektron mavjud. Agar s- va p-orbitallar to'ldirilgan bo'lsa, bitta elektron sathda 2 + 6 = 8 elektron mavjud. Agar s-, p- va d-orbitallar to'ldirilgan bo'lsa, elektron sathida 2 + 6 + 10 = 18 elektron mavjud. Nihoyat, agar s-, p-, d- va f-orbitallar to'ldirilgan bo'lsa, elektron sathida 2 + 6 + 10 + 14 = 32 elektron mavjud. Shunday qilib, davrlardagi elementlarning soni elektron darajadagi elektronlarning maksimal mumkin bo'lgan soniga to'g'ri keladi.
Savol №3
Atomlarning tuzilishi nazariyasiga asoslanib, nima uchun elementlar guruhlari asosiy va ikkilamchi bo'linishini tushuntiring.
Elementlarning davriy tizimining asosiy kichik guruhlari elementlarida tashqi elektron sathining orbitallari elektronlar bilan to'ldiriladi. Yon kichik guruhlarning elementlarida oxirgi elektron sathining orbitallari elektronlar bilan to'ldirilgan.
Savol №4
s-, p-, d- va f-momentlar qanday mezonlarga ko'ra farqlanadi?
s-elementlar atomlarida s-orbitallar, p-elementlar atomlarida p-orbitallar, d-elementlar atomlarida p-orbitallar toʻldiriladi.
– d-orbitallar va f-elementlar atomlarida – f-orbitallar.
Savol №5
Kimyoviy elementlarning davriy sistemasi jadvalidan foydalanib D.I. Mendeleyev, elektronlarning orbitallarda joylashishi va vanadiy V, nikel Ni va mishyak As elementlar atomlaridagi energiya darajalarining diagrammasini tuzing. Ulardan qaysi biri p-elementlar va qaysilari d-elementlar va nima uchun?
Vanadiy atomi:
1s2 2s2 2p6 3s2 3p6 3d3 4s2
Nikel atomi: 1s2 2s2 2p6 3s2 3p6 3d8 4s2
Arsen atomi: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3
Vanadiy va nikel atomlarida 3d pastki daraja to'ldiriladi, shuning uchun ular d elementlar deb ataladi. Mishyak atomida 4p pastki sathi to'ldiriladi, ya'ni mishyak p-element hisoblanadi.
Savol №6
Sababini tushuntiring kimyoviy belgi vodorod odatda I guruhning asosiy kichik guruhiga va VII guruhning asosiy kichik guruhiga joylashtiriladi.
Vodorod atomi ishqoriy metall atomlarida bo'lgani kabi tashqi (va faqat) elektron qavatida bitta s-elektronga ega. Shuning uchun vodorod davriy tizimning birinchi guruhiga joylashtiriladi. Boshqa tomondan, tashqi elektron qobiqni to'ldirish uchun vodorod atomida galogen atomlari kabi bitta elektron yo'q, shuning uchun vodorod davriy tizimning VII guruhining asosiy kichik guruhiga ham joylashtirilgan.
Savol №7
Elektronlarning orbitallarda tarqalish qonuniyatlari asosida lantanidlar va aktinidlar nima uchun o'xshash kimyoviy xossalarga ega ekanligini tushuntiring.
Lantanidlar va aktinidlar atomlarida tashqi tomondan uchinchi elektron daraja to'ldiriladi. Kimyoviy xossalar asosan tashqi qobiqning elektronlariga bog'liq bo'lgani uchun lantanidlar va aktinidlar xossalari jihatidan juda o'xshashdir.
Savol №8
Sizga ma'lum bo'lgan sun'iy ravishda olingan elementlarni nomlang, ularning D.I. kimyoviy elementlar davriy jadvalidagi o'rnini ko'rsating. Mendeleyev va diagrammalarni chizish, dan
bu elementlar atomlaridagi orbitallardagi elektronlarning joylashishini aks ettiradi.
Ular tabiatda uchramaydi va faqat sun'iy yo'l bilan texnetiy (№ 43), prometiy (№ 61), astatin (№ 85), fransiy (No 87) va transuran elementlari, ya'ni tarkibida mavjud bo'lgan elementlarni olish mumkin. urandan keyingi davriy tizim (93 va undan ortiq raqamlar bilan).
Elektron sxemalar texnetiy, prometiy, astatin va fransiy:
43 Tc 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d5 5s2
61 Pm 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f5 5s2 5p6 6s2
85 1s2 da 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p5
Transuran elementlaridan birinchisi - neptunning elektron sxemasi:
93 Np
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f4 6s2 6p6 6d1 7s2
Savol №9
"Valentlik" tushunchasining mohiyatini atomlarning tuzilishi va kimyoviy bog'lanishning shakllanishi haqidagi zamonaviy g'oyalar nuqtai nazaridan tushuntiring.
Valentlik raqamga teng kimyoviy bog'lanishlar berilgan elementning atomi boshqa elementlarning atomlari bilan hosil bo'lishi mumkin. Tashqi elektron darajadagi elektronlar kimyoviy bog'lanishlar hosil bo'lishida ishtirok etadi. Valentlikni, shuningdek, ma'lum bir kimyoviy element atomi boshqa elementlarning atomlari bilan kimyoviy bog'lanishni ta'minlaydigan elektronlar soni sifatida ham aniqlash mumkin.
Savol №10
Nima uchun valentlikning raqamli qiymati har doim ham tashqi energiya sathlaridagi elektronlar soniga to'g'ri kelmaydi?
Kimyoviy bog'lanishlarning paydo bo'lishi atomda juftlashtirilmagan elektronlar mavjudligida mumkin. Ko'pgina elementlarda tashqi elektron darajadagi barcha elektronlar juftlashtirilmaydi.
Masalan, kislorod va oltingugurt atomlarining tashqi sathida oltita elektron bor, lekin ulardan faqat ikkitasi juftlashtirilmagan:
16S↓ | ||||||||||||||
Biroq, tashqi elektron darajadagi oltingugurt atomida hali ham bo'sh 3d orbitallar mavjud bo'lib, ularga 3s va 3p orbitallardan elektronlar o'tishi mumkin, natijada oltingugurt atomida olti juft bo'lmagan elektronlar bo'ladi:
16S↓ | ||||||||||||||
Shuning uchun oltingugurtning maksimal valentligi oltita, ya'ni tashqi elektron darajadagi elektronlar soniga to'g'ri keladi. Ikkinchi darajadagi kislorod atomida d-orbitallar mavjud emas, shuning uchun elektron juftlashuv imkoniyati yo'q va kislorod valentligi ikkitadan ko'p bo'lishi mumkin emas, ya'ni u tashqi darajadagi elektronlar soniga teng emas. .
Savol №11
Nima uchun 2-davr elementlarining maksimal valentligi 4 raqamidan oshmasligi kerak?

Ikkinchi davr elementlarining atomlarida 4 dan ortiq bo'lmagan elektronlar bo'lishi mumkin emas, chunki ikkinchi elektron sathda bitta s-orbital va uchta p-orbital mavjud. Valentlik juftlashtirilmagan elektronlar soniga teng, shuning uchun ikkinchi davr elementlarining valentligi 4 dan ortiq bo'lishi mumkin emas.
Savol №12
Azot kislotasidagi azotning va uglerod oksidi (II)dagi uglerod va kislorodning valentligini aks ettiruvchi elektron sxemalarni tuzing.
a) Uglerod oksidi molekulasi. Uglerod va kislorod atomlarining elektron qobiqlarining tuzilishi:
Uglerod oksidi molekulasida uglerod atomidagi ikkita juftlashtirilmagan elektron va kislorod atomidagi ikkita bog'lanmagan elektrondan ikkita bog'lanish hosil bo'ladi. Kislorod atomi 2p orbitalda yana bir juft elektronga, uglerod atomi esa erkin 2p orbitalga ega. Bir juft elektron kislorod atomidan uglerod atomiga o'tib, donor-akseptor bog'ini hosil qiladi. Uglerod oksidi (II) ning elektron formulasi quyidagicha ifodalanishi mumkin:
(o'q donor-akseptor aloqasini ko'rsatadi).
b) Nitrat kislota molekulasi. Vodorod, kislorod va azot atomlarining elektron sxemalari:
Vodorod atomi bitta elektron tufayli kislorod atomi bilan bog' hosil qiladi. Kislorod atomining ikkinchi elektroni azot atomi bilan bog'lanishda ishtirok etadi:
Azot atomida ikkita juftlashtirilmagan elektron qoladi va u ikkinchi kislorod atomi bilan ikkita aloqa hosil qiladi:
HONO
Da azot atomida hali ham elektron juftlik mavjud 2s orbitallar.
DA Uchinchi kislorod atomida elektronlarning juftlashuvi sodir bo'ladi va erkin orbital hosil bo'ladi:
Azot atomidan bir juft elektron kislorod atomining bo'shatilgan orbitaliga o'tadi va donor-akseptor bog'i hosil bo'ladi:
Savol №13
Nima uchun zamonaviy tushunchalarga ko'ra, valentlik tushunchasi ionli birikmalarga taalluqli emas?
Valentlik atom tomonidan hosil qilingan bog'lanishlar soniga teng va tashqi elektron darajadagi elektronlar soniga bog'liq. Ionli birikmalar musbat va manfiy zaryadlangan ionlardan tashkil topgan boʻlib, ular elektr tortishish taʼsirida bir-biriga bogʻlangan. Ion birikmalarida ionlar orasidagi bog'lanish soni bog'liq
kristall panjaraning tuzilishi bo'yicha elaklar, har xil bo'lishi mumkin va tashqi elektron darajadagi elektronlar soniga bog'liq emas.
Savol №14
Davrlarda chapdan o'ngga va bir davrdan ikkinchisiga o'tishda atom radiuslarining o'zgarishida qanday qonuniyatlar kuzatiladi?
Davrlarda atom radiuslari chapdan o'ngga kamayadi. Bu yadro zaryadining ortishi va elektronlarning yadroga kuchliroq tortilishi bilan bog'liq. elektron qobiq kichrayib borayotgandek. Guruhlarda atomlarning radiuslari yuqoridan pastga qarab ortadi, chunki elektron qobiqlar soni ortib boradi.
Savol №15
D.I tomonidan berilgan davriy qonunning formulasini eslang. Mendeleev va bu qonunning zamonaviy shakllantirilishi. Aniq misollarda, nafaqat kimyoviy elementlarning xossalari, balki ularning birikmalarining shakllari va xossalari davriy ravishda o'zgarib turishini tasdiqlang.
D.I tomonidan berilgan davriy qonunning formulasi. Mendeleev shunday dedi: kimyoviy elementlarning xossalari bu elementlarning atom massalariga davriy bog'liqdir. Zamonaviy formulada aytilishicha, kimyoviy elementlarning xususiyatlari davriy ravishda ushbu elementlar yadrosining zaryadiga bog'liq. Kimyoviy elementlar birikmalarining xossalari ham davriy ravishda o'zgarib turadi. Masalan, I guruhning asosiy kichik guruhidagi barcha metallarning oksidlari (Li2 O, Na2 O, K2 O, Rb2 O, Cs2 O) asosiy xossalarini, IV guruhning asosiy kichik guruhining barcha elementlarining oksidlari (CO2, SiO2) , GeO2 SnO2, PbO2) - kislotali xossalari .
3-topshiriq raqami 1
0,68 g noma'lum moddaning to'liq yonishi bilan 1,28 g oltingugurt oksidi (IV) va 0,36 g suv olindi. Toping kimyoviy formula yondirilgan modda.
Suv va oltingugurt oksidining (IV) molyar massalarini hisoblang:
M (H2 O) \u003d 1 2 + 16 \u003d 18 g / mol
M(SO2) \u003d 32 + 16 2 \u003d 64 g / mol
Keling, moddaning yonishi paytida hosil bo'lgan suv moddasi va oltingugurt oksidi (IV) miqdorini hisoblaylik:
n(H2O) = | m(H2O) | ||||||||
M(H2O) | |||||||||
n(SO2) = | |||||||||
M(SO2) | |||||||||
Chunki reaksiyada SO2 va H2 O olinadi, u holda boshlangich moddada faqat S, H va O bolishi mumkin.Keyin dastlabki moddani Sx Hy Oz formulasi bilan sxematik tasvirlash mumkin. Keyin reaksiya tenglamasi yoziladi
x+y | |||||||||
0,02 mol suvda 0,02 2 = 0,04 mol vodorod atomlari mavjud. 0,02 mol oltingugurt oksidi tarkibida 0,02 mol vodorod atomlari mavjud. Moddadagi vodorod va oltingugurtning massasini hisoblang:
m (H) \u003d n (H) M (H) \u003d 0,04 mol 1 g / mol \u003d 0,04 g.
m(S) = n(S) M(S) = 0,02 mol 32 g/mol = 0,64 g
Oltingugurt va vodorodning massasi 0,64 + 0,04 = 0,68 g, ya'ni u moddaning massasiga teng, ya'ni moddada oltingugurt va vodoroddan boshqa elementlar yo'q. 0,04 mol vodorodga 0,02 mol oltingugurt, ya'ni 2 vodorod atomiga 1 oltingugurt atomi to'g'ri keladi, H2 S moddaning eng oddiy formulasi vodorod sulfididir.
Javob: vodorod sulfid H2S.
3-topshiriq raqami 2
20 g vodorod sulfidi 10 g natriy gidroksidi bo'lgan eritmadan o'tkazildi. Bu holatda qanday tuz hosil bo'lgan? Uning massasi va miqdorini aniqlang.
Ikki tuz hosil bo'lishi mumkin - tenglama (1) bo'yicha natriy sulfid va (2) tenglamaga muvofiq natriy gidrosulfidi.
2NaOH + H2S = Na2S + 2H2O | |
NaOH + H3 8 \u003d NaHS + H2 O |
Natriy gidroksid va vodorod sulfidining molyar massalarini hisoblang:
M (NaOH) = 23 + 16 + 1 = 40 g / mol
M (H2 S) = 1 2 + 32 = 34 g / mol
Natriy gidroksid va vodorod sulfidining miqdorini hisoblang:
(2) tenglamaga asosan 1 mol natriy gidroksid 1 mol vodorod sulfidi bilan reaksiyaga kirishadi, ya’ni 0,59 mol vodorod sulfidi bilan reaksiyaga kirishish uchun 0,59 mol natriy gidroksid kerak bo‘ladi va shartga ko‘ra atigi 0,25 mol olingan. . Binobarin, vodorod sulfidi ortiqcha olinadi va natriy gidrosulfidi hosil bo'ladi, hisoblash natriy gidroksid yordamida amalga oshiriladi. 1 mol natriy gidroksiddan, tenglamaga ko'ra, 1 mol natriy gidrosulfidi hosil bo'ladi, shuning uchun 0,25 mol natriy gidroksiddan 0,25 mol natriy gidrosulfidi olinadi.
Hisoblash molyar massa natriy gidrosulfidi:
M (NaHS) = 23 + 1 + 32 = 56 g / mol
Natriy gidrosulfidining massasini hisoblang:
m(NaHS) = n (NaHS) M(NaHS) = 0,25 mol 56 g/mol = 14 g.
Javob: 0,25 mol (14 g) natriy gidrosulfidi olinadi.
3-topshiriq raqami 3
100 g gidratlangan alyuminiy xlorid AlCl3 6H2 O dan qancha alyuminiy oksidi grammda olish mumkin?






