Šta je toplota fuzije. Velika enciklopedija nafte i gasa
Poznata je činjenica da supstanca može biti u jednom od agregatnih stanja – gasovito, tečno, čvrsto. I može se kretati od jednog do drugog. Najjednostavniji primjer - komad leda se topi, pretvara u tekućinu, a zatim u paru. U cijelom tom procesu pretvaranja u paru, faza topljenja je vrlo zanimljiva i jedan od njenih parametara je specifična toplina fuzije.
Ako se sjećate kako se topljenje odvija, tada se može razlikovati nekoliko faza. Uzmimo olovo kao primjer. U prvoj fazi, olovo se zagrijava, temperatura raste na 327 (tačka topljenja). Nakon što je topljenje počelo, dugo se ništa ne dešava.
Temperatura olova, bez obzira na toplinu koja mu se dovodi, ostaje konstantna i ostaje sve dok se cijeli proces ne završi. I tek nakon toga, uz nastavak grijanja, temperatura ponovo počinje rasti. Iz uočene slike slijede neki zaključci. U čvrstom tijelu, svi molekuli su u određenom redu i čvrsto su povezani sa susjednim molekulima.
Da bi se slobodno kretale na drugo mjesto, veze sa susjednim molekulima moraju biti prekinute, što se dešava tokom procesa topljenja. Da bi se to postiglo, tijelo mora prenijeti određenu brzinu topline, koja se zove toplina fuzije. Svaka supstanca će zahtijevati različitu količinu topline. Razlog je takvo svojstvo tvari kao što je specifična toplina fuzije, koja se definira kao količina topline koja se troši da se otopi jedan kilogram tvari. Jedinica mjere je džul/kilogram.
Kao što je već spomenuto, za svaki materijal ova vrijednost je drugačija. topljenje olova se razlikuje od iste vrijednosti za led. I tu se javlja vrlo zanimljiv trenutak. Specifična toplina taljenja čelika je u prosjeku 85 kJ/kg, a za vodu (led) isti parametar je u prosjeku 335 kJ/kg. Za led, visoka vrijednost ovog parametra može se smatrati velikim darom prirode.
Zaista, zahvaljujući tome, sav snijeg, led se ne topi odmah, već se sve dešava dugo. Inače bi se snijeg vrlo brzo otopio, a poplave bi bile obilnije i razornije. Osim toga, takva jedinstvena svojstva vode doprinose stabilizaciji klime na planeti.
Postoje tabele sa podacima o specifičnoj toploti fuzije pojedinih materijala. Poznavajući ovu vrijednost, izračunava se koliko je topline potrebno da bi se materijal otopio i određuje koliko je goriva potrebno za topljenje. Ako se tijelo zagrije do tačke topljenja, tada je toplina potrebna samo za topljenje, a ako je njegova temperatura ispod tačke topljenja, tada je potrebna toplina da se supstanca zagrije do
Takvi proračuni su izuzetno korisni u industriji za izračunavanje troškova proizvodnje.
Usput, kada se rastopljena tvar ohladi, dolazi do obrnutog procesa topljenja - kristalizacije. U ovom slučaju, kada se tvar ohladi, pokidane veze između molekula se obnavljaju i toplina se oslobađa.
Uzimajući u obzir proces topljenja supstance i pojave koje se u tom procesu dešavaju, definisan je koncept kao što je specifična toplota fuzije. Ovaj pokazatelj je upoređen za različite supstance, te je utvrđeno kako visoka vrijednost ovog parametra u ledu ima blagotvoran učinak na klimu planete.
Stranica 3
Specifične toplote topljenja leda i isparavanja vode na 273 K su 0 33 i 2 5 MJ/kg, respektivno.
Vazduh se brzo ispumpava iz toplotno izolovane posude koja sadrži vodu na 0 C, 117% vode je isparilo u otisku, a usled intenzivnog isparavanja, sva neisparena voda je zamrznuta. Specifična toplota topljenja leda je 0,33 MJ/kg.
Koliki je maksimalni rad Lmax koji se može dobiti od mašine koja radi ciklično, čiji je grijač masa mi 1 kg vode pri početna temperatura T 373 K, a frižider - m2 - 1 kg leda na temperaturi T2 273 K, do trenutka kada se sav led otopi. Kolika će biti temperatura vode T u ovom trenutku. Specifična toplota topljenja leda je q 335 kJ/kg, zavisnost specifične toplote vode o temperaturi je zanemarena.
Brojni proračuni procesa prijenosa topline u kojima dolazi do topljenja i skrućivanja provode se pomoću jednačine toplotni bilans. Kao primjer, razmotrite kako se sastavlja takva jednadžba pri određivanju specifične topline topljenja leda pomoću kalorimetra.
Iz posude u kojoj se nalazi 100 g vode na 0 C, zrak se brzo ispumpava; istovremeno, zbog intenzivnog isparavanja, neisparena voda se smrzava. Koliko vode se na ovaj način može pretvoriti u led. Specifična toplota isparavanja na 0 C / - 597 cal / g; Specifična toplota topljenja leda A je 80 cal/g. Posudu smatrajte toplotno izolovanom.
Iz posude u kojoj se nalazi masa od t100 g vode na temperaturi od 0 C, zrak se brzo ispumpava; istovremeno, zbog intenzivnog isparavanja, neisparena voda se smrzava. Koja se masa vode može na ovaj način pretvoriti u led. Specifična toplota isparavanja na 0 C / - 2 49 MJ / kg; specifična toplota topljenja leda H 0 336 MJ/kg Posuda se smatra toplotno izolovanom.
Specifična toplota isparavanja vode na 0 C je 2,54 - 10e J/kg, specifična toplota topljenja leda je 3 35 105 J/kg.
Rezultirajući led je drugačiji fizička svojstva od običan led, koji ima temperaturu od 0 C. Specifična toplota voda u temperaturnom opsegu od - 10 C do OS je jednako cl 4 17 103 JDkg K); specifični toplotni kapacitet leda u ovom temperaturnom opsegu je c2 2 17 103 JDkg K); specifična toplota topljenja leda na 0 C je 3 32 105 J/kg.
V 2 l tečnog azota se čuva u Dewar posudi na temperaturi od tt - 195 C. Odrediti specifičnu toplotu isparavanja azota ha, ako je poznato da će se na temperaturi od t°C otopiti 40 g leda u istom plovilu u roku od 22 5 h. Gustina tečnog azota p 8 - 102 kg/m3; specifična toplota topljenja leda X l 3 3 105 J/kg. Pretpostavimo da je brzina opskrbe toplinom unutar posude proporcionalna temperaturnoj razlici izvan i unutar posude.
Odrediti masu m vode koja se može pretvoriti u led na 0 C isparavanjem etra, čija je masa M 0,1 kg, a temperatura t je 20 C. Izmjena topline se događa samo između etra i vode. Specifična toplota isparavanja etra g 3 8 105 J/kg, specifična toplota fuzije leda A 3, 3 - 105 J/kg, specifična toplota vode sv 4200 J/kg K, eter se 2100 J/kg K.
Komad leda težine 6 kg na temperaturi od -20 C spušten je u vodu temperature 60 C; masa vode je 10 kg. Specifični toplotni kapacitet leda je 2 1 kJ / (kg - K); specifična toplota topljenja leda - 0 33 MJ / kg.
Određivanje specifične topline fuzije vatrostalnih tijela (tijela sa visoke temperature topljenje) je težak zadatak. Specifična toplina fuzije takvog kristala niskog taljenja kao što je led može se odrediti pomoću kalorimetra. Koristeći - zakon održanja energije, sastavićemo jednačinu toplotnog bilansa (§ 209), koja nam omogućava da odredimo specifičnu toplotu topljenja leda.
Voda, uz određene mjere opreza, može biti prehlađena na temperaturu od 4 - 10 C. Ovo stanje vode je nestabilno, a uz bilo koje smetnje, voda se pretvara u led s temperaturom od t°C. Pretpostavimo da je specifična toplota voda ne zavisi od temperature i jednaka je 4 2 kJ/(kg – C), a specifična toplota topljenja leda g 0/34 MJ/kg.
Komad leda uzet na temperaturi od -8 C spušta se u mesingani kalorimetar mase 300 g koji sadrži 1 kg vode na 18 C. Specifični toplotni kapacitet vode je 4 19 kJ / (kg - K), led - 2 1 kJ / (kg - K), mesing - 0 38 kJ / (kg - K); specifična toplota topljenja leda je 0 33 MJ/kg.
V2 l tečnog azota se čuva u Dewar posudi na temperaturi tl - - 195 C. Gustina tečnog azo p8 je 102 kg/m3; specifična toplota topljenja leda Yal 3 3 - 105 J/kg. Pretpostavimo da je brzina opskrbe ms unutar posude proporcionalna temperaturnoj razlici izvan i unutar posude.
Kako temperatura raste čvrste materije a tečnosti raste kinetička energija njihove čestice: počinju da osciliraju brže. Na određenoj temperaturi, koja je sasvim određena za datu supstancu, sile privlačenja između čestica više ih ne mogu zadržati na čvorovima kristalne rešetke (redak dugog dometa prelazi u kratkodometni), i kristal počinje da se topi, tj. materija počinje da se rastvara.
topljenje - proces prelaska supstance iz čvrstog u tečno stanje.
Stvrdnjavanje - proces prelaska supstance iz tečnog u čvrsto stanje.
Tokom procesa topljenja, temperatura kristala ostaje konstantna. Ova temperatura se zove tačka topljenja. Svaka supstanca ima svoju tačku topljenja.
iskustvo: Sa ulice (ili iz zamrzivača) donose malo snijega i termometrom promatraju promjenu njegove temperature. Oni vide da u početku temperatura snijega raste, a zatim, u procesu topljenja, ostaje konstantna (očitavanja termometra se ne mijenjaju). I tek nakon što se sav snijeg otopi, temperatura formirane vode ponovo počinje rasti.
Konstantnost temperature tokom topljenja je od velike praktične važnosti, jer omogućava kalibraciju termometara, izradu osigurača i indikatora koji se tope na strogo određenoj temperaturi. Poznavanje tačke topljenja razne supstance važno sa čisto domaćeg gledišta: inače, ko će garantovati da se ovaj lonac ili tiganj neće otopiti na vatri plinskog plamenika?
Tačka topljenja i temperatura stvrdnjavanja jednaka njoj su karakteristične osobine tvari. Živa se topi i stvrdnjava na temperaturi od -39 o C, pa se živini termometri ne koriste na krajnjem sjeveru. Umjesto živinih termometara na ovim geografskim širinama koriste se alkoholni termometri (-114 o C). Najvatrostalniji metal je volfram (3420 o C).
Količina topline potrebna za taljenje tvari određena je formulom:
, gdje je m masa tvari, specifična toplina fuzije.
j/kg
Specifična toplota fuzije - količina topline potrebna da se otopi 1 kg tvari na njenoj tački. Svaka supstanca ima svoje. Nalazi se u tabeli.
Tačka topljenja neke supstance zavisi od pritiska. Za supstance čija se zapremina povećava topljenjem, povećanje pritiska povećava tačku topljenja i obrnuto. Kod vode se tokom topljenja volumen smanjuje, a kada se pritisak poveća, led se topi na nižoj temperaturi.
Tokom skrućivanja, atomi se ponovo redaju u određenom redosledu i toplota stvrdnjavanja se oslobađa. Čim se tijelo potpuno očvrsne, njegova temperatura počinje opadati.
Ulaznica broj 5.
Povezane informacije:
- A. temperatura, ylgaldylyk, aua kozgalysynyn zhyldamdygy, infrakyzyl saulelen.
- Žilavost - sposobnost materijala da se odupru krtom lomu na niskim temperaturama.
- Dijagram stanja je izgrađen u koordinatama temperature i koncentracije.
- Van der Waalsove izoterme i njihovo poređenje sa stvarnim izotermama. kritična temperatura. Unutrašnja energija van der Waalsovog gasa.
- Isparavanje i kondenzacija. Relativna vlažnost i njeno mjerenje. Kipuće. Temperatura ključanja. Specifična toplota isparavanja.
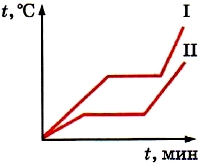
U prethodnom pasusu razmatrali smo grafikon topljenja i očvršćavanja leda. Grafikon pokazuje da dok se led topi, njegova temperatura se ne mijenja (vidi sliku 18). I tek nakon što se sav led otopi, temperatura nastale tekućine počinje rasti. Ali na kraju krajeva, čak i tokom procesa topljenja, led prima energiju od goriva koje gori u grijaču. A iz zakona održanja energije slijedi da ona ne može nestati. Kolika je potrošnja energije goriva tokom topljenja?
Znamo da su u kristalima molekuli (ili atomi) raspoređeni u strogom redu. Međutim, čak iu kristalima oni su u termičkom kretanju (osciliraju). Kada se telo zagreje prosječna brzina molekularno kretanje se povećava. Posljedično, njihova prosječna kinetička energija i temperatura također se povećavaju. Na grafikonu, ovo je sekcija AB (vidi sliku 18). Kao rezultat toga, raspon vibracija molekula (ili atoma) se povećava. Kada se tijelo zagrije na temperaturu topljenja, redoslijed rasporeda čestica u kristalima će biti narušen. Kristali gube oblik. Supstanca se topi od čvrsto stanje u tečnost.
Posljedično, sva energija koju kristalno tijelo primi nakon što je već zagrijano do tačke topljenja troši se na uništavanje kristala. S tim u vezi, tjelesna temperatura prestaje da raste. Na grafikonu (vidi sliku 18) ovo je BC presek.
Eksperimenti pokazuju da je za transformaciju različitih kristalnih supstanci iste mase u tečnost na tački taljenja potrebna različita količina toplote.
Fizička veličina koja pokazuje koliko toplote treba preneti kristalno telo mase 1 kg da bi se potpuno prešlo u tečno stanje na tački taljenja naziva se specifična toplota topljenje.
Specifična toplota fuzije je označena sa λ (grčko slovo "lambda"). Njegova jedinica je 1 J/kg.
Odredite specifičnu toplinu fuzije u eksperimentu. Tako je utvrđeno da je specifična toplota topljenja leda 3,4 10 5 - . To znači da je za transformaciju komada leda težine 1 kg, uzetog na 0°C, u vodu iste temperature potrebno 3,4 10 5 J energije. A da bi se rastopila šipka olova težine 1 kg, uzeta na njenoj tački topljenja, trebat će 2,5 10 4 J energije.
Dakle, na tački topljenja, unutrašnja energija supstance u tečno stanje više unutrašnja energija iste mase materije u čvrstom stanju.
Za izračunavanje količine topline Q potrebne za topljenje kristalno telo masa m, uzeta na tački topljenja i normalna atmosferski pritisak, potrebno je pomnožiti specifičnu toplinu fuzije λ sa tjelesnom masom m:
Iz ove formule se može utvrditi da
λ = Q / m, m = Q / λ
Eksperimenti to pokazuju kada se izleče kristalna supstanca oslobađa se tačno ista količina toplote koja se apsorbuje kada se topi. Dakle, prilikom skrućivanja vode težine 1 kg na temperaturi od 0 °C oslobađa se količina toplote jednaka 3,4 10 5 J. Tačno ista količina toplote je potrebna za otapanje leda težine 1 kg na temperaturi od 0°C.

Kada se supstanca stvrdne, sve se dešava obrnutim redosledom. Brzina, a time i prosječna kinetička energija molekula u ohlađenoj rastopljenoj tvari, opada. Privlačne sile sada mogu držati molekule koje se sporo kreću blizu jedna drugoj. Kao rezultat toga, raspored čestica postaje uređen - formira se kristal. Energija koja se oslobađa tokom kristalizacije troši se na održavanje konstantna temperatura. Na grafikonu, ovo je EF sekcija (vidi sliku 18).
Kristalizacija je olakšana ako su strane čestice, kao što su čestice prašine, prisutne u tekućini od samog početka. Oni postaju centri kristalizacije. U normalnim uslovima postoji mnogo centara kristalizacije u tečnosti, u blizini kojih dolazi do formiranja kristala.
Tabela 4
Specifična toplota fuzije određenih supstanci (pri normalnom atmosferskom pritisku)

Tokom kristalizacije energija se oslobađa i prenosi na okolna tijela.
Formulom je određena i količina topline koja se oslobađa tokom kristalizacije tijela mase m
U tom slučaju se smanjuje unutrašnja energija tijela.
Primjer. Za pripremu čaja turist je u lonac stavio led težine 2 kg i temperature od 0°C. Koliko je toplote potrebno da se ovaj led pretvori u kipuću vodu na 100°C? Energija utrošena na zagrevanje čajnika se ne uzima u obzir.

Kolika bi količina topline bila potrebna kada bi turist umjesto leda iz rupe uzeo vodu iste mase iste temperature?
Zapišimo stanje problema i riješimo ga.

Pitanja
- Kako objasniti proces topljenja tijela na osnovu doktrine o strukturi materije?
- Na koliko se troši energija goriva pri topljenju kristalnog tijela zagrijanog do tačke topljenja?
- Koja je specifična toplota fuzije?
- Kako objasniti proces stvrdnjavanja na osnovu doktrine o strukturi materije?
- Kako se izračunava količina topline koja je potrebna da se otopi kristalno tijelo uzeto na tački topljenja?
- Kako izračunati količinu toplote koja se oslobađa tokom kristalizacije tijela koje ima tačku topljenja?
Vježba 12
Vježbajte
- Stavite dvije identične konzerve na šporet. U jednu sipajte vodu težine 0,5 kg, u drugu stavite nekoliko kockica leda iste mase. Obratite pažnju koliko je vremena potrebno da voda u obe tegle proključa. Napišite kratak prikaz svog iskustva i objasnite rezultate.
- Pročitajte odlomak „Amorfna tijela. Topljenje amorfna tela". Pripremite izvještaj o tome.






