Struktura atoma. Rutherfordovo iskustvo. Istorija razvoja prirodnih nauka u srednjem veku
Planetarni model atoma predložio je E. Rutherford 1910. godine. Prve studije strukture atoma napravio je uz pomoć alfa čestica. Na osnovu rezultata dobijenih u eksperimentima na njihovom rasejanju, Rutherford je sugerisao da ceo pozitivan naboj atom je koncentrisan u malom jezgru u svom centru. S druge strane, negativno nabijeni elektroni su raspoređeni u ostatku svog volumena.
Malo pozadine
Prvu briljantnu pretpostavku o postojanju atoma iznio je starogrčki naučnik Demokrit. Od tada ideja o postojanju atoma, čije kombinacije daju sve supstance oko nas, nije napustila maštu ljudi nauke. S vremena na vrijeme su mu se obraćali razni predstavnici, ali prije početkom XIX stoljeća njihove izgradnje bile su samo hipoteze, a ne potkrijepljene eksperimentalnim podacima.
Konačno, 1804. godine, više od sto godina prije nego što se pojavio planetarni model atoma, engleski naučnik John Dalton pružio je dokaze za njegovo postojanje i uveo koncept atomske težine, koji je bio njegov prvi kvantitativna karakteristika. Kao i njegovi prethodnici, on je zamišljao atome kao najmanje komadiće materije, poput čvrstih kuglica, koje se ne mogu podijeliti na još manje čestice.
Otkriće elektrona i prvi model atoma
Prošao je skoro vek kada je, konačno, u kasno XIX veka, Englez J. J. Thomson je takođe otkrio prvu subatomsku česticu, negativno naelektrisan elektron. Budući da su atomi električno neutralni, Thomson je mislio da moraju biti sastavljeni od pozitivno nabijenog jezgra čiji su elektroni rasuti po cijelom volumenu. Na osnovu različitih eksperimentalnih rezultata, 1898. predložio je svoj model atoma, koji se ponekad naziva "šljive u pudingu", jer je atom u njemu predstavljen kao sfera ispunjena nekom pozitivno nabijenom tekućinom, u koju su ugrađeni elektroni, kao " šljive u puding. Radijus ovakvog sfernog modela bio je oko 10 -8 cm.Ukupni pozitivni naboj tečnosti je simetrično i jednolično uravnotežen negativnim naelektrisanjem elektrona, kao što je prikazano na slici ispod.
Ovaj model je na zadovoljavajući način objasnio činjenicu da kada se supstanca zagreje, ona počinje da emituje svetlost. Iako je ovo bio prvi pokušaj da se shvati šta je atom, nije uspeo da zadovolji rezultate eksperimenata koje su kasnije izveli Rutherford i drugi. Thomson se 1911. složio da njegov model jednostavno ne može odgovoriti kako i zašto dolazi do raspršivanja α-zraka uočenih u eksperimentima. Stoga je napušten, a zamijenjen je savršenijim planetarnim modelom atoma.
Kako je uopće uređen atom?
Ernest Rutherford je dao objašnjenje fenomena radioaktivnosti koje mu je donijelo nobelova nagrada, ali njegov najznačajniji doprinos nauci došao je kasnije, kada je ustanovio da se atom sastoji od gustog jezgra okruženog orbitama elektrona, kao što je Sunce okruženo orbitama planeta. 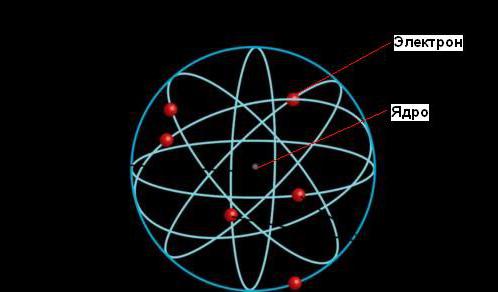
Prema planetarnom modelu atoma, većina njegove mase koncentrirana je u malom (u poređenju s veličinom cijelog atoma) jezgri. Elektroni se kreću oko jezgra, putujući nevjerovatnim brzinama, ali većina volumena atoma je prazan prostor.
Veličina jezgra je toliko mala da je njegov prečnik 100.000 puta manji od prečnika atoma. Promjer jezgra Rutherford je procijenio na 10 -13 cm, za razliku od veličine atoma - 10 -8 cm. Izvan jezgra, elektroni se vrte oko njega velikom brzinom, što rezultira centrifugalnim silama koje balansiraju elektrostatičke sile. privlačnosti između protona i elektrona.
Rutherfordovi eksperimenti
Planetarni model atoma nastao je 1911. godine, nakon čuvenog eksperimenta sa zlatnom folijom, koji je omogućio da se dobiju neke fundamentalne informacije o njegovoj strukturi. Rutherfordov put do otkrića atomskog jezgra je dobar primjer uloga kreativnosti u nauci. Njegova potraga počela je još 1899. godine, kada je otkrio da određeni elementi emituju pozitivno nabijene čestice koje mogu probiti bilo šta. Te je čestice nazvao alfa (α) česticama (sada znamo da su to jezgre helijuma). Kao i svi dobri naučnici, Rutherford je bio radoznao. Pitao se mogu li se alfa čestice koristiti za otkrivanje strukture atoma. Rutherford je odlučio da snop alfa čestica usmjeri na list vrlo tanke zlatne folije. Odabrao je zlato jer je moglo proizvesti limove tanke i do 0,00004 cm. Iza lista zlatne folije postavio je ekran koji je svijetlio kada su alfa čestice udarile u njega. Korišćen je za detekciju alfa čestica nakon što prođu kroz foliju. Mali prorez na ekranu omogućio je snopu alfa čestica da dođe do folije nakon izlaska iz izvora. Neki od njih moraju proći kroz foliju i nastaviti se kretati u istom smjeru, drugi dio moraju se odbiti od folije i reflektirati ispod oštri uglovi. Shemu eksperimenta možete vidjeti na donjoj slici. 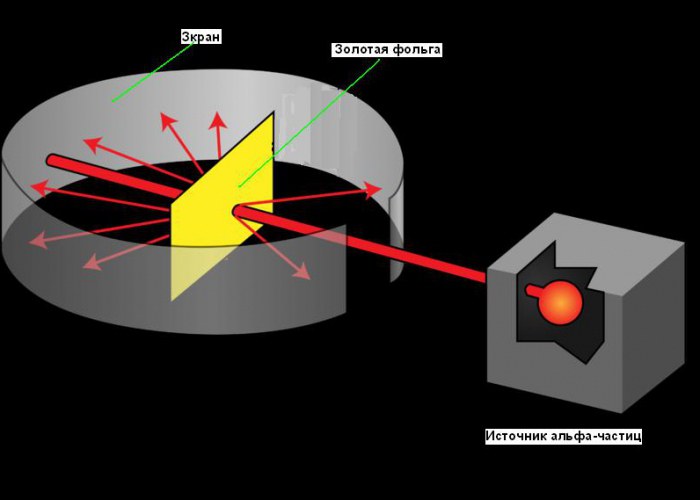
Šta se dogodilo u Rutherfordovom eksperimentu?
Na osnovu J. J. Thomsonovog modela atoma, Rutherford je pretpostavio da će čvrste regije pozitivnog naboja koje ispunjavaju cijeli volumen atoma zlata odstupati ili savijati putanje svih alfa čestica dok prolaze kroz foliju.
Međutim, velika većina alfa čestica prošla je upravo kroz zlatnu foliju kao da je nije bilo. Činilo se da prolaze kroz prazan prostor. Samo nekoliko njih skreće s pravog puta, kako se na početku i pretpostavljalo. Ispod je grafikon broja čestica raspršenih u odgovarajućem smjeru u odnosu na kut raspršenja. 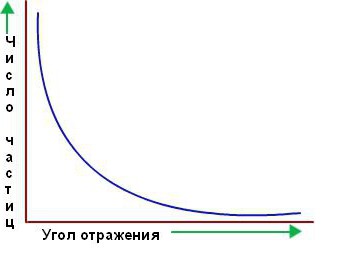
Iznenađujuće, mali procenat čestica se odbio od folije, poput košarkaške lopte koja se odbija od table. Rutherford je shvatio da su ova odstupanja rezultat direktnog sudara između alfa čestica i pozitivno nabijenih komponenti atoma.
Jezgro zauzima centralno mesto
Na osnovu zanemarljivog procenta alfa čestica reflektovanih od folije, možemo zaključiti da su sav pozitivni naboj i gotovo sva masa atoma koncentrirani u jednom malom prostoru, a ostatak atoma je uglavnom prazan prostor. Rutherford je područje koncentriranog pozitivnog naboja nazvao jezgrom. Predvidio je i ubrzo otkrio da sadrži pozitivno nabijene čestice, koje je nazvao protoni. Rutherford je predvidio postojanje neutralnog atomske čestice, nazvao neutronima, ali ih nije mogao otkriti. Međutim, njegov učenik James Chadwick otkrio ih je nekoliko godina kasnije. Slika ispod prikazuje strukturu jezgra atoma uranijuma. 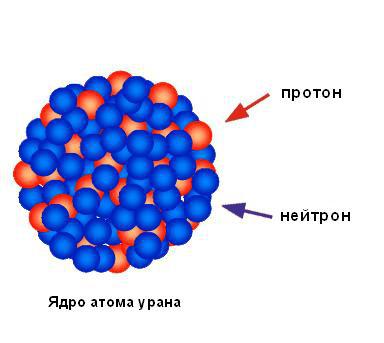
Atomi se sastoje od pozitivno nabijenih teških jezgara okruženih negativno nabijenim ekstremno lakim česticama-elektronima koji rotiraju oko njih, i to takvim brzinama da mehaničke centrifugalne sile jednostavno balansiraju njihovu elektrostatičku privlačnost prema jezgri, te je s tim u vezi navodno osigurana stabilnost atoma.
Nedostaci ovog modela
Rutherfordova glavna ideja bila je povezana s idejom malog atomskog jezgra. Pretpostavka o orbitama elektrona bila je čista pretpostavka. Nije znao tačno gde i kako se elektroni okreću oko jezgra. Stoga, Rutherfordov planetarni model ne objašnjava raspodjelu elektrona u orbitama.
Osim toga, stabilnost Rutherfordovog atoma bila je moguća samo uz kontinuirano kretanje elektrona po orbitama bez gubitka kinetičke energije. Ali elektrodinamički proračuni su pokazali da je kretanje elektrona duž bilo koje krivolinijske putanje, praćeno promjenom smjera vektora brzine i pojavom odgovarajućeg ubrzanja, neizbježno praćeno emisijom elektromagnetske energije. U ovom slučaju, prema zakonu održanja energije, kinetička energija elektrona mora se vrlo brzo potrošiti na zračenje, te mora pasti na jezgro, kao što je shematski prikazano na donjoj slici. 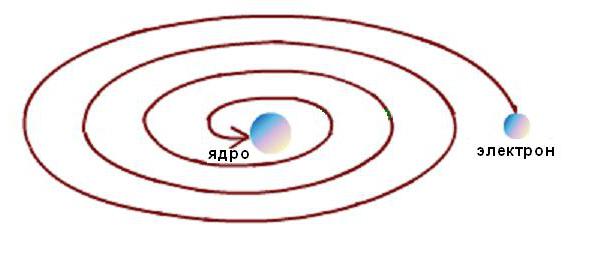 Ali to se ne dešava, jer su atomi stabilne formacije. Između modela fenomena i eksperimentalnih podataka nastala je tipična naučna kontradikcija.
Ali to se ne dešava, jer su atomi stabilne formacije. Između modela fenomena i eksperimentalnih podataka nastala je tipična naučna kontradikcija.
Od Rutherforda do Nielsa Bohra
Sljedeći veliki korak naprijed u istoriji atoma dogodio se 1913. godine, kada je danski naučnik Niels Bohr objavio opis detaljnijeg modela atoma. Ona je jasnije odredila mjesta gdje bi elektroni mogli biti. Iako su kasniji naučnici razvili sofisticiranije atomske dizajne, Bohrov planetarni model atoma bio je u osnovi ispravan, a veliki dio se i danas prihvaća. Imao je mnoge korisne primjene, na primjer, koristi se za objašnjenje svojstava različitih kemijskih elemenata, prirode njihovog spektra zračenja i strukture atoma. Planetarni model i Bohrov model bili su najvažnije prekretnice koje su označile nastanak novog pravca u fizici - fizike mikrosvijeta. Bohr je 1922. dobio Nobelovu nagradu za fiziku za svoj doprinos našem razumijevanju strukture atoma.
Šta je novo Bohr unio u model atoma?
Dok je još bio mlad, Bor je radio u Rutherfordovoj laboratoriji u Engleskoj. Pošto je koncept elektrona bio slabo razvijen u Rutherfordovom modelu, Bohr se fokusirao na njih. Kao rezultat toga, planetarni model atoma je značajno poboljšan. Borovi postulati, koje je formulirao u svom članku "O strukturi atoma i molekula", objavljenom 1913., glase:
1. Elektroni se mogu kretati oko jezgra samo na fiksnim udaljenostima od njega, koje su određene količinom energije koju imaju. On je ove fiksne nivoe nazvao energetskim nivoima ili elektronskim školjkama. Bor ih je zamislio kao koncentrične sfere, sa jezgrom u središtu svake. U ovom slučaju, elektroni sa nižom energijom naći će se na nižim nivoima, bliže jezgru. Oni koji imaju više energije naći će se na više visoki nivoi, daleko od jezgra.
2. Ako elektron apsorbuje neku (sasvim izvesnu za dati nivo) količinu energije, onda će skočiti na sledeći, viši energetski nivo. Suprotno tome, ako izgubi istu količinu energije, vratit će se na prvobitni nivo. Međutim, elektron ne može postojati na dva nivoa energije.
Ova ideja je ilustrovana slikom. 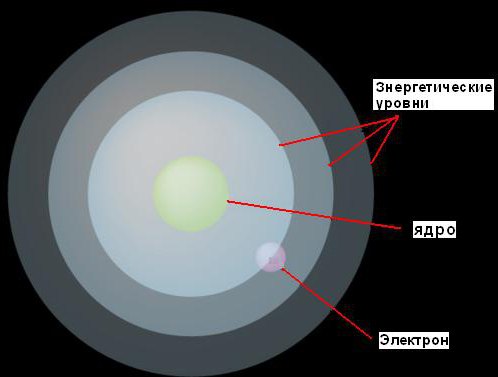
Energetski dijelovi za elektrone
Bohrov model atoma je zapravo kombinacija dvije različite ideje: Rutherfordovog atomskog modela s elektronima koji se okreću oko jezgra (u suštini planetarni Bohr-Rutherfordov model atoma) i ideje Maxa Plancka o kvantiziranju energije materije, objavljeno 1901. Kvant (množina - kvanti) je minimalna količina energije koju supstanca može apsorbirati ili emitovati. To je neka vrsta koraka diskretizacije količine energije.
Ako se energija poredi sa vodom i želite da je dodate materiji u obliku čaše, ne možete tek tako sipati vodu u neprekidnom mlazu. Umjesto toga, možete ga dodati u malim količinama, poput kašičice. Bohr je vjerovao da ako elektroni mogu apsorbirati ili izgubiti samo fiksne količine energije, onda bi svoju energiju trebali mijenjati samo za te fiksne količine. Dakle, oni mogu zauzimati samo fiksne nivoi energije oko jezgra, koji odgovaraju kvantizovanim prirastima njihove energije.
Tako iz Borovog modela izrasta kvantni pristup objašnjavanju strukture atoma. Planetarni model i Borov model bili su svojevrsni koraci od klasične fizike do kvantne fizike, koja je glavno oruđe u fizici mikrosvijeta, uključujući i atomsku fiziku.
Godine 1903. engleski naučnik Thomson predložio je model atoma, koji je u šali nazvan "zemička sa suvim grožđem". Prema njemu, atom je sfera sa ujednačenim pozitivnim nabojem, u kojoj su negativno nabijeni elektroni isprepleteni poput grožđica.
Međutim, daljnje studije atoma pokazale su da je ova teorija neodrživa. A nekoliko godina kasnije, drugi engleski fizičar, Rutherford, izveo je niz eksperimenata. Na osnovu rezultata izgradio je hipotezu o strukturi atoma, koja je i danas priznata u svijetu.
Rutherfordovo iskustvo: prijedlog njegovog modela atoma
U svojim eksperimentima, Rutherford je propuštao snop alfa čestica kroz tanku zlatnu foliju. Zlato je odabrano zbog svoje plastičnosti, što je omogućilo stvaranje vrlo tanke folije, debele gotovo jedan sloj molekula. Iza folije se nalazio poseban ekran koji je bio osvijetljen kada je bio bombardiran alfa česticama koje su padale na njega. Prema Thomsonovoj teoriji, alfa čestice su trebale nesmetano proći kroz foliju, poprilično odstupajući u stranu. Međutim, ispostavilo se da su se neke od čestica ponašale na ovaj način, a vrlo mali dio se vratio nazad, kao da udara u nešto.
Odnosno, otkriveno je da unutar atoma postoji nešto čvrsto i malo, od čega su se alfa čestice odbijale. Tada je Rutherford predložio planetarni model strukture atoma. Rutherfordov planetarni model atoma objasnio je rezultate i njegovih eksperimenata i eksperimenata njegovih kolega. Do danas nije predložen nijedan bolji model, iako se neki aspekti ove teorije još uvijek ne slažu s praksom u nekim vrlo uskim područjima nauke. Ali u osnovi, planetarni model atoma je najkorisniji od svih. Šta je ovaj model?
Planetarni model strukture atoma
Kao što ime govori, atom se poredi sa planetom. U ovom slučaju, planeta je jezgro atoma. A elektroni se okreću oko jezgra na prilično velikoj udaljenosti, baš kao što se sateliti okreću oko planete. Samo je brzina rotacije elektrona stotine hiljada puta veća od brzine rotacije najbržeg satelita. Stoga, tokom svoje rotacije, elektron stvara, takoreći, oblak iznad površine jezgra. A postojeći naboji elektrona odbijaju iste naboje formirane od drugih elektrona oko drugih jezgara. Stoga se atomi ne "lijepe zajedno", već se nalaze na određenoj udaljenosti jedan od drugog.
A kada govorimo o sudaru čestica, mislimo da se one dovoljno približavaju jedna drugoj velika udaljenost i odbijaju ih polja njihovih naboja. Nema direktnog kontakta. Čestice u materiji su generalno veoma udaljene jedna od druge. Ako bi bilo na koji način bilo moguće implodirati zajedno čestice bilo kojeg tijela, ono bi se smanjilo za milijardu puta. Zemlja bi postala manja od jabuke. Dakle, glavni volumen bilo koje tvari, koliko god to čudno zvučalo, zauzima praznina u kojoj se nalaze nabijene čestice, koje se na udaljenosti drže elektronskim silama interakcije.
Trebate pomoć oko studija?
Prethodna tema: Radioaktivnost: alfa, beta, gama zračenjeSljedeća tema: Atomsko jezgro: Nuklearni naboj
2.5. Rutherfordovi eksperimenti. Rutherfordov model atoma
A. Rutherfordovi eksperimenti
Godine 1911. Rutherford je izveo eksperimente izuzetnog značaja koji su dokazali postojanje atomskog jezgra. Za proučavanje atoma, Rutherford je koristio njegovo sondiranje (bombardiranje) uz pomoć α-čestica, koje nastaju pri raspadu radijuma, polonijuma i nekih drugih elemenata. Rutherford i njegovi saradnici, čak i u ranijim eksperimentima 1909. godine, otkrili su da α-čestice imaju pozitivan naboj jednak po modulu dvostrukom naboju elektrona q =+2e, i masa koja se poklapa sa masom atoma helijuma, tj.
m a\u003d 6,62 10 -27 kg,
što je oko 7300 puta više od mase elektrona. Kasnije je otkriveno da su α-čestice jezgra atoma helijuma. Sa ovim česticama, Rutherford je bombardovao atome teških elemenata. Elektroni zbog svoje male mase ne mogu promijeniti putanju α-čestice. Njihovo raspršivanje (promjena smjera kretanja) može biti uzrokovano samo pozitivno nabijenim dijelom atoma. Dakle, iz raspršivanja α-čestica može se odrediti priroda raspodjele pozitivnog naboja, a time i mase unutar atoma.
Bilo je poznato da α-čestice koje emituje polonijum lete brzinom od 1,6-107 m/s. Polonijum je stavljen unutar olovnog kućišta, duž kojeg je izbušen uski kanal. Snop α-čestica, prošavši kroz kanal i otvor, pada na foliju. Zlatna folija se može napraviti izuzetno tanka - debljine 4-10 -7 m (400 atoma zlata; ovaj broj se može procijeniti poznavanjem mase, gustine i molarne mase zlata). Nakon folije, α-čestice su udarile u poluprozirno sito obloženo cink sulfidom. Sudar svake čestice sa ekranom bio je praćen bljeskom svjetlosti (scintilacijom) zbog fluorescencije, što je uočeno pod mikroskopom.
Uz dobar vakuum unutar uređaja (da nije došlo do raspršivanja čestica iz molekula zraka), u nedostatku folije, na ekranu se pojavio svijetli krug od scintilacija uzrokovanih tankim snopom α-čestica. Kada je folija postavljena na putanju snopa, velika većina α-čestica i dalje nije odstupila od prvobitnog smjera, odnosno prolazile su kroz foliju kao da je prazan prostor. Međutim, postojale su alfa čestice koje su promijenile svoju putanju, pa čak i odskočile.
Marsden i Geiger, Rutherfordovi studenti i saradnici, izbrojali su više od milion scintilacija i utvrdili da se otprilike jedna od 2.000 alfa čestica odbija pod uglovima većim od 90°, a jedna od 8.000 do 180°. Bilo je nemoguće objasniti ovaj rezultat na osnovu drugih modela atoma, posebno Thomsona.
Proračuni pokazuju da, kada je raspoređen po atomu, pozitivan naboj (čak i bez uzimanja u obzir elektrona) ne može stvoriti dovoljno intenzivno električno polje sposobno da odbaci α-česticu nazad. Jačina električnog polja jednoliko nabijene lopte je maksimalna na površini lopte i smanjuje se na nulu kako se približava centru. Rasipanje α-čestica pod velikim uglovima dešava se kao da je ceo pozitivni naboj atoma koncentrisan u njegovom jezgru – oblasti koja zauzima veoma mali volumen u poređenju sa celokupnom zapreminom atoma.
Vjerovatnoća da α-čestice udare u jezgro i odbiju ih pod velikim uglovima je vrlo mala, tako da se za većinu α-čestica činilo da folija ne postoji.
Rutherford je teorijski razmatrao problem raspršenja α-čestica u Kulonovom električnom polju jezgra i dobio formulu koja omogućava određivanje broja N elementarni pozitivni naboji +e sadržani u jezgri atoma date folije za raspršivanje. Eksperimenti su pokazali da broj N jednak rednom broju elementa u periodičnom sistemu D. I. Mendeljejeva, tj N=Z(za zlato Z= 79).
Tako je Rutherfordova hipoteza o koncentraciji pozitivnog naboja u jezgru atoma omogućila da se utvrdi fizičko značenje rednog broja elementa u periodičnom sistemu elemenata. Neutralni atom također mora sadržavati Z elektrona. Bitno je da se broj elektrona u atomu, određen različitim metodama, podudara sa brojem elementarnih pozitivnih naboja u jezgru. Ovo je poslužilo kao test validnosti nuklearnog modela atoma.
B. Rutherfordov nuklearni model atoma
Sumirajući rezultate eksperimenata na raspršivanju α-čestica zlatnom folijom, Rutherford je ustanovio:
♦ atomi su po svojoj prirodi uglavnom transparentni za α-čestice;
♦ odstupanja α-čestica pod velikim uglovima moguća su samo ako unutar atoma postoji veoma jako električno polje, stvoreno pozitivnim nabojem povezanim sa velikom masom koncentrisanom u veoma maloj zapremini.
Da bi objasnio ove eksperimente, Rutherford je predložio nuklearni model atoma: u atomskom jezgru (područja s linearnim dimenzijama od 10 -15 -10 -14 m) sav njegov pozitivni naboj i gotovo cijela masa atoma (99,9%) su koncentrisani. Oko jezgra u području s linearnim dimenzijama od ~10 -10 m (dimenzije atoma su procijenjene u molekularno-kinetičkoj teoriji), negativno nabijeni elektroni se kreću po zatvorenim orbitama, čija masa iznosi samo 0,1% mase jezgra. Shodno tome, elektroni se nalaze na udaljenosti od jezgra od 10.000 do 100.000 promjera jezgra, odnosno glavni dio atoma je prazan prostor.
Rutherfordov nuklearni model atoma liči na Sunčev sistem: u centru sistema je "sunce" - jezgro, a oko njega "planete" - elektroni se kreću po orbitama, pa se ovaj model naziva planetarno. Elektroni ne padaju na jezgro jer su električne sile privlačenja između jezgra i elektrona uravnotežene centrifugalnim silama zbog rotacije elektrona oko jezgra.
Godine 1914., tri godine nakon stvaranja planetarnog modela atoma, Rutherford je istraživao pozitivne naboje u jezgri. Bombardirajući atome vodika elektronima, otkrio je da se neutralni atomi pretvaraju u pozitivno nabijene čestice. Budući da atom vodika ima jedan elektron, Rutherford je odlučio da je jezgro atoma čestica koja nosi elementarni pozitivni naboj +e. On je nazvao ovu česticu proton.
Planetarni model se dobro slaže sa eksperimentima o rasejanju α-čestica, ali ne može da objasni stabilnost atoma. Razmotrimo, na primjer, model atoma vodika koji sadrži jezgro protona i jedan elektron koji se kreće brzinom v oko jezgra u kružnoj orbiti poluprečnika r. Elektron mora spiralno ulaziti u jezgro, a frekvencija njegovog okretanja oko jezgra (dakle, frekvencija elektromagnetnih talasa koje on emituje) mora se neprekidno menjati, odnosno atom je nestabilan, a njegovo elektromagnetno zračenje mora imati kontinuirano spektra.
U stvari, ispada da:
a) atom je stabilan;
b) atom zrači energiju samo pod određenim uslovima;
c) zračenje atoma ima linijski spektar određen njegovom strukturom.
Stoga je primjena klasične elektrodinamike na planetarni model atoma dovela do potpune kontradiktornosti s eksperimentalnim činjenicama. Prevazilaženje nastalih poteškoća zahtijevalo je stvaranje kvalitativno novog kvantna- teorija atoma. Međutim, uprkos svojoj nedosljednosti, planetarni model je i dalje prihvaćen kao približna i pojednostavljena slika atoma.
Planetarni model atoma
Planetarni model atoma: jezgro (crveno) i elektroni (zeleno)
Planetarni model atoma, ili Rutherfordov model, - povijesni model strukture atoma, koji je predložio Ernest Rutherford kao rezultat eksperimenta s raspršivanjem alfa čestica. Prema ovom modelu, atom se sastoji od malog pozitivno nabijenog jezgra, u kojem je koncentrisana gotovo cijela masa atoma, oko koje se kreću elektroni, baš kao što se planete kreću oko Sunca. Planetarni model atoma odgovara modernim idejama o strukturi atoma, uzimajući u obzir činjenicu da je kretanje elektrona kvantne prirode i nije opisano zakonima klasične mehanike. Istorijski gledano, Rutherfordov planetarni model naslijedio je "model pudinga od šljiva" Josepha Johna Thomsona, koji postulira da su negativno nabijeni elektroni smješteni unutar pozitivno nabijenog atoma.
Rutherford je 1911. godine predložio novi model strukture atoma kao zaključak iz eksperimenta raspršivanja alfa čestica na zlatnoj foliji, izvedenog pod njegovim vodstvom. U ovom rasejanju neočekivano veliki broj alfa čestica bio je raspršen pod velikim uglovima, što je ukazivalo na to da je centar rasejanja male dimenzije i da je u njemu koncentrisana značajna količina energije. električni naboj. Rutherfordovi proračuni su pokazali da centar raspršenja, pozitivno ili negativno nabijen, mora biti najmanje 3000 puta manji od veličine atoma, što je u to vrijeme već bilo poznato i procijenjeno na oko 10 -10 m. Pošto su elektroni već bili poznati u tog vremena, i njihova masa i naboj su određeni, tada je centar rasejanja, koji je kasnije nazvan jezgrom, morao imati suprotan naboj od elektrona. Rutherford nije povezao količinu naboja s atomskim brojem. Ovaj zaključak je donesen kasnije. I sam Rutherford je sugerirao da je naboj proporcionalan atomskoj masi.
Nedostatak planetarnog modela bila je njegova nekompatibilnost sa zakonima klasične fizike. Ako se elektroni kreću oko jezgre kao planeta oko Sunca, tada je njihovo kretanje ubrzano, pa bi prema zakonima klasične elektrodinamike trebali zračiti elektromagnetne valove, gubiti energiju i pasti na jezgro. Sljedeći korak u razvoju planetarnog modela bio je Bohrov model, koji je postulirao druge, različite od klasičnih, zakone kretanja elektrona. Kvantna mehanika je u potpunosti mogla riješiti kontradikcije elektrodinamike.
Wikimedia fondacija. 2010 .
Pogledajte šta je "Planetarni model atoma" u drugim rječnicima:
planetarni model atoma- planetinis atomo modelis statusas T sritis fizika atitikmenys: angl. model planetarnog atoma vok. Planetenmodell des Atoms, n rus. planetarni model atoma, f pranc. modele planétaire de l'atome, m … Fizikos terminų žodynas
Bohrov model atoma sličnog vodiku (Z je naboj jezgra), gdje je negativno nabijeni elektron zatvoren u atomska školjka, okružuje mali, pozitivno nabijen atomsko jezgro... Wikipedia
Model (francuski model, ital. modello, od lat. modulus mjera, mjera, uzorak, norma), 1) uzorak koji služi kao standard (standard) za serijsku ili masovnu reprodukciju (M. automobila, M. odjeće itd. .). ), kao i vrstu, marku bilo kojeg ... ...
I Model (Model) Walter (24. januara 1891, Gentin, Istočna Pruska, 21. april 1945, blizu Duisburga), nacistički njemački general feldmaršal (1944). U vojsci od 1909. godine, učestvovao u 1. svetskom ratu 1914. 18. Od novembra 1940. komandovao je 3. tenkom ... ... Velika sovjetska enciklopedija
Atom se sastoji od pozitivno nabijenog jezgra i negativno nabijenih čestica koje rotiraju oko njega - elektrona koji čine njegovu elektronsku ljusku.
Zbir naelektrisanja elektrona je po apsolutnoj vrednosti jednak pozitivnom naelektrisanju jezgra, tako da je atom kao celina električno neutralan sistem. Veličina atoma određena je njegovom veličinom elektronska školjka i čine vrijednost reda veličine 10-8 cm.
Elektroni u ljusci atoma raspoređeni su u slojevima. Broj elektronskih slojeva jednak je serijskom broju hemijski element u periodnom sistemu elemenata D.I. Mendeljejev.
U prvom sloju K, koji je najbliži jezgru, ne rotira se više od dva elektrona. U sljedećem sloju L - ne više od 8, u M sloju - ne više od 18, au četvrtom sloju N - ne više od 32 elektrona. Na ovaj način, najveći broj elektrona ovih slojeva jednak je dvostrukom kvadratu broja sloja Z = 2n2. U narednim slojevima ovo pravilo se krši, a broj elektrona može biti: u petom sloju O - od 1 do 29, u šestom sloju P - od 1 do 9 i u dodatnom (poslednjem) sloju Q - ne više od 2 elektrona.
Svaki atom postoji samo u određenim diskretnim energetskim stanjima koja odgovaraju strogo definiranoj vrijednosti njegove energije.
Prijelaz atoma iz jednog energetskog stanja u drugo je praćen apsorpcijom ili emisijom energije. U svom normalnom stanju, atom ne zrači.
Ako jedan od elektrona, prilikom sudara s nekom česticom izvana, dobije dodatnu energiju, onda će otići na udaljeniju orbitu sloja kojem odgovara njegova nova energija. U tom slučaju atom ulazi u pobuđeno stanje, a zatim jedan od elektrona vanjskog sloja skače na slobodno mjesto. Nakon kratkog vremena (reda od 10-8 s), atom se vraća u normalno stanje, dok emituje vidljivo svetlo, ultraljubičasto ili rendgensko zračenje.
Ako elektron atoma primi veliku energiju, tada će biti potpuno nokautiran (uklonjen) iz atoma. Ovaj proces se naziva jonizacija.
Jezgro atoma sastoji se od pozitivno nabijenih čestica (protona) i neutralnih čestica bez naboja (neutrona). Obje ove čestice se obično nazivaju nukleoni.
Proton je materijalna čestica koja ima masu mr = 1,6726. 10-24 godine = 1,007275 amu Pozitivan naboj je jednak 1e+. Budući da je masa neutrona (mn = 1,008665 amu) samo 0,14% veća od mase protona, ova razlika se obično ne uzima u obzir u proračunima i masa neutrona se praktično smatra jednakom masi protona .
Dimenzije jezgra su vrlo male: 10-12-10-13 cm (jezgro je 100.000 puta manje od atoma). Uprkos maloj veličini jezgra, u njemu je koncentrisano 99,95% mase atoma. S obzirom na to, gustina nuklearne materije je veoma velika i iznosi oko 1017 kg/m3.
Naboj jezgra, izražen u elementarnim jedinicama, numerički je jednak rednom broju elementa u periodičnom sistemu D.I. Mendeljejev. Ovo omogućava određivanje broja protona u jezgri datog atoma po rednom broju elementa Z.
Ukupan broj nukleona u jezgru atoma može se odrediti takozvanim masenim brojem A. Maseni broj je atomska težina elementa zaokružena na cijele jedinice. Pošto je broj protona u jezgru brojčano jednak rednom broju elementa Z, broj neutrona je jednak razlici maseni broj A i serijski broj Z, tj. N = A - Z. Na primjer, helijum ima Z = 2 i A = 4, što znači da u jezgru atoma helija postoje dva protona i dva neutrona.
Dakle, mjesto elementa u periodičnom sistemu elemenata D.I. Mendeljejev i njegova atomska težina otkrivaju ne samo strukturu atoma, već i strukturu njegovog jezgra.
Vrsta atoma sa datim brojem protona i neutrona naziva se nuklid.
Vrijednost atomske težine u tabeli elemenata gotovo je uvijek izražena kao razlomak. To je zato što se gotovo svaki element zapravo sastoji od nekoliko varijanti ovog elementa koji imaju isti električni naboj, ali različita masa, tj. isti broj protona u jezgru, ali različit broj neutrona. Vrste hemijskog elementa koje imaju isti broj protona u jezgri atoma, ali različit broj neutrona, nazivaju se izotopi.
Svi izotopi datog elementa nalaze se u jednoj ćeliji tabele elemenata periodnog sistema. Frakcijska vrijednost atomske težine elementa odražava u ovom slučaju prosječnu vrijednost atomske težine svih izotopa ovog elementa. Trenutno je poznato više od 1500 izotopa, od kojih je najviše 300 stabilnih (čija jezgra se ne mijenjaju tokom dužeg vremenskog perioda), ostali su radioaktivni (čije jezgre se vremenom raspadaju).
Planetarni model strukture atoma prvi je predložio J. Perrin, pokušavajući da objasni uočena svojstva orbitalnim kretanjem elektrona. Ali V. Vin je to smatrao neodrživim. Prvo, elektron tokom rotacije, prema klasičnoj elektrodinamici, mora neprekidno zračiti energiju i na kraju pasti na jezgro. Drugo, zbog kontinuiranog gubitka energije, zračenje atoma mora imati kontinuirani spektar, a posmatra se linijski spektar.
Eksperimente o prolasku a - čestica kroz tanke ploče zlata i drugih metala izveli su zaposlenici E. Rutherforda E. Marsden i H. Geiger (1908).
Otkrili su da gotovo sve čestice slobodno prolaze kroz ploču, a samo 1/10 000 njih doživljava snažan otklon - do 150 °. Thomsonov model to nije mogao objasniti, ali Rutherford, njegov bivši pomoćnik, napravio je procjene udjela odstupanja i došao do planetarnog modela: pozitivni naboj je koncentrisan u zapremini reda 10-15. sa značajnom težinom.
Uzimajući u obzir orbite elektrona u atomu koje treba fiksirati, Thomson je 1913. također došao do planetarnog modela strukture atoma.
Ali, rješavajući problem stabilnosti takvog atoma koristeći Coulombov zakon, pronašao je stabilnu orbitu za samo jedan elektron. Ni Thomson ni Rutherford nisu mogli objasniti emisiju a - čestica tokom radioaktivnog raspada - ispostavilo se da bi i elektroni trebali biti u centru atoma ?!
O tome je govorila i M. Sklodowska-Curie. Rutherford je to prihvatio, ali je morao dodijeliti funkciju lijepljenja jezgara zajedno s elektronima kako Kulonova odbojnost ne bi razbila jezgro. Ovi modeli nisu omogućili dobijanje kvantitativnih rezultata u skladu sa eksperimentima. Godine 1913. nekim eksperimentalnim podacima o Rutherfordovom modelu data je težina. radioaktivne pojave. Njegov pomoćnik G. Moseley je mjerio frekvenciju spektralne linije broj atoma Periodnog sistema i utvrdio da je „atomu inherentna određena karakteristična vrijednost koja se redovno povećava tokom prijelaza od atoma do atoma. Ova količina ne može biti ništa drugo do naboj unutrašnjeg jezgra” [Cit. prema: 5, str. 194].
Izgradnja teorije strukture atoma na osnovu planetarnog modela naišla je na obilje kontradikcija.
U početku je danski fizičar N. Bohr pokušao primijeniti klasičnu mehaniku i elektrodinamiku na problem usporavanja nabijenih čestica pri kretanju kroz materiju, ali je za datu vrijednost energije elektrona postalo moguće pripisati proizvoljnim parametrima orbite (ili frekvencije) na njega, što je dovelo do paradoksa.
Pokazalo se da je Rutherfordov planetarni model strukture atoma nekompatibilan s Maxwellovom elektrodinamikom.
U februaru 1913. pojavili su se članci o tumačenju spektra zvijezda J. Nicholsona. On je, proširujući Planckovu ideju na atome, predložio da se kvantiziraju projekcije impulsa elektrona. Tako se pojavio atom s diskretnim orbitama, duž kojih su se rotirali grupe elektrona, emitujući elektromagnetne valove frekvencije jednake frekvenciji cirkulacije. Takav model bio je prikladan za visoko pobuđene atome, a Nicholson je objasnio neke od karakteristika u spektrima zvijezda i maglina na osnovu modela atoma - ideju o elektronskom prstenu koji rotira oko pozitivno nabijenog jezgra.
Atom je karakterizirao, prije svega, njegov emisioni spektar. On je sa spektralnim frekvencijama povezao frekvencije posebno postuliranih mehaničkih vibracija elektrona okomitih na ravan prstena.






