Kimyoviy elementlarning nisbiy atom massasi
Dars 4. Kimyoviy elementlar. Kimyoviy elementlarning belgilari. Nisbiy atom massasi.
Kimyoviy element- bir xil turdagi atomlar to'plami.
Nima uchun bir xil atomlar shunday nomlangan?"Element" so'zi (lot. elementum) antik davrda (Tsitseron, Ovid, Horace tomonidan) biror narsaning bir qismi (nutq elementi, ta'lim elementi va boshqalar) sifatida ishlatilgan. Qadimda: “So‘zlar harflardan tuzilganidek, jismlar ham elementlardan iborat” degan naql keng tarqalgan edi. Shuning uchun bu so'zning ehtimol kelib chiqishi: lotin alifbosidagi bir qator undosh harflar nomi bilan: l, m, n, t ("el" - "em" - "en" - "tum").
KIMYOVIY TILI
Insoniyat turli xil tillardan foydalanadi. Tabiiy tillardan tashqari (yapon, ingliz, rus - jami 2,5 mingdan ortiq) sun'iy tillar ham mavjud, masalan, esperanto. Sun'iy tillar orasida turli fanlar tillari ajralib turadi. Shunday qilib, kimyo o'zining kimyoviy tilidan foydalanadi. kimyoviy til- kimyoviy axborotni ixcham, ixcham va vizual qayd etish va uzatish uchun mo'ljallangan belgilar va tushunchalar tizimi. Ko'pgina tabiiy tillarda yozilgan xabar jumlalarga, jumlalar so'zlarga va so'zlar harflarga bo'linadi.
Biz siz bilan maxsus, kimyoviy tilda gaplashamiz. Unda, ona rus tilida bo'lgani kabi, biz birinchi navbatda harflarni - kimyoviy belgilarni o'rganamiz, keyin so'zlarni - ularga asoslangan formulalarni, so'ngra ikkinchisining yordami bilan - jumlalarni - kimyoviy reaktsiyalar tenglamalarini yozishni o'rganamiz:
Bolgar o'qituvchilari Kiril va Metyus slavyan yozuvi-alifbosining mualliflari. Ammo kimyoviy yozuvning otasi shved olimi J. Ya. Berzelius bo'lib, u harflar - belgilar sifatida taklif qilgan. kimyoviy elementlar ularning lotincha nomlarining bosh harflaridan foydalaning yoki agar bir nechta elementlarning nomlari shu harf bilan boshlansa, bosh harfga ismning keyingi harflaridan yana bittasini qo'shing.
Kimyoviy belgilar (kimyoviy belgilar) - kimyoviy elementlarning harf belgilari. Ular elementning lotincha nomining birinchi yoki birinchi va keyingi harflaridan biridan iborat, masalan, uglerod - C (Carboeum), kaltsiy - Ca (Kalsiy), kadmiy - Cd ...
Kimyoviy element belgisikimyoviy element belgisidir.
Tarix ma'lumotnomasi: Kimyogarlar qadimgi dunyo va o'rta asrlarda moddalar, kimyoviy operatsiyalar va qurilmalarni belgilash uchun ramziy tasvirlar, harflarning qisqartmalari, shuningdek ikkalasining kombinatsiyasi ishlatilgan. Antik davrning ettita metali ettita samoviy jismning astronomik belgilari bilan tasvirlangan: Quyosh ( ☉ , oltin), oylar (☽ , kumush), Yupiter (♃ , qalay), Venera (♀, mis), Saturn (♄ , qo'rg'oshin), Merkuriy (☿ , simob), Mars (♁, temir).
15-18-asrlarda topilgan metallar - vismut, rux, kobalt - nomlarining birinchi harflari bilan belgilangan. Vino spirtining belgisi (lot. spiritus vini) S va V harflaridan tashkil topgan. Kuchli aroq (lot. aqua fortis, nitrat kislota) va oltin aroq (lot. aqua regis, aqua regia, aralashmasi) belgilari. xlorid va nitrat kislotalar) mos ravishda suvÑ belgisi va F va R bosh harflaridan iborat. Shishaning belgisi (lat. vitrum) ikkita V harfidan hosil bo'ladi - tekis va teskari.
Qadimgi kimyoviy belgilarni tartibga solishga urinishlar 18-asr oxirigacha davom etdi. DA XIX boshi asrda ingliz kimyogari J. Dalton kimyoviy elementlarning atomlarini doiralar orqali belgilashni taklif qildi, ularning ichida nuqta, tire, metallarning inglizcha nomlarining bosh harflari va boshqalar qo'yilgan.
Daltonning kimyoviy belgilari Buyuk Britaniya va G'arbiy Evropada ma'lum darajada tarqaldi, lekin tez orada shved kimyogari J. J. Berzelius 1814 yilda taklif qilgan sof alifbo belgilari bilan almashtirildi. Kimyoviy belgilarni tuzishda u ifodalagan tamoyillar hozirgi kungacha o'z kuchini saqlab kelmoqda. Rossiyada Berzeliusning kimyoviy belgilari haqida birinchi bosma hisobot 1824 yilda Moskva shifokori I. Ya. Zatsepin tomonidan tuzilgan.
NISBIY ATOM MASSASI
Tarix ma'lumotnomasi: Ingliz olimi Jon Dalton (1766-1844) o'z ma'ruzalarida talabalarga yog'ochdan o'yilgan atomlarning modellarini ko'rsatib, ular qanday qilib birlashishi mumkinligini ko'rsatdi. turli moddalar. Talabalardan biriga atomlar nima ekanligini so'rashganda, u shunday javob berdi: "Atomlar turli rangga bo'yalgan yog'och kublar bo'lib, ularni janob Dalton ixtiro qilgan".
Albatta, Dalton o'zining "kublari" bilan emas, balki o'n ikki yoshida maktab o'qituvchisi bo'lganligi bilan ham mashhur bo'ldi. Zamonaviy atomistik nazariyaning paydo bo'lishi Dalton nomi bilan bog'liq. U fan tarixida birinchi marta atomlar massasini o'lchash imkoniyati haqida fikr yuritdi va buning uchun aniq usullarni taklif qildi. Atomlarni to'g'ridan-to'g'ri tortish mumkin emasligi aniq. Dalton faqat "gazsimon va boshqa jismlarning eng kichik zarralari og'irliklarining nisbati", ya'ni ularning nisbiy massalari haqida gapirdi. Hatto bugungi kunda ham har qanday atomning massasi aniq ma'lum bo'lsa-da, u hech qachon grammda ifodalanmaydi, chunki bu juda noqulay. Masalan, uran atomining massasi - Yerda mavjud bo'lgan eng og'ir elementlar - atigi 3,952 10 ni tashkil qiladi. –22 d) Demak, atomlarning massasi nisbiy birliklarda ifodalanib, berilgan element atomlarining massasi boshqa element atomlarining massasidan necha marta katta ekanligini ko’rsatadi, standart sifatida olinadi. Aslida, bu Daltonga ko'ra "vazn nisbati", ya'ni. qarindosh atom massasi. Atomlarning massalari juda kichik.
Ayrim atomlarning mutlaq massalari:
m(C) \u003d 1,99268 ∙ 10 -23 g
m(H) \u003d 1,67375 ∙ 10 -24 g
m(O) \u003d 2,656812 ∙ 10 -23 g
Hozirgi vaqtda fizika va kimyo fanlarida yagona o'lchov tizimi qabul qilingan. Kiritilgan atom massa birligi (a.m.u.)
m (a.m.u.) \u003d 1/12 m (12C) \u003d 1,66057 ∙ 10 -24 g.
Ar (H) = m (atom) / m (a.m.u.) = 1,67375 ∙ 10 -24 g / 1,66057 ∙ 10 -24 g = 1,0079 amu
Ar - berilgan atom 12C atomining 1/12 qismidan necha marta og'irroq ekanligini ko'rsatadi, bu o'lchovsiz miqdor.
Nisbiy atom massasi
massasi 12 a.m.u bo'lgan uglerod atomi massasining 1/12 qismidir.
Nisbiy atom massasi o'lchovsiz miqdordir!!!
Masalan, kislorod atomining nisbiy atom massasi 15,994 ga teng. Nisbiy atom massasi qiymatlarini o'zlari hisobga olish har doim ham shart emas. Siz D. I. Mendeleev tomonidan kimyoviy elementlarning davriy tizimida berilgan qiymatlardan foydalanishingiz mumkin. Bu shunday yozilishi kerak:
Ar(O) = 16 .
Biz har doim yaxlitlangan qiymatdan foydalanamiz.
Istisno xlor atomining nisbiy atom massasini ifodalaydi: Ar (Cl) = 35,5.
Atomning mutlaq va nisbiy massalari o'rtasidagi munosabat quyidagi formula bilan ifodalanadi:
Elementlarning tabiatda tarqalishi. Kosmik materiyaning asosiy massasi H va He (99,9%).
107 ta kimyoviy elementdan faqat 89 tasi tabiatda uchraydi; yadro reaksiyalari(arzimas miqdorda Te, Pm, Np, Fr uranning o'z-o'zidan bo'linishi paytida hosil bo'ladi va uran rudalarida mavjud). Erning borish mumkin bo'lgan qismida atom raqamlari 8 dan 26 gacha bo'lgan 10 ta element eng ko'p uchraydi.Ular yer qobig'ida quyidagi nisbiy miqdorlarda mavjud:
Ro'yxatda keltirilgan 10 ta element er qobig'i massasining 99,92% ni tashkil qiladi.
Element |
atom raqami |
|
47,00 |
||
29,50 |
||
8,05 |
||
4,65 |
||
Ushbu maqolada biz kimyoviy elementlarning massasini ifodalashning turli imkoniyatlarini ko'rib chiqamiz.
Atomlar bir-biridan farq qiladi: massasi, hajmi va tuzilishi.
Atomlarning massasi va o'lchamlari.
Hozirgi fan atomning massasi va hajmini aniqlash imkoniyatiga ega. Eng kichik atom He (geliy), taxminan o'lchami 0,00000000098 m. (98 * 10 -10). Eng yengil atom esa H (vodorod) atomidir va uning massasi 0,000000000000000000000000016735kg. (1,6735 * 10 −27).
Kimyoviy elementlarning aksariyat atomlari odatda geliy atomidan ancha katta.
Va eng katta atom Fr (frantsiy) atomidir va uning o'lchami taxminan 0,00000000686 m. Bu He (geliy) atomidan 7 marta katta.
Har xil kimyoviy elementlarning atomlari massasi jihatidan ham ko'proq farq qiladi, atomning massasi m a harfi bilan belgilanadi va SIda ifodalanadi.
Va massaning hajm birligi
19-asrda atom - molekulyar ta'limotlarning shakllanishi davrida. odamlar atomlarning aniq o'lchamlari va massalari haqida hali bilishmagan, shuning uchun olimlar ularning nisbiy qiymatlaridan foydalanishni boshladilar. Nisbiy qiymatlar massa nisbatlaridan hisoblab chiqilgan oddiy moddalar bir-biriga reaktsiyalarda. Olimlar kimyogarlar ular atomlarning massalariga proportsional ekanligini ta'kidladilar. Jon Dalton eng engil atom - H (vodorod) ni taqqoslash birligini qabul qildi.
Taqqoslash uchun uglerod a.e.m (atom massa birligi) massasining 1/12 qismi ishlatiladi. Xalqaro belgi - u (birlik - birlik).
Atom massa birligi- bu uglerod atomi massasining 1/12 qismi va u 1,66 10 −27 kg ga teng.
Nisbiy atom massasi haqida.
Turli elementlarning o'rtacha massalarini a.e.m (u) bilan taqqoslab, kimyoviy moddalarning nisbiy atom massalarining qiymatlarini olish mumkin. elementlar. Nisbiy atom massasi jismoniy miqdor, kimyoviy element atomining massasi uglerod atomining 1/12 qismidan necha marta katta ekanligini ko'rsatadi.
Belgilash: A r formulasi.
Dars materiallaridan siz ba'zi kimyoviy elementlarning atomlari boshqa kimyoviy elementlarning atomlaridan massa jihatidan farq qilishini bilib olasiz. O'qituvchi sizga kimyogarlar atomlarning massasini qanday o'lchaganini aytib beradi, ular juda kichik bo'lib, siz ularni elektron mikroskop bilan ham ko'ra olmaysiz.
Mavzu: Dastlabki kimyoviy g'oyalar
Dars: Kimyoviy elementlarning nisbiy atom massasi
19-asr boshlarida (Robert Boyl ishidan 150 yil keyin) ingliz olimi Jon Dalton kimyoviy elementlar atomlarining massasini aniqlash usulini taklif qildi. Keling, ushbu usulning mohiyatini ko'rib chiqaylik.
Dalton molekula bo'lgan modelni taklif qildi murakkab modda turli kimyoviy elementlarning faqat bitta atomini o'z ichiga oladi. Masalan, u suv molekulasi 1 vodorod va 1 kislorod atomidan iborat deb hisoblagan. Daltonga ko'ra oddiy moddalar tarkibiga kimyoviy elementning faqat bitta atomi ham kiradi. Bular. Kislorod molekulasi bitta kislorod atomidan iborat bo'lishi kerak.
Va keyin, moddadagi elementlarning massa ulushlarini bilib, bir element atomining massasi boshqa element atomining massasidan necha marta farq qilishini aniqlash oson. Shunday qilib, Dalton moddadagi elementning massa ulushi uning atomining massasi bilan belgilanadi, deb hisoblagan.
Ma'lumki, magniy oksididagi magniyning massa ulushi 60%, kislorodning massa ulushi esa 40% ni tashkil qiladi. Daltonning fikrlash yo'lidan kelib chiqib aytishimiz mumkinki, magniy atomining massasi kislorod atomining massasidan 1,5 marta katta (60/40 = 1,5):
Olim vodorod atomining massasi eng kichik ekanligini payqadi, chunki. vodorodning massa ulushi boshqa elementning massa ulushidan katta bo'ladigan murakkab modda yo'q. Shuning uchun u elementlar atomlarining massalarini vodorod atomining massasi bilan solishtirishni taklif qildi. Va shu tarzda u kimyoviy elementlarning nisbiy (vodorod atomiga nisbatan) atom massalarining birinchi qiymatlarini hisoblab chiqdi.
Vodorodning atom massasi birlik sifatida qabul qilindi. Va ma'nosi nisbiy massa oltingugurt 17 bo'lib chiqdi. Ammo olingan barcha qiymatlar taxminiy yoki noto'g'ri, chunki. o'sha paytdagi tajriba texnikasi mukammallikdan yiroq edi va Daltonning materiya tarkibiga o'rnatilishi noto'g'ri edi.
1807-1817 yillarda. Shvetsiyalik kimyogari Yons Yakob Berzelius elementlarning nisbiy atom massalarini aniqlashtirish uchun katta izlanishlar olib bordi. U zamonaviy natijalarga yaqin natijalarga erishdi.
Berzeliusning ishidan ancha kechroq kimyoviy elementlar atomlarining massalari uglerod atomi massasining 1/12 qismi bilan taqqoslana boshladi (2-rasm).
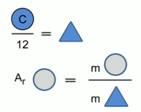
Guruch. 1. Kimyoviy elementning nisbiy atom massasini hisoblash modeli
Kimyoviy elementning nisbiy atom massasi kimyoviy element atomining massasi uglerod atomi massasining 1/12 qismidan necha marta katta ekanligini ko'rsatadi.
Nisbiy atom massasi A r bilan belgilanadi, uning o'lchov birliklari yo'q, chunki u atomlar massalarining nisbatini ko'rsatadi.
Masalan: A r (S) = 32, ya'ni. oltingugurt atomi uglerod atomi massasining 1/12 qismidan 32 marta og'irroq.
Uglerod atomining 1/12 qismining mutlaq massasi mos yozuvlar birligi bo'lib, uning qiymati yuqori aniqlik bilan hisoblanadi va 1,66 * 10 -24 g yoki 1,66 * 10 -27 kg ni tashkil qiladi. Ushbu mos yozuvlar massasi deyiladi atom massa birligi (a.u.m).
Kimyoviy elementlarning nisbiy atom massalarining qiymatlarini eslab qolish shart emas, ular kimyo bo'yicha har qanday darslik yoki ma'lumotnomada, shuningdek D.I.ning davriy jadvalida keltirilgan. Mendeleev.
Nisbiy atom massalarining qiymatlarini hisoblashda butun sonlarga yaxlitlash odatiy holdir.
Istisno xlorning nisbiy atom massasi - xlor uchun 35,5 qiymati ishlatiladi.
1. Kimyo fanidan topshiriqlar va mashqlar to'plami: 8-sinf: darslikka P.A. Orjekovskiy va boshqalar."Kimyo, 8-sinf" / P.A. Orjekovskiy, N.A. Titov, F.F. Hegel. - M.: AST: Astrel, 2006 yil.
2. Ushakova O.V. Kimyo darsligi: 8-sinf: darslikka P.A. Orjekovskiy va boshqalar «Kimyo. 8-sinf” / O.V. Ushakova, P.I. Bespalov, P.A. Orjekovskiy; ostida. ed. prof. P.A. Orjekovskiy - M .: AST: Astrel: Profizdat, 2006. (24-25-betlar)
3. Kimyo: 8-sinf: darslik. umumiy uchun muassasalar / P.A. Orjekovskiy, L.M. Meshcheryakova, L.S. Pontak. M.: AST: Astrel, 2005. (§10)
4. Kimyo: inorg. kimyo: darslik. 8 hujayra uchun. umumiy muassasalar / G.E. Rudzitis, FuGyu Feldman. - M .: Ta'lim, "Moskva darsliklari" OAJ, 2009. (§§8,9)
5. Bolalar uchun ensiklopediya. 17-jild. Kimyo / bob. V.A tomonidan tahrirlangan. Volodin, etakchi. ilmiy ed. I. Leenson. – M.: Avanta+, 2003 yil.
Qo'shimcha veb-resurslar
1. Raqamli ta'lim resurslarining yagona to'plami ().
2. "Kimyo va hayot" jurnalining elektron versiyasi ().
Uy vazifasi
24-25 b. 1-7-sonlar dan Ish kitobi kimyo fanidan: 8-sinf: darslikka P.A. Orjekovskiy va boshqalar «Kimyo. 8-sinf” / O.V. Ushakova, P.I. Bespalov, P.A. Orjekovskiy; ostida. ed. prof. P.A. Orjekovskiy - M.: AST: Astrel: Profizdat, 2006 yil.






