Nisbiy massa nima. Atom massasi formulasi
Har qanday tananing massasi bor. Keling, bir qop olma kabi tanani olaylik. Bu tananing massasi bor. Uning massasi sumkadagi har bir olma massasining yig'indisi bo'ladi. Bir qop guruch ham o'z massasiga ega bo'lib, u juda kichik va engil bo'lsa-da, barcha guruch donalarining massasini qo'shib aniqlanadi.
Barcha jismlar materiyadan iborat. Jismning massasi uning tarkibidagi moddalarning massasidan iborat. Moddalar, o'z navbatida, zarralar, molekulalar yoki atomlardan iborat, shuning uchun moddaning zarralari ham massaga ega.
§ 2. Atom massa birligi
Kislorod atomining massasi taxminan o'n olti marta katta va 2,66 ga teng∙ 10 -23 g, uglerod atomining massasi 1,99∙ 10 -23 g.Atomning massasi - deb belgilanadi.m a.
Bu holda vodorod atomining massasi 1 amu, kislorod atomining massasi 16 amu, uglerod atomining massasi 12 amu bo'ladi.
Kimyogarlar uzoq vaqt davomida har qanday elementning bitta atomi massasini (gramm, kilogramm va hokazo) o'lchashimiz uchun odatiy va qulay birliklarda qancha og'irlikda ekanligini bilishmagan.
Ayrim elementlarning atomlari boshqalardan necha marta og‘irroq ekanligini aniqlashga urinishlar bo‘ldi. Shunday qilib, olimlar bir element atomining massasini boshqa element atomining massasi bilan solishtirishga harakat qilishdi.
Ushbu muammoni hal qilish ham katta qiyinchiliklarga duch keldi va birinchi navbatda standartni tanlash bilan, ya'ni. kimyoviy element, unga nisbatan qolgan elementlarning atom massalarini solishtirish amalga oshirilishi kerak.
§3 . Nisbiy atom massasi
19-asr olimlari moddalar tarkibini aniqlash uchun eksperimental ma'lumotlar asosida bu muammoni hal qildilar. Eng yengil atom vodorod atomi standart sifatida qabul qilindi. Eksperimental ravishda kislorod atomi vodorod atomidan 16 marta og'irroq ekanligi aniqlandi, ya'ni uning nisbiy massa(vodorod atomining massasiga nisbatan) 16 ga teng.
 Bu qiymat harflar bilan belgilangan A r (indeks "r " - bosh harfdan Inglizcha so'z"nisbiy" - nisbiy). Shunday qilib, kimyoviy elementlarning nisbiy atom massalari qiymatining yozuvi quyidagicha bo'lishi kerak: vodorodning nisbiy atom massasi 1 ga, kislorodning nisbiy atom massasi 16 ga, uglerodning nisbiy atom massasi 12 ga teng.
Bu qiymat harflar bilan belgilangan A r (indeks "r " - bosh harfdan Inglizcha so'z"nisbiy" - nisbiy). Shunday qilib, kimyoviy elementlarning nisbiy atom massalari qiymatining yozuvi quyidagicha bo'lishi kerak: vodorodning nisbiy atom massasi 1 ga, kislorodning nisbiy atom massasi 16 ga, uglerodning nisbiy atom massasi 12 ga teng.
Nisbiy atom massasi bitta kimyoviy element atomining massasi standart bo'lgan atomning massasidan necha marta katta ekanligini ko'rsatadi, shuning uchun bu qiymat hech qanday o'lchamga ega emas.
Yuqorida aytib o'tilganidek, dastlab atom massalarining qiymatlari vodorod atomining massasiga nisbatan aniqlangan. Keyinchalik atom massalarini aniqlash standarti uglerod atomi massasining 1/12 qismini tashkil etdi (uglerod atomi vodorod atomidan 12 marta og'irroq).
Elementning nisbiy atom massasi ( A r ) kimyoviy element atomi massasining uglerod atomi massasining 1/12 qismiga nisbati.
Kimyoviy elementlarning atom massalarining qiymatlari kimyoviy elementlarning davriy tizimida D.I. Mendeleev. Davriy jadvalni ko'rib chiqing va uning har qanday hujayralarini, masalan, 8 raqamini ko'rib chiqing.
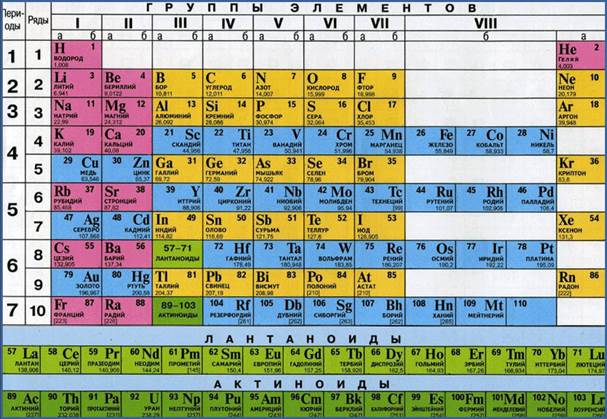
ostida kimyoviy belgi va pastki qatordagi ism qiymatni bildiradi atom massasi kimyoviy element:kislorodning nisbiy atom massasi 15,9994 ga teng. E'tibor bering: deyarli barcha kimyoviy elementlarning nisbiy atom massalari kasr qiymatiga ega. Buning sababi izotoplarning mavjudligi. Eslatib o'taman, izotoplar bir xil kimyoviy elementning atomlari deyiladi, massasi biroz farq qiladi.
Maktabda hisob-kitoblar odatda butun sonlarga yaxlitlangan nisbiy atom massalarining qiymatlaridan foydalanadi. Ammo ba'zi hollarda fraksiyonel qiymatlar qo'llaniladi, masalan: xlorning nisbiy atom massasi 35,5 ga teng.
§ 4. Nisbiy molekulyar og‘irlik
Atomlarning massalari molekula massasiga qo'shiladi.
Moddaning nisbiy molekulyar og'irligi - bu moddaning molekulasining massasi uglerod atomi massasining 1/12 qismidan necha marta katta ekanligini ko'rsatadigan raqam.
Nisbiy molekulyar og'irlik - bilan belgilanadiJanob
Moddalarning nisbiy molekulyar og'irligi moddalar tarkibini ifodalovchi kimyoviy formulalar bo'yicha hisoblanadi. Nisbiy molekulyar og'irlikni topish uchun moddaning molekulasini tashkil etuvchi elementlarning nisbiy atom massalari qiymatlarini miqdoriy tarkibi, ya'ni har bir element atomlari sonini hisobga olgan holda jamlash kerak. (in kimyoviy formulalar indekslar yordamida ifodalanadi). Masalan, formulaga ega bo'lgan suvning nisbiy molekulyar og'irligi H2O , nisbiyning ikkita qiymati yig'indisiga teng
vodorodning atom massasi va kislorodning nisbiy atom massasining bir qiymati:![]()
Formulaga ega bo'lgan sulfat kislotaning nisbiy molekulyar og'irligi H 2 SO 4 yig'indisiga teng
vodorodning nisbiy atom massasining ikkita qiymati, oltingugurtning nisbiy atom massasining bir qiymati va kislorodning nisbiy atom massasining to'rtta qiymati:![]() .
.
Nisbiy molekulyar og'irlik o'lchovsiz kattalikdir. Buni atom massa birliklarida ifodalangan molekulalarning haqiqiy massasi bilan aralashtirib yubormaslik kerak.
Adabiyot:
EMAS. Kuznetsova. Kimyo. 8-sinf. uchun o'quv qo'llanma ta'lim muassasalari. – M. Ventana-Graf, 2012 yil.
Vizual dizayn uchun foydalaniladigan manbalar:
http://www.google.ru/imgres?imgurl=http%3A%2F%2Fwww.pskgu.ru%2Febooks%2Fkimages%2Fst000_26.jpg&imgrefurl=http%3A%2F%2Fwww.pskgu.ru%2Febooks%2Fkps018. HTM & H = 333 & w = TBNID = AUSXYHOTCZUHMM% & dotsp = 0 va NDSP = 0 & NDSP = 0 & NDSP = 0
atom massasi atom yoki molekulani tashkil etuvchi barcha protonlar, neytronlar va elektronlar massalarining yig'indisidir. Protonlar va neytronlar bilan solishtirganda, elektronlarning massasi juda kichik, shuning uchun hisob-kitoblarda hisobga olinmaydi. Rasmiy nuqtai nazardan noto'g'ri bo'lsa-da, bu atama ko'pincha elementning barcha izotoplarining o'rtacha atom massasiga ishora qilish uchun ishlatiladi. Aslida, bu nisbiy atom massasi, shuningdek, deyiladi atom og'irligi element. Atom og'irligi - bu elementning barcha tabiiy izotoplarining atom massalarining o'rtacha qiymati. Kimyogarlar o'z ishlarini bajarayotganda atom massasining ushbu ikki turini farqlashlari kerak - atom massasining noto'g'ri qiymati, masalan, reaktsiya mahsulotining unumi uchun noto'g'ri natijaga olib kelishi mumkin.
Qadamlar
Elementlarning davriy tizimi bo'yicha atom massasini topish
- Atom massa birligi massani tavsiflaydi berilgan elementning bir mol grammda. Bu qiymat amaliy hisob-kitoblarda juda foydali, chunki u ma'lum miqdordagi atomlar yoki ma'lum bir moddaning molekulalarining massasini osongina molga aylantirish uchun ishlatilishi mumkin va aksincha.
-
Mendeleyev davriy sistemasidagi atom massasini toping. Ko'pchilik standart jadvallar Mendeleev har bir elementning atom massalarini (atom og'irliklarini) o'z ichiga oladi. Qoida tariqasida, ular element bilan hujayraning pastki qismida kimyoviy elementni bildiruvchi harflar ostida raqam sifatida beriladi. Bu odatda butun son emas, balki kasr.
Esda tutingki, davriy jadval elementlarning o'rtacha atom massalarini ko'rsatadi. Yuqorida ta'kidlab o'tilganidek, davriy jadvaldagi har bir element uchun berilgan nisbiy atom massalari atomning barcha izotoplari massalarining o'rtacha ko'rsatkichlari hisoblanadi. Bu o'rtacha qiymat ko'plab amaliy maqsadlar uchun qimmatlidir: masalan, u bir nechta atomlardan tashkil topgan molekulalarning molyar massasini hisoblashda qo'llaniladi. Biroq, siz alohida atomlar bilan ishlayotganingizda, bu qiymat odatda etarli emas.
- O'rtacha atom massasi bir nechta izotoplar uchun o'rtacha qiymat bo'lganligi sababli, davriy jadvalda ko'rsatilgan qiymat emas. aniq har qanday bitta atomning atom massasining qiymati.
- Alohida atomlarning atom massalari bitta atomdagi proton va neytronlarning aniq sonini hisobga olgan holda hisoblanishi kerak.
Atom massasi qanday yozilishini bilib oling. Atom massasi, ya'ni berilgan atom yoki molekulaning massasi standart SI birliklarida - gramm, kilogramm va hokazolarda ifodalanishi mumkin. Biroq, bu birliklarda ifodalangan atom massalari juda kichik bo'lgani uchun ular ko'pincha birlashtirilgan atom massa birliklarida yoki qisqacha a.m.u bilan yoziladi. atom massa birliklari. Bir atom massa birligi standart uglerod-12 izotopining 1/12 massasiga teng.
Alohida atomning atom massasini hisoblash
-
Berilgan element yoki uning izotopining atom raqamini toping. Atom raqami - bu element atomlaridagi protonlar soni va hech qachon o'zgarmaydi. Masalan, barcha vodorod atomlari va faqat ularda bitta proton bor. Natriyning atom raqami 11 ga teng, chunki u o'n bir protonga ega, kislorod esa sakkizta protonga ega bo'lgani uchun atom raqami sakkizga teng. Mendeleevning davriy tizimida har qanday elementning atom raqamini topishingiz mumkin - uning deyarli barcha standart versiyalarida bu raqam kimyoviy elementning harf belgisi ustida ko'rsatilgan. Atom raqami har doim musbat butun sondir.
- Aytaylik, bizni uglerod atomi qiziqtiradi. Uglerod atomlarida har doim oltita proton bor, shuning uchun biz uning atom raqami 6 ekanligini bilamiz. Bundan tashqari, biz davriy jadvalda uglerodli hujayraning yuqori qismida (C) "6" raqami borligini ko'ramiz. atom uglerod soni oltita.
- E'tibor bering, elementning atom raqami davriy jadvaldagi nisbiy atom massasi bilan yagona bog'liq emas. Garchi, ayniqsa, jadvalning yuqori qismidagi elementlar uchun elementning atom massasi uning atom raqamidan ikki baravar ko'p ko'rinishi mumkin bo'lsa-da, u hech qachon atom raqamini ikkiga ko'paytirish orqali hisoblanmaydi.
-
Yadrodagi neytronlar sonini toping. Neytronlar soni bir elementning turli atomlari uchun har xil bo'lishi mumkin. Agar protonlar soni bir xil bo'lgan bir xil elementning ikkita atomida neytronlar soni har xil bo'lsa, ular ushbu elementning turli izotoplaridir. Hech qachon o'zgarmaydigan protonlar sonidan farqli o'laroq, ma'lum bir element atomlaridagi neytronlar soni ko'pincha o'zgarishi mumkin, shuning uchun elementning o'rtacha atom massasi ikkita qo'shni butun sonlar orasidagi o'nli kasr sifatida yoziladi.
Proton va neytronlar sonini qo'shing. Bu atomning atom massasi bo'ladi. Yadroni o'rab turgan elektronlar soniga e'tibor bermang - ularning umumiy massasi juda kichik, shuning uchun ular sizning hisob-kitoblaringizga deyarli ta'sir qilmaydi.
Elementning nisbiy atom massasini (atom og'irligini) hisoblash
-
Namunada qaysi izotoplar borligini aniqlang. Kimyogarlar ko'pincha ma'lum bir namunadagi izotoplar nisbatini massa spektrometri deb ataladigan maxsus asbob yordamida aniqlaydilar. Biroq, trening davomida ushbu ma'lumotlar sizga topshiriqlar, nazorat va boshqalar sharoitida ilmiy adabiyotlardan olingan qiymatlar shaklida taqdim etiladi.
- Bizning holatimizda, aytaylik, biz ikkita izotop bilan ishlaymiz: uglerod-12 va uglerod-13.
-
Namunadagi har bir izotopning nisbiy ko'pligini aniqlang. Har bir element uchun har xil izotoplar turli nisbatlarda uchraydi. Bu nisbatlar deyarli har doim foiz sifatida ifodalanadi. Ba'zi izotoplar juda keng tarqalgan, boshqalari esa juda kam uchraydi - ba'zida juda kam uchraydi, shuning uchun ularni aniqlash qiyin. Ushbu qiymatlarni massa spektrometriyasi yordamida aniqlash yoki ma'lumotnomada topish mumkin.
- Faraz qilaylik, uglerod-12 konsentratsiyasi 99%, uglerod-13 esa 1%. Uglerodning boshqa izotoplari haqiqatan ham mavjud, lekin juda kichik miqdorda, bu holda ularni e'tiborsiz qoldirish mumkin.
-
Har bir izotopning atom massasini uning namunadagi konsentratsiyasiga ko'paytiring. Har bir izotopning atom massasini uning foiziga ko'paytiring (o'nlik kasr bilan ifodalanadi). Foizlarni ga aylantirish uchun kasr, ularni 100 ga bo'lish kifoya. Olingan konsentratsiyalar har doim 1 ga qo'shilishi kerak.
- Bizning namunamiz tarkibida uglerod-12 va uglerod-13 mavjud. Agar uglerod-12 namunaning 99% va uglerod-13 1% bo'lsa, u holda 12 (uglerod-12 ning atom massasi) ni 0,99 ga va 13 ni (uglerod-13 ning atom massasi) 0,01 ga ko'paytiring.
- Ma'lumotnomalar elementning barcha izotoplarining ma'lum miqdoriga asoslangan foizlarni beradi. Ko'pgina kimyo darsliklarida bu ma'lumot kitob oxiridagi jadvalga kiritilgan. O'rganilayotgan namuna uchun izotoplarning nisbiy konsentratsiyasini massa spektrometri yordamida ham aniqlash mumkin.
-
Natijalarni qo'shing. Oldingi bosqichda olingan ko'paytirish natijalarini jamlang. Ushbu operatsiya natijasida siz elementingizning nisbiy atom massasini topasiz - bu element izotoplarining atom massalarining o'rtacha qiymati. Agar element berilgan elementning o'ziga xos izotopi emas, balki butun sifatida ko'rib chiqilsa, aynan shu qiymatdan foydalaniladi.
- Bizning misolimizda uglerod-12 uchun 12 x 0,99 = 11,88, uglerod-13 uchun 13 x 0,01 = 0,13. Bizning holatimizda nisbiy atom massasi 11,88 + 0,13 = 12,01 .
- Ba'zi izotoplar boshqalarga qaraganda kamroq barqarordir: ular yadroda proton va neytronlari kamroq bo'lgan elementlarning atomlariga aylanadi va zarrachalarni chiqaradi. atom yadrosi. Bunday izotoplar radioaktiv deyiladi.
Atomlar va molekulalarning massalari juda kichik, shuning uchun o'lchov birligi sifatida atomlardan birining massasini tanlash va unga nisbatan qolgan atomlarning massalarini ifodalash qulay. Atom nazariyasi asoschisi Dalton aynan shunday qildi, u vodorod atomining massasini birlik sifatida qabul qilib, atom massalari jadvalini tuzdi.
1961 yilgacha fizikada 16 O kislorod atomi massasining 1/16 qismi atom massa birligi (qisqartirilgan amu) sifatida, kimyoda esa aralashma bo'lgan tabiiy kislorodning o'rtacha atom massasining 1/16 qismi olingan. uchta izotopdan iborat. Kimyoviy massa birligi jismoniydan 0,03% katta edi.
Hozirgi vaqtda fizika va kimyo fanlarida yagona o'lchov tizimi qabul qilingan. Atom massasining standart birligi sifatida 12 C uglerod atomi massasining 1/12 qismi tanlangan.
1 am \u003d 1/12 m (12 C) \u003d 1,66057 × 10 -27 kg \u003d 1,66057 × 10 -24 g.
TA'RIF
Elementning nisbiy atom massasi (A r)- bu element atomining o'rtacha massasining atom massasining 1/12 qismiga nisbati 12 C ga teng bo'lgan o'lchovsiz miqdor.
Nisbiy atom massasini hisoblashda er qobig'idagi elementlarning izotoplarining ko'pligi hisobga olinadi. Masalan, xlorning ikkita izotopi 35 Cl (75,5%) va 37 Cl (24,5%).Xlorning nisbiy atom massasi:
A r (Cl) \u003d (0,755 × m (35 Cl) + 0,245 × m (37 Cl)) / (1/12 × m (12 C) = 35,5.
Nisbiy atom massasining ta'rifidan kelib chiqadiki, atomning o'rtacha mutlaq massasi nisbiy atom massasining amuga teng:
m (Cl) = 35,5 × 1,66057 × 10 -24 = 5,89 × 10 -23 g.
Muammoni hal qilishga misollar
MISOL 1
| Mashq qilish | Quyidagi moddalarning qaysi birida kislorod elementining massa ulushi kattaroq: a) rux oksidida (ZnO); b) magniy oksidida (MgO)? |
| Yechim |
Rux oksidining molekulyar og'irligini toping: Mr(ZnO) = Ar(Zn) + Ar(O); Mr(ZnO)=65+16=81. Ma'lumki, M = Mr, bu M(ZnO) = 81 g / mol degan ma'noni anglatadi. Keyin rux oksididagi kislorodning massa ulushi quyidagilarga teng bo'ladi: ō (O) = Ar (O) / M (ZnO) × 100%; ō(O) = 16 / 81 × 100% = 19,75%. Magniy oksidining molekulyar og'irligini toping: Mr(MgO) = Ar(Mg) + Ar(O); Janob (MgO) = 24+ 16 = 40. Ma'lumki, M = Mr, bu M(MgO) = 60 g / mol degan ma'noni anglatadi. Keyin magniy oksididagi kislorodning massa ulushi quyidagilarga teng bo'ladi: ō (O) = Ar (O) / M (MgO) × 100%; ō (O) = 16 / 40 × 100% = 40%. Shunday qilib, kislorodning massa ulushi magniy oksidida kattaroqdir, chunki 40 > 19,75. |
| Javob | Kislorodning massa ulushi magniy oksidida kattaroqdir. |
2-MISA
| Mashq qilish | Quyidagi birikmalarning qaysi birida metallning massa ulushi kattaroq: a) alyuminiy oksidida (Al 2 O 3); b) temir oksidida (Fe 2 O 3)? |
| Yechim | HX tarkibi molekulasidagi X elementning massa ulushi quyidagi formula bilan hisoblanadi: ō (X) = n × Ar (X) / M (HX) × 100%. Tavsiya etilgan birikmalarning har birida kislorodning har bir elementining massa ulushini hisoblaylik (D.I.Mendeleyevning davriy sistemasidan olingan nisbiy atom massalarining qiymatlari butun sonlarga yaxlitlanadi). Alyuminiy oksidning molekulyar og'irligini toping: Janob (Al 2 O 3) = 2 × Ar (Al) + 3 × Ar (O); Janob (Al 2 O 3) \u003d 2 × 27 + 3 × 16 \u003d 54 + 48 \u003d 102. Ma'lumki, M \u003d Mr, bu M (Al 2 O 3) \u003d 102 g / mol degan ma'noni anglatadi. Keyin oksiddagi alyuminiyning massa ulushi quyidagilarga teng bo'ladi: ō (Al) \u003d 2 × Ar (Al) / M (Al 2 O 3) × 100%; ō (Al) \u003d 2 × 27 / 102 × 100% \u003d 54/102 × 100% \u003d 52,94%. Temir oksidi (III) ning molekulyar og'irligini toping: Mr (Fe 2 O 3) = 2 × Ar (Fe) + 3 × Ar (O); Janob (Fe 2 O 3) \u003d 2 × 56 + 3 × 16 \u003d 112 + 48 \u003d 160. Ma'lumki, M \u003d Mr, bu M (Fe 2 O 3) \u003d 160 g / mol degan ma'noni anglatadi. Keyin oksiddagi temirning massa ulushi quyidagilarga teng bo'ladi: ō (O) \u003d 3 × Ar (O) / M (Fe 2 O 3) × 100%; ō (O) = 3 × 16 / 160 × 100% = 48 / 160 × 100% = 30%. Shunday qilib, metallning massa ulushi alyuminiy oksidida kattaroqdir, chunki 52,94>30. |
| Javob | Metallning massa ulushi alyuminiy oksidida kattaroqdir. |






