Molekulska formula h2so4. Strukturna kemijska formula sumporne kiseline. Međudjelovanje s nemetalima
Nerazrijeđena sumporna kiselina je kovalentan spoj.
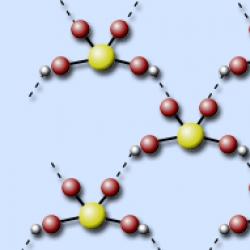
Sumporna kiselina je u molekuli tetraedarski okružena s četiri atoma kisika, od kojih su dva dio hidroksilnih skupina. S–O veze su dvostruke, a S–OH jednostruke.
Bezbojni kristali poput leda imaju slojevitu strukturu: svaka molekula H 2 SO 4 povezana je s četiri susjedne jake vodikove veze, tvoreći jedinstveni prostorni okvir.

Struktura tekuće sumporne kiseline slična je strukturi čvrste, samo je narušena cjelovitost prostornog okvira.
Fizikalna svojstva sumporne kiseline
U normalnim uvjetima, sumporna kiselina je teška, uljasta tekućina bez boje i mirisa. U tehnologiji, sumporna kiselina je smjesa vode i sumpornog anhidrida. Ako je molarni omjer SO 3 : H 2 O manji od 1, tada se radi o vodenoj otopini sumporne kiseline, ako je veći od 1, to je otopina SO 3 u sumpornoj kiselini.
100% H 2 SO 4 kristalizira na 10,45 ° C; T kip = 296,2 °C; gustoća 1,98 g/cm3. H 2 SO 4 se miješa s H 2 O i SO 3 u bilo kojem omjeru i stvara hidrate; toplina hidratacije je toliko visoka da smjesa može prokuhati, prskati i izazvati opekline. Dakle, potrebno je dodati kiselinu u vodu, a ne obrnuto, jer kada se doda voda u kiselinu, lakša voda će završiti na površini kiseline, gdje će se koncentrirati sva stvorena toplina.
Kada se vodene otopine sumporne kiseline koje sadrže do 70% H 2 SO 4 zagrijavaju i kuhaju, u parnu fazu oslobađa se samo vodena para. Para sumporne kiseline također se pojavljuje iznad koncentriranijih otopina.
U smislu strukturnih značajki i anomalija, tekuća sumporna kiselina slična je vodi. Isti je sustav vodikovih veza, gotovo isti prostorni okvir.
Kemijska svojstva sumporne kiseline
Sumporna kiselina jedna je od najjačih mineralnih kiselina; zbog svoje visoke polarnosti H–O veza se lako kida.
Sumporna kiselina disocira u vodenoj otopini tvoreći vodikov ion i kiseli ostatak:
H2SO4 = H++ HSO4-;
HSO 4 - = H + + SO 4 2- .
Sažeta jednadžba:
H2SO4 = 2H + + SO4 2-.
Pokazuje svojstva kiselina , reagira s metalima, metalnim oksidima, bazama i solima.
Razrijeđena sumporna kiselina ne pokazuje oksidirajuća svojstva; kada stupa u interakciju s metalima, oslobađa se vodik i sol koja sadrži metal u najnižem oksidacijskom stanju. Na hladnoći, kiselina je inertna prema metalima kao što su željezo, aluminij, pa čak i barij.
Koncentrirana kiselina ima oksidacijska svojstva. Mogući produkti međudjelovanja jednostavnih tvari s koncentriranom sumpornom kiselinom navedeni su u tablici. Prikazana je ovisnost produkta redukcije o koncentraciji kiseline i stupnju aktivnosti metala: što je metal aktivniji, to dublje reducira sulfatni ion sumporne kiseline.

Interakcija s oksidima:
CaO + H 2 SO 4 = CaSO 4 = H 2 O.
Interakcija s bazama:
2NaOH + H2SO4 = Na2SO4 + 2H2O.
Interakcija sa solima:
Na 2 CO 3 + H 2 SO 4 = Na 2 SO 4 + CO 2 + H 2 O.
Oksidativna svojstva
Sumporna kiselina oksidira HI i HBr do slobodnih halogena:
H 2 SO 4 + 2HI = I 2 + 2H 2 O + SO 2.
Sumporna kiselina uklanja kemijski vezanu vodu iz organskih spojeva koji sadrže hidroksilne skupine. Dehidracijom etilnog alkohola u prisutnosti koncentrirane sumporne kiseline nastaje etilen:
C2H5OH = C2H4 + H20.
Pougljenje šećera, celuloze, škroba i drugih ugljikohidrata u kontaktu sa sumpornom kiselinom također se objašnjava njihovom dehidracijom:
C6H12O6 + 12H2SO4 = 18H2O + 12SO2 + 6CO2.
Kiseline su kemijski spojevi koji se sastoje od atoma vodika i kiselinskih ostataka, na primjer, SO4, SO3, PO4 itd. One su anorganske i organske. Prvi uključuju klorovodičnu, fosfornu, sulfidnu, dušičnu i sumpornu kiselinu. Drugi uključuju octenu kiselinu, palmitinsku kiselinu, mravlju kiselinu, stearinsku kiselinu itd.
Što je sumporna kiselina
Ova kiselina sastoji se od dva atoma vodika i kiselinskog ostatka SO4. Ima formulu H2SO4.
Sumporna kiselina ili, kako se još naziva, sulfatna kiselina, odnosi se na anorganske dibazične kiseline koje sadrže kisik. Ova tvar se smatra jednom od najagresivnijih i kemijski aktivnih. U većini kemijskih reakcija djeluje kao oksidacijsko sredstvo. Ova kiselina se može koristiti u koncentriranom ili razrijeđenom obliku, u kojem slučaju ima malo drugačija kemijska svojstva.
Fizička svojstva
Sumporna kiselina u normalnim je uvjetima tekuća, vrelište joj je približno 279,6 stupnjeva Celzijusa, ledište kada se pretvara u čvrste kristale je oko -10 stupnjeva za sto posto i oko -20 za 95 posto.

Čista stopostotna sulfatna kiselina je uljasta tekuća tvar bez mirisa, boje i gotovo dvostruko veće gustoće od vode - 1840 kg/m3.
Kemijska svojstva sulfatne kiseline
Sumporna kiselina reagira s metalima, njihovim oksidima, hidroksidima i solima. Razrijeđen vodom u različitim omjerima, može se ponašati drugačije, pa pogledajmo pobliže svojstva koncentrirane i slabe otopine sumporne kiseline zasebno.
Koncentrirana otopina sumporne kiseline
Otopina koja sadrži najmanje 90 posto sulfatne kiseline smatra se koncentriranom. Takva otopina sumporne kiseline sposobna je reagirati čak i s nisko aktivnim metalima, kao i s nemetalima, hidroksidima, oksidima i solima. Svojstva takve otopine sulfatne kiseline slična su onima koncentrirane nitratne kiseline.

Interakcija s metalima
Tijekom kemijske reakcije koncentrirane otopine sulfatne kiseline s metalima koji se nalaze desno od vodika u nizu elektrokemijskih napona metala (dakle, s onima koji nisu najaktivniji), nastaju sljedeće tvari: sulfat metala s kojim dolazi do interakcije vode i sumpornog dioksida. Metali, kao rezultat interakcije s kojima nastaju navedene tvari, uključuju bakar (cuprum), živu, bizmut, srebro (argentum), platinu i zlato (aurum).

Interakcija s neaktivnim metalima
S metalima koji su lijevo od vodika u naponskom nizu, koncentrirana sumporna kiselina ponaša se nešto drugačije. Kao rezultat ove kemijske reakcije nastaju sljedeće tvari: sulfat određenog metala, sumporovodik ili čisti sumpor i voda. U metale s kojima dolazi do slične reakcije također spadaju željezo (ferum), magnezij, mangan, berilij, litij, barij, kalcij i svi ostali koji su u naponskom nizu lijevo od vodika, osim aluminija, kroma, nikla i titana - s njima koncentrirana sulfatna kiselina ne stupa u interakciju.
Međudjelovanje s nemetalima
Ova tvar je jako oksidacijsko sredstvo, tako da je sposobna sudjelovati u redoks kemijskim reakcijama s nemetalima, kao što su, na primjer, ugljik (ugljik) i sumpor. Kao rezultat takvih reakcija, voda se nužno oslobađa. Kada se ova tvar doda ugljiku, također se oslobađaju ugljični dioksid i sumporov dioksid. A ako sumporu dodate kiselinu, dobit ćete samo sumporni dioksid i vodu. U takvoj kemijskoj reakciji sulfatna kiselina ima ulogu oksidacijskog sredstva.
Interakcija s organskim tvarima
Među reakcijama sumporne kiseline s organskim tvarima može se razlikovati pougljenje. Ovaj proces se događa kada se ova tvar sudari s papirom, šećerom, vlaknima, drvom itd. U ovom slučaju, ugljik se oslobađa u svakom slučaju. Ugljik nastao tijekom reakcije može djelomično reagirati sa sumpornom kiselinom ako je u suvišku. Na fotografiji je prikazana reakcija šećera s otopinom sulfatne kiseline srednje koncentracije.

Reakcije sa solima
Također, koncentrirana otopina H2SO4 reagira sa suhim solima. U tom slučaju dolazi do standardne reakcije izmjene, u kojoj nastaje metalni sulfat koji je bio prisutan u strukturi soli i kiselina s ostatkom koji je bio u soli. Međutim, koncentrirana sumporna kiselina ne reagira s otopinama soli.
Interakcija s drugim tvarima
Također, ova tvar može reagirati s metalnim oksidima i njihovim hidroksidima, u tim slučajevima dolazi do reakcija izmjene, u prvom se oslobađa metalni sulfat i voda, u drugom - isto.
Kemijska svojstva slabe otopine sulfatne kiseline
Razrijeđena sumporna kiselina reagira s mnogim tvarima i ima ista svojstva kao sve kiseline. On, za razliku od koncentriranog metala, stupa u interakciju samo s aktivnim metalima, odnosno onima koji su u nizu napona lijevo od vodika. U tom slučaju dolazi do iste reakcije supstitucije kao i kod bilo koje kiseline. Ovo oslobađa vodik. Također, takva kisela otopina stupa u interakciju s otopinama soli, što rezultira reakcijom izmjene, o kojoj je već bilo riječi, s oksidima - isto kao i koncentrirana, i s hidroksidima - također isto. Osim običnih sulfata, postoje i hidrosulfati, koji su produkt međudjelovanja hidroksida i sumporne kiseline.

Kako prepoznati sadrži li otopina sumpornu kiselinu ili sulfate
Da bi se utvrdilo jesu li te tvari prisutne u otopini, koristi se posebna kvalitativna reakcija na sulfatne ione, što omogućuje otkrivanje. Sastoji se od dodavanja barija ili njegovih spojeva u otopinu. To može rezultirati bijelim talogom (barijev sulfat), što ukazuje na prisutnost sulfata ili sumporne kiseline.
Kako se proizvodi sumporna kiselina?
Najčešća metoda industrijske proizvodnje ove tvari je njezina ekstrakcija iz željeznog pirita. Ovaj se proces odvija u tri faze, od kojih svaka uključuje određenu kemijsku reakciju. Pogledajmo ih. Najprije se piritu dodaje kisik, što rezultira stvaranjem ferum oksida i sumpor dioksida, koji se koristi za daljnje reakcije. Ova interakcija se događa na visokoj temperaturi. Slijedi faza u kojoj se sumporni trioksid dobiva dodavanjem kisika u prisutnosti katalizatora, a to je vanadijev oksid. Sada, u posljednjoj fazi, dobivenoj tvari se dodaje voda i dobiva se sulfatna kiselina. Ovo je najčešći postupak za industrijsku ekstrakciju sulfatne kiseline, najčešće se koristi jer je pirit najpristupačnija sirovina pogodna za sintezu tvari opisane u ovom članku. Sumporna kiselina dobivena ovim postupkom koristi se u raznim područjima industrije - kako u kemijskoj, tako iu mnogim drugim, na primjer, u rafiniranju nafte, preradi ruda itd. Njezina je uporaba također često predviđena u tehnologiji proizvodnje mnogih sintetičkih vlakana .
Cilj: Upoznati strukturu, fizikalna i kemijska svojstva te primjenu sumporne kiseline.
Obrazovni ciljevi: Razmotriti fizikalna i kemijska svojstva (zajednička s drugim kiselinama i specifična) sumporne kiseline, pripravak, pokazati veliku važnost sumporne kiseline i njezinih soli u nacionalnom gospodarstvu.
Odgojni zadaci: Nastaviti kod učenika razvijati dijalektičko-materijalističko shvaćanje prirode.
Razvojni zadaci: Razvoj općih obrazovnih vještina i sposobnosti, rad s udžbenikom i dodatnom literaturom, pravila za rad na radnoj površini, sposobnost sistematiziranja i generaliziranja, uspostavljanje uzročno-posljedičnih veza, izražavanje vlastitih misli uvjerljivo i kompetentno, izvođenje zaključaka, sastavljanje dijagrami, skica.
Tijekom nastave
1. Ponavljanje obrađenog.
Frontalna razredna anketa. Usporedite svojstva kristalnog i plastičnog sumpora. Objasnite bit alotropije.
2. Učenje novog gradiva.
Nakon pažljivog slušanja priče, na kraju lekcije ćemo objasniti zašto se sumporna kiselina čudno ponašala s vodom, drvetom i zlatnim prstenom.
Reproducira se audio zapis.
Avanture sumporne kiseline.
U jednom kemijskom kraljevstvu živjela je čarobnica, zvala se Sumporne kiseline. Na izgledu nije bilo tako loše: bezbojna tekućina, viskozna poput ulja, bez mirisa. Sumporne kiselineŽelio sam biti slavan, pa sam otišao na put.
Hodala je 5 sati, a kako je dan bio prevruć, bila je jako žedna. I odjednom je ugledala bunar. "Voda!" - uzvikne kiselina i dotrčavši do bunara dotakne vodu. Voda je strahovito šištala. Preplašena čarobnica je uz vrisak odjurila. Naravno, mlada kiselina to nije znala miješana sumporne kiseline S vodom se oslobađa velika količina topline.
„Ako voda dođe u dodir s sumporne kiseline, tada voda, nemajući vremena za miješanje s kiselinom, može kuhati i izbaciti prskanje sumporne kiseline. Ovaj zapis pojavio se u dnevniku mladog putnika, a zatim je ušao u udžbenike.
Budući da joj kiselina nije utažila žeđ, raširena stabla odlučila je leći i odmoriti se u hladu. Ali ni u tome nije uspjela. Što prije Sumporne kiseline Dotaknuo sam drvo, počelo je ugljenisati. Ne znajući razlog tome, prestrašena kiselina je pobjegla.
Ubrzo je došla u grad i odlučila otići do prve trgovine na koju je naišla na putu. Ispostavilo se da je to zlatarna. Prilazeći vitrinama, kiselina je vidjela mnogo lijepih prstenova. Sumporne kiseline Odlučila sam isprobati jedan prsten. Zatraživši od prodavača zlatni prsten, putnik ga je stavio na svoj dugi, lijepi prst. Čarobnici se jako svidio prsten i odlučila ga je kupiti. Ovime bi se mogla pohvaliti svojim prijateljima!
Nakon izlaska iz grada, kiselina je otišla kući. Putem ju je progonila misao zašto su se voda i drvo tako čudno ponašali kad su je dodirnuli, a ovoj zlatnoj stvari ništa se nije dogodilo? “Da, jer je zlato in sumporne kiseline ne oksidira." Bile su to posljednje riječi koje je kiselinom napisao u svoj dnevnik.
Objašnjenja nastavnika.
Elektroničke i strukturne formule sumporne kiseline.
Budući da je sumpor u 3. periodi periodnog sustava, ne poštuje se pravilo okteta (struktura od osam elektrona) i atom sumpora može dobiti do dvanaest elektrona. Elektronske i strukturne formule sumporne kiseline su sljedeće:
(Sumporovih šest elektrona označeno je zvjezdicom)
Priznanica.
Sumporna kiselina nastaje međudjelovanjem sumporovog oksida (5) s vodom (SO 3 + H 2 O -> H 2 SO 4).
Fizička svojstva.
Sumporna kiselina je bezbojna, teška, nehlapljiva tekućina. Kada se otopi u vodi, dolazi do vrlo jakog zagrijavanja. Zapamti to Nemojte ulijevati vodu u koncentriranu sumpornu kiselinu!
Koncentrirana sumporna kiselina apsorbira vodenu paru iz zraka. To se može provjeriti ako se otvorena posuda s koncentriranom sumpornom kiselinom uravnoteži na vagi: nakon nekog vremena čašica s posudom će pasti.
Kemijska svojstva.
Razrijeđena sumporna kiselina ima zajednička svojstva karakteristična za sve kiseline. Osim toga, sumporna kiselina ima specifična svojstva.
Kemijska svojstva sumpora - Primjena .
Učiteljska demonstracija zabavnog iskustva.
Kratak sigurnosni brifing.
Popsicle (ugljen iz šećera)
| Oprema | Plan iskustva | Zaključak |
|
U čašu uspite 30 g šećera u prahu. Čašom izmjerite 12 ml koncentrirane sumporne kiseline. U čaši sa staklenim štapićem (izvadite stakleni štapić i stavite u čašu s vodom) pomiješajte šećer i kiselinu u kašastu masu. Nakon nekog vremena smjesa potamni, zagrije se i ubrzo iz stakla počinje puzati porozna ugljena masa - sladoled na štapiću | Pougljenje šećera sumpornom kiselinom (koncentriranom) objašnjava se oksidacijskim svojstvima te kiseline. Reducirajuće sredstvo je ugljik. Proces je egzoterman. 2H 2 SO 4 +C 12 O 11 + H22 -> 11C + 2SO 2 +13H 2 O + CO 2 |
Učenici ispunjavaju tablicu zabavnim doživljajima u svojim bilježnicama.
Obrazloženje učenika o tome zašto se sumporna kiselina tako čudno ponaša s vodom, drvom i zlatom.
Primjena.
Zbog svojih svojstava (sposobnost apsorpcije vode, oksidacijska svojstva, nehlapljivost), sumporna kiselina se široko koristi u nacionalnom gospodarstvu. Spada u glavne proizvode kemijske industrije.

- dobivanje boja;
- dobivanje mineralnih gnojiva;
- pročišćavanje naftnih derivata;
- elektrolitička proizvodnja bakra;
- elektrolit u baterijama;
- dobivanje eksploziva;
- dobivanje boja;
- dobivanje umjetne svile;
- dobivanje glukoze;
- dobivanje soli;
- proizvodnja kiselina.
Soli sumporne kiseline široko se koriste, na primjer
Na2SO4 * 10H20– natrijev sulfat kristalni hidrat (Glauberova sol)- koristi se u proizvodnji sode, stakla, lijekova i veterine.
CaSO4 x 2H20– kristalni hidrat kalcijevog sulfata (prirodni gips)- koristi se za dobivanje poluvodenog gipsa, potrebnog u građevinarstvu, au medicini - za nanošenje gipsanih zavoja.
CuSO4*5H20– kristalni hidrat bakrenog sulfata (2) (bakreni sulfat)- koristi se u borbi protiv štetočina i biljnih bolesti.
Rad učenika s izvantekstualnim dijelom udžbenika.
Ovo je zanimljivo
...u zaljevu Kara-Bogaz-Gol voda sadrži 30% Glauberove soli na temperaturi od +5°C, ova sol ispada u obliku bijelog taloga, poput snijega, a s početkom toplijeg vremena , sol se ponovno otapa. Budući da se u ovoj uvali pojavljuje i nestaje Glauberova sol, nazvana je mirabilit, što znači "nevjerojatna sol".
3. Pitanja za učvršćivanje obrazovnog materijala, napisana na ploči.
- Zimi se između prozorskih okvira ponekad stavlja posuda s koncentriranom sumpornom kiselinom. U koju svrhu se to radi, zašto se posuda ne može do vrha napuniti kiselinom?
- Zašto se sumporna kiselina naziva "kruhom" kemije?
Domaća zadaća i upute kako je izraditi.

Gdje je potrebno, napišite jednadžbe u ionskom obliku.
Zaključak lekcije, ocjenjivanje i komentiranje.
Reference.
- Rudzitis G.E. Feldman F.G., Kemija: Udžbenik za razrede 7-11 večernje (smjene) srednje škole u 2 sata. Dio 1-3 izdanje - M.: Prosveshchenie, 1987.
- Kemija u školi br.6, 1991.
- Strempler Genrikh Ivanovič, Kemija u slobodno vrijeme: knjiga. za srednjoškolce i stara dob /sl. auto uz sudjelovanje V.N. Rastopchiny.- F.: Ch. izd. KSE, 1990. (monografija).
Strukturna formula
Istinita, empirijska ili bruto formula: H2SO4
Kemijski sastav sumporne kiseline
Molekulska težina: 98,076
Sumporne kiseline H 2 SO 4 je jaka dvobazna kiselina koja odgovara najvišem oksidacijskom stupnju sumpora (+6). U normalnim uvjetima, koncentrirana sumporna kiselina je teška, uljasta tekućina, bez boje i mirisa, s kiselim "bakrenim" okusom. U tehnici se sumpornom kiselinom naziva njezina smjesa s vodom i sumpornim anhidridom SO 3. Ako je molarni omjer SO 3 : H 2 O manji od 1, tada se radi o vodenoj otopini sumporne kiseline, ako je veći od 1, to je otopina SO 3 u sumpornoj kiselini (oleum).
Ime
U 18.-19. stoljeću sumpor za barut proizvodio se iz sumpornog pirita (pirita) u tvornicama vitriola. Sumporna kiselina u to se vrijeme nazivala "ulje vitriola" (u pravilu je to bio kristalni hidrat, konzistencije koja je podsjećala na ulje), očito otuda i naziv njenih soli (ili bolje rečeno kristalnih hidrata) - vitriol .
Priprema sumporne kiseline
Industrijska (kontaktna) metoda
U industriji se sumporna kiselina proizvodi oksidacijom sumpornog dioksida (plina sumpornog dioksida koji nastaje izgaranjem sumpora ili sumpornih pirita) u trioksid (sumporni anhidrid), nakon čega slijedi reakcija SO 3 s vodom. Sumporna kiselina dobivena ovom metodom naziva se i kontaktna kiselina (koncentracija 92-94%).
Metoda nitroze (toranj).
Ranije se sumporna kiselina proizvodila isključivo dušikovom metodom u posebnim tornjevima, a kiselina se nazivala toranjska kiselina (koncentracija 75%). Suština ove metode je oksidacija sumporovog dioksida dušikovim dioksidom u prisutnosti vode.
Drugi način
U onim rijetkim slučajevima kada sumporovodik (H 2 S) istiskuje sulfat (SO 4 -) iz soli (s metalima Cu, Ag, Pb, Hg), nusprodukt je sumporna kiselina. Sulfidi ovih metala imaju najveću čvrstoću, kao i prepoznatljivu crnu boju.
Fizikalna i fizikalno-kemijska svojstva
Vrlo jaka kiselina, pri 18 o C pK a (1) = −2,8, pK a (2) = 1,92 (K z 1,2 10 -2); duljine veza u molekuli S=O 0,143 nm, S-OH 0,154 nm, kut HOSOH 104°, OSO 119°; vrije, stvarajući azeotropnu smjesu (98,3% H 2 SO 4 i 1,7% H 2 O s vrelištem od 338,8 o C). Sumporna kiselina koja odgovara 100% sadržaju H 2 SO 4 ima sastav (%): H 2 SO 4 99,5, HSO 4 - - 0,18, H 3 SO 4 + - 0,14, H 3 O + - 0,09, H 2 S 2 O 7, - 0,04, HS20 7 - - 0,05. Miješa se s vodom i SO 3 u svim omjerima. U vodenim otopinama sumporna kiselina gotovo potpuno disocira na H 3 O +, HSO 3 + i 2HSO 4 -. Tvori hidrate H 2 SO 4 ·nH 2 O, gdje je n = 1, 2, 3, 4 i 6,5.
Oleum
Otopine sumpornog anhidrida SO 3 u sumpornoj kiselini nazivaju se oleum, one tvore dva spoja H 2 SO 4 ·SO 3 i H 2 SO 4 ·2SO 3. Oleum također sadrži pirosumporne kiseline. Vrelište vodenih otopina sumporne kiseline raste s povećanjem njezine koncentracije i doseže maksimum pri sadržaju od 98,3% H 2 SO 4. Vrelište oleuma opada s povećanjem sadržaja SO3. S povećanjem koncentracije vodenih otopina sumporne kiseline ukupni tlak pare iznad otopina opada i doseže minimum pri sadržaju od 98,3% H 2 SO 4. Kako se koncentracija SO 3 u oleumu povećava, ukupni tlak pare iznad njega raste. Tlak pare iznad vodenih otopina sumporne kiseline i oleuma može se izračunati pomoću jednadžbe:
log p=A-B/T+2,126
vrijednosti koeficijenata A i B ovise o koncentraciji sumporne kiseline. Para nad vodenim otopinama sumporne kiseline sastoji se od smjese vodene pare, H 2 SO 4 i SO 3, a sastav pare razlikuje se od sastava tekućine pri svim koncentracijama sumporne kiseline, osim kod odgovarajuće azeotropne smjese. Kako temperatura raste, disocijacija se povećava. Oleum H2SO4·SO3 ima najveću viskoznost, s porastom temperature η opada. Električni otpor sumporne kiseline je najmanji pri koncentraciji SO 3 i 92% H 2 SO 4, a najveći pri koncentraciji od 84 i 99,8% H 2 SO 4. Za oleum, minimalni ρ je pri koncentraciji od 10% SO 3. S povećanjem temperature raste ρ sumporne kiseline. Dielektrična konstanta 100% sumporne kiseline 101 (298,15 K), 122 (281,15 K); krioskopska konstanta 6,12, ebulioskopska konstanta 5,33; koeficijent difuzije para sumporne kiseline u zraku varira ovisno o temperaturi; D = 1,67·10⁻5T3/2 cm²/s.
Kemijska svojstva
Sumporna kiselina u koncentriranom obliku kada se zagrijava je prilično jak oksidans. Oksidira HI i djelomično HBr do slobodnih halogena. Oksidira mnoge metale (iznimke: Au, Pt, Ir, Rh, Ta.). U tom se slučaju koncentrirana sumporna kiselina reducira do SO2. Na hladnom u koncentriranoj sumpornoj kiselini Fe, Al, Cr, Co, Ni, Ba se pasiviziraju i ne dolazi do reakcija. Najjači redukcijski agensi reduciraju koncentriranu sumpornu kiselinu na S i H 2 S. Koncentrirana sumporna kiselina upija vodenu paru, pa se koristi za sušenje plinova, tekućina i krutina, npr. u eksikatorima. Međutim, koncentrirana H 2 SO 4 se djelomično reducira vodikom, zbog čega se ne može koristiti za sušenje. Odvajanjem vode od organskih spojeva i ostavljanjem crnog ugljika (drveni ugljen), koncentrirana sumporna kiselina dovodi do pougljenjenja drva, šećera i drugih tvari. Razrijeđeni H 2 SO 4 svojim oslobađanjem stupa u interakciju sa svim metalima koji se nalaze u nizu elektrokemijskog napona lijevo od vodika. Oksidirajuća svojstva razrijeđene H 2 SO 4 nisu karakteristična. Sumporna kiselina tvori dvije serije soli: srednje - sulfate i kisele - hidrosulfate, kao i estere. Poznate su peroksomonosumporna (ili karokiselina) H 2 SO 5 i peroksodisulfatna H 2 S 2 O 8 kiselina. Sumporna kiselina također reagira s bazičnim oksidima pri čemu nastaje sulfat i voda. U pogonima za obradu metala otopina sumporne kiseline koristi se za uklanjanje sloja metalnog oksida s površine metalnih proizvoda koji su tijekom proizvodnog procesa izloženi visokoj toplini. Tako se željezni oksid uklanja s površine željeznog lima djelovanjem zagrijane otopine sumporne kiseline. Kvalitativna reakcija na sumpornu kiselinu i njezine topljive soli je njihova interakcija s topljivim barijevim solima, što rezultira stvaranjem bijelog taloga barijevog sulfata, netopljivog u vodi i kiselinama, na primjer.
Primjena
Sumporna kiselina se koristi:
- u preradi ruda, posebno u ekstrakciji rijetkih elemenata, uključujući uran, iridij, cirkonij, osmij itd.;
- u proizvodnji mineralnih gnojiva;
- kao elektrolit u olovnim baterijama;
- za dobivanje raznih mineralnih kiselina i soli;
- u proizvodnji kemijskih vlakana, boja, dima i eksploziva;
- u naftnoj, metaloprerađivačkoj, tekstilnoj, kožarskoj i drugim industrijama;
- u prehrambenoj industriji - registriran kao dodatak hrani E513 (emulgator);
- u industrijskoj organskoj sintezi u reakcijama:
- dehidracija (proizvodnja dietil etera, estera);
- hidratacija (etanol iz etilena);
- sulfonacija (sintetski deterdženti i međuproizvodi u proizvodnji bojila);
- alkilacija (proizvodnja izooktana, polietilen glikola, kaprolaktama) itd.
- Za obnavljanje smola u filtrima u proizvodnji destilirane vode.
Svjetska proizvodnja sumporne kiseline iznosi cca. 160 milijuna tona godišnje. Najveći potrošač sumporne kiseline je proizvodnja mineralnih gnojiva. Fosforna gnojiva P 2 O 5 troše 2,2-3,4 puta više mase sumporne kiseline, a (NH 4) 2 SO 4 sumporna kiselina troši 75% mase utrošenog (NH 4) 2 SO 4. Stoga nastoje graditi tvornice sumporne kiseline zajedno s tvornicama za proizvodnju mineralnih gnojiva.
Povijesni podaci
Sumporna kiselina poznata je od davnina, u prirodi se pojavljuje u slobodnom obliku, na primjer, u obliku jezera u blizini vulkana. Možda se prvi spomen kiselih plinova proizvedenih kalcinacijom stipse ili željeznog sulfata "zelenog kamena" nalazi u spisima koji se pripisuju arapskom alkemičaru Jabiru ibn Hayyanu. U 9. stoljeću je perzijski alkemičar Ar-Razi, kalcinirajući smjesu željeznog i bakrenog sulfata (FeSO 4 7H 2 O i CuSO 4 5H 2 O), također dobio otopinu sumporne kiseline. Ovu je metodu unaprijedio europski alkemičar Albert Magnus, koji je živio u 13. stoljeću. Shema za proizvodnju sumporne kiseline iz željeznog sulfata je toplinska razgradnja željezovog (II) sulfata nakon čega slijedi hlađenje smjese. Djela alkemičara Valentina (13. stoljeće) opisuju metodu za proizvodnju sumporne kiseline apsorbiranjem plina (sumporni anhidrid) koji se oslobađa spaljivanjem mješavine praha sumpora i nitrata s vodom. Naknadno je ova metoda postala temelj tzv. “komorna” metoda, koja se provodi u malim komorama obloženim olovom koje se ne otapa u sumpornoj kiselini. U SSSR-u je ova metoda postojala do 1955. godine. Alkemičari 15. stoljeća također su poznavali način dobivanja sumporne kiseline iz pirita - sumporni pirit, jeftinija i češća sirovina od sumpora. Sumporna kiselina se na ovaj način proizvodi već 300 godina, u malim količinama u staklenim retortama. Kasnije, u vezi s razvojem katalize, ova metoda je zamijenila komornu metodu za sintezu sumporne kiseline. Trenutno se sumporna kiselina proizvodi katalitičkom oksidacijom (na V 2 O 5) sumporovog oksida (IV) u sumporov oksid (VI) i naknadnim otapanjem sumpornog oksida (VI) u 70% sumpornoj kiselini da se dobije oleum. U Rusiji je proizvodnja sumporne kiseline prvi put organizirana 1805. u blizini Moskve u okrugu Zvenigorod. Godine 1913. Rusija je bila na 13. mjestu u svijetu po proizvodnji sumporne kiseline.
dodatne informacije
Sićušne kapljice sumporne kiseline mogu nastati u srednjim i višim slojevima atmosfere kao rezultat reakcije vodene pare i vulkanskog pepela koji sadrži velike količine sumpora. Nastala suspenzija, zbog visokog albeda oblaka sumporne kiseline, otežava sunčevoj svjetlosti da dopre do površine planeta. Stoga (i kao rezultat velikog broja sitnih čestica vulkanskog pepela u gornjoj atmosferi, koje također ometaju pristup sunčeve svjetlosti planetu), nakon posebno jakih vulkanskih erupcija može doći do značajnih klimatskih promjena. Na primjer, kao rezultat erupcije vulkana Ksudach (poluotok Kamčatka, 1907.), povećana koncentracija prašine u atmosferi je ostala oko 2 godine, a karakteristični noktilucentni oblaci sumporne kiseline uočeni su čak iu Parizu. Eksplozija planine Pinatubo 1991. godine, koja je u atmosferu ispustila 3 × 10 7 tona sumpora, rezultirala je time da su 1992. i 1993. godine bile znatno hladnije od 1991. i 1994. godine.
Standardi
- Tehnička sumporna kiselina GOST 2184-77
- Baterijska sumporna kiselina. Tehničke specifikacije GOST 667-73
- Sumporna kiselina posebne čistoće. Tehničke specifikacije GOST 1422-78
- Reagensi. Sumporne kiseline. Tehničke specifikacije GOST 4204-77
Svaka kiselina je složena tvar čija molekula sadrži jedan ili više vodikovih atoma i kiselinski ostatak.
Formula sumporne kiseline je H2SO4. Prema tome, molekula sumporne kiseline sadrži dva atoma vodika i kiselinski ostatak SO4.
Sumporna kiselina nastaje kada sumporni oksid reagira s vodom
SO3+H2O -> H2SO4
Čista 100% sumporna kiselina (monohidrat) teška je tekućina, viskozna poput ulja, bez boje i mirisa, kiselkastog "bakrenog" okusa. Već na temperaturi od +10 ° C stvrdnjava se i pretvara u kristalnu masu.
Koncentrirana sumporna kiselina sadrži približno 95% H2SO4. I stvrdnjava se na temperaturama ispod –20°C.
Interakcija s vodom

Sumporna kiselina dobro se otapa u vodi, miješajući se s njom u bilo kojem omjeru. Time se oslobađa velika količina topline.
Sumporna kiselina može apsorbirati vodenu paru iz zraka. Ovo se svojstvo koristi u industriji za sušenje plinova. Plinovi se suše propuštanjem kroz posebne spremnike sa sumpornom kiselinom. Naravno, ova metoda se može koristiti samo za one plinove koji ne reagiraju s njim.
Poznato je da kada sumporna kiselina dođe u dodir s mnogim organskim tvarima, osobito ugljikohidratima, te tvari pougljenje. Činjenica je da ugljikohidrati, poput vode, sadrže i vodik i kisik. Sumporna kiselina im oduzima te elemente. Ono što ostaje je ugljen.
U vodenoj otopini H2SO4 indikatori lakmus i metiloranž pocrvene, što ukazuje da je ova otopina kiselkastog okusa.
Interakcija s metalima
Kao i svaka druga kiselina, sumporna kiselina je sposobna zamijeniti atome vodika s atomima metala u svojoj molekuli. U interakciji je s gotovo svim metalima.
Razrijeđena sumporna kiselina reagira s metalima poput obične kiseline. Kao rezultat reakcije nastaje sol s kiselim ostatkom SO4 i vodikom.
Zn + H2SO4 = ZnSO4 + H2
A koncentrirana sumporna kiselina je vrlo jak oksidans. Oksidira sve metale, bez obzira na njihov položaj u nizu napona. A kada reagira s metalima, sam se reducira na SO2. Vodik se ne oslobađa.
Su + 2 H2SO4 (konc) = CuSO4 + SO2 + 2H2O
Zn + 2 H2SO4 (konc.) = ZnSO4 + SO2 + 2H2O
Ali zlato, željezo, aluminij i metali platinske skupine ne oksidiraju u sumpornoj kiselini. Stoga se sumporna kiselina prevozi u čeličnim cisternama.
Soli sumporne kiseline koje nastaju kao rezultat takvih reakcija nazivaju se sulfati. Bezbojni su i lako kristaliziraju. Neki od njih su visoko topljivi u vodi. Malo su topljivi samo CaSO4 i PbSO4. BaSO4 je gotovo netopljiv u vodi.
Interakcija s bazama

Reakcija između kiselina i baza naziva se reakcija neutralizacije. Kao rezultat reakcije neutralizacije sumporne kiseline nastaje sol koja sadrži kiselinski ostatak SO4 i vodu H2O.
Primjeri reakcija neutralizacije sumporne kiseline:
H2SO4 + 2 NaOH = Na2SO4 + 2 H2O
H2SO4 + CaOH = CaSO4 + 2 H2O
Sumporna kiselina reagira neutralizacijom s topivim i netopivim bazama.
Budući da molekula sumporne kiseline ima dva atoma vodika, a za njezinu neutralizaciju potrebne su dvije baze, klasificira se kao dvobazna kiselina.
Interakcija s bazičnim oksidima
Iz školskog tečaja kemije znamo da su oksidi složene tvari koje sadrže dva kemijska elementa, od kojih je jedan kisik u oksidacijskom stanju -2. Bazični oksidi nazivaju se oksidi 1, 2 i nekih 3 valentnih metala. Primjeri bazičnih oksida: Li2O, Na2O, CuO, Ag2O, MgO, CaO, FeO, NiO.
Sumporna kiselina reagira s bazičnim oksidima u reakciji neutralizacije. Kao rezultat te reakcije, kao i u reakciji s bazama, nastaju sol i voda. Sol sadrži kiseli ostatak SO4.
CuO + H2SO4 = CuSO4 + H2O
Interakcija sa solima
Sumporna kiselina reagira sa solima slabijih ili hlapljivih kiselina, istiskujući te kiseline iz njih. Kao rezultat te reakcije nastaju sol s kiselim ostatkom SO4 i kiselina
H2SO4+BaCl2=BaSO4+2HCl
Primjena sumporne kiseline i njezinih spojeva

Barijeva kaša BaSO4 može blokirati X-zrake. Ispunivši njime šuplje organe ljudskog tijela, radiolozi ih pregledavaju.
U medicini i građevinarstvu naširoko se koriste prirodni gips CaSO4 * 2H2O i kristalni hidrat kalcijevog sulfata. Glauberova sol Na2SO4 * 10H2O koristi se u medicini i veterini, u kemijskoj industriji - za proizvodnju sode i stakla. Bakreni sulfat CuSO4 * 5H2O poznat je vrtlarima i agronomima koji ga koriste za borbu protiv štetočina i biljnih bolesti.
Sumporna kiselina ima široku primjenu u raznim industrijama: kemijskoj, obradi metala, naftnoj, tekstilnoj, kožarskoj i dr.