Как и когда меняется внутренняя энергия тела. Способы изменения внутренней энергии
Выясним, как можно вычислять изменение внутренней энергии при теплообмене. Чтобы возможно точнее это сделать, нужно свести к минимуму неучтенные потери теплоты при теплообмене. Поэтому при научных исследованиях теплообмен осуществляют в калориметре (рис. 6.1), применение которого позволяет достаточно точно определять теплоту отданную или полученную телом в процессе теплообмена.
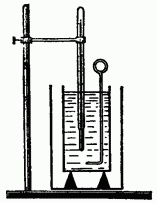
Калориметр состоит из двух сосудов: внешнего и внутреннего. Внутренний сосуд делается из хорошего проводника тепла (латуни, меди), так как его температура должна быть такой же, как у налитой в него жидкости.
Наружный сосуд предохраняет внутренний сосуд от потерь тепла путем конвекции и излучения. Поэтому его обычно окрашивают белой краской или делают из блестящей жести.
Чтобы предохранить внутренний сосуд от потерь тепла путем теплопроводности, его ставят на деревянные подставки (у дерева плохая теплопроводность). Во внутренний сосуд помещают мешалку (из такого же материала, как сосуд) и термометр.
Теплообмен осуществляют следующим образом. С помощью весов определяют массу внутреннего сосуда калориметра и мешалки, а затем и массу налитой в него жидкости, например воды. После этого измеряют массу тела, нагревают его до известной температуры и, заметив начальную температуру жидкости, опускают нагретое тело в калориметр. Измерив конечную температуру жидкости, можно подсчитать, сколько теплоты отдало тело в процессе теплообмена.
С помощью таких опытов легко установить, что изменение внутренней энергии какого-либо тела прямо пропорционально его массе и изменению температуры тела
![]()
здесь с - коэффициент пропорциональности. Поскольку изменение внутренней энергии при теплообмене оценивается количеством теплоты имеем
Начальную температуру тела обычно обозначают а конечную Тогда в случае нагревания тела а в случае охлаждения
Опыты показывают, что зависит от рода вещества, от внешних условий, от агрегатного состояния вещества. Эти зависимости и выражаются коэффициентом с в формулах (6.1) и (6.2).
Величина с, характеризующая зависимость изменения внутренней энергии тела при нагревании или охлаждении от рода вещества и от внешних условий, называется удельной теплоемкостью вещества. Удельная теплоемкость вещества измеряется количеством теплоты, необходимым для нагревания единицы массы вещества на единицу температуры:
![]()
Выведем единицу удельной теплоемкости в СИ:
В СИ за единицу удельной теплоемкости принимается удельная теплоемкость такого вещества, для которого при нагревании массы в 1 кг на 1 К затрачивается 1 Дж энергии. При небольших изменениях температуры удельную теплоемкость можно считать постоянной. Для решения задач ее берут из таблиц.
Следует иметь в виду, что при определении количества теплоты, необходимой для нагревания или выделенной при охлаждении тела, иногда пользуются теплоемкостью тела С - величиной, измеряемой количеством теплоты, необходимым для нагревания тела на единицу температуры. Следовательно,
Пользоваться при расчетах теплоемкостью всего тела особенно удобно, когда отдельные части тела сделаны из разного вещества. В СИ за единицу теплоемкости тела принимается (Покажите это с помощью формулы (6.3).)
Отметим еще, что удельная теплоемкость газа зависит от характера процесса, при котором происходит его нагревание. Например, удельная теплоемкость газа при постоянном давлении больше его удельной теплоемкости при постоянном объеме так как в первом случае нужно не только увеличить внутреннюю энергию газа, но и затратить энергию на выполнение работы, совершаемой газом над внешними телами в процессе его расширения (§ 5.10). Во втором же случае подведенная к газу теплота идет только на увеличение его внутренней энергии.
Внутренней энергией называется сумма кинетических энергий всех частиц, из которых состоит тело, и потенциальных энергий взаимодействия этих частиц между собой. Сюда включается энергия взаимодействия электронов с ядрами и энергия взаимодействия составных частей ядра.
Внутренняя энергия зависит от его температуры. Температура характеризует среднюю кинетическую энергию частиц вещества. При изменении температуры меняется расстояние между частицами, следовательно, меняется и энергия взаимодействия между ними.
Внутренняя энергия меняется также при переходе вещества из одного агрегатного состояния в другое. Процессы, связанные с изменением температуры или агрегатного состояния вещества, называют тепловыми . Тепловые процессы сопровождаются изменением внутренней энергии тела.
Химические реакции, ядерные реакции также сопровождаются изменением внутренней энергии тела, т.к. меняется энергия взаимодействия частиц, участвующих в реакциях. Внутренняя энергия меняется при излучении или поглощении энергии атомами при переходе электронов с одной оболочки на другую.
Одним из способов изменения внутренней энергии является работа . Так при трении двух тел происходит повышение их температуры, т.е. возрастает их внутренняя энергия. Например, при обработке металлов – сверлении, обточке, фрезеровании.
При контакте двух тел с разными температурами происходит передача энергии от тела с высокой температурой к телу с низкой температурой. Процесс передачи энергии от одного тела к другому, имеющему более низкую температуру, называется теплопередача.
Таким образом, в природе существует два процесса, при которых меняется внутренняя энергия тела:
а) превращение механической энергии во внутреннюю и наоборот; при этом совершается работа;
б) теплопередача; при этом работа не совершается.
Если смешать горячую и холодную воду, то на опыте можно убедиться, что количество теплоты, отданное горячей водой, и количество теплоты, полученное холодной водой, равны между собой. Опыт показывает, что если между телами происходит теплообмен, то внутренняя энергия всех нагревающихся тел увеличивается на столько, на сколько уменьшается внутренняя энергия остывающих тел. Таким образом, энергия переходит от одних тел к другим, но суммарная энергия всех тел остается неизменной. Это закон сохранения и превращения энергии .
Во всех явлениях, происходящих в природе, энергия не возникает и не исчезает. Она только превращается из одного вида в другой, при этом её значение сохраняется.
Пример, свинцовая пуля, летевшая с некоторой скоростью, ударяется о преграду и нагревается.
Или, льдинка, падая из снежной тучи, тает у земли.
Или, чайник с водой нагревается на газовой плите, часть воды испаряется.
Закон сохранения энергии представляет научную основу для расчетов во всех областях науки и техники. Следует учитывать, что полностью внутреннюю энергию нельзя превратить в механическую.
Внутреннюю энергию можно изменить двумя способами.
Если работа совершается над телом, его внутренняя энергия увеличивается.
Вну́тренняя эне́ргия тела (обозначается как E или U) - это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
Эта формула является математическим выражением первого начала термодинамики
Для квазистатических процессов выполняется следующее соотношение:
Температура, измеренная в кельвинах
Энтропия, измеренная в джоулях/кельвин
Давление, измеренное в паскалях
Количество частиц в систем
Теплота сгорания топлива. Условное топливо. Количество воздуха необходимое для горения топлива.
О качестве топлива судят по его теплоте сгорания. Для характеристики твердых и жидких видов топлива служит показатель удельной теплоты сгорания, который представляет собой количество теплоты, выделяемое при полном сгорании единицы массы (кДж/кг). Для газообразных видов топлива применяется показатель объемной теплоты сгорания, представляющий собой количество теплоты выделяемое при сгорании единицы объема (кДж/м3). Кроме того, газообразное топливо в ряде случаев оценивают по количеству теплоты, выделяемой при полном сгорании одного моля газ (кДж/моль).
Теплоту сгорания определяют не только теоретически, но и опытным путем, сжигая определенное количество топлива в специальных приборах, называемых калориметрами. Теплоту сгорания оценивают по повышению температуры воды в колориметре. Результаты, полученные этим методом, близки к значениям, рассчитанным по элементарному составу топлива.
Вопрос 14 Изменение внутренней энергии при нагревании и охлаждении. Работа газа при изменении обьема.
Внутренняя энергия тела зависит от средней кинетической энергии его молекул, а эта энергия, в свою очередь, зависит от температуры. Поэтому, изменяя температуру тела, мы изменяем и его внутреннюю энергию.При нагревании тела его внутренняя энергия увеличивается, при охлаждении уменьшается.
Внутреннюю энергию тела можно изменить и без совершения работы. Так, например, ее можно увеличить, нагрев на плите чайник с водой или опустив ложку в стакан с горячим чаем. Нагревается камин, в котором разведен огонь, крыша дома, освещаемая солнцем, и т. д. Повышение температуры тел во всех этих случаях означает увеличение их внутренней энергии, но это увеличение происходит без совершения работы.
Изменение внутренней энергии тела без совершения работы называется теплообменом. Теплообмен возникает между телами (или частями одного и того же тела), имеющими разную температуру.
Как, например, происходит теплообмен при контакте холодной ложки с горячей водой? Сначала средняя скорость и кинетическая энергия молекул горячей воды превышают среднюю скорость и кинетическую энергию частиц металла, из которого изготовлена ложка. Но в тех местах, где ложка соприкасается с водой, молекулы горячей воды начинают передавать часть своей кинетической энергии частицам ложки, и те начинают двигаться быстрее. Кинетическая энергия молекул воды при этом уменьшается, а кинетическая энергия частиц ложки увеличивается. Вместе с энергией изменяется и температура: вода постепенно остывает, а ложка нагревается. Изменение их температуры происходит до тех пор, пока она и у воды, и у ложки не станет одинаковой.
Часть внутренней энергии, переданной от одного тела к другому при теплообмене, обозначают буквой и называютколичеством теплоты.
Q - количество теплоты.
Количество теплоты не следует путать с температурой. Температура измеряется в градусах, а количество теплоты (как и любая другая энергия) - в джоулях.
При контакте тел с разной температурой более горячее тело отдает некоторое количество теплоты, а более холодное тело его получает.
Работа при изобарном расширении газа. Одним из основных термодинамических процессов, совершающихся в большинстве тепловых машин, является процесс расширения газа с совершением работы. Легко определить работу, совершаемую при изобарном расширении газа.
Если при изобарном расширении газа от объема V1 до объема V2 происходит перемещение поршня в цилиндре на расстояние l (рис. 106), то работа A", совершенная газом, равна
Где p - давление газа, - изменение его объема.
Работа при произвольном процессе расширения газа. Произвольный процесс расширения газа от объема V1 до объема V2 можно представить как совокупность чередующихся изобарных и изохорных процессов.
Работа при изотермическом расширении газа . Сравнивая площади фигур под участками изотермы и изобары, можно сделать вывод, что расширение газа от объема V1 до объема V2 при одинаковом начальном значении давления газа сопровождается в случае изобарного расширения совершением большей работы.
Работа при сжатии газа. При расширении газа направление вектора силы давления газа совпадает с направлением вектора перемещения, поэтому работа A", совершенная газом, положительна (A" > 0), а работа А внешних сил отрицательна: A = -A" < 0.
При сжатии газа направление вектора внешней силы совпадает с направлением перемещения, поэтому работа А внешних сил положительна (A > 0), а работа A", совершенная газом, отрицательна (A" < 0).
Адиабатный процесс . Кроме изобарного, изохорного и изотермического процессов, в термодинамике часто рассматриваются адиабатные процессы.
Адиабатным процессом называется процесс, происходящий в термодинамической системе при отсутствии теплообмена с окружающими телами, т. е. при условии Q = 0.
Вопрос 15 Условия равновесия тела. Момент силы. Виды равновесия.
Равновесие, или баланс, некоторого числа связанных явлений в естественных и гуманитарных науках.
Система считается находящейся в положении равновесия, если все воздействия на эту систему компенсируются другими или отсутствуют вообще. Сходное понятие - устойчивость. Равновесие может быть устойчивым, неустойчивым или безразличным.
Характерные примеры равновесия:
1. Механическое равновесие, также известно как статическое равновесие, - состояние тела, находящегося в покое, или движущегося равномерно, в котором сумма сил и моментов, действующих на него, равна нулю.
2. Химическое равновесие - положение, в котором химическая реакция протекает в той же степени, как и обратная реакция, и в результате не происходит изменения количества каждого компонента.
3. Физический баланс людей и животных, который поддерживается за счёт понимания его необходимости и в некоторых случаях - при помощи искусственного поддержания этого баланса[источник не указан 948 дней].
4. Термодинамическое равновесие - состояние системы, в котором его внутренние процессы не приводят к изменениям макроскопических параметров (таких, как температура и давление).
Р авенство нулю алгебраической суммы моментов сил не означает также, что при этом тело обязательно находится в покое. На протяжении нескольких миллиардов лет с постоянным периодом продолжается вращение Земли вокруг оси именно потому, что алгебраическая сумма моментов сил, действующих на Землю со стороны других тел, очень мала. По той же причине продолжает вращение с постоянной частотой раскрученное велосипедное колесо, и только внешние силы останавливают это вращение.
Виды равновесия . В практике большую роль играет не только выполнение условия равновесия тел, но и качественная характеристика равновесия, называемая устойчивостью. Различают три вида равновесия тел: устойчивое, неустойчивое и безразличное. Равновесие называется устойчивым, если после небольших внешних воздействий тело возвращается в исходное состояние равновесия. Это происходит, если при небольшом смещении тела в любом направлении от первоначального положения равнодействующая сил, действующих на тело, становится отличной от нуля и направлена к положению равновесия. В устойчивом равновесии находится, например, шар на дне углубления.
Общее условие равновесия тела . Объединяя два вывода, можно сформулировать общее условие равновесия тела: тело находится в равновесии, если равны нулю геометрическая сумма векторов всех приложенных к нему сил и алгебраическая сумма моментов этих сил относительно оси вращения.
Вопрос 16 Парообразование и конденсация. Испарение. Кипение жидкости. Зависимость кипения жидкости от давления.
Парообразование - свойство капельных жидкостей изменять свое агрегатное состояние и превращаться в пар. Парообразование, происходящее лишь на поверхности капельной жидкости, называется испарением. Парообразование по всему объему жидкости называется кипением; оно происходит при определенной температуре, зависящей от давления. Давление, при котором жидкость закипает при данной температуре, называется давлением насыщенных паров pнп, его значение зависит от рода жидкости и ее температуры.
Испаре́ние - процесс перехода вещества из жидкого состояния в газообразное (пар). Процесс испарения является обратным процессу конденсации (переход из парообразного состояния в жидкое. Испарение(парообразование), переход вещества из конденсированной (твердой или жидкой) фазы в газообразную (пар); фазовый переход первого рода.
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость. В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, то есть когда скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным. Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара.
Кипе́ние - процесс парообразования в жидкости (переход вещества из жидкого в газообразное состояние), с возникновением границ разделения фаз. Температура кипения при атмосферном давлении приводится обычно как одна из основных физико-химических характеристик химически чистого вещества.
Кипение различают по типу:
1. кипение при свободной конвекции в большом объеме;
2. кипение при вынужденной конвекции;
3. а так же по отношению средней температуры жидкости к температуре насыщения:
4. кипение жидкости, недогретой до температуры насыщения (поверхностное кипение);
5. кипение жидкости, догретой до температуры насыщения
Пузырьковый
Кипение, при котором пар образуется в виде периодическизарождающихся и растущих пузырей, называется пузырьковым кипением. При медленном пузырьковом кипении в жидкости (а точнее, как правило на стенках или на дне сосуда) появляются пузырьки, наполненные паром. За счёт интенсивного испарения жидкости внутрь пузырьков, они растут, всплывают, и пар высвобождается в паровую фазу над жидкостью. При этом в пристеночном слое жидкость находится в слегка перегретом состоянии, т. е. её температура превышает номинальную температуру кипения. В обычных условиях эта разница невелика (порядка одного градуса).
Плёночный
При увеличении теплового потока до некоторой критической величины отдельные пузырьки сливаются, образуя у стенки сосуда сплошной паровой слой, периодически прорывающийся в объём жидкости. Такой режим называется плёночным.
©2015-2017 сайт
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование.






