Термодинамические процессы в координатах p v. Цикл паровой компрессорной холодильной установки. Адиабатный процесс газа
Каждое из этих уравнений содержит два множителя. Один характеризует качество или напряженность энергии (ω2 − квадрат скорости, H – высота подъема груза, T – температура, p −давление), а второй – выражает количество или ёмкость тела по отношению к данной энергии (m – масса тела, V − удельный объем, S – энтропия). Первый множитель является интенсивным фактором, а второй – экстенсивным. То есть энтропия представляет собой емкость термодинамической системы по отношению к тепловой напряженности.
Клаузиус дал формулировки первого и второго законов термодинамики.
Энергия Вселенной постоянна.
Энтропия Вселенной стремится к максимуму.
Таким образом, это должно привести к тепловой смерти Вселенной, когда температура выровняется. Но это противоречит, тому, что закон возрастания энтропии получен для изолированной системы.
TS – диаграмма.
На этой диаграмме по оси ординат откладывается температура, а по оси абсцисс – энтропия.
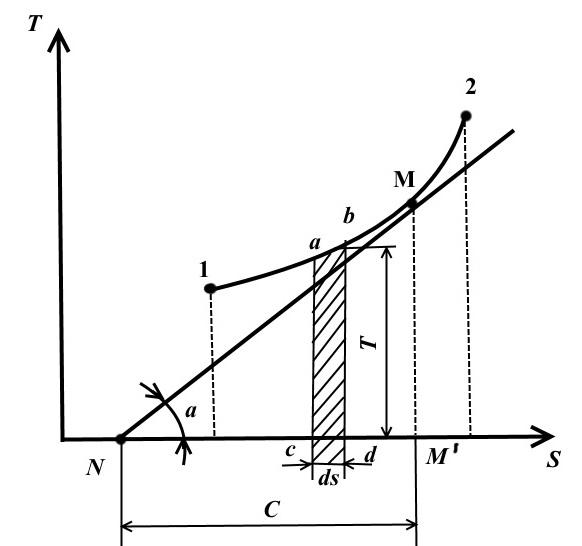
Равновесное состояние в TS − диаграмме изображаются точками с координатами, соответствующими значениям температуры и энтропии.
Обратимый термодинамический процесс изменения состояния рабочего тела от начального состояния 1 до конечного состояния 2 изображается на TS − диаграмме непрерывной кривой, проходящей между этими точками.
Площадь abdc равна TdS = dq , т.е. выражает элементарное количество теплоты, получаемой или отдаваемой системой в обратимом процессе.
Площадь под кривой 1-2 равна
То есть площадь под кривой в TS − диаграмме, представляет собой теплоту, подведенную к системе или отведенную от нее.
Поэтому TS − диаграмму называют тепловой.
Проведем в произвольной точке M на кривой 1-2 касательную к этой кривой
Величина представляет собой истинную теплоемкость процесса.
![]()
Газовые процессы в TS − диаграмме.
Изотермический процесс .
При изотермическом процессе T = const . Поэтому TS − диаграмме он изображается прямой линией, параллельной оси абсцисс.
С учетом того, что dT =0 , зависимости изменения энтропии идеального газа в изотермическом процессе примут вид
(уходит слагаемое в правой части)
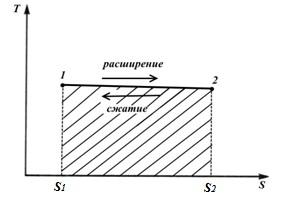
Процесс 1-2 – это процесс, в котором энтропия увеличивается, а следовательно, к газу подводится теплота и газ совершает работу расширения, эквивалентную этой теплоте.
Процесс2-1− это процесс сжатия, в котором теплота, эквивалентная работе сжатия, отводится от газа и энтропия уменьшается
Площадь фигуры S 1 12 S 2 соответствует количеству теплоты q , сообщаемому газу, и одновременно работе l (изотермический процесс)
Адиабатный процесс
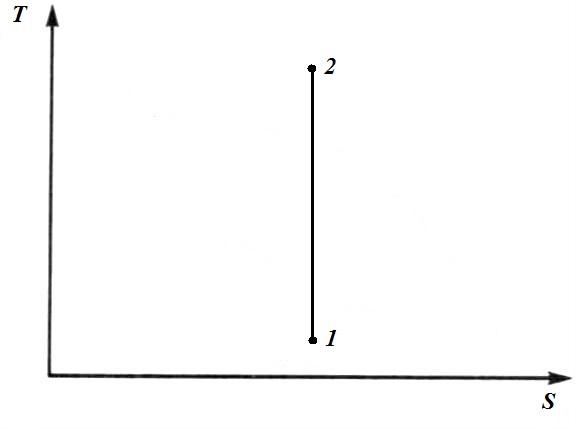
В адиабатном процессе q =0 и dq =0, а следовательно dS =0.
Следовательно, в адиабатном процессе S = const и в TS − диаграмме адиабатный процесс изображается прямой линией, параллельной оси T .
Поскольку в адиабатном процессе S = const ,то адиабатные обратимые процессы называют также изоэнтропными.
При адиабатном сжатии температура рабочего тела повышается, а при расширении понижается. Поэтому процесс1-2 – это процесс сжатия, а процесс 2-1 – это расширение.
Из уравнения
![]() (3)
(3)
При k = const получим
![]()
Для обратимого адиабатного процесса S 1 = S 2 = const , тогда из (*)
− уравнение адиабаты в координатах p и V .
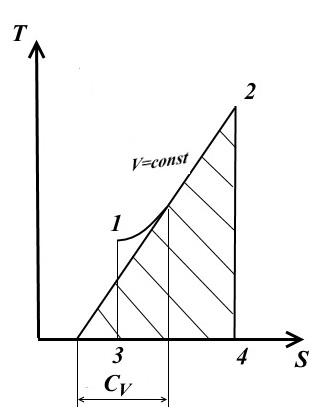
Изохорный процесс
Для изохорного процесса V = const , dV =0.
При постоянной теплоемкости (из ур. (1))
−вид на TS – диаграмме
Подкасательная к кривой процесса в любой её точке определяет значение истинной теплоёмкости C V .
Подкасательная будет положительной только в том случае, если кривая будет обращена выпуклостью вниз.
Площадь под кривой процесса 1-2 на TS – диаграмме дает в масштабе количество подведенной (или отведенной в процессе 2-1) теплоты q , равное изменению внутренней энергии U 2 - U 1 .
Изобарный процесс
В изобарном процессе давление постоянное p = const
В этом случае
![]() из
(2)
из
(2)
Следовательно, при p = const как и при V = const изобара является логарифмической кривой, поднимается следа направо и обращена выпуклостью вниз.
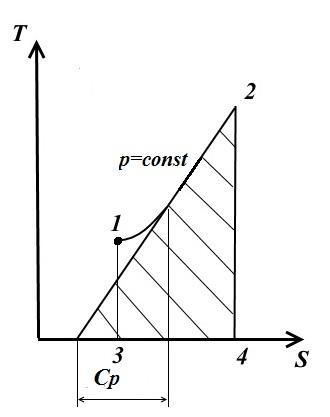
Подкасательная к кривой 1-2 в любой её точке дает значения истинной теплоёмкости C p .
Площадь под кривой дает кол-во теплоты q , которая сообщается газу при p = const , равное изменению энтальпии i 2 - i 1 .
Политропный процесс
В политропном процессе.Теплоёмкость в этом процессе
![]()
Отсюда, для конечного изменения состояния газа
![]()
Политропный процесс на TS – диаграмме изображается кривой, расположение которой зависит от показателя n .
Круговой процесс. Цикл Карно.
Изобразим в TS – диаграмме произвольный обратимый цикл 1 a 2 b 1 .

В процессе 1 a 2 рабочее тело получает кол-во теплоты q 1 , численно равное площади под кривой 1 a 2, а в процессе 2-b -1 отдает кол-во теплоты q 2 , численно равное площади под кривой 2-b -1.
Часть теплоты
переходит в работу цикла l (∆ u =0 в цикле).
Работа цикла положительна, если цикл проходит по часовой стрелке и отрицательна, если против часовой стрелки (направление цикла в pV и TS − диаграммах одинакова).
Термический к.п.д. кругового процесса
Изменение энтропии в любом цикле равно нулю.
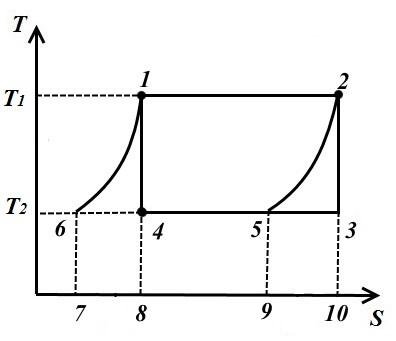
Цикл Карно состоит из двух изотерм и двух адиабат. В TS – диаграмме он будет изображаться в виде прямоугольника (горизонтальные линии – изотермы, вертикальные – адиабаты)
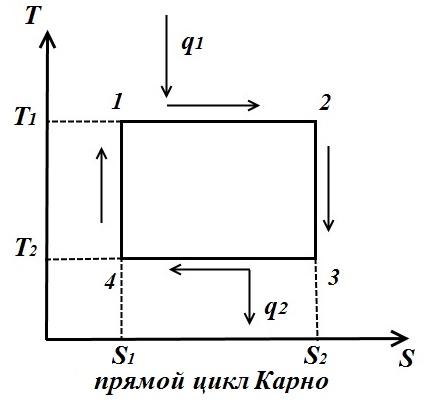
Количество теплоты, подведенное к рабочему телу, числено равно площади прямоугольника 12S 2 S 1 :
Количество теплоты, отведенное к холодильнику, соответствует площади прямоугольника 34S 1 S 2 :
Теплота, эквивалентная работе цикла, равная площади цикла
Термический к.п.д. цикла
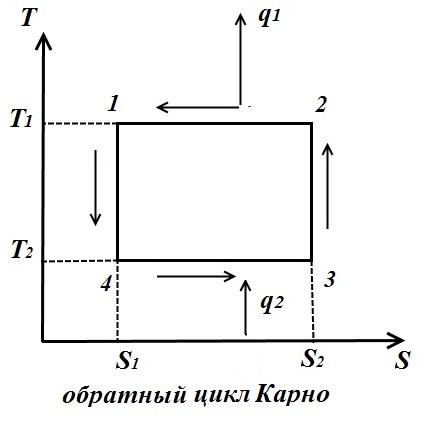
Для обратного цикла (рис. справа)
Холодильный коэффициент обратного цикла
![]()
Среднеинтегральная температура
В произвольном обратимом цикле подвод и отвод теплоты происходит при переменных температурах. Для упрощения термодинамических исследований вводится понятие среднеинтегральной температуры.
Рассмотрим произвольный политропный процесс в TS – диаграмме, в котором к рабочему телу подводится теплота q (процесс 1-2).
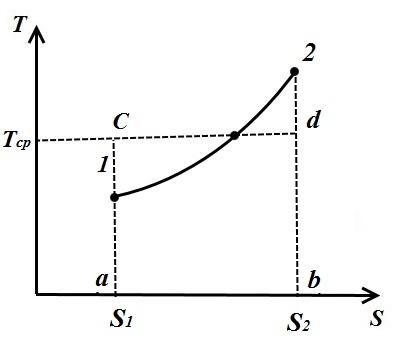
Под среднеинтегральной температурой рабочего тела в процессе 1-2 понимается температура, которая равна высоте прямоугольника abdc равновеликого площади a 12 b под кривой процесса 1-2, т.е
![]()
Поскольку
а отрезок
Таким образом, среднеинтегральная температура газа для любого процесса равна отношению кол-ва, теплоты, сообщаемого газу или отбираемого от него, к изменению энтропии.
Для любого политропного процесса
![]()
и среднеинтегральная температура (из (*))

Отсюда видно, что среднеинтегральная температура в любом политропном процессе зависит только от начальной T 1 и конечной T 2 температур и не зависит от характера процесса.
В произвольном цикле, в котором сжатие и расширение газа являются адиабатными (участки 1-2, 3-4), кол-во теплоты подводимой на участок 2-3
и отводимой на участке 4-1
Тогда термический к.п.д. цикла
![]() ,
,
то есть термический к.п.д. произвольного цикла равен термическому к.п.д. цикла Карно, осуществляемому между среднеинтегральными температурами процессов подводя T 1 Cp и отводя T 2 Cp теплоты.
Обобщенный цикл Карно
Цикл Карно имеет наивысший термический к.п.д. однако возможны и другие циклы, которые при некоторых дополнительных условиях могут иметь термический к.п.д., равный к.п.д. цикла Карно.
Рассмотрим пример такого цикла на рис. показан цикл Карно 1-2-3-4, состоящий, из двух адиабат 2-3, 4-1 и двух изотерм 1-2, 3-4.
Проведём из точки 1 и 2 две эквидистантные кривые 1-6 и 2-5 до пересечения с изотермой T 2 = const и рассмотрим обратный цикл 1-2-5-6, состоящий из двух изотерм и двух эквидистантных кривых 6-1(политропы) и 2-5.
В процессе 1-2 к рабочему телу при температуре T 1 = const подводится кол-во теплоты
В процессе 2-5 от рабочего тела отводится кол-во теплоты, равное площади фигуры 9-5-2-10.
В процессе 5-6 от рабочего тела при T 2 = const отводится кол-во теплоты
В процессе 6-1 к рабочему телу подводится кол-во теплоты q 6-1 , равное площади 7-6-1-8.
Поскольку кривые 1-6, 2-5 эквидистантны, то пл. 7618 = пл. 952-10 следовательно, кол-во теплоты также одинаково.
Это показывает, что промежуточные теплоприемники и теплопередатчики являются только регенераторами теплоты, которые в процессе 2-5 от рабочего тела отбирают теплоту, а в процессе 6-1 отдают её в том же количестве рабочему телу. Таким образом, 1-2-5-6 действительными внешними источниками являются теплопередатчик с температурой T 1 и теплоприёмник с температурой T 2 .
Теплота, превращаемая в цикле в работу
Термический к.п.д. определяется по формуле
То есть, термический к.п.д. рассматриваемого цикла равен к.п.д. цикла Карно.
Термодинамический цикл, в котором отвод теплоты от рабочего тела осуществляется в одном или нескольких процессах цикла для подвода в одном или нескольких процессах называется регенеративным циклом.
В отличие от цикла Карно, для регенеративного цикла необходим промежуточный источник, аккумулирующий теплоту.
Термодинамическая шкала температур
При использовании различных термодинамических тел шкала получается неравномерной из-за особенностей теплового расширения этих веществ.
Второй закон термодинамики позволяет построить шкалу температур, не зависящую от свойств термометрического тела (предложена Кельвином)
В цикле Карно термический к.п.д. не зависит от свойств рабочего тела, а является функцией температур горячего и холодного источника.
Термический к.п.д.
Таким образом, отношение температур рабочего тела может быть определено отношением теплоты. Отсюда следует, что если циклы Карно (рис.) образованы с помощью эквидистантных изотерм, то в этих циклах в работу превращается одинаковое кол-во теплоты.

Пусть изотермы температур T 0 и T k соответствуют температурам таяния льда (0 °С) и кипение воды (100 °С).
В цикле Карно 1234 в работу превращается теплота q равная площади фигуры 1234 . Если разбить эту площадь сеткой равностоящих изотерм на 100 равных частей, в каждом из полученных циклов Карно в работу будет превращаться кол-во теплоты 0,01 q . Температурный интервал между изотермами составит 1 °С.
Аналогично можно построить шкалу, лежащую ниже изотермы с температурой T 0 (0 °С).
За нижнюю точку термодинамической шкалы принята температура, при которой термический к.п.д. цикла Карно =1. Согласно
при T 2 =0 . Более низкой температуры существовать не может, поскольку в этом случае , что противоречит второму закону термодинамики.
Следовательно T =0 (-273.15 ) – это наименьшая возможная температура и она может быть принята за начальную постоянную естественную точку температурной шкалы. Таким образом, абсолютная температура не может иметь отрицательных значений.
Термодинамическая шкала температур получена для идеального газа.
В термодинамике изучают самые разнообразные процессы. Однако в них выделяют четыре основных процесса, рассматриваемых как обратимые:
изохорный , протекающий при постоянном объеме;
изобарный , протекающий при постоянном давлении;
изотермический , протекающий при постоянной температуре (название процесса происходит от соединения греческих слов «изос» – равный и «терме» – теплота);
адиабатный , протекающий без подвода и отвода теплоты (по-гречески «адиабатос» – непроницаемый).
Кроме перечисленных четырех основных процессов в термодинамике рассматриваются еще так называемые политропные процессы (по-гречески «поли» – много, «тропос» – путь). В этих процессах могут одновременно изменяться все параметры рабочего тела и, кроме того, происходить подвод или отвод теплоты. Как ниже будет объяснено, четыре основых процесса являются частными случаями политропного процесса.
Методика исследования термодинамических процессов
Следует прежде всего отметить, что любой газовый процесс, у которого
с = const, называется политропным с общим уравнением pv n = const.
n называется показателем политропы.
Методика исследования термодинамических процессов заключается в следующем:
1. Устанавливаем уравнение данного процесса и производим его графическое изображение в pv и Ts координатной системах (последняя рассматривается далее).
2. Устанавливаем соотношение между p,v и Т.
3. По общей для всех процессов расчетной формуле определяем изменение внутренней энергии (du = c v dT ).
4. По общему уравнению работы определяется работа данного термодинамического процесса.
5. Определяется теплота данного процесса по формуле q = .
Изохорный процесс
1. Уравнение политропы рv n = const можно записать в виде р v =const, откуда видно, что для изохорного процесса n принимает значение .
2. Из уравнений состояния p 1 v = RT 1 и p 2 v = RT 2 получаем .
На практике этот процесс встречается как составная часть процессов, происходящих в ДВС (взрывообразование (сжигание топлива) в карбюраторных двигателях)и при охлаждении или нагревании газа в баллоне (рис.9, а).
5. q = u, т.е. вся подведенная теплота идет на увеличение внутренней энергии. Коэффициент показывает долю теплоты, пошедшей на изменение внутренней энергии; 1 –z показывает, какая часть подведенной теплоты пошла на совершение работы. Изохора в T-s координатах (рис. 9, б) изображается логарифмической кривой (см. 6.5).
Изобарный процесс
1. Из уравнения политропы рv n = const видно, что оно превращается в уравнение изобарного процесса (р = const) при n = 0.
2. Из уравнений состояния pv 1 = RT 1 и pv 2 = RT 2 имеем
3. u = с v (T 2 – T 1). (47)
4. т.е. . (48)
5. dq = du + d . (49)
Определим, как распределяется подведенная теплота:
z = = ,
т.е. из всего подведенной теплоты .
Этот процесс является составной частью циклов ДВС и ГТУ (рис.10). Изобара в T-s координатах изображается логарифмической кривой более пологой, чем изохора (т.к. с p > с v , см. 6.5).
Изотермический процесс
1. T = const, pv n = const. Из уравнения состояния pv = RT следует, что для этого процесса n должен быть равен 1, т.е. pv = const. Изотерма в p-v координатах изображается равнобокой гиперболой (рис. 11, а), а в T-s координатах – прямой линией (рис. 11, б).
2. p 1 v 1 = p 2 v 2 ; . (50)
3. du =0, т.к. dT = 0.
5. q = , в этом процессе вся теплота переходит в работу.
Это наивыгоднейший процесс сжатия компрессоров, т.к. температура при сжатии постоянна
z = 1 – z = 1.
Адиабатный процесс
Адиабатным называется процесс, протекающий без теплообмена с окружающей средой. Весьма близко подходят к адиабатным все быстротекущие процессы (выстрел, взрыв, течение пара через проточную часть турбины и т.д.).
В силу этого, в дальнейшем изложении реальные тепловые процессы, протекающие достаточно быстро, с допустимой инженерной погрешностью будут рассматриваться как процессы адиабатные (например, процессы сжатия и расширения в тепловых двигателях).
1. dq = с v dT + pdv ; dq = 0, тогда
с v dT + pdv = 0. (52)
Продифференцируем pv =RT. Получим pdv+vdp=RdT, откуда . Подставим полученное dT в (52): . Разделим на и получим pdv = 0. Однако = k –1, тогда pdv + vdp + (k– 1)pdv = 0.
pdv + vdp + kpdv – pdv = 0. Разделим на pv : . Проинтегрируем и получим ln p + ln v k = const или ln(pv k ) = const. В конечном виде получено уравнение адиабаты:
pv k = const. (53)
В p-v координатах адиабата представляет собой неравнобокую гиперболу, идущую круче изотермы (n = k = 1,4, рис. 12, а).
2. Из уравнения адиабаты p 1 v 1 k = p 2 v 2 k. . Отсюда
Запишем характеристическое уравнение для точек 1 и 2: p 1 v 1 =RT 1 и p 2 v 2 =RT 2 и поделим первое на второе. Получим
Теперь воспользуемся выражением (54), подставив его вместо в выражение (55):
Для получения соотношения между температурами и давлениями подставим в (55) , выраженное через соотношение давлений из (54):
3, 4. В адиабатном процессе изменение внутренней энергии идет на совершение работы: O = d + du , отсюда d = – du или .
После интегрирования получим или (т. к. при расширении )
Из уравнения Майера c p – c v = R. c p = kc v . Отсюда kc v – c v = R и .
Подставим полученное значение c v в формулу (58):
Из уравнения Клапейрона (pv=RT ) можно записать и вынеся p 1 v 1 за скобки, получим
5. q = 0.
В адиабатном процессе энтропия остается постоянной (s = const), поэтому этот процесс называют иногда изоэнтропийным (см. 5.6).
Коэффициент z не имеет смысла.
Политропный процесс
Все рассмотренные выше процессы имели особенность: в каждом из них на какую-либо из величин накладывалось ограничение (р = const, t = const, v = const, dq = 0). Поэтому эти процессы могут считаться частными случаями изменения состояния газа.
Кроме этого, следствием данных ограничений является то, что подводимая или отводимая теплота q распределяется между и таким образом, что принимает определенное значение.
Однако очевидно, что могут иметь место процессы, в которых нет этих ограничений и z может принимать другие значения. Единственным ограничением для таких процессов будет постоянство z , т.е. и постоянство теплоемкости (т.к. , q = с ).
Интегрируя его при n = const, получим уравнение политропы
pv n = const. (65)
Как было отмечено выше, показатель n принимает для каждого процесса определенное значение.
Поскольку уравнение политропы не отличается по виду от уравнения адиабаты, то все соотношения между основными параметрами представляются формулами, аналогичными адиабатному процессу
То же можно сказать о выражениях для определения работы политропного процесса
n1.docx
*Первый закон динамики.
Параметры рабочего тела p , V , T , U , i , S .
Внутренняя энергия рабочего тела
Внутренняя энергия рабочего тела. Физический смысл и размерность.
Процессы обратимые и необратимые. Равновесные и неравновесные.
Энтальпия. Физические свойства.
Теплоёмкость рабочего тела
Изохорный процесс газа
Изобарный процесс газа.
Изотермический процесс газа.
Адиабатный процесс газа.
Второй закон термодинамики
Формулировки второго закона термодинамики.
Цикл Карно и его свойства.
Таблицы водяного пара.
i – S диаграмма водяного пара.
Адиабатический процесс p – V , i – S и T – S диаграммах.
Многоступенчатое сжатие в компрессоре.
Цикл ДВС со сгоранием при V = const
Цикл ДВС со сгоранием при p = const
Цикл ДВС с подводом тепла при V и p = const
Цикл ДВС со смешанным подводом тепла.
Цикл газотурбинной установки
Цикл паросиловой установки. Цикл Ренкина.
Цикл воздушной компрессорной холодильной установки.
Цикл паровой компрессорной холодильной установки.
Процесс парообразования в p – V диаграмме.
Процесс p = const водяного пара. Изображение процесса в p – V , i – S и T – S диаграммах.
Повторный перегрев пара.
Процесс T = const водяного пара. Изображение процесса в p – V , i – S и T – S диаграммах.
Таблицы средних теплоёмкостей. Определение теплоты при помощи таблиц.
Удельные расходы пара и тепла в паросиловых установках
Цикл газотурбинной установки с регенерацией.
Уравнение состояния рабочего тела.
Формула Майера.
Понятие «Холодильный коэффициент».
Первый закон термодинамики является частным случаем общего закона сохранения и превращение энергии применительно к процессам взаимного превращения теплоты и работы. Закон утверждает, что сумма всех видов энергии изолированной системы при любых происходящих в системе процессах остается постоянной:
При осуществлении термодинамического процесса подводимая к телу теплота Q идет на изменение его внутренней энергии и совершение механической работы:
Для 1 кг рабочего тела
ПАРАМЕТРЫ РАБОЧЕГО ТЕЛА P , V , T , U , I , S .
Величины, характеризующие тело в данном состоянии, называют параметрами состояния. Чаще всего состояние тела определяется следующими параметрами: удельным объемом, давлением, энтальпией и температурой.
Удельный объем (v ) тела представляет собой объем единицы его массы. В технической термодинамике за единицу массы принимают килограмм (кг), за единицу объема- кубический метр (м 3). Если V - объем в м 3 , занимаемый телом массой М в кг, то удельный объем
Плотность – величина обратная удельному объему
Давление р в Международной системе единиц (СИ) измеряют в паскалях. Паскаль (Па) - давление, вызываемое силой 1 ньютон (Н), равномерно распределенной по нормальной к ней поверхности площадью 1 м 2 . Таким образом, в единицах СИ паскаль измеряют в ньютонах на квадратный метр (Н/м 2).
Температура характеризует степень нагретого тела. Ее измеряют или по термодинамической температурной шкале, или по международной практической температурной шкале. Единицей термодинамической температуры является кельвин (К), представляющий собой 1/273,16 часть термодинамической температуры тройной точки воды.
Энтальпия
u и произведения pv .
Где dl t ( dl t = - vdp ).
Величина i p , v , T , и. Физический смысл величины i может пояснен на основе уравнения dq = di - vdp , которое для процесса p = const запишется как:
dq p = di . (86)
Откуда следует, что di
Изменение энтальпии в любом процессе определяется только начальным и конечным состояниями тела и не зависит от характера процесса.
Энтропия является функцией состояния, поэтому её изменение в термодинамическом процессе определяется только начальными и конечными значениями параметров состояния. Изменение энтропии в основных термодинамических процессах:
в изохорном
в изобарном
в изотермическом
в адиабатном
в политропном
ВНУТРЕННЯЯ ЭНЕРГИЯ РАБОЧЕГО ТЕЛА, ФИЗИЧЕСКИЙ СМЫСЛ И РАЗМЕРНОСТЬ.
Внутренняя энергия – это вся энергия заключенная в теле или системе тел. Эту энергию можно представить в виде суммы отдельных видов энергий: кинетической энергии молекул, включающей энергию поступательного и вращательного движения молекул, а также колебательного движения атомов в самой молекуле; энергии электронов; внутриядерной энергии; энергии взаимодействия между ядром молекулы и электронами; потенциальной энергии или энергии положения молекул в каком либо внешнем поле сил; энергии электромагнитного излучения.
Полную внутреннюю энергию тела принято обозначать U (Дж), а удельную внутреннюю энергию u (Дж/кг ) .
Внутренняя энергия равна:
Где – внутренняя кинетическая энергия молекул, внутренняя потенциальная энергия молекул, – постоянная интегрирования.
В технической термодинамике рассматриваются только такие процессы, в которых изменяются кинетическая и потенциальная составляющие внутренней энергии.
Изменение внутренней энергии идеального газа для любого процесса при бесконечно малом изменении состояния (для 1 кг)
В теплотехнических расчётах обычно требуется знать изменение внутренней энергии, а не её абсолютное значение; поэтому начало отсчёта (0 К или 0 0 С) для конечного результата () не имеет значения.
где - средняя массовая теплоёмкость при постоянном объёме в пределах
Таким образом, изменение внутренней энергии идеального газа для любого процесса равно произведению средней теплоёмкости при постоянном объёме на разность температур газа.
ПРОЦЕССЫ ОБРАТИМЫЕ И НЕОБРАТИМЫЕ. РАВНОВЕСНЫЕ И НЕРАВНОВЕСНЫЕ
Термодинамический процесс – это последовательное изменение состояния тела, происходящее в результате энергетического взаимодействия рабочего тела с окружающей средой.
Понятия обратимый и необратимый термодинамический процесс тесно связаны с равновесием системы. Рассмотрим такую термодинамическую систему у которой отсутствует теплообмен с окружающей средой (адиабатная термодинамическая система). Происходящие в такой системе термодинамические процессы называют обратимыми, если система в ходе прямого и обратного процесса вернется в исходное состояние без какого-либо дополнительного теплового воздействия окружающей среды на систему. В случае если система в ходе обратного процесса не может возвратиться в исходное состояние или для этого требуется подвод тепла, то такой процесс называется необратимым.
Процесс при каждом изменении давления и температуры может быть обратимым только в том случае, когда на протяжении всего процесса от точки к точке термодинамической системы давление постоянно и температура в каждой точке равна температуре окружающей среды или их разность бесконечно мала.
Обратимые термодинамические процессы являются идеальным или теоретическим случаем. Все реальные процессы являются необратимыми, так как на практике выполнение условия квазистатичности трудно выполнимо. Кроме того, необратимость процессов вызывается наличием внутреннего трения в рабочем теле и поверхностного трения в техническом оборудовании (течение в сопле, трение поверхности поршня о стенку цилиндра и т.д.). Для преодоления трения всегда необходимо затратить некоторое количество механической работы, которая в ходе процесса превращается в тепло.
ЭНТАЛЬПИЯ. ФИЗИЧЕСКИЕ СВОЙСТВА
Энтальпией термодинамического тела называют сумму внутренней энергии u и произведения p v .
Где dl t - есть дифференциал технической работы ( dl t = - vdp ).
Полученное уравнение является также второй формулировкой первого закона термодинамики, используя понятия энтальпии и технической работы.
Величина i может также рассматриваться как параметр состояния термодинамического тела наряду с ранее введенными p , v , T , u . Физический смысл величины i может пояснен на основе уравнения (dq = di - vdp ), которое для процесса p = const запишется как: dq p = di .
Откуда следует, что di
есть элементарное количество теплоты, подведенное к термодинамическому телу в процессе постоянного давления.
Изменение энтальпии в любом процессе определяется только начальным и конечным состояниями тела и не зависит от промежуточных состояний и характера процесса.
ТЕПЛОЁМКОСТЬ РАБОЧЕГО ТЕЛА
Теплоемкостью
называют количество теплоты, которое необходимо сообщить телу (газу), чтобы повысить температуру какой-либо количественной единицы на 1° С.
Для определения значений перечисленных выше теплоемкостей достаточно знать величину одной какой-либо - из них. Удобнее, всего иметь величину мольной теплоемкости, тогда массовая теплоемкость:
а объемная теплоемкость:
Объемная и массовая теплоемкости связаны между собой зависимостью:
где - плотность газа при нормальных условиях.
Теплоемкость газа зависит от его температуры. По этому признаку различают среднюю и истинную теплоёмкость.
Если
q
-
количествотеплоты, сообщаемой единице количества газа (или отнимаемого от него) при изменении температуры газа от t
1
до t
2
то
Представляет собой среднюю теплоёмкость
в пределах. Предел этого отношения, когда разность температур стремиться к нулю, называют истинной теплоёмкостью.
ИЗОХОРНЫЙ ПРОЦЕСС ГАЗА
Изохорный процесс
– процесс сообщения или отнятия теплоты при постоянном объеме газа (
v
=
const).
При постоянном объёме давление газа изменяется прямо пропорционально абсолютным температурам:
Внешняя работа газа при v
=
const равна нулю l
=0.
количество теплоты или изменение внутренней энергии газа:
Изохорный процесс на pv – диаграмме отображается прямой вертикальной линией - изохора. При положительном количестве тепла линия идёт снизу вверх.
Изменение энтропии находится:
ИЗОБАРНЫЙ ПРОЦЕСС ГАЗА.
Изобарный процесс – процесс сообщения или отнятия теплоты при постоянном давлении (р
= const)
Кривая процесса называется изобарой.
Поскольку в изобарном процессе dp
=0
то в системе не совершается техническая работа, а количество тепла необходимое для перехода тела из состояния 1 в состояние 2 определяется как:
Таким образом в изобарном термодинамическом процессе подводимое (отводимое) к телу количество тепла пропорционально изменению энтальпии в данном процессе. Данный вывод справедлив как для обратимого так и для необратимого процессов, при условии, что система находится в термодинамическом равновесии в начале и конце процесса.
В случае обратимого процесса:
Изобарный процесс на pv
–
диаграмме отображается прямой горизонтальной линией. При подводе тепла в процесс линия простирается слева направо.

Механическая работа в таком процессе:
Удельная располагаемая (полезная) внешняя работа:
Из уравнения состояния идеального газа можно получить следующее соотношение для изобарного процесса:
Таким образом, при изобарном процессе объём идеального газа пропорционален абсолютной температуре. При расширении газа температура повышается, при сжатии уменьшается.
Изменение энтропии в изобарном процессе может быть расчитано следующим образом:
ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС ГАЗА.
Изотермический процесс – процесс сообщения или. отнятия теплоты при постоянной температуре (
t
-
const)
Для изотермического процесса идеального газа зависимость между начальными и конечными параметрами определяется формулами:
При постоянной температуре объём газа изменяется обратно пропорционально его давлению.
На pv
-
диаграмме изотермы идеального газа представляются равносторонней гиперболой. Площадь под кривой процесса численно выражает механическую работу в данном процессе. 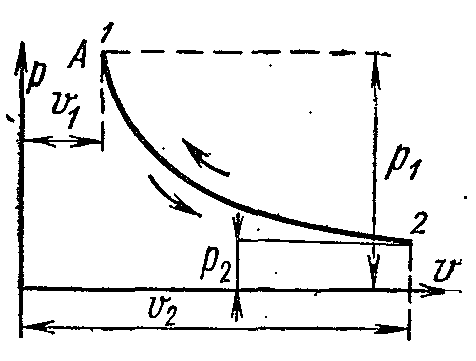
Работа 1 кг идеального газа находят из уравнений:
Так как в изотермическом процессе t
= const, то для идеального газа
Изменение энтропии в изотермическом процессе
Выразится следующей формулой:
АДИАБАТНЫЙ ПРОЦЕСС ГАЗА.
Процесс протекающий без подвода и отвода теплоты, т.е. при отсутствии теплообмена с окружающей средой, называют адиабатным, а кривая этого процесса –адиабатой. Условия процесса: dq =0 , q =0.
Т.к. dq =0 , то согласно первому закону термодинамики:
Таким образом совершаемая рабочим телом механическая работа в адиабатном термодинамическом процессе равна уменьшению внутренней энергии тела, техническая работа при этом пропорциональна изменению (уменьшению) энтальпии. В обратимом диабатном процессе энтропия термодинамического тела не меняется: S = Const .
Уравнение адиабаты в системе координат pv – диаграммы при постоянной теплоёмкости () для идеального газа: где - показатель адиабаты
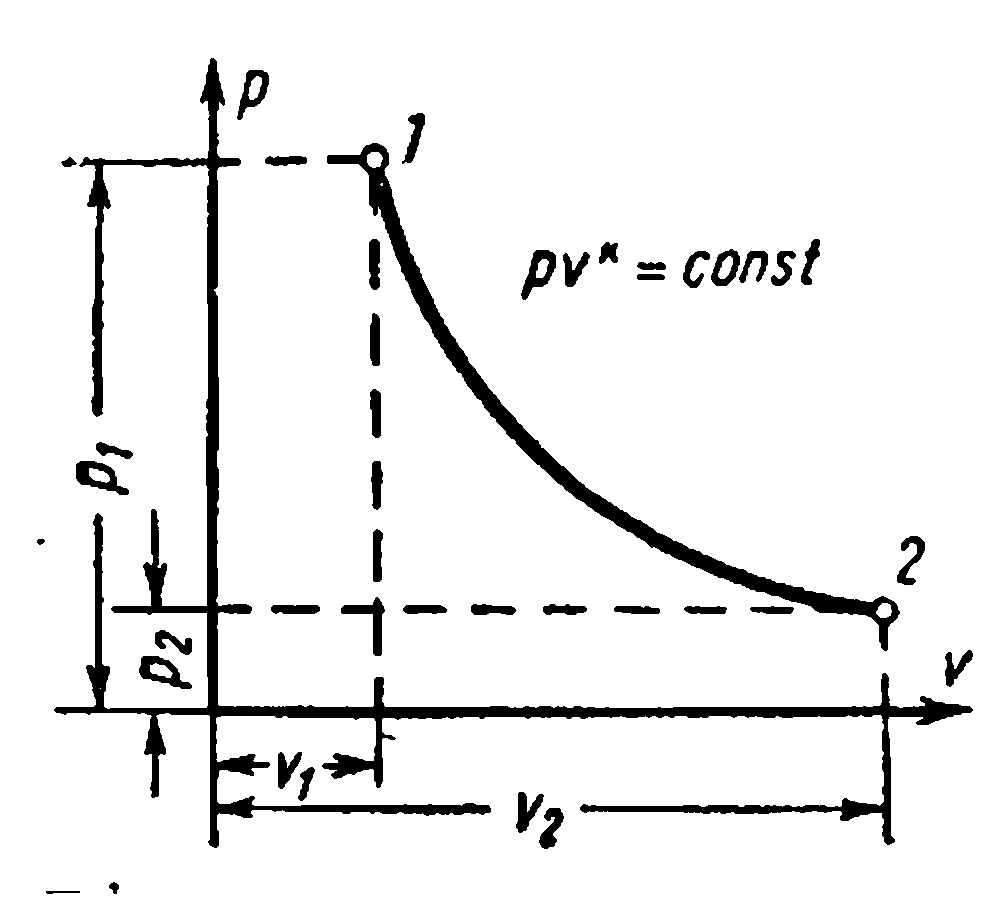
Зависимости между начальными и конечными параметрами процесса: между р и v ,
между T и v
между р и T
Работу 1 кг газа находят по следующим формулам
Изменение внутренней энергии газа и работа адиабатного процесса равны по величине и противоположны по знаку. .
Изменение внутренней энергии идеального газа в адиабатном процессе может быть также выражено уравнением
Второй закон термодинамики
Второй закон термодинамики устанавливает направление протекания самопроизвольных тепловых процессов в природе и определяет условия превращения теплоты в работу. Закон утверждает, что теплота в природе самопроизвольно переходит только от тел более нагретых к менее нагретым.
В соответствии со вторым законом термодинамики для превращения теплоты в работу в любом тепловом двигателе необходимо иметь два тела с различными температурами. Более нагретое тело будет источником теплоты для получения работы, менее нагретое – теплоприемником. При этом к. п. д. теплового двигателя всегда будет меньше единицы.
Второй закон динамики математически может быть выражен:
Где dS
–
бесконечно малое приращении энтропии системы;
dQ – бесконечно малое количество теплоты, полученной системой от источника теплоты;
T - абсолютная температура источника теплоты.
Знак неравенства соответствует необратимым процессам, а равенства - обратимым. Следовательно, аналитическое выражение второго закона термодинамики для бесконечно малого обратимого процесса примет вид
dQ = TdS
а т.к. согласно первому закону термодинамики
dQ=dU+pdV
TdS=dU+pdV.
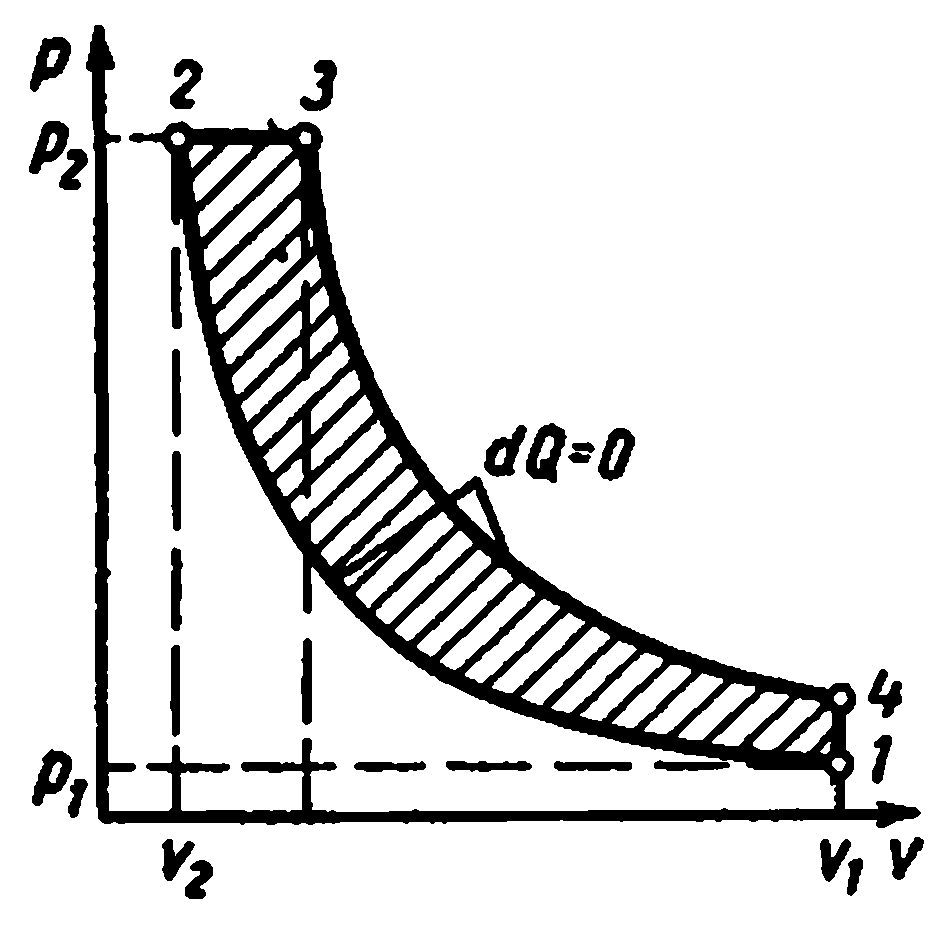
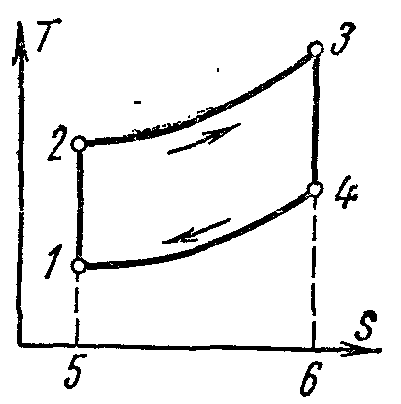
Цикл Карно и его свойства.
Цикл Карно. Состоит из двух изотерм и двух адиабат. Этот цикл представляет собой замкнутый процесс, совершаемый рабочим телом в идеальной тепловой машине при наличии двух источников теплоты: нагревателя и холодильника.

Цикл Карно в pv -диаграмме
Процессы 1-2 и 3-4 являются изотермическими, а 2-3 и 4-1 - адиабатными. Начальная температура рабочего тела в цикле принимается равной температуре нагревателя T 1 . При изотермическом расширении от состояния 1 до состояния 2 рабочее тело получает от нагревателя количество теплоты q 1 при температуре T 1 . На участке 2-3 рабочее тело адиабатно расширяется. При этом температура рабочего тела понижается от T 1 до T 2 , а давление падает от p 2 до p 3 . При сжатии по изотерме 3-4 от рабочего тела отводится к холодильнику количество теплоты q 2 при температуре T 2 . Дальнейшее сжатие по адиабате 4-1 приводит к повышению температуры рабочего тела от T 2 до T 1 , а рабочее тело возвращается в первоначальное состояние.
Суммарная работа цикла l ц графически изображается площадью 12341.
Термический к. п. д. цикла:
Работа цикла Карно
Термический к.п.д. цикла:

Характеристики цикла:
Степень сжатия
Степень повышения давления
Количество подведённой теплоты:
Количество отведённой теплоты:
Работа цикла
Термический к.п.д. цикла:
Цикл с подводом теплоты при постоянном давлении состоит из двух адиабат, одной изобары и одной изохоры.
Характеристики цикла:
Степень сжатия
Количество подведённой теплоты:
Количество отведённой теплоты:
Работа цикла
Термический к.п.д. цикла:
Цикл с комбинированным подводом теплоты состоит из двух адиабат, двух изохор и одной изобары

Характеристики цикла
Количество подведённой теплоты
Количество отведённой теплоты
Термический к.п.д. цикла
Таблицы водяного пара.
Перегретый пар или насыщенный пар по своим свойствам значительно отличаются от идеальных газов. Уравнения для состояния паров весьма сложны и в расчётной практике не применяются. Для практических целей используют таблицы и диаграммы, составленные на основании опытных и теоретических данных. Таблицы составлены с высокой степенью точности для перегретых и насыщенных паров до температуры 1000 0 С и давления 98,0 Мпа.
В таблицах для насыщенного пара приведены температуры насыщения, давления, значения удельных объёмов, энтальпия и энтропия жидкости и сухого пара, теплота парообразования. В таблицах перегретого пара приведены для различных давлений и температур величины основных параметров: удельный объём, энтальпия и энтропия.
i – S диаграмма водяного пара .
Большим достоинством is диаграммы является то, что техническая работа и количество теплоты, участвующие в процессах, изображаются отрезками линий, а не площадями. При построении is - диаграммы по оси ординат откладывается удельная энтальпия пара, а по оси абсцисс – удельная энтропия. За начало координат принято состояние воды в тройной точке, где, .
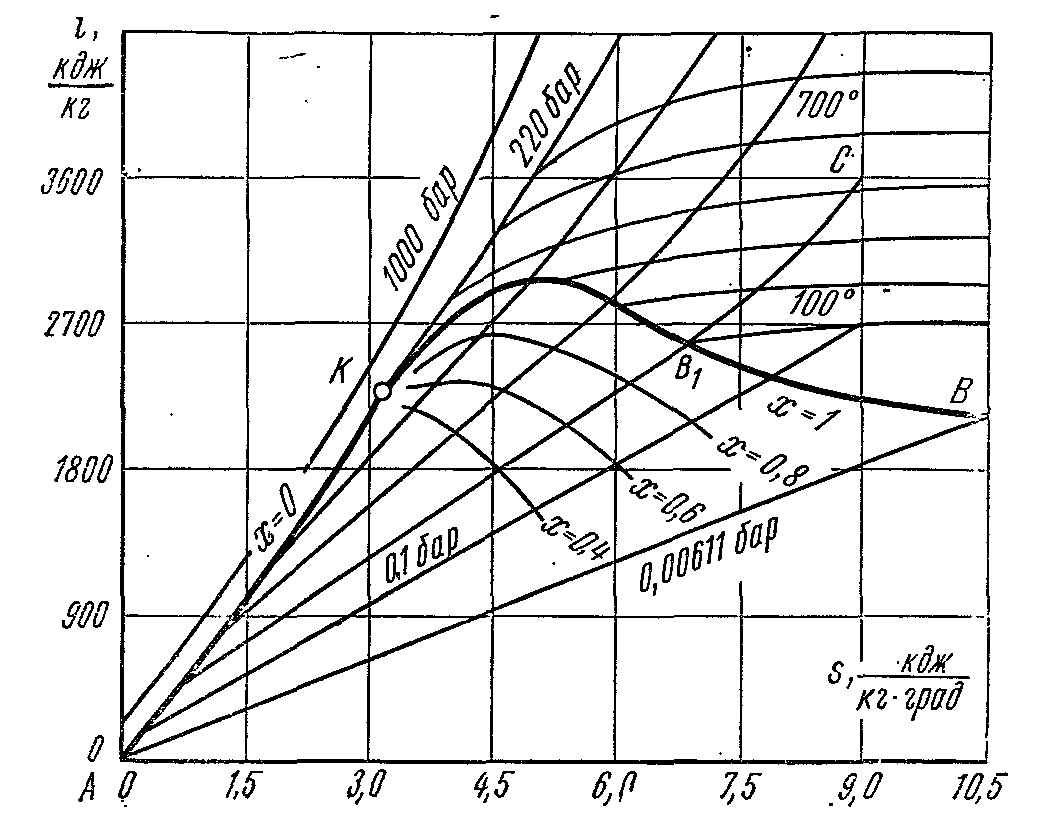
Пользуясь данными таблиц водяного пара, на диаграмму наносят пограничные кривые жидкости и пара, сходящиеся в критической точке К. Пограничная кривая жидкости выходит из начала координат, т.к. в этой точке энтропию и энтальпию принимают равной нулю. Состояние воды отмечают точками на соответствующих изобарах. Линии изобар в области влажного пара являются прямыми наклонными линиями расходящимися веером от пограничной кривой жидкости. В изобарном процессе:
Угловой коэффициент наклона изобары к оси абсцисс в каждой точке диаграммы числено равен абсолютной температуре данного состояния. Т.к. в области влажного пара изобара совпадает с изотермой, то согласно последнему уравнению изобары влажного пара являются прямыми линиями:
А это и есть уравнение прямой линии. В области перегретого пара изобары имеют кривизну с выпуклостью, обращённой вниз. В области влажного пара наносится сетка линий постоянной сухости пара (x=const) которые сходятся в критической точке К.
Изотермы в области влажного пара совпадают с изобарами. В области перегретого пара они расходятся: изобары поднимаются вверх, а изотермы представляют собой кривые линии, обращённые выпуклостью вверх. На диаграмму наносят сетку изохор, которые имеют вид кривых, поднимающихся более круто вверх по сравнению с изобарами. Обратимый адиабатный процесс изображается вертикальной прямой. Область лежащая ниже изобары тройной точки изображает состояния смеси пар + лёд.
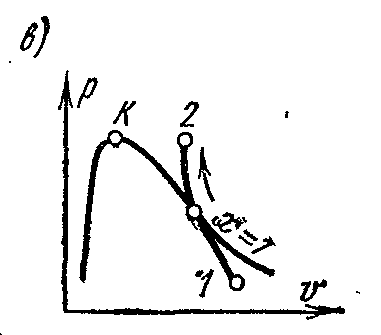
Адиабатический процесс p – V , i – S и T – S диаграммах.
Адиабатный процесс совершается без подвода и отвода теплоты, и энтропия рабочего тела при обратимом процессе остаётся постоянной величиной: s=const. Поэтому на is
и
Ts
-
диаграммах адиабаты изображаются вертикальными прямыми: рис. а и б

При адиабатном расширении давление и температура пара уменьшаются; перегретый пар переходит в сухой, а затем во влажный пар. Из условий постоянства энтропии возможны определение конечных параметров пара, если известны параметры начального и один параметр конечного состояний.
На pv - диаграмме обратимый адиабатный процесс изображается некоторой кривой (рис. в)
Удельная работа в адиабатном процессе определяется из уравнения:
Изменение удельной внутренней энергии:
Многоступенчатое сжатие в компрессоре.
Для получения газа высокого давления применяют многоступенчатые компрессоры
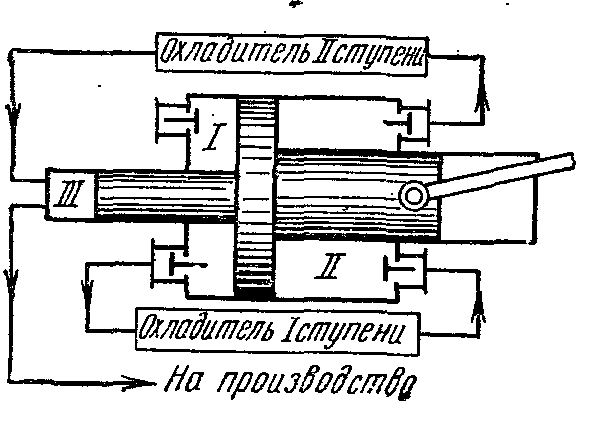
В которых сжатие газа осуществляется политропно в нескольких последовательно соединённых цилиндрах с промежуточным его охлаждением после каждого сжатия.
Применение сжатия газа в нескольких цилиндрах понижает отношение давлений в каждом из них и повышает объёмный к.п.д. компрессора. Кроме того, промежуточное охлаждение газа после каждой ступени улучшает условия смазки поршня в цилиндре и уменьшает расход энергии на привод компрессора.

Идеальная индикаторная диаграмма трёхступенчатого компрессора, где 0-1 – линия всасывания в первую ступень;
1-2 – политропный процесс сжатия в первой ступени; 2-а – линия нагнетания из первой ступени в первый охладитель; а-3 – линия всасывания во вторую ступень; 3-4 – политропный процесс сжатия во второй ступени; 4-в – линия нагнетания из второй ступени во второй охладитель; в-5 – линия всасывания в третью ступень; 5-6 - политропный процесс сжатия в третьей ступени; 6-с – линия нагнетания из третьей ступени в резервуар или на производство. Отрезки 2-3, 4-5 изображают уменьшение объёма газа в процессе при постоянном давлении от охлаждения в первом и втором охладителях. Охлаждение рабочего тела во всех охладителях производится до одной и той же температуры, равной начальной Т 1 , поэтому температуры газа в точках 1, 3 и 5 одинаковые и лежат на изотерме 1 – 7.
Отношение давлений во всех ступенях обычно берётся одинаковым:
При одинаковых отношениях давлений во всех ступенях, равенстве начальных температур и равенстве показателей политропы равны между собой и конечные температуры газа в отдельных ступенях компрессора:
Степень увеличения давления в каждой ступени или при z ступеней
Степень увеличения давления в каждой ступени равна корню z-й степени из отношений конечного давления
К начальному
При равенстве температур газа у входа в каждую ступень и равенстве отношений давлений во всех цилиндрах получаем равенство затраченных работ во всех ступенях компрессора:
Во второй ступени
Работа в третьей ступени
Откуда l
1
=l
2
=l
3
Полная удельная работа в джоулях, расходуемая на сжатие газа в трёх ступенях компрессора: l к =3 l 1
При одинаковых условиях сжатия газа количества теплоты, отводимые от газа в отдельных ступенях, равны между собой:
Теплоту отводимую от газа в любом охладителе при изобарном процессе охлаждения, находим по формуле:

В Ts - диаграммах процессы адиабатного сжатия изображены прямыми 1-2, 3-4, 5-6, а процессы охлаждения кривыми 2-3, 4-5, 6-7.
Процессы политропного сжатия изображены кривыми 1-2, 3-4, 5-6, а процессы охлаждения в охладителях - линиями 2-3, 4-5, 6-7.
Цикл ДВС со сгоранием при V = const
![]()
На рисунке изображена индикаторная диаграмма двигателя, работающего с быстрым сгоранием топлива при постоянном объёме. В качестве горючего используется бензин, светильный или генераторный газ, спирты и др.
При ходе поршня из левого мёртвого положения в крайнее правое через всасывающий клапан засасывается горючая смесь. Этот процесс изображён кривой 0-1, называется линией всасывания, она не является термодинамическим процессом, т.к. в нём основные параметры не изменяются, а изменяются только масса и объём смеси в цилиндре. При обратном движении поршня всасывающий клапан закрывается, происходит сжатие горючей смеси. Изображается кривой 1-2, называется линией сжатия. В точке 2 происходит воспламенение горючей смеси от электрической искры. Сгорание горючей смеси происходит почти мгновенно, т.е. практически при постоянном объёме. Этот процесс изображён кривой 2-3. В результате сгорания топлива температура газа резко возрастает и давление увеличивается (точка 3). Затем продукты горения расширяются. Поршень перемещается в правое мёртвое положение, и газы совершают полезную работу. На индикаторной диаграмме процесс расширения изображается кривой 3-4, называемой линией расширения. В точке 4 открывается выхлопной клапан, и давление в цилиндре падает почти до наружного давления. При дальнейшем движении поршня справа на лево из цилиндра удаляются продукты сгорания через выхлопной клапан при давлении, несколько превышающим атмосферное давление. Изображается кривой 4-0 и называется линией выхлопа. Такой рабочий процесс совершается за четыре хода поршня или за два оборота вала. Такие двигатели называются четырёхтактными.
Цикл с подводом теплоты при постоянном объёме состоит из двух адиабат и двух изохор
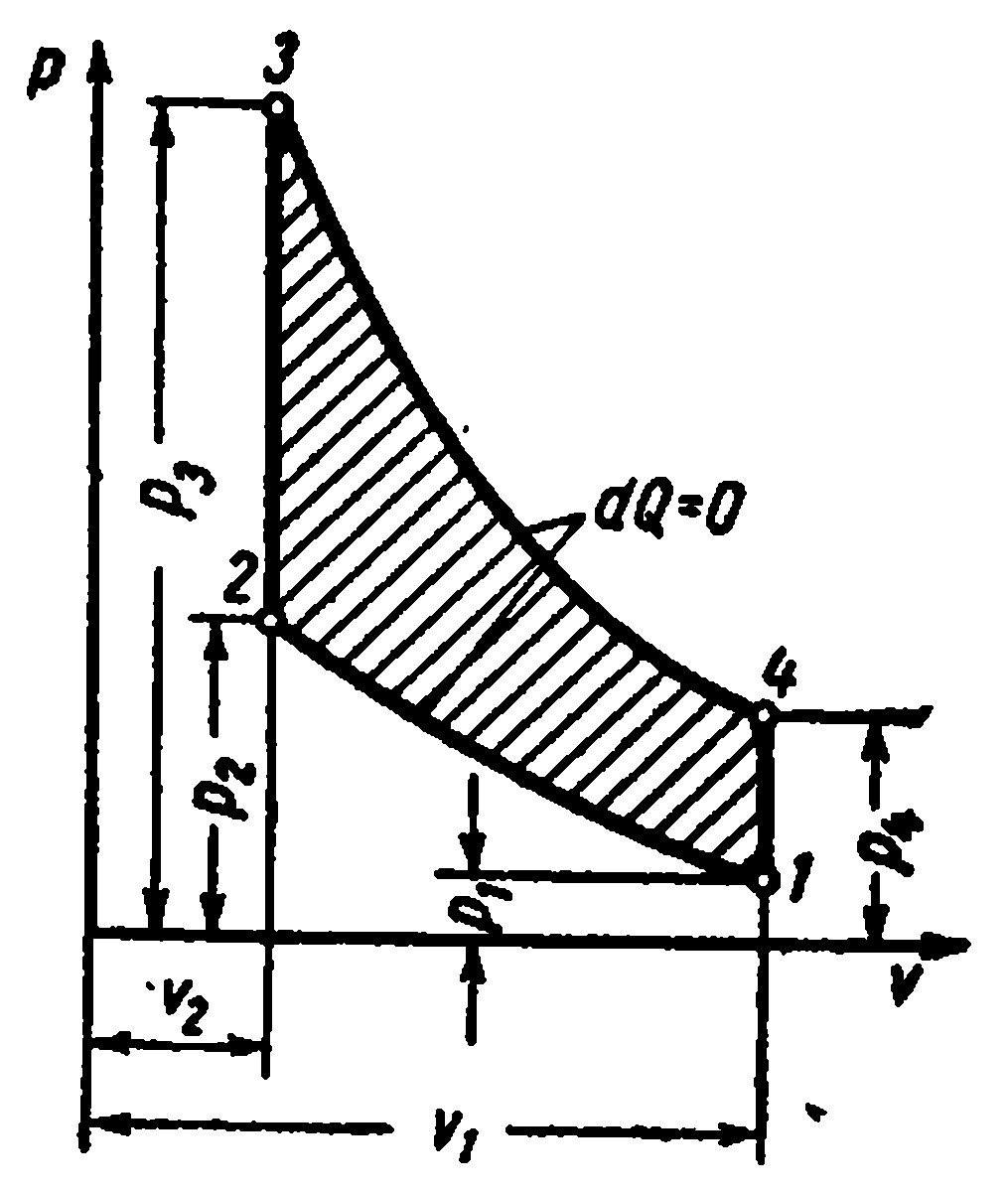
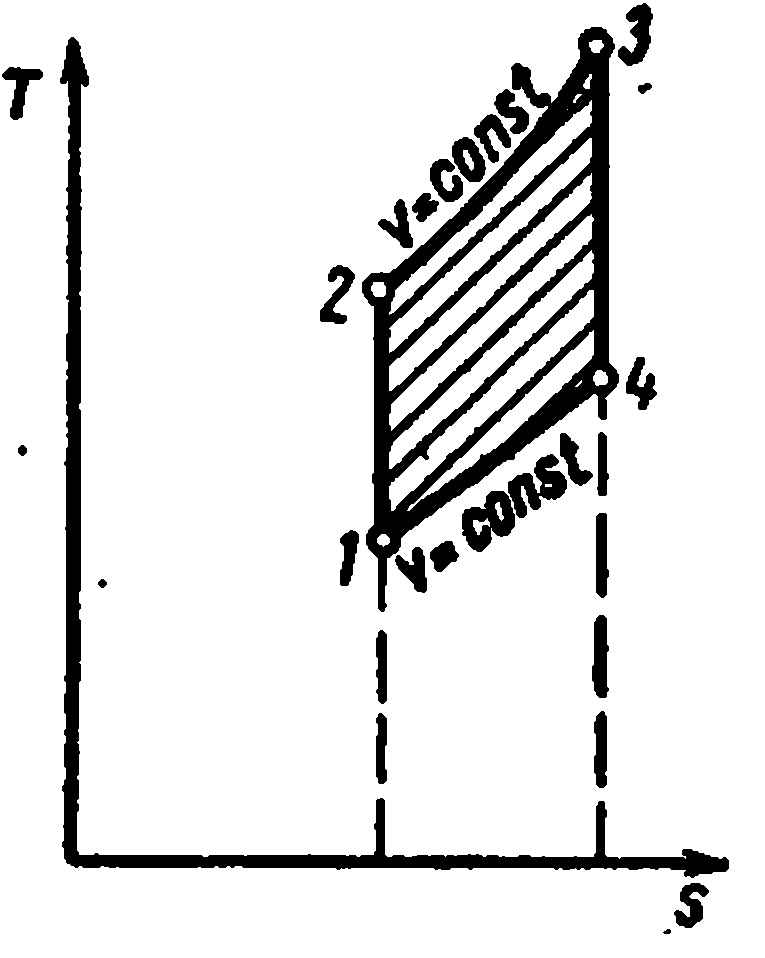
Характеристиками цикла являются:
– степень сжатия
– степень повышения давления
Количество подведённой теплоты:
Количество отведённой теплоты:
Работа цикла
Термический к.п.д. цикла:
Цикл ДВС со сгоранием при p = const
Изучение циклов с подводом количества теплоты при постоянном объёме показало, что для повышения экономичности двигателя, работающего по этому циклу, необходимо применять высокие степени сжатия. Воздух при большом сжатии имеет настолько высокую температуру что подаваемое в цилиндр топливо самовоспламеняется без запальных приспособлений. Раздельное сжатие воздуха и топлива позволяет использовать любое жидкое тяжёлое и дешёвое топливо – нефть, мазут, смолы, каменноугольные масла.
Таким достоинством обладают двигатели, работающие с постепенным сгоранием топлива при постоянном давлении. В них воздух сжимается в цилиндре двигателя, а жидкое топливо распыляется сжатым воздухом от компрессора.
Идеальный цикл двигателя с постепенным сгоранием топлива при постоянном давлении, т.е. цикл с подводом количества теплоты при постоянном давлении осуществляется следующим образом.
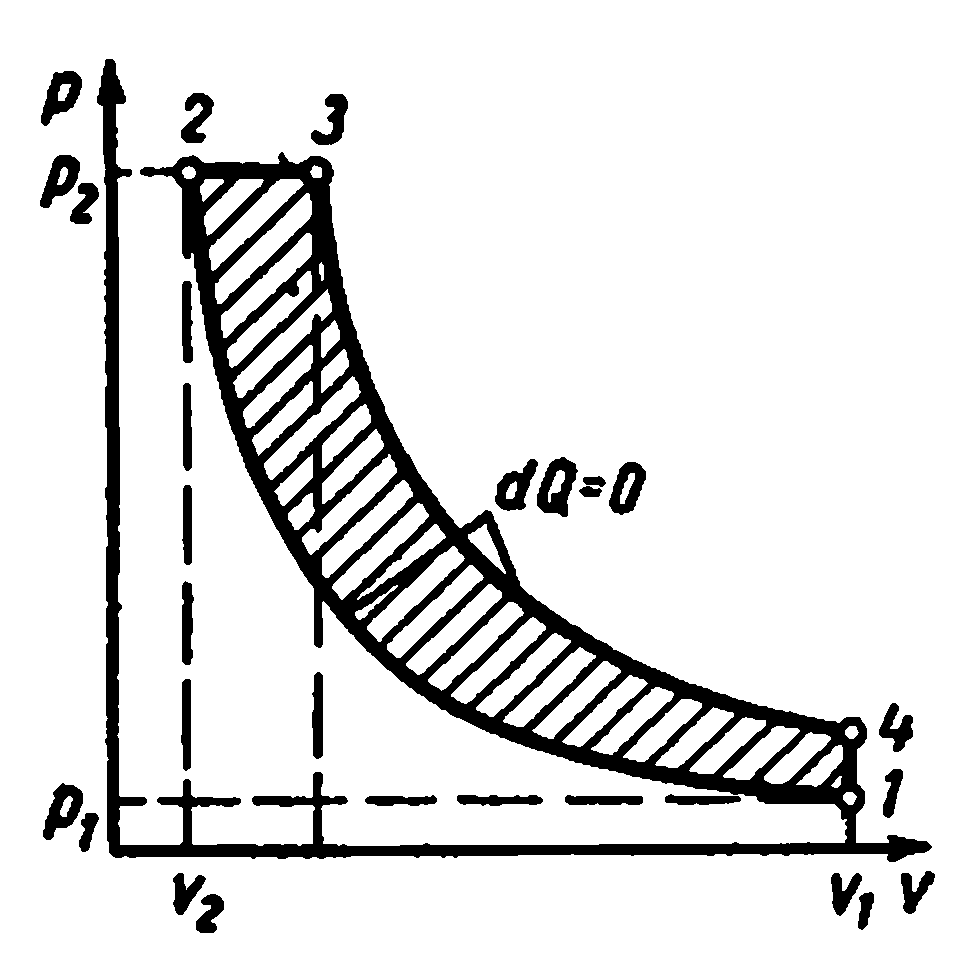

Газообразное рабочее тело с начальными параметрами p 1 , v 1 , T 1 сжимается по адиабате 1-2; затем телу по изобаре 2-3 сообщается некоторое количество теплоты q 1 . От точки 3 рабочее тело расширяется по адиабате 3-4. По изохоре 4-1 рабочее тело возвращается в первоначальное состояние, при этом в теплоприёмник отводится теплота q 2 .
Характеристики цикла:
Степень сжатия
Степень предварительного расширения.
Количество подведённой теплоты:
Количество отведённой теплоты:
Работа цикла
Термический к.п.д. цикла:
Цикл ДВС с подводом тепла при V и p = const
В бескомпрессорном двигателе высокого сжатия со смешанным подводом количества теплоты жидкое топливо топливным насосом подаётся через топливную форсунку в головку цилиндра в виде мельчайших капелек. Попадая в нагретый воздух, топливо самовоспламеняется и горит в течении всего периода, пока открыта форсунка: вначале при постоянном объёме, а затем при постоянном давлении.

Идеальный цикл двигателя со смешанным подводом количества теплоты изображён в pv – и Ts – диаграммах.
Рабочее тело с начальными параметрами p 1 , v 1 , T 1 сжимается по адиабате 1-2 до точки 2. По изохоре 2-3 к рабочему телу подводится первая доля теплоты. По изобаре 3-4 подводится вторая доля теплоты. От точки 4 рабочее тело расширяется по адиабате 4-5. По изохоре 5-1 рабочее тело возвращается в первоначальное состояние – в точку 1, при этом отводится теплота в теплоприёмник.
Характеристики цикла являются:
Степень сжатия
– степень повышения давления
Степень предварительного расширения.
Определим термический КПД цикла при условии что теплоёмкости c
p
,
c
v
и показатель адиабаты k
=
c
p
/
c
v
постоянны:
Первая доля подведённой теплоты:
Вторая доля подведённого количества теплоты:
Количество отведённой теплоты:
Термический КПД цикла
Цикл газотурбинной установки
Рабочим телом в газотурбинных установках являются продукты сгорания жидкого или газообразного топлива.

На рисунке представлена схема наиболее распространённого типа газотурбинной установки со сгоранием топлива при постоянном давлении.
Компрессор К, расположенный на одном валу с газовой турбиной Т
, всасывает воздух из атмосферы и сжимает его до заданного давления. Сжатый в компрессоре воздух поступает в камеру сгорания КС
; туда же топливным насосом ТН
подаётся жидкое горючее. Сгорание происходит при постоянном давлении. Из камеры сгорания газы поступают в сопла С
, из которых они с большой скоростью поступают на рабочие лопатки Л
турбины и приводят во вращение её ротор. Отработавшие газы через выпускной патрубок П
выпускаются в атмосферу.
Цикл ГТУ с подводом количества теплоты в процессе
p
=
const
.
Идеальный цикл газотурбинной установки на pv
– и
Ts
– диаграммах
с подводом теплоты при p
=
const
.
Цикл состоит из двух адиабат и двух изобар.
Отвод теплоты от рабочего тела производится не по изохоре, как в ДВС, а по изобаре. Рабочее тело с начальными параметрами p 1 , v 1 , T 1 сжимается по адиабате 1-2 до точки 2. От точки2 к рабочему телу подводится некоторое удельное количество теплоты q 1 по изобаре 2-3. Затем рабочее тело расширяется по адиабате 3-4 до начального давления и возвращается по изобаре 4-1 в первоначальное состояние, при этом отводится удельное количество теплоты q 2 .
Характеристиками цикла является степень повышения давления в компрессоре и степень изобарного расширения.
Количество подводимой теплоты:
Количество отводимой теплоты:
Термический КПД цикла
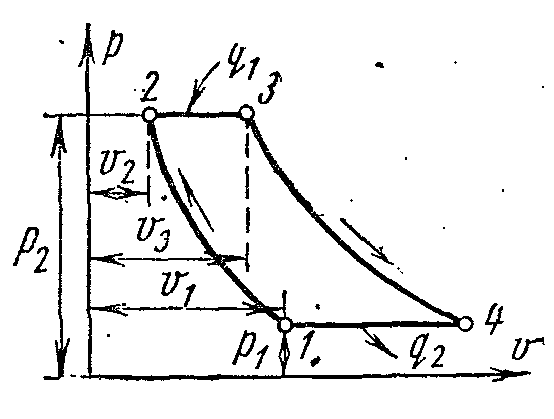
Цикл паросиловой установки. Цикл Ренкина.
За основной цикл в паротурбинной установке принят идеальный цикл Ренкина. В этом цикле осуществляется полная конденсация рабочего тела в конденсаторе, вследствие чего вместо громоздкого малоэффективного компрессора для подачи воды в котёл применяют питательный водяной насос, который имеет малые габариты и высокий КПД.
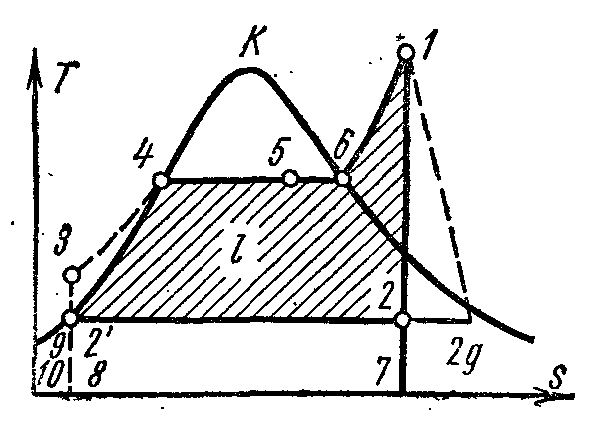
На pv - диаграмме точка 4 характеризует состояние кипящей воды в котле при давлении p 1 . Линия 4-5 изображает процесс парообразования в котле; затем пар подсушивается в перегревателе при давлении p 1 . Полученный пар по адиабате 1-2 расширяется в цилиндре парового двигателя до давления p 2 в конденсаторе. В процессе 2 – пар полностью конденсируется до состояния кипящей жидкости при давлении p 2 , отдавая теплоту парообразования охлаждающей воде. Процесс сжатия воды осуществляется в насосе; получающееся при этом повышение температуры воды ничтожно мало, и им в исследованиях при давлениях до 3,0 – 4,0 МПа пренебрегают. Линия 3-4 изображает изменение объёма воды при нагревании от температуры в конденсаторе до температуры кипения. Работа насоса изображается заштрихованной пл. 03 7. Энтальпия пара при выходе из перегревателя в точке 1 равна i 1 и на Ts –диаграмме изображается пл. 9 34617109. Энтальпия пара при входе в конденсатор в точке 2 равна i 2 и на Ts –диаграмме изображается пл. 9 . Энтальпия воды при выходе из конденсатора в точке равна i 1 и на Ts –диаграмме изображается пл. 9 8109. Полезная работа пара в цикле Ренкина l изображается на pv - диаграмме пл. .
Если в цикле Ренкина учитывать работу насоса, то процесс адиабатного сжатия воды в нём представится на Ts - диаграмме адиабатой, а изобара 3-4 соответствует нагреванию воды в котле при давлении p 1 до соответствующей температуры кипения.
Термический КПД цикла Ренкина определяется по формуле:
Удельное количество теплоты в цикле подводится при p
=
const
в процессах 3-4 (подогрев воды до температуры кипения), 4-6 (парообразование) и 6-1(перегрев пара) и равно разности энтальпий начальной и конечной точек процесса:
Это удельное количество теплоты изображается на Ts
–диаграмме
пл. 8 . Отвод удельного количества теплоты q
2
осуществляется в конденсаторе по изобаре 2- , следовательно
Отводимая теплота изображается на Ts –диаграмме пл.
Термический КПД цикла Ренкина:
Цикл воздушной компрессорной холодильной установки
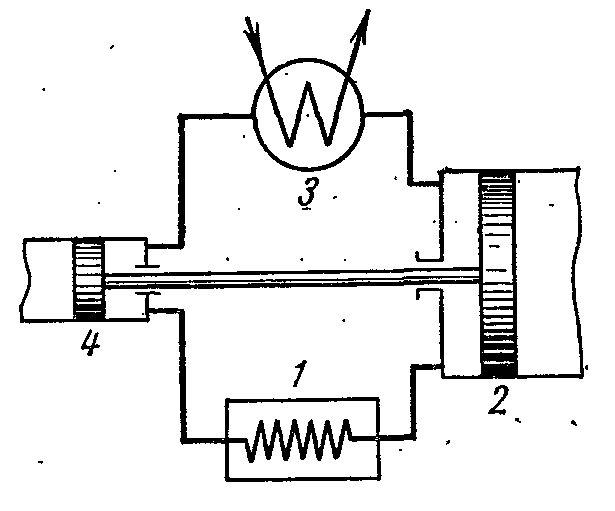
На рисунке изображена схема воздушной холодильной установки, где в качестве рабочего тела применяют воздух, являющийся наиболее удобным, безвредным и доступным рабочим телом. Воздушная холодильная установка работает следующим образом.
Воздух, охлаждающий помещение 1, сжимается в компрессоре 2, в результате чего температура его увеличивается. Сжатый воздух при постоянном давлении нагнетается в теплообменник 3, в котором охлаждается водой до температуры окружающей среды. После этого сжатый воздух поступает в расширительный цилиндр, или детандер 4, где расширяется до начального давления. При расширении температура воздуха падает до -60 или -70 0 С и холодильный воздух направляется для охлаждения помещения, где, нагреваясь, опять поступает в компрессор.

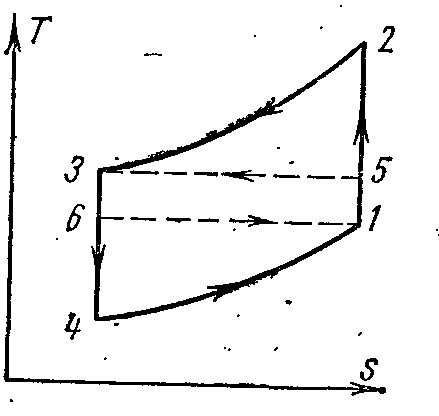
В pv – и Ts – диаграммах:
Воздух в процессе 1-2 адиабатно сжимается от давления p 1 до p 2 . В изобарном процессе 2-3 от воздуха отводится удельное количество теплоты внешнему источнику и температура его понижается от T 2 до Т 3 . При адиабатном расширении в процессе 3-4 воздух дополнительно охлаждается от температуры Т 3 до Т 4 . Далее в изобарном процессе 4-1 происходит отвод теплоты от охлаждаемого помещения (теплоотдатчика), в результате чего воздух нагревается от Т 4 до Т 1 .
Работа затрачиваемая на осуществление цикла, равна разности удельных количеств теплоты q 1 и q 2. Считая теплоёмкость постоянной имеем:
Тогда холодильный коэффициент цикла:
=
Из адиабатных процессов 1-2 и 3-4
И
Но p
2
=
p
3
, а p
1
=
p
4
тогда
Окончательно имеем
Где Т
1
– температура охлаждаемого помещения или температура воздуха, засасываемого в компрессор.
Т 2 – температура сжатого воздуха.
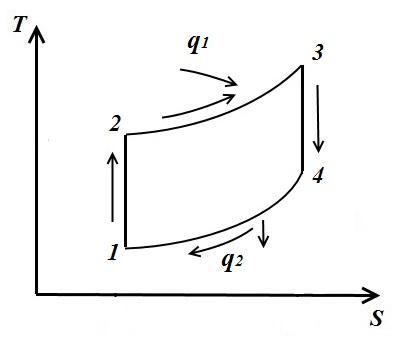
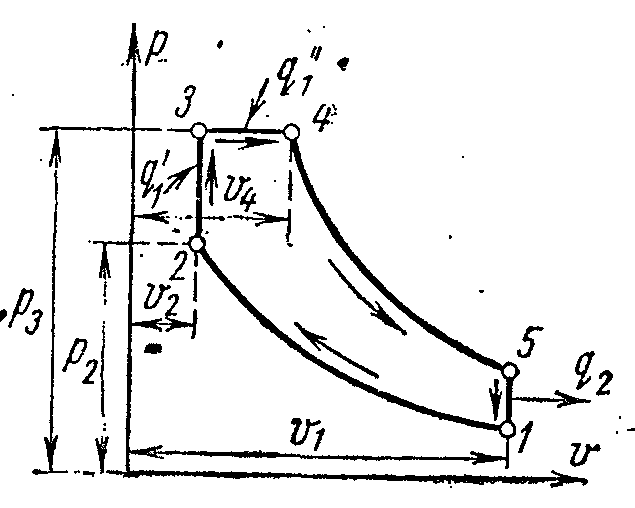
Цикл паровой компрессорной холодильной установки
Наибольшее распространение для охлаждения тел до температуры -20 0 С получили холодильные установки, в которых холодильным агентом являются легкокипящие жидкости - аммиак, фреоны, сернистый ангидрид и другие при невысоких давлениях (желательно близких к атмосферному).
На рисунке схема компрессорной установки, работающей на парах аммиака NH 3 .
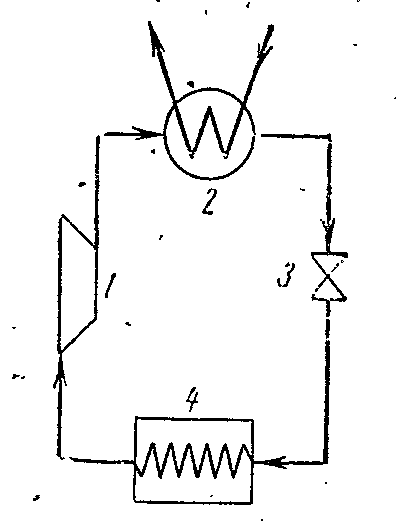

1- компрессор; 2- конденсатор; 3- дроссельный вентиль; 4 – охлаждаемое помещение (испаритель)
В компрессоре сжимается аммиачный сухой насыщенный пар или влажный пар с большой степенью сухости по адиабате 1-2 до состояния перегретого пара в точке 2. Из компрессора пар нагнетается в конденсатор, где полностью превращается в жидкость (процесс 2-3-4). Из конденсатора жидкий аммиак проходит через дроссельный вентиль, в котором дросселируется, что сопровождается понижением температуры и давления. Затем жидкий аммиак с низкой температурой поступает в охладитель, где, получая количество теплоты (в процессе 5-1) испаряется и охлаждает рассол, который циркулирует в охлаждаемых камерах. Процесс дросселирования как необратимый процесс изображается на диаграмме условной кривой 4-5.
В паровой компрессорной установке не применяется расширительный цилиндр (детандер), а рабочее тело дросселируется в регулировочном вентиле. Замена расширительного цилиндра дросселем сопровождается возрастанием энтропии, что вызывает некоторую потерю холодопроизводительности, но эта замена значительно упрощает установку и даёт возможность легко регулировать давление пара и получать необратимую температуру в охладителе.
Удельная работа затраченная на совершение цикла: =
Холодильный коэффициент компрессорной аммиачной установки:
Где - удельное количество теплоты, воспринимаемое аммиачным паром в охладителе.
Холодильный коэффициент установки
Значения энтальпий в уравнении определяют по is
-диаграмме
или по таблице аммиака.
Паровые холодильные установки имеют большое преимущество перед воздушными. Они компактны, дёшевы и имеют более высокий холодильный коэффициент.
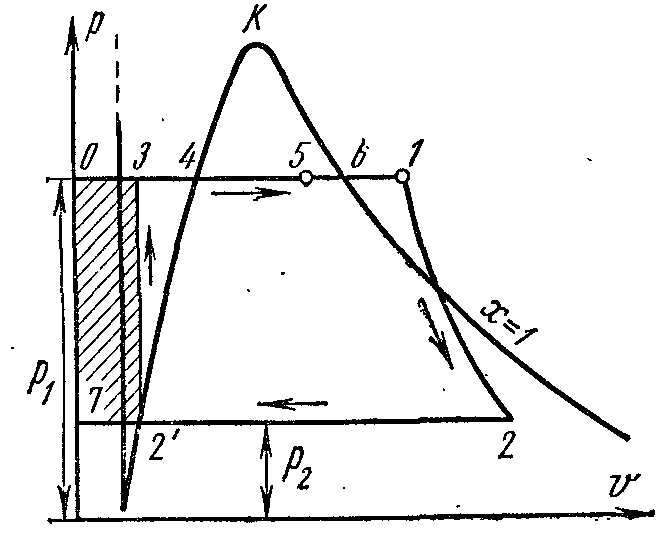
Процесс парообразования в p – V диаграмме
Фазовая pv – диаграмма системы, состоящей из жидкости и пара, представляет собой график зависимости удельных объёмов воды и пара от давления.
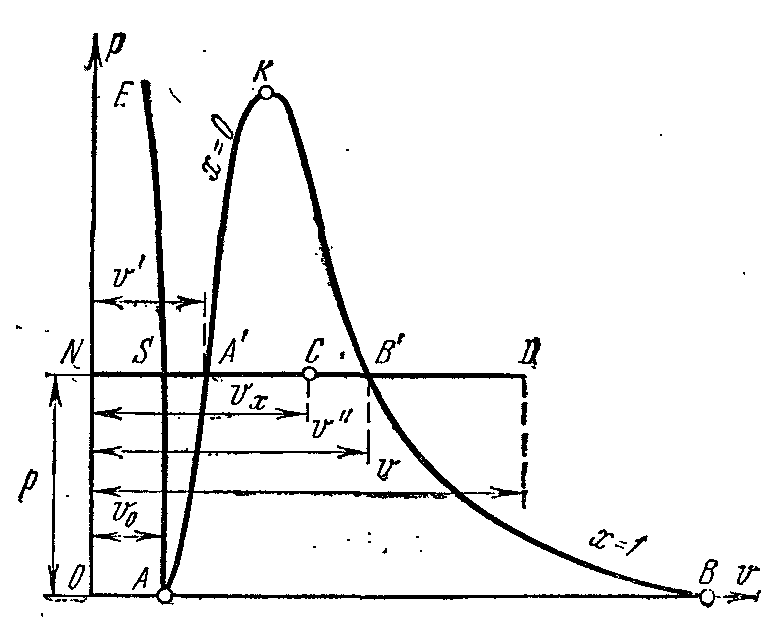
Пусть вода при температуре 0 0 С и некотором давлении? занимает удельный объём v 0 (отрезок NS) . Вся кривая АЕ выражает зависимость удельного объёма воды от давления при температуре 0 0 С . Т.к. вода вещество почти несжимаемое то кривая АЕ почти параллельна оси ординат. Если при постоянном давлении сообщать воде теплоту, то её температура будет повышаться и удельный объём увеличиваться. При некоторой температуре t s вода закипает, а её удельный объём v ’ в точке А’ достигнет при данном давлении максимального значения. С увеличением давления растёт температура кипящей жидкости t s и объём v ’ также увеличивается. График зависимости v ’ АК которая называется пограничной кривой жидкости. Характеристикой кривой является степень сухости x =0 . В случае дальнейшего подвода теплоты при постоянном давлении начнётся процесс парообразования. При этом количество воды уменьшается, количество пара увеличивается. В момент окончания парообразования в точке В’ пар будет сухим насыщенным. Удельный объём сухого насыщенного пара обозначается v ’’ .
Если процесс парообразования протекает при постоянном давлении то температура его не изменяется и процесс A ’ B ’ является одновременно изобарным и изотермическим. В точках A ’ и B ’ вещество находится в однофазном состоянии. В промежуточных точках вещество состоит из смеси воды и пара. Такую смесь тел называют двухфазной системой .
График зависимости удельного объёма v ’’ от давления представлен кривой КВ, которая называется пограничной кривой пара.
Если к сухому насыщенному пару подводить теплоту при постоянном давлении, то температура и объём его будут увеличиваться и пар из сухого насыщенного перейдёт в перегретый (точка D ). Обе кривые АК и КВ делят диаграмму на три части. Влево от пограничной кривой жидкости АК до нулевой изотермы располагается область жидкости. Между кривыми АК и КВ располагается двухфазная система, состоящая из смеси воды и сухого пара. Вправо от КВ и вверх от точки К располагается область перегретого пара или газообразного состояния тела. Обе кривые АК и КВ сходятся в одной точке К , называемой критической точкой.
Критическая точка является конечной точкой фазового перехода жидкость – пар, начинающегося в тройной точке. Выше критической точки существование вещества в двухфазном состоянии невозможно. Никаким давлением нельзя перевести газ в жидкое состояние притемпературах выше критической.
Параметры критической точки для воды:
t к =374,12 0 С; v к =0,003147 м 3 /кг;
? к =22,115 МПа; i к =2095,2 кДж/кг
s к =4,424 кДж/(кг·К).
Процесс p = const водяного пара. Изображение процесса в p – V , i – S и T – S диаграммах.
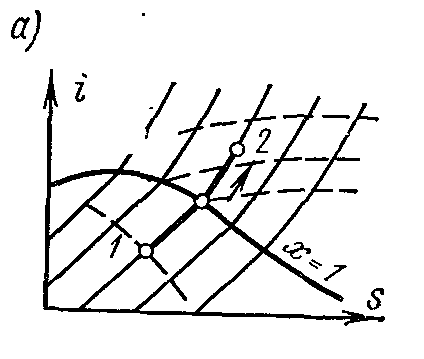
На is – диаграмме изобара в области насыщенного пара представляется прямой линией, пересекающей пограничные кривые жидкости пара. При подводе теплоты к влажному пару степень сухости его увеличивается и он (при постоянной температуре) переходит в сухой, а при дальнейшем подводе теплоты – в перегретый пар. Изобара в области перегретого пара представляет собой кривую, направленную выпуклостью вниз.
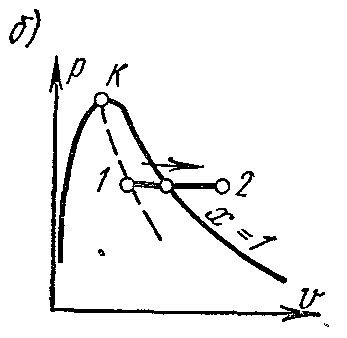
На pv – диаграмме изобарный процесс изображается отрезком горизонтальной прямой, который в области влажного пара изображает и изотермический процесс одновременно.
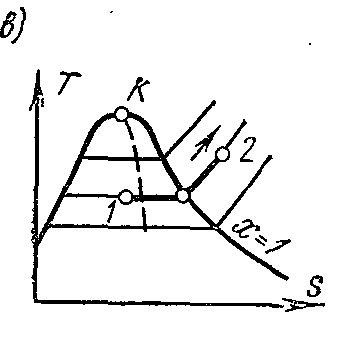
На Ts – диаграмме в области влажного пара изобара изображается прямой горизонтальной линией, а в области перегретого пара – кривой, обращённой выпуклостью вниз. Значения всех необходимых величин для расчёта берутся из таблиц насыщенных и перегретых паров.
Изменение удельной внутренней энергии пара:
Внешняя работа:
Подведённое удельное количество теплоты:
В том случае, когда q задано и требуется найти параметры второй точки, лежащей в области двухфазных состояний, применяется формула для энтальпии влажного пара:
Процесс T = const водяного пара. Изображение процесса в p – V , i – S и T – S диаграммах.
Изотермический процесс.

На is – диаграмме в области влажного пара изотерма совпадает с изобарой и является прямой наклонной линией. В области перегретого пара изотерма изображается кривой с выпуклостью вверх.
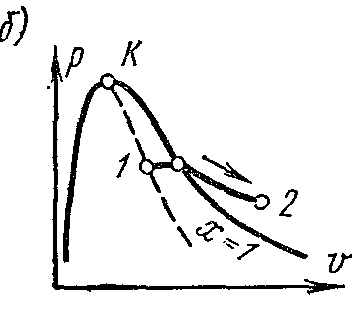
На pv – диаграмме в области влажного пара изотермический процесс изображается горизонтальной прямой. Для насыщенного пара этот процесс совпадает с изобарным. В области перегрева давление пара понижается, а процесс изображается кривой с выпуклостью к оси абцисс.
![]()
На Ts – диаграмме изотермный процесс изображается отрезком горизонтали.
Удельная внутренняя энергия водяного пара в отличие от внутренней энергии идеального газа изменяется в следствии изменения потенциальной составляющей, поэтому при T
=
const
Подведённое удельное количество теплоты в процессе:
Внешняя работа определяется из первого закона термодинамики:
Формула Майера.
Особое значение в термодинамике имеют теплоемкости газа при постоянном давлении, т.е. в изобарном процессе – и при постоянном объеме, т.е. в изохорном процессе – . Эти теплоемкости связываются формулой Майера
Отношение теплоемкостей
Где k – показатель адиабаты.
Понятие «Холодильный коэффициент»
Холодильный коэффициент безразмерная величина (обычно больше единицы), характеризующая энергетическую эффективность работы холодильной машины; равна отношению холодопроизводительности к количеству энергии (работе), затраченной в единицу времени на осуществление холодильного цикла. Определяется типом холодильного цикла, по котором у работает машина, совершенством её основных элементов и для одной и той же машины зависит от температурных условий её работы.
Холодильный коэффициент идеальной холодильной машины, работающей по обратному циклу Карно:
где T
мин
и T
макс
– соответственно низшая и высшая температуры в цикле.
Холодильный коэффициент воздушной холодильной машины (рисунок),
где T 1 и T 2 – соответственно температуры начала и конца адиабатного сжатия;
T
3
и T
4
– температуры начала и конца адиабатного расширения в детандере.
p
н
и T
н
)
по формуле
Цикл газотурбинной установки с регенерацией
Термический КПД ГТУ со сгоранием топлива при p = const растёт с увеличением степени повышения давлений. Однако с ростом увеличивается и температура газов в конце сгорания топлива Т 3 в результате чего быстро разрушаются лопатки турбин и сопловые аппараты, охлаждение которых затруднительно. Чтобы увеличить КПД ГТУ, частично изменили условия их работы. В установках стали применять регенерацию теплоты, многоступенчатое сжатие воздуха в компрессоре, многоступенчатое сгорание и т.д. Это дало значительный эффект и повысило в установках степень совершенства превращения работы в теплоту.
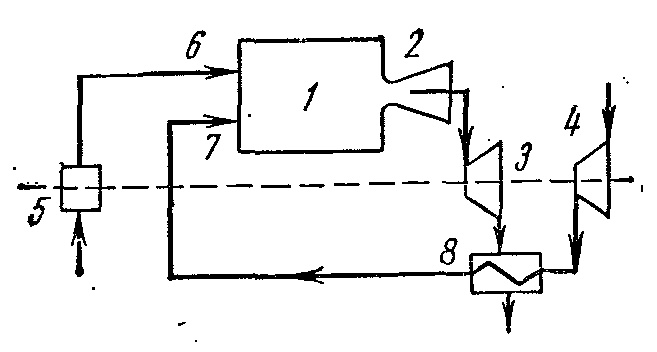
Сжатый воздух из турбокомпрессора 4 направляется регенератор 8 где получает теплоту при постоянном давлении от газов, вышедших из камеры сгорания 1 через сопло 2 в турбину 3. Подогретый воздух из регенератора 8 через форсунку 7, а топливо из топливного насоса 5 через форсунку 6 направляется в камеру сгорания 1.
Идеальный цикл такой установки на диаграммах:

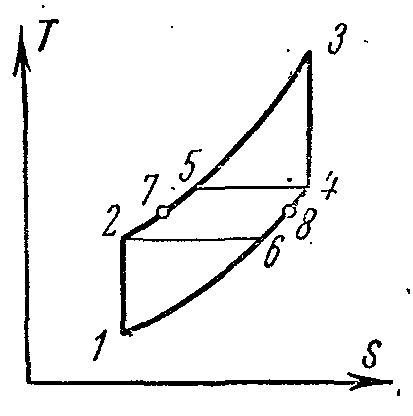
1-2 адиабатическое сжатие воздуха в компрессоре;
2-5 изобарный подвод теплоты в регенераторе;
5-3 подвод теплоты при постоянном давлении в камере сгорания;
3-4 адиабатное расширение продуктов сгорания в соплах турбины;
4-6 изобарный отвод теплоты от газов в регенераторе;
6-1 изобарный отвод теплоты от газов по выходе из регенератора теплоприёмнику.
Если предположить что охлаждение газов в регенераторе происходит до температуры воздуха, поступающего в него, т.е. отТ 4 до Т 6 =Т 2 то регенерация полная.
Термический КПД цикла при полной регенерации, когда Т
4
-Т
6
=Т
5
-Т
2
находится:
где
Температуры в основных точках цикла:
КПД цикла
Удельные расходы пара и тепла в паросиловых установках
При расчётах паротурбинных установок и отдельных элементов в ней требуется знание удельного расхода пара, обозначаемого d .
Теоретический удельный расход пара и тепла в килограммах на 1 МДж:
Где i
1
и i
2
–энтальпия, кДЖ/кг.
Теоретический удельный расход пара и тепла в килограммах на 1 кВт·ч:
Повторный перегрев пара
Исследование работы паротурбинной установки показывает, что повышение начального давления и уменьшение конечного давления ведёт к увеличению КПД цикла. Однако одно повышение начального давления увеличивает конечную влажность пара. Для уменьшения влажности пара в конце расширения повышают начальную температуру его. Одним из способов повышения степени сухости пара на выходе из турбины является вторичный его перегрев. Перегретый пар из котла с начальным давлением и температурой поступает в первый цилиндр турбины, состоящий из нескольких ступеней, где расширяется по адиабате до некоторого давления p 1 . Образовавшийся пар отводят в специальный перегреватель, где он подвергается вторичному перегреву при постоянном давлении. Затем его снова возвращают в турбину, где пар продолжает расширяться до давления в конденсаторе.

Точка 1 соответствует начальному состоянию пара; точка 2 – конечному состоянию пара за турбиной после вторичного перегрева. Конечная степень сухости в результате введения промежуточного перегрева повышается от x 2 до x 1 . Кроме того вторичный перегрев пара даёт некоторый экономический эффект (2-3%), если средняя температура подвода теплоты в дополнительном цикле 7-2-2 ’ -6-7 будет выше средней температуры подвода теплоты в цикле с однократным перегревом, и эффект будет тем больше, чем выше температура в начальной и конечной точках промежуточного перегрева. При давлениях близких к критическому и сверхкритическому, иногда применяют два промежуточных перегрева и более. Тогда термический КПД цикла
Где –адиабатное теплопадение в первом и втором цилиндрах турбины;
– количество теплоты, подведённое в котле и первом перегревателе;
Количество теплоты, подведённое во втором перегревателе.
Удельный расход пара






