Энтропия энтальпия внутренняя энергия в чем отличие. Внутренняя энергия и энтальпия
ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
Основные понятия химической термодинамики. Система, равновесное состояние и термодинамический процесс. Экстенсивные и интенсивные свойства. Функции состояния и функции процесса. Может ли термодинамическая величина, являющаяся, в общем случае, функцией процесса, приобретать свойства функции состояния? При положительном ответе приведите примеры.
Первое начало термодинамики. Внутренняя энергия. Теплота и работа как формы передачи энергии. Взаимосвязь этих величин в изохорном и изотермическом процессах.
Первый закон термодинамики, формулировки 1-го закона термодинамики. Внутренняя энергия системы. Теплота и работа как формы передачи энергии. 1-ый закон термодинамики применительно к изотермическому и изохорному процессам.
Изобразите схематически на одном графике в координатах параметров состояния Р= f (V ) процессы обратимого изотермического и обратимого изобарного расширения идеального двухатомного газа от одного и того же начального состояния до двукратного увеличения объёма. Поясните для какого из указанных выше процессов работа расширения больше?
График адиабаты (жирная линия) на диаграмме для газа. -давлениегаза; - объём.
В частном случае, когда работа совершается через изменение объёма, можно определить её следующим способом: пусть газ заключён в цилиндрический сосуд, плотно закрытый легко скользящим поршнем, если газ будет расширяться, то он будет перемещать поршень и при перемещении на отрезок совершать работу
где F - сила, с которой газ действует на поршень. Перепишем уравнение:
где s - площадь поршня. Тогда работа будет равна
где -давление газа, - малое приращение объёма. Аналогично видно, что уравнение выполняется и для сосудов с произвольной поперечной формой сечения
Изохорная и изобарная молярные теплоемкости. Связь между ними для идеального газа. Зависимость изобарной теплоемкости от температуры для веществ в кристаллическом, жидком и газообразном состоянии.
При нагревании жидких и твердых тел их объем практически не изменяется, и работа расширения оказывается равной нулю. Поэтому все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: C V – молярная теплоемкость в изохорном процессе (V = const) и C p – молярная теплоемкость в изобарном процессе (p = const).
В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует
где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на ΔT . Отсюда следует:
где R – универсальная газовая постоянная. При p = const
Таким образом, соотношение, выражающее связь между молярными теплоемкостями C p и C V , имеет вид (формула Майера ):
|
C p = C V + R . |
|
При фазовых переходах (из одной кристаллической модификации в другую, из твердого состояния в жидкое и т.п.) теплоемкость меняется скачкообразно, при этом для большинства веществ C V жидкого вещества при температуре плавления несколько больше C V кристаллического (рис. 1.7). |
|||
|
| |||
|
| |||
|
Рис. 1.7. Зависимость теплоемкости HCl от температуры T T Ф.П. – температура фазового перехода; T ПЛ. – температура плавления; T КИП. – температура кипения | |||
|
3. Теплоемкость газообразных и жидких веществ обычно растет с повышением температуры (рис. 1.8). | |||
|
| |||
|
Зависимость теплоемкости веществ от температуры в интервале от 298 до T принято описывать | |||
|
для органических веществ эмпирическим уравнением: C P = a + в T + c T 2 (1.22) |
| ||
6. Внутренняя энергия и энтальпия си, их взаимосвязь. Зависимость внутренней энергии и энтальпии вещества от температуры. Интегрирование соответствующих уравнений.
Внутренней энергией системы называется сумма потенциальной энергии взаимодействия всех частиц тела между собой и кинетической энергией их движения, т.е. внутренняя энергия системы складывается из энергии поступательного и вращательного движения молекул, энергии внутримолекулярного колебательного движения атомов и атомных групп, составляющих молекулы, энергии вращения электронов в атомах, энергии, заключающейся в ядрах атомов, энергии межмолекулярного взаимодействия и других видов энергии.
Абсолютная величина внутренней энергии тела неизвестна, но для изучения химических явления важно знать только изменение внутренней энергии при переходе системы из одного состояния в другое.Во многих процессах передача энергии может осуществляться частично в виде теплоты и частично в виде работы.
Таким образом, теплота и работа характеризуют качественно и количественно две различные формы передачи энергии от одного тела к другому; они измеряются в тех же единицах, что и энергия.
Работу или энергию любого вида можно представить как произведение двух факторов: фактора интенсивности на изменение фактора емкости, называемого также фактором экстенсивности (если фактор интенсивности остается постоянным во время процесса).Так, например, обычная работа (механическая), равна произведению приложенной силы на приращение пути:
Если к системе (веществу или совокупности веществ) подводится теплота Q, то согласно закону сохранения энергии она в общем случае расходуется на возрастание внутренней энергии системы U и на совершение работы А, т.е.
(1)где U - изменение внутренней энергии системы при переходе из начального состояния U НАЧ в конечное U КОН.
![]() При
химических реакциях в основном
характеризуется работа против внешнего
давления. Она в первом приближении равна
произведению давления на изменение
объема V системы:
При
химических реакциях в основном
характеризуется работа против внешнего
давления. Она в первом приближении равна
произведению давления на изменение
объема V системы:
(2)где V - изменение объема в процессе.
При изохорном процессе А=0, т.к. изменения объема системы не происходит ( V=0).Следовательно, переходу системы, предположим из состояния 1 в состояние 2 отвечает равенство:
(3)Поэтому, если реакция протекает при V=const, то выделение и поглощение теплоты Q V связано с изменением внутренней энергии U.
Для изобарического процесса V - разность между суммой объемов продуктов реакций и суммой объемов исходных веществ (Р=const).
![]() (4)Для
изобарического процесса тепловой эффект
Q P будет
равен:
(4)Для
изобарического процесса тепловой эффект
Q P будет
равен:
![]() (5)(6)
(5)(6)
Обозначим,(8) - Энтальпия
Энтальпия равна сумме внутренней энергии и произведения объема на давление.
Энтальпия как и внутренняя энергия является экстенсивной функцикй состояния, зависящей от природы вещества, давления и температуры. В пределах температурной области где фазовое состояние системы не меняется, энтальпия является монотонной функцией основных параметров.
т.е. H - это тепловой эффект реакции Q p при p=const.
Энтальпия является функцией состояния, т.е. её изменение определяется заданными начальными и конечными состояниями системы и не зависит от пути перехода.
dim [H]=[кДж] или [кДж/моль]
Таким образом, при изохорическом процессе тепловой эффект реакции:
Тепловым эффектом (теплотой химической реакции) называют количество теплоты (энергии), выделяемое или поглощаемое системой в ходе реакции при условиях постоянного объема или давления, а получаемые продукты имеют ту же температуру, что и исходное вещество.
внутренняя
энергия идеального газа не зависит от
объема и давления, а является лишь
функцией температуры, то на основании
уравнения (2.7) после его интегрирования
получим для внутренней энергии при
любой температуре T
:
U
Т
= U
о + с
V
(Т
– Т
o).
(5.2)
Энтальпия
идеального газа, как и внутренняя
энергия, также зависит только от
температуры. Так как, по определению, H
= U
+ pV
,
а для 1 моля газа pV
= RT
и
(с
р
– с
V
)
=R
,
то
Н
= U
о + с
р
(Т
– Т
o).
(5.3)
Изохорный
и изобарный потенциалы идеального газа
при постоянной температуре определяются
интегрированием уравнений (4.28) и (4.34).
Для одного моля идеального газа при T
=
const
dF
=
– pdV
=
– 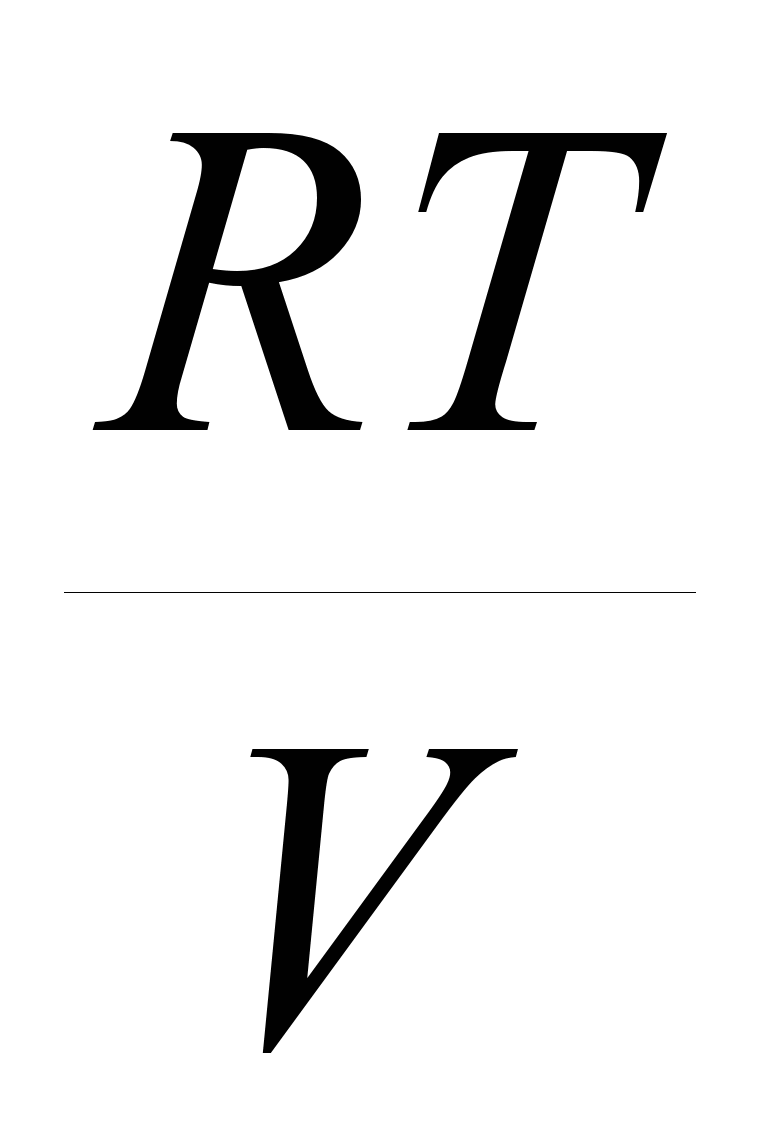 dV
,
(5.
4)
откуда после интегрирования
получаем
F
= F
(Т
)
– RT
lnV.
(5.5)
dV
,
(5.
4)
откуда после интегрирования
получаем
F
= F
(Т
)
– RT
lnV.
(5.5)
Термохимия. Закон Гесса и его термодинамическое обоснование. Связь тепловых эффектов химической реакции при постоянном давлении и постоянном объеме.
Закон Гесса - основной закон термохимии, который формулируется следующим образом:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания .
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы).

На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А 1 , А 2 … в продукты реакции В 1 , В 2 …, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔH i . Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением.
ТЕРМОХИМИЧЕСКИЕ УРАВНЕНИЯ
Закон Гесса
Все качественные расчеты производятся в соответствии с законном Гесса:
Изменение энтальпии реакции зависит только от физического состояния и химической природы исходных веществ и продуктов реакции и не зависит от промежуточных стадий реакции. (1840г)
Следствия из закона Гесса:
1) Тепловой эффект прямой реакции равен по величине и противоложен по знаку тепловому эффекту обратной реакции.
2) Тепловой эффект реакции равен разности сумм энтальпий образования реакции продуктов и исходных веществ, умноженных на стехиометрические коэффициенты.
3) Тепловой эффект реакции равен разности сумм энтальпий сгорания реакции исходных веществ и продуктов, умноженных на стехиометрические коэффициенты.
Термодинамические параметры
Термодинамические параметры – это физические величины, которые характеризуют состояние и процессы в термодинамических системах.
Их так же называют термодинамическими свойствами. Они делятся на интенсивные (которые не зависят от количества вещества) – это температура, давление, концентрация, и экстенсивные (зависят от количества вещества) – это масса, объем, энергия. Совокупность значений термодинамических свойств характеризует термодинамическое состояние системы.
Термодинамические свойства используют для описания термодинамических систем и часто в количественном описании представляются как набор величин.
Внутренняя энергия и энтальпия
Энтальпия – это обобщенный параметр, который учитывает изменения в системе энергии за счет выделения теплоты и совершения работы. Энтальпию так же называют теплосодержанием системы, так как изменение энтальпии при постоянном давлении равно поглощенной теплоте. Это экстенсивное свойство системы.
Если в химической реакции участвуют только жидкие и твердые вещества, то изменение энтальпии реакции примерно равно изменению внутренней энергии. Это происходит за счет того, что изменение объема практически равно нулю и получается, что работа расширения не совершается.
Но если в результате химической реакции газообразные вещества выделяются или поглощаются, то уравнение используется в полном объеме. При изотермическом расширении идеального газа внутренняя энергия равна нулю. В общем случае изменение энергии в системе происходит в связи с обменом между системой и окружающей средой тепла или работы.
Энтропия и ее роль в описании процессов протекающих в изолированной и закрытой системах
Энтропия – это количественное термодинамическое свойство, которое объясняет случайность или беспорядок в системе; иными словами отсутствие организованности. Чем больше беспорядок, тем больше значение энтропии и наоборот. Энтропия пропорциональна вероятности системы S=klnW, где k – константа Вольцмана. Энтропия Вселенной всегда увеличивается. Согласно второму закону термодинамики в изолированных системах возможны только такие процессы, при которых происходит рост энтропии. Когда энтропия достигает максимально возможного уровня, в системе наступает равновесие. Энтропия чистого, совершенного кристалла при 0 К равна нулю (третий закон термодинамики).
Если система не является изолированной, то сумма изменений энтропий системы и окружения при необратимых процессах всегда положительна. Эта сумма равна нулю только в термодинамически обратимых процессах.
В закрытых системах только с помощью энтропии нельзя определить направление и равновесия, в них используют обобщенные параметры: энергию Гельмгольца и энергию Гиббса.
Энергия Гельмгольца используют в процессах, где V и T постоянны. dA=dU-TdS
Энергия Гиббса используют в процессах, где P и T постоянны. dG=dH-TdS 298K
Качественное определение изменения энтальпии и энтропии
Изменение свободной энергии в системе, ее роль при описании процессов, протекающих в закрытой системе
Величина G характеризует способность системы совершать полезную работу
С помощью энергии Гиббса можно определить направление протекания процесса.
Если G<0, то процесс протекает самопроизвольно.
Если G=0, то наступает равновесие.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Факторы, влияющие на химическое равновесие
На химическое равновесие системы влияют концентрация, давление (для газообразных веществ), температура, а так же катализаторы.
Константа равновесия
Константа равновесия равна отношению, в числитель которого входит произведение равновесных концентраций продуктов реакции, а в знаменатель - произведение концентраций исходных веществ, при этом все значения концентраций берутся в степенях, равных стехиометрическим коэффициентам в уравнении реакции. А так же константа равновесия равна отношению констант скоростей прямой и обратной реакции.
Смещение химического равновесия
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1885 году французским ученым Ле-Шателье.
Факторы влияющие на химическое равновесие:
1) температура
При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции.
CaCO3=CaO+CO2 -Q t →, t↓ ←
N2+3H2↔2NH3 +Q t ←, t↓ →
2) давление
При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
CaCO3=CaO+CO2 P ←, P↓ →
1моль=1моль+1моль
3) концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции-в сторону исходных веществ.
S2+2O2=2SO2 [S],[O] →, ←
Катализаторы не влияют на смещение химического равновесия!
10. Принцип ЛЕ – ШАТЕЛЬЕ (рассмотреть на пример)
Если система находится в равновесии, то при изменении одного из условий (темп., конц., давл.) равновесие смещается в сторону той реакции, которая противодействует произведенному изменению. N2(г)+3H2(г) <-> 2NH3(г) +Q
Катализаторы
Катализатор – это вещество, которое изменяет скорость химической реакции, но не входит в состав конечных продуктов. Катализаторы не влияют на состав равновесной реакционной смеси, но ускоряют реакцию, что сокращает время, необходимое для достижения химического равновесия. Есть катализаторы (положительные катализаторы) и ингибиторы (отрицательные катализаторы).
Гомогенный и гетерогенный катализ
При гомогенном катализе реагирующие вещества и катализатор образуют однофазную систему – газовую или жидкую, между катализатором и реагирующими веществами нет поверхности раздела. Для гомогенного катализа установлено, что скорость химической реакции пропорциональна концентрации катализатора.
При гетерогенном катализе реагирующие вещества и катализатор образуют систему из разных фаз. В этом случае между катализатором и реагирующими веществами существует поверхность задела. Обычно катализатор – твердое вещество, а реагирующие вещества газы или жидкости. Активность твердого катализатора зависит от свойств его поверхности (размера, химического состава, строения и состояния). Действие положительных катализаторов сводится к уменьшению энергии активации реакции, другими словами к снижению высоты энергетического барьера. При этом образуется активированный комплекс с более низким уровнем энергии, и скорость реакции сильно возрастает.
СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКИЙ ЗАКОН
Изотопы, изобары, тип ядер?
Изотопы были впервые обнаружены в опытах Дж.Дж.Томсона в 1912 году, когда он наблюдал отклонение заряженных частиц в электрическом и магнитном поле. Изотопами были названы разновидности атомов одного и того же химического элемента, имеющие одинаковые заряды ядер, но различные массовые числа. Элементы в природе состоят из смесей изотопов, например, природный углерод 12 6 С и 13 6 С. Но масса атомов очень мала поэтому ввели относительные единицы, названные атомными единицами массы это 1/12 часть массы углерода 12.
Изобары – разновидности атомов разных химических элементов, имеющие одинаковое массовое число, но различные атомные номера.
Типы ядер:
Уравнение Шрёдингера
Для электрона, движущегося в одномерном пространстве в поле сил с потенциальной энергией V имеет следующий вид:
-(h^2/8pi^2m)d^2рога/dx^2+Vрога=Eрога
В этом уравнении m – масса электрона, x – координата для электрона вдоль оси x, E – полная энергия, рога – волновая функция. Вторая производная волновой функции по координате х.
Волновые числа
величина, связанная с длиной волны λ соотношением: k = 2π/λ (число волн на длине 2π). В спектроскопии В. ч. часто называют величину, обратную длине волны (1/λ).
Принцип Паули
На каждой орбитали могут находиться только два электрона, причем спины их противоположны. В атоме не может быть двух электронов с одинаковыми четырьмя квантовыми числами.
Правило Гунда
Наиболее устойчивой конфигурацией среди нескольких возможных для орбиталей с одинаковой энергией является та, которая содержит наибольшее количество неспаренных электронов.
Квантовые числа
Главное квантовое число n определяет полную энергию электрона. Каждому числу соответствует энергетический уровень. n=1,2,3,4…или K,L,M,N…
Орбитальное квантовое число l определяет подуровни на энергетическом уровне. Квантовое число l определяет форму орбиталей (n-1) 0,1,2…
Магнитное квантовое число ml определяет число орбиталей на подуровне. …-2,-1,0,+1,+2… Общее число орбиталей на подуровне равно 2l+1
Спиновое квантовое число ms относится к двум различным ориентациям +1/2 -1/2 на каждой орбитали может быть только два электрона с противоположными спинами.
Степени окисления элементов
Степень окисления (окислительное число, формальный заряд) - вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Представления о степени окисления положены в основу классификации и номенклатуры неорганических соединений.
Степень окисления соответствует заряду иона или формальному заряду атома в молекуле или в химической формальной единице, например:
Степень окисления указывается сверху над символом элемента. В отличие от указания заряда атома, при указании степени окисления первым ставится знак, а потом численное значение, а не наоборот:
Степень окисления,
Заряды.
Степень окисления атома в простом веществе равна нулю, например:
Алгебраическая сумма степеней окисления атомов в молекуле всегда равна нулю:
Понятие степени окисления вполне применимо и для нестехиометрических соединений (КС 8 , Mo 5 Si 3 , Nb 3 B 4 и др.). Например в известной реакции обжига пирита:
4FeS 2 +11O 2 = 2Fe 2 O 3 + 8SO 2
удобнее всего принять в исходном соединение степень окисления у железа +3 (хотя реально атом железа смещает от себя 2 электрона, то есть степень окисления железа +2), а у серы −3/2 (!), что совсем не противоречит определению степени окисления, как условной единицы и позволяет так же просто, как и в случае других окислительно-восстановительных процессов, уравнять реакцию.
Суммарная степень окисления атомов в молекуле всегда равна нулю.
ХИМИЧЕСКАЯ СВЯЗЬ
Порядок связи
Порядок связи в теории молекулярных орбиталей определяется выражением
![]()
где и - суммарные количества электронов на связывающих и разрыхляющих орбиталях соответственно.
Типы химической связи
Известно, что атомы могут соединяться друг с другом с образованием как простых, так и сложных веществ. При этом образуются различного типа химические связи: ионная, ковалентная (неполярная и полярная), металлическая и водородная. Одно из наиболее существенных свойств атомов элементов, определяющих, какая связь образуется между ними – ионная или ковалентная, - это электроотрицательность, т.е. способность атомов в соединении притягивать к себе электроны.
Тип химической связи зависит от того, насколько велика разность значений электроотрицательностей соединяющихся атомов элементов. Чем больше отличаются по электроотрицательности атомы элементов, образующих связь, тем химическая связь полярнее. Провести резкую границу между типами химических связей нельзя. В большинстве соединений тип химической связи оказывается промежуточным; например, сильнополярная ковалентная химическая связь близка к ионной связи. В зависимости от того, к какому из предельных случаев ближе по своему характеру химическая связь, ее относят либо к ионной, либо к ковалентной полярной связи.
Гибридизация электронов
Гибридизация орбиталей - гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам. Виды гибридизации
[править]sp-гибридизация
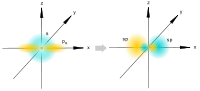
sp-гибридизация
Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
[править]sp 2 -гибридизация

sp 2 -гибридизация
Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
[править]sp 3 -гибридизация
![]()
sp 3 -гибридизация
Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28", что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Гибридизация и геометрия молекул
Представления о гибридизации атомных орбиталей лежат в основе теории отталкивания электронных пар Гиллеспи-Найхолма. Каждому типу гибридизации соответствует строго определённая пространственная ориентация гибридных орбиталей центрального атома, что позволяет её использовать как основу стереохимических представлений в неорганической химии.
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары) .
| Тип гибридизации | Число гибридных орбиталей | Геометрия | Структура | Примеры |
| sp | Линейная | | BeF 2 , CO 2 , NO 2 + | |
| sp 2 | Треугольная |  | BF 3 , NO 3 – , CO 3 2– | |
| sp 3 | Тетраэдрическая | 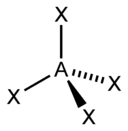 | CH 4 , ClO 4 – , SO 4 2– , NH 4 + | |
| dsp 2 | Плоскоквадратная |  | Ni(CO) 4 , XeF 4 | |
| sp 3 d | Гексаэдрическая | 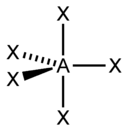 | PCl 5 , AsF 5 | |
| sp 3 d 2 | Октаэдрическая | 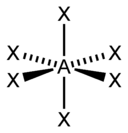 | SF 6 , Fe(CN) 6 3– , CoF 6 3– |
Сигма и пи связь
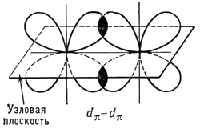
Сигма- и пи-связи (s- и p-связи), ковалентные химические связи, характеризующиеся определенней, но различной пространственной симметриейраспределения электронной плотности. Как известно, ковалентная связь образуется в результате обобществления электронов взаимодействующихатомов. Результирующее электронное облако s-связи симметрично относительно линии связи, т. е. линии, соединяющей ядра взаимодействующихатомов. Простые связи в химических соединениях обычно являются (т-связями (см. Простая связь). Электронное облако p-связи симметрично относительно плоскости, проходящей через линию связи (рис. 1, б), причём в этой плоскости (называемой узловой) электронная плотность равна нулю. Употребление греческих букв s и p связано с соответствием их латинским буквам s и р в обозначении электронов атома, при участии которых впервые появляется возможность для образования s- и p-связей соответственно. Поскольку облака атомных р-орбиталей (p x , р у, p z) симметричны относительно соответствующих осей декартовых координат (х, у, z), то, если одна р-орбиталь, например p z , принимает участие в образовании s-связи (ось z - линия связи), две оставшиеся р-орбитали (p x , p y) могут принять участие в образовании двух p-связей (их узловые плоскости будут yz и xz соответственно; см. рис. 2). В образовании s и p-связей могут принять участие также d- (см. рис. 1) и f-электроны атома.
Если между атомами в молекуле возникают одновременно как s-, так и p-связи, то результирующая связь является кратной (см. Кратные связи,Двойная связь, Тройная связь, а также Валентность).
 Рис. 1. Схематическое изображение пространственной ориентации орбиталей при образовании s-связи в результате s - s-, s - p s - , p s - p s -взаимодействий (а) и p-связи в результате p p - , p p - , d p - d p - взаимодействий (б).
Рис. 1. Схематическое изображение пространственной ориентации орбиталей при образовании s-связи в результате s - s-, s - p s - , p s - p s -взаимодействий (а) и p-связи в результате p p - , p p - , d p - d p - взаимодействий (б). 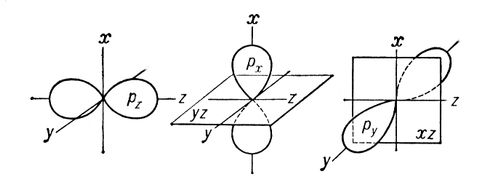 Рис. 2. Схематическое изображение облаков p x -, р у -, p z - электронов. Показаны оси декартовых координат и узловые плоскости p x - и р у -орбиталей.
Рис. 2. Схематическое изображение облаков p x -, р у -, p z - электронов. Показаны оси декартовых координат и узловые плоскости p x - и р у -орбиталей.
|
Дипольный момент
Одинарная и кратная свзяь
Связи σ и π. Одинарные и кратные связи
Два атома между собой могут образовывать и кратные связи, то есть двойные и тройные. При этом составляющая, образующаяся первой, всегда будет σ-связью (обладает наибольшей прочностью и определяет геометрическую форму молекулы).
Вторая и третья составляющие называются π-связями, они образуются при боковом перекрывании любых орбиталей, кроме s
-орбиталей: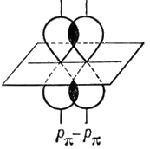

Например, 2p -орбитали двух атомов углерода могут сформировать между собой одинарную, двойную и тройную связи. В первом случае образуется остов молекулы этана C 2 H 6 .
При двойном связывании атомов углерода первые 2p -орбитали создают σ-связь, а вторые - π-связь; в этом случае образуется остов молекулы этилена C 2 H 4 .
При тройном связывании (одна σ-связь, две π-связи) образуется остов молекулы ацетилена C 2 H 2 .
Такие кратные связи всегда короче и прочнее, чем одинарные, их труднее разорвать. Часто именно этим объясняется химическая инертность веществ - таких, как азот N 2 (:N≡N:) и диоксид углерода CO 2 (O=C=O).
Примеры частиц с кратными связями - это также молекулы SO 3 , SO 2 , NO 2 и анионы CO 3 2− , SO 4 2− , SO 3 2−
Ионная свзяь и ее свойства
Образуется за счет полной передачи одного или нескольких электронов между атомами. Атом, отдающий электрон (электроны), становится катионом, а принимающий – анионом. Ионная возникает как результат электростатических сил притяжения между противоположно заряженными ионами. Ионная связь характерна для соединений и элементов, атомы которых имеют большое различие значений электроотрицательности, она возникает между атомами щелочных металлов (электроположительные элементы) и галогенов (электроотрицательные элементы). СВОЙСТВА
Структура ионных соединений
Структура идеального ионного соединения, обусловленная максимальным притяжением между разноименными ионами и минимальным отталкиванием одноименных ионов, во многом определяется соотношением ионных радиусов катионов и анионов. Это можно показать простыми геометрическими построениями.
51. Донорно – акцепторная связь. Ее свойства, привести примеры
Донорно-акцепторный механизм (иначе координационный механизм) - способ образования ковалентной химической связи между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов, атома-донора и свободной орбитали атома-акцептора.
Термины «донорно-акцепторная связь» или «координационная связь» некорректны, поскольку это не есть вид химической связи, а лишь теоретическая модель, описывающая особенность её образования. Свойства ковалентной химической связи, образованной по донорно-акцепторному механизму, ничем не отличаются от свойств связей, образованных по обменному механизму (например, связи N-H в ионе аммония NH 4 + или связи O-H в ионе гидроксония Н 3 O +).

Образование аддукта аммиака итрифторида бора
Донорами обычно выступают атомы азота, кислорода, фосфора, серы и др., имеющие неподелённые электронные пары на валентных орбиталях малого размера. Роль акцептора могут выполнять ионизированный атом водорода H + , некоторые p-металлы (напр., алюминий при образовании иона AlH 4 -) и, в особенности, d-элементы, имеющие незаполненные энергетические ячейки в валентном электронном слое.
Именно с позиций донорно-акцепторного механизма описывается образование локализованных ковалентных связей в молекулах и молекулярных ионах комплексных (координационных) соединений: связь формируется за счёт неподелённой пары электронов лиганда и свободной орбитали атома-комплексообразователя. Донорно-акцепторный механизм также описывает образование промежуточных продуктов (интермедиатов) реакции, например, комплексов с переносом заряда.
Модель донорно-акцепторного механизма существует только в рамках представлений о валентности как о локализации электронной плотности при образовании ковалентных связей (метод валентных схем). В рамках метода молекулярных орбиталей необходимости в подобных представлениях нет.
Водродная связь
Это тип межмолекулярных взаимодействий. Эти связи представляют собой слабые постоянно действующие силы между атомом Н, ковалентно связанным с очень электроотрицательным атомом А, и электроотрицательным атомом В, способным предоставить для образования связи свободную пару электронов. Водородную связь обозначают тремя точками. –А-Н…В-
Водородные связи образуются только с атомами наиболее электроотрицательных элементов. Наиболее важные из них – F, O, N, Cl . ДОП.
53. Межмолекулярные силы взаимодействия, их свойства (силы Ван-дер-Вальса)
Силы Ван-дер-Вальса включают в себя несколько видов взаимодействий: ориентационное диполь-дипольное, индукционное и дисперсионное.
1) Если две молекулы одного и того же вещества или различных веществ представляют собой постоянные диполи, то они притягиваются друг к другу противоположно заряженными краями и соответствующим образом ориентируются в пространстве. ФОРМУЛА (стр. 172).
2) Индукционное взаимодействие заключается в том, что полярная молекула вызывает поляризацию (индуцирует диполь) соседней неполярной молекулы. Далее они ориентируются относительно друг друга в пространстве. В конечном результате наблюдается взаимодействие: диполь – индуцированный диполь.ФОРМУЛА (стр. 172).
3) Дисперсионное взаимодействие - это слабые силы притяжения между нейтральными атомами, например атомами благородных газов, или молекулами, включая неполярные молекулы. ФОРМУЛА (стр. 173).
РАСТВОРЫ
Что называется раствором
Растворы – это термодинамически устойчивые гомогенные системы переменного состава, содержащие два или более компонента. Вещество, концентрация которого больше всех остальных веществ называется растворителем, а другие вещества – растворенными. Фазовое состояние растворителя в растворе не изменяется, например, вода остается жидкостью и в растворе. Растворы бывают жидкие, твердые и газообразные.
Вода
Водя является одним из наиболее общих растворителей на Земле. Молекула воды имеет угловое строение: (105 градусов). Химическая связь О-Н ковалентная, но общая электронная пара оттянута к атому О. На каждом атоме Н появляется положительный заряд, а на О – отрицательный. Эти частичные заряды создают полярность молекулы, что придет воде как растворителю особые свойства. Чистая вода имеет низкую концентрацию О и ОН и плохо проводит электрический ток. Существенное влияние на свойства воды оказывают межмолекулярные водородные связи. Молекулы воды, связанные водородными связями, образуют ажурную пространственную сетку. Вода может находиться в трех агрегатных состояниях: жидком, твердом (лед) или газообразном (пар). Испарение воды и сублимация льда происходят при любой температуре.
Ассоциация молекул воды
Молекулы воды, являющиеся постоянными диполями, могут за счет взаимного
притяжения противоположно заряженных полюсов комбинироваться по две, три и т. д.
Однако действующие при этом силы притяжения невелики, и в случае воды подобная
дипольная ассоциация играет лишь второстепенную роль.
Основное значение для ассоциации молекул воды имеет образование так
называемых водородный связей. Последние возникают за счет притяжения водорода
одной молекулы воды к кислороду другой по приводимой схеме:
Н
?
О-Н···О-Н
.
.
Н
Возможность такого притяжения согласуется с допущением о наличии значительных
эффективных зарядов и у водорода (?Н = ?0,33), и у кислорода (?О = ?0,66) в молекуле
воды.
Диаграмма состояния воды
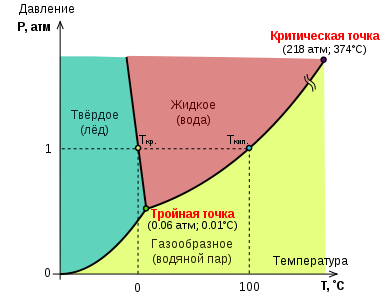
Растворы неэлектролитов
Неэлектролиты - вещества, водные растворы и расплавы которых не проводят электрический ток, так как их молекулы не диссоциируют на ионы.
65. Первый и второй законы Рауля!
Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
Книга 2 раздел 1.6
Растворы электролитов
Поскольку сильные электролиты почти полностью распадаются на ионы в водных растворах, то концентрация ионов может быть высокой. В концентрированных растворах сильных электролитов ионы сближаются настолько, что взаимодействие между ними становится весьма существенным. За счет межионного взаимодействия понижается подвижность ионов, и при участии ионов в химических реакциях создается эффект уменьшения концентрации. Поэтому ионы вступают в химические реакции не в соответствии с их истиной концентрацией, а в соответствии с их кажущейся концентрацией – активностью. Между активностью и концентрацией иона в растворе существует зависимость: ai=yi*ci .
Изотонический коэффициент
Позволяет учитывать влияние неидеальности растворов на их физические свойства. Молекулы растворенных веществ могут диссоциировать, что характерно для растворов электролитов, но наряду с диссоциацией может происходить и ассоциация молекул. Для учета изменения числа частиц в растворе за счет процессов их диссоциации и ассоциации используют изотонический коэффициент i.
Изотонический коэффициент выражает отношение числа частиц растворенного вещества к числу его частиц в исходном состоянии. Для растворов неэлектролитов изотонический коэффициент равен 1, процесс диссоциации – и.к. больше 1, ассоциация – меньше 1. Экспериментальное определение изотонического коэффициента позволяет вычислить степень диссоциации или ассоциации растворенного вещества.
Амфотерные гидроксиды
Амфотерные гидроксиды - химические вещества, которые в кислой среде ведут себя как основания, а в щелочной - как кислоты.
В пределах каждого периода элементы со свойствами металлов сменяются элементами, которые проявляют свойства как металлов, так и неметаллов. Соединения этих элементов называются амфотерными. Элемент алюминий проявляет в соединениях свойства металла и неметалла. Подобные свойства имеют элементы А-групп - Be, Ga, Ge, Sn, Pb, Sb, Bi и другие, а также большинство элементов Б-групп - Cr, Mn, Fe, Zn, Cd и другие. Практически все они нерастворимы в воде, являются слабыми электролитами.
При нагревании соединения разлагаются. В большинстве случаев при взаимодействии гидроксида металла образуется гидроксосоль соответствующей кислоты: например, таким образом взаимодействие протекает для Al(3 +), Cr(3+), Zn(2+) и многих других металлов. Данная реакция является обратимой, положение равновесия зависит от природы металла pH среды и частично от температуры. Так же в растворе могут существовать ионы с меньшим координационным числом металла.
Активность ионов
Активность (ионов) - эффективная концентрация с учетом электростатического взаимодействия между ионами в растворе. Активность отличается от концентрации на некоторую величину. Отношение активности (а) к концентрации вещества в растворе (с, в г-ион/л) называется коэффициентом активности: γ = a/c.
Коэффициент активности
Коэффициент активности - отношение активности данного компонента раствора к его концентрации, характеризующее отклонение свойств реальных растворов от свойств идеальных растворов. В идеальных растворах и при бесконечном разбавлении К. а. равен единице. Приближенные значения К. а. вычисляются по уравнению Дебая - Хюккеля.
Диссоциация воды
Диссоциация воды - разложение воды на составляющие химические элементы, иногда происходящая с созданием новых элементов, изначально в разлагаемом растворе не содержащихся, или содержащихся до начала разложения в меньшем количестве, чем после завершения процесса диссоциации.
Диссоциация воды является эндотермической реакцией (см.эндотермическая реакция), т.е. идущей с поглощением теплоты из окружающей среды.
Известные способы диссоциации воды:
1. Электролиз водных растворов-электролитов. - наименее эффективный из известных на сегодня способв разложения воды, так как в этом случае энергия затрачивается, в основном, на нагрев проводника - электролита, настолько, что диссциируемый раствор не только не охлаждается, но, напротив, подвергается значительному нагреву. В промышленности XX века именно этот способ получил наибольшее растпространение, в силу того, что обеспечивает спрос и позволяет поддерживать высокие цены на такой товар, как невосполнимые энергоресурсы, из которых получают электричество, таких как нефть, газ, каменный угль и т.п.
2.Модель процесса разложения воды в центробежном поле Например, во вращающийся барабан заливается подогретый электролит, в котором при вращении в результате начинающегося электрохимического процесса происходит разложение воды на водород и кислород. Этот процесс разлагает воду с помощью кинетической энергии внешнего источника и тепловой энергии подогретого электролита. На основе данного процесса имеется ряд патентов, один из которых (RU 98/00190 (22.06.1998)) авторы - Кудымов Г.И и Студенников В.В. позиционируют, в том числе, и как и тепловой насос, поглощающий теплоту окружающей среды, таким образом, получение водородно-кислородной смеси здесь производится, в значительной мере за счет энергии окружающей среды или за счет обычно безвозвратно теряемого тепла, например выхлопных газов двигателей внутреннего сгорания.
Ионное произведение воды
Равновесную величину произведения концентрации ионов воды назвали ионным произведением воды. Обозначается Кв и равно 10 -14 Кв=(Н +)(ОН -)
Водородный показатель (pH)
pH – это отрицательный десятичный логарифм равновесной концентрации ионов водорода. С помощью значения pH можно определить среду раствора. Величину pH определяют при помощи специального прибора – pH-метра, а так же при помощи индикаторов. Так же pH можно определить через равновесную концентрацию гидроксид-ионов pH=14-pOH.
Произведение растворимости
В насыщенном растворе малорастворимого ионного соединения произведение концентрации его ионов при данной температуре есть величина постоянная и называется произведением растворимости. ПР распространяется только на малорастворимые сильные электролиты, это значит что в растворе они должны полностью распадаться на ионы и не должны участвовать во вторичных реакциях.
Если в химическую формулу соединения входят стехиометрические коэффициенты, отличные от единицы, то концентрации ионов берут в степенях, равных их стехиометрическим коэффициентам.
Три случая гидролиза
Возможны три варианта гидролиза:
1) Гидролиз по катиону – это гидролиз соли, содержащей катион слабого основания и анион сильной кислоты.
2) Гидролиз по аниону – это гидролиз соли, содержащей катион сильного основания и анион слабой кислоты.
3) Гидролиз по катиону и аниону – это гидролиз соли, содержащей катион слабого основания и анион слабой кислоты.
Буферные растворы
Внутренняя энергия У вещества (или системы) - это полная энергия частиц, составляющих данное вещество (см. также § 54). Она слагается из кинетической и потенциальной энергий частиц. Кинетическая энергия - это энергия поступательного, колебательного и вращательного движения частиц; потенциальная энергия обусловлена силами притяжения и отталкивания, действующими между частицами.
Внутренняя энергия зависит от состояния вещества. Изменение внутренней энергии системы AU при том или ином процессе можно определять. Пусть в результате какого-нибудь процесса система переходит из начального состояния 1 в конечное состояние 2, совершая при этом работу А и поглощая из внешней среды теплоту .
Ясно, что внутренняя энергия системы уменьшится на величину А, возрастет на величину Q и в конечном состоянии будет равна
где и - внутренняя энергия системы в начальном (1) и в конечном (2) состояниях. Если обозначить разность через , то уравнение можно представить в виде:
![]()
Это уравнение выражает закон сохранения энергии, согласно которому изменение внутренней энергии не зависит от способа проведения процесса, а определяется только начальным и конечным состояниями системы. Однако какая часть энергии пойдет на совершение работы, а какая превратится в теплоту - зависит от способа проведения процесса: соотношение между работой и теплотой может быть различным. В частности, если в ходе процесса не производится никакой работы, в том числе работы расширения против внешнего давления, т. е., если объем системы не изменяется, то
где - теплота, поглощенная системой в условиях постоянного объема.
Последнее уравнение дает возможность определять изменение внутренней энергии при различных процессах. Например, в случае нагревания вещества при постоянном объеме изменение внутренней энергии определяется по теплоемкости этого вещества:
Здесь - молярная теплоемкость вещества при постоянном объеме; n - количество вещества; -разность между конечной и начальной температурами.
В случае химической реакции, протекающей без изменения объема системы, изменение внутренней энергии равно взятому с обратным знаком тепловому эффекту этой реакции.
где n - количество вещества; Ср - молярная теплоемкость вещества при постоянном давлении.
При изменениях агрегатного состояния вещества и при аллотропных переходах изменение энтальпии равно по величине, но обратно по знаку теплоте соответствующего превращения (плавление, кипение, превращение из одной модификации в другую). Наконец, в случае химической реакции изменение энтальпии равно взятому с обратным знаком тепловому эффекту реакции, проведенной при постоянной температуре и постоянном давлении.
Энтальпия, как и внутренняя энергия, характеризует энергетическое состояние вещества, но включает энергию, затрачиваемую на преодоление внешнего давления, т. е. на работу расширения. Подобно внутренней энергии, энтальпия определяется состоянием системы и не зависит от того, каким путем это состояние достигнуто. В случае газов различие между и в ходе того или иного процесса может быть значительным. В случае систем, не содержащих газов, изменения внутренней энергии и энтальпии, сопровождающие процесс, близки друг к другу. Это объясняется тем, что изменения объема при процессах, претерпеваемых веществами в конденсированных (т. е. в твердом или в жидком) состояниях, обычно очень невелики, и величина мала в сравнении с .

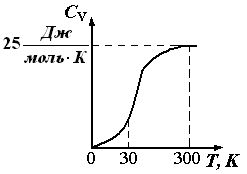 Рис.
1.6. Зависимость теплоемкости
кристаллических веществ
от
температуры
Рис.
1.6. Зависимость теплоемкости
кристаллических веществ
от
температуры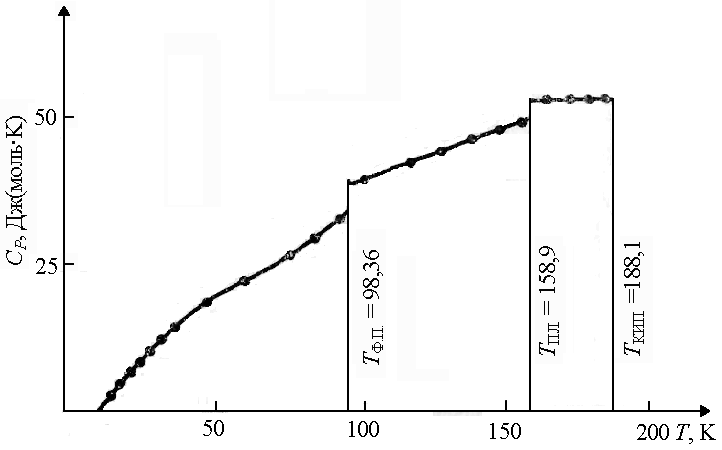
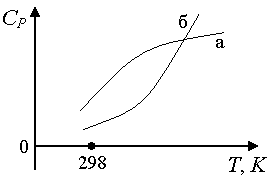 Рис.
1.8. Зависимость теплоемкости газов от
температуры:
а) если кривая при
невысоких^
T
имеет
большую кривизну, чем при высоких, ее
предпочтительнее описывать эмпирическим
степенным рядом вида:
C
P
= a
+ в
T
+ c’
/T
2 ;
б)
кривую б
степенным
рядом вида: C
P
= a
+ в
T
+ c
T
2
Рис.
1.8. Зависимость теплоемкости газов от
температуры:
а) если кривая при
невысоких^
T
имеет
большую кривизну, чем при высоких, ее
предпочтительнее описывать эмпирическим
степенным рядом вида:
C
P
= a
+ в
T
+ c’
/T
2 ;
б)
кривую б
степенным
рядом вида: C
P
= a
+ в
T
+ c
T
2




