Как изменяется энтропия. Термодинамическая энтропия. Круговой процесс. Цикл Карно
В большинстве химических процессов одновременно происходит два явления: передача энергии и изменение в упорядоченном расположении частиц относительно друг друга. Все частицы (молекулы, атомы, ионы) стремятся к беспорядочному движению, поэтому система стремится перейти из более упорядоченного состояния в менее упорядоченное. Количественной мерой беспорядка (хаотичности, неупорядоченности) системы является энтропия S . Например, если баллон с газом соединить с пустым сосудом, то газ из баллона распределится по всему объему сосуда. Система из более упорядоченного состояния перейдет с менее упорядоченное, значит, энтропия при этом увеличится (ΔS > 0).
Вряд ли понятие физики так часто используется вне физики - и поэтому часто отклоняется от своего фактического значения - как энтропия. Концепция имеет очень узкий смысл. Конкретное определение этой физической величины было сделано австрийским физиком Людвигом Больцманом во второй половине года. Он сосредоточился на микроскопическом поведении жидкости, то есть газа или жидкости. Неупорядоченное движение атомов или молекул понималось как тепло, которое было решающим для его определения.
В замкнутой системе с фиксированным объемом и фиксированным числом частиц, указал Больцманн, энтропия пропорциональна логарифму числа микростадий в системе. В микросостояниях он понимал все возможности укладки молекул или атомов заключенной в жидкость жидкости. Его формула определяет энтропию как меру «свободы расположения» молекул и атомов: если число приемлемых микросостояний возрастает, энтропия растет. Есть меньше возможностей для того, как могут образовываться частицы жидкости, энтропия меньше.
Энтропия всегда возрастает (ΔS > 0) при переходе системы из более упорядоченного состояния в менее упорядоченное: при переходе вещества из кристаллического состояния в жидкое и из жидкого в газообразное, при повышении температуры, при растворении и диссоциации кристаллического вещества и т.д.
При переходе системы из менее упорядоченного состояния в более упорядоченное энтропия системы уменьшается (ΔS < 0), например при конденсации, кристаллизации, понижении температуры и т.д.
Формулу Больцмана часто интерпретируют так, как будто энтропия эквивалентна «беспорядку». Однако эта упрощенная картина легко вводит в заблуждение. Примером этого является пена в ванной: когда пузырьки лопнут, а поверхность воды становится гладкой, кажется, что расстройство уменьшается. Но энтропия этого не делает! Фактически, он даже увеличивается, потому что после всплеска пены возможное пространство для молекул жидкости больше не ограничивается внешними мембранами везикул, поэтому число проглатываемых микросостояний увеличилось.
Что такое энтропия
Определение Больцмана позволяет нам понять одну сторону этого термина, но энтропия также имеет другой макроскопический аспект, который немецкий физик Рудольф Клаузиус уже обнаружил несколько лет назад. Паровой двигатель был изобретен, классический тепловой двигатель. Тепловые двигатели преобразуют разность температур в механическую работу. Затем физики попытались понять принципы, которым подчиняются эти машины. Исследователи обнаружили, что только несколько процентов тепловой энергии могут быть преобразованы в механическую энергию.
В термодинамике изменение энтропии связано с теплотой выражением:
dS = δQ/T или ΔS=ΔH / T
Энтропии веществ, как и их энтальпии образования относят к стандартным условиям. Стандартная энтропия 1 моль обозначается S 0 298 , это справочная величина, измеряется в Дж/(К·моль) (Прил.2).
Например, стандартная энтропия
Остальное было как-то потеряно - без понимания причины. Теория термодинамики, по-видимому, не обладала физической концепцией, которая учитывала разную валентность энергии и ограничивала возможность преобразования тепловой энергии в механическую. Решение получило форму энтропии. Клаузиус ввел термин как термодинамическую переменную и определил ее как макроскопическую меру свойства, ограничивающую удобство использования энергии.
Согласно Клаузиусу, изменение энтропии системы зависит от подаваемого тепла и температуры. Вместе с теплом энтропия всегда передается, поэтому ее вывод. Кроме того, Клаузиус пришел к выводу, что энтропия в замкнутых системах, в отличие от энергии, не является фактором сохранения. Это был второй главный момент термодинамики в физике.
льда……………..S 0 298 = 39,7 Дж/(К·моль);
воды…………….S 0 298 = 70,08 Дж/(К·моль);
водяного пара…..S 0 298 = 188,72 Дж/(К·моль),
т.е. энтропия возрастает – степень беспорядка вещества в газообразном состоянии больше.
У графита S 0 298 = 5,74 Дж/(К·моль), у алмаза S 0 298 = 2,36 Дж/(К·моль), так как у веществ с аморфной структурой энтропия больше, чем с кристаллической.
«В замкнутой системе энтропия никогда не уменьшается». Поэтому энтропия всегда увеличивается или остается постоянной. Это вводит временную линию в физику замкнутых систем, поскольку термодинамические процессы в замкнутых системах необратимы с ростом энтропии.
Теория лабораторной работы
Процесс был бы обратимым, если бы энтропия оставалась постоянной. Но это только теоретически возможно. Все реальные процессы необратимы. Согласно Больцману, можно также сказать, что число возможных микросостояний возрастает в любое время. Эта микроскопическая интерпретация расширяет термодинамически-макроскопическую интерпретацию Клаузиуса. Энтропия окончательно разрешила загадку исчезающей энергии в тепловых двигателях. Часть тепловой энергии окончательно выводится из механической юзабилити и снова высвобождается, потому что энтропия в закрытых системах не должна уменьшаться.
Энтропия S 0 298 , Дж/(К·моль) растет с усложнением молекул, например:
В ходе химических реакций энтропия также изменяется, так, при увеличении числа молекул газообразных веществ энтропия системы возрастает, при уменьшении - понижается.
Изменение энтропии системы в результате протекания процессов определяется по уравнению:
Общие сведения о термодинамике
Поскольку результаты Клаузиуса и Больцмана, энтропия также переместилась в другие области физики. Даже за пределами физики их атаковали, по крайней мере, как математическую концепцию. С таким размером он охарактеризовал потерю информации в передачах по телефону.
Идеальный цикл теплового двигателя Карно
Энтропия также играет роль в химии и биологии: в некоторых открытых системах могут образовываться новые структуры, пока энтропия выходит наружу. Это должны быть так называемые диссипативные системы, в которых энергия превращается в тепловую энергию. Эта теория структурного образования исходит от бельгийского физика-химика Илья Пригожина. На сегодняшний день опубликована работа, в которой новые аспекты добавлены в физическую сферу концепции.
ΔS 0 = ∑ ΔS 0 прод. - ∑ ΔS 0 исх.
Например: в реакции
С (графит) + СО 2(г) = 2СО (г) ; ΔS 0 298 = 87,8 Дж/К
В левой части уравнения 1 моль газообразного вещества СО 2 (г), а в правой – 2 моль газообразного вещества 2СО(г), значит, объем системы увеличивается и энтропия возрастает (ΔS > 0).
С увеличением энтропии (ΔS > 0) протекают также реакции:
![]()
Почему эффективность тепловых двигателей ограничена? Рудольф Клаузиус решил эту загадку, представив концепцию энтропии. Физик рассмотрел круговой процесс идеализированного теплового двигателя, в котором расширение и сжатие чередуются в изотермических и изэнтропических условиях. Сопоставляя сохранение энергии во второй основной набор термодинамики, следующее неравенство для эффективности приводит к этому так называемому процессу Карно.
Таким образом, максимальная достижимая эффективность теплового двигателя ограничена термодинамическими законами. Например, если машина работает от 100 до 200 градусов Цельсия, максимальная достижимая эффективность составляет около 21 процента. Две дополнительные полезные идеи могут быть получены математически из сохранения энергии и второго основного набора термодинамики: при выполнении работ тепло может проходить только от холодного до теплого тела - холодильники и тепловые насосы нуждаются в энергоснабжении.
2 Н 2 О (г) = 2 Н 2(г) + О 2(г)
2 Н 2 О 2(ж) = 2 Н 2 О (ж) + О 2(г)
СаСО 3(к) = СаО (к) + СО 2(г) , ΔS 0 298 = 160,48 Дж/К
В реакции образования аммиака
N 2(г) + 3 H 2(г) = 2 NH 3(г) ; ΔS 0 298 = - 103,1 Дж/К
Объем системы уменьшается, поэтому и энтропия понижается (ΔS < 0).
С уменьшением энтропии (ΔS < 0) протекают реакции:
3 H 2(г) + N 2(г) = 2 NH 3(г)
2 H 2(г) + О 2(г) = 2 H 2 O (ж)
Во-вторых, никакая работа не может быть выполнена с резервуаром с подогревом постоянной температуры. Для этой цели всегда необходим поток тепла между резервуарами разных температур. Термин энтропия - новое образование Рудольфа Клаузиуса из греческих слов и грубо переводится в «конверсионный контент».
Формула говорит, что энтропия всегда передается вместе с теплом. Определение энтропии Больцмана основано на понимании тепла как неупорядоченного движения атомов или молекул. Микросостояниями являются возможности того, как молекулы или атомы заблокированной жидкости могут быть расположены. Энтропия - обширная одна из. Любому равновесному состоянию термодинамической системы можно однозначно присвоить значение энтропии. В статистической физике энтропия является мерой объема фазового пространства, достижимой системой.
В реакциях между твердыми веществами и в процессах, в которых количество газообразных веществ не меняется, энтропия практически не меняется и ее изменение определяется структурой молекул или структурой кристаллической решетки, например:
С (графит) + О 2(г) = СО 2(г) , ΔS 0 298 = 2,9 Дж/К
Al (к) + Sb (к) = AlSb (к) , ΔS 0 298 = - 5,01 Дж/К
Пример №1. Рассчитайте и объясните изменение энтропии для процесса
В рамках классической термодинамики энтропия представляет собой меру для. Это изменение энтропии является положительным при вводе тепла, отрицательным с удалением тепла. Клаузиус также описал умножение энтропии без передачи тепла необратимыми процессами в изолированном с неравенством.
История термина «энтропия»
![]()
Уравнение представляет собой форму второго главного набора термодинамики. С процессом, показанным на рисунке в адиабатической системе, где можно указать только начальное состояние и конечное состояние, это не так. Однако для идеального газа разность энтропии может быть вычислена простым способом посредством обратимого процесса изотермического замещения, как описано в разделе «Примеры». В дополнение к энергии энтропия является наиболее важной концепцией, и полезно перейти к отправной точке этой науки для лучшего понимания и повторения развития.
2SO 2(г) + O 2(г) = 2SO 2(г)
Решение.
ΔS 0 = 2 S 0 SO 3(г) – (2 S 0 SO2(г) + S 0 O 2(г)) = 2 · 256,23 – (2 · 248,1 + 205,04) = - 188,78 Дж/К.
Так как ΔS < 0, энтропия уменьшается вследствии уменьшения объема системы, т.е. уменьшения числа молей газообразных веществ (в левой части 3 моль газообразных веществ, в правой – 2 моль).
Пример №2. Рассчитайте и объясните изменение энтропии для процесса:
Машина смогла выполнить свою задачу, но ей потребовалось много топлива. В это время связь между энергией и теплом была совершенно неясной, и Юлиус Майер все равно должен был опубликовать ее более 130 лет. Вдохновленный работой своего отца на мельницах, Карно описал паровой двигатель в циклическом процессе, в котором тепло течет от горячего источника до холодного слива, тем самым делая работу.
В своей оригинальной работе Карно выразил мнение о том, что тепло является своего рода невесомой субстанцией, которая всегда течет от жаркого до более холодного тела, так как вода всегда движется вниз. И точно так же, как падающая вода, тепло может все же работать, тем выше градиент, в частности, машина не может делать больше работы, чем была поставлена теплота. Карно поправил себя позже и уже признал эквивалентность тепла и энергии за десять лет до Майера, Джоуля и Томсона. Он тем временем опередил свое время, но, к сожалению, он умер молодым, и его работа осталась на первый взгляд незамеченной.
Решение. Выпишем из Прил. 2 значения стандартных энтропий веществ
Согласно следствию из закона Гесса,
ΔS 0 = (2 S 0 CuO (к) + S 0 SO 2(г)) – (S 0 Cu2S(к) + 2 S 0 O 2(г)) = (2 · 42,64 + 248,1) – (119,24 + 205,04) = 9,1 Дж/К.
Энтропия незначительно увеличивается, это объясняется усложнением структуры молекулы SO 2(г) по сравнению с молекулой O 2(г) .
Пример №3. Определить изменение энтропии для процесса:
Только Клаузиус сформулировал связь между разностью температур - источником и раковиной - с эффективностью теплообменника и что эта эффективность не может быть превышена другим тепловым двигателем, поскольку в противном случае тепло самопроизвольно вытекало из холодного в горячее тело. Невозможность такого процесса в природе теперь называется Клаузиусом, сформулированным ею с круговым процессом.
Не существует циклически работающей машины, единственным эффектом которой является перенос тепла из кулера в более теплый резервуар. Проще говоря, основное утверждение утверждает, что температурные различия не могут спонтанно увеличиваться в природе. Клаузиус мог с этим требовать предложение.
С (графит) + О 2(г) = СО 2(г)
Решение: Выпишем из Прил. 2 значения стандартных энтропий
ΔS 0 = S 0 СО2(г) – (S 0 С(г) + S 0 О2(г)) = 213,68 – (5,74+ 205,04) = 2,9 Дж/К.
Так как ΔS > 0, энтропия в процессе реакции незначительно увеличивается. Объем системы не изменяется, но энтропия растет вследствие усложнения структуры молекулы СО 2 по сравнению с молекулой О 2 .
Термодинамика как функция состояния
Для любого кругового процесса. Знак эквивалентности применим только к обратимым процессам. С этой теоремой Клаузиуса очевидно размер. Клаузиус назвал эту величину энтропией, и с течением времени стало привычным формулировать основное предложение непосредственно с энтропией, что никоим образом не приводит к более глубокому пониманию. Только спустя десятилетия, с его статистической механикой, объяснение энтропии можно было бы найти как меру достижимых микросостояний системы. Тепло распределяется случайным образом по атомам и молекулам, распределяя энергию и переходя от горячего к холоду, потому что обратный путь просто слишком маловероятен.
Энергия Гиббса
Самопроизвольно, т.е. без затраты энергии извне, система может переходить только из менее устойчивого состояния в более устойчивое.
В химических процессах одновременно действуют два фактора:
Тенденция к переходу системы в состояние с наименьшей внутренней энергией, что уменьшает энтальпию системы (ΔH → min );
Тенденция к переходу системы к более беспорядочному состоянию, что увеличивает энтропию (ΔS → max ).
Изменение энергии системы называется энтальпийным фактором , количественно он выражается через тепловой эффект реакции ΔH . Он отражает тенденцию к образованию связей и укрупнению частиц.
Возрастание энтропии в системе называется энтропийным фактором , количественно он выражается в единицах энергии (Дж) и рассчитывается как T·ΔS . Он отражает тенденцию к более беспорядочному расположению частиц, к распаду веществ на более простые частицы.
Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянных Т и Р, отражается изменением изобарно-изотермического потенциала или свободной энергии Гиббса ΔG и выражается уравнением:
ΔG = ΔH – T · ΔS
При постоянном давлении и температуре (изобарно-изотермический процесс) самопроизвольно протекают реакции в сторону уменьшения энергии Гиббса.
По характеру изменения энергии Гиббса можно судить о принципиальной возможности или невозможности осуществления процесса.
Если ΔG < 0 , реакция может протекать самопроизвольно в прямом направлении. Чем больше уменьшение энтальпийного фактора и возрастание энтропийного фактора, тем сильнее стремление системы к протеканию реакции. При этом энергия Гиббса в исходном состоянии системы больше, чем в конечном.
Если энергия Гиббса ΔG > 0 , реакция самопроизвольно в прямом направлении протекать не может.
Если ΔG=0 , система находится в состоянии химического равновесия, энтальпийный и энтропийный факторы равны (ΔH = T · ΔS) . Температура, при которой ΔG = 0 , называется температурой начала реакции : T = ΔH /ΔS . При этой температуре и прямая и обратная реакция равновероятны. Возможность (или невозможность) самопроизвольного протекания реакции при различных соотношениях величины ΔH и ΔS представлена в таблице.
Пример №1.
Сu 2 S (к) + 2 O 2(г) = 2 CuO (к) + SO 2(г)
Укажите возможность ее протекания в стандартных условиях в закрытой системе.
Решение: Изменение свободной энергии Гиббса в химической реакции при стандартных условиях (Т = 298 К, Р = 101325 Па) рассчитывается по уравнению ΔG 0 = ΔH 0 – T · ΔS 0 .
Тепловой эффект химической реакции ΔH 0 = - 545,5 кДж (см. расчет выше). Изменение энтропии в химической реакции ΔS 0 = -9,1 Дж/К (см. расчет выше).
При расчете ΔG 0 нужно учитывать, что ΔH 0 выражается в кДж, а ΔS 0 в Дж/К, для этого ΔS 0 нужно умножить на 10 -3 .
Изменение свободной энергии Гиббса в химической реакции
ΔG 0 = ΔH 0 - T·ΔS 0 = - 545,5 – = -548,21 кДж.
Так как ΔG 0 < 0, следовательно, в стандартных условиях самопроизвольное протекание данной химической реакции в прямом направлении возможно.
Пример №2. Исходя из значений ΔH 0 и ΔS 0 рассчитайте ΔG 0 реакции
MgСО 3(к) = MgО (к) + СО 2(г)
Укажите возможность ее протекания при стандартных условиях в закрытой системе. При какой температуре начнется разложение карбоната кальция?
Решение: Выпишем из Приложений1 и 2 значения стандартных этальпий ΔH 0 f , кДж/моль и энтропий S 0 , Дж/(К·моль):
Рассчитаем изменение энтальпии и энтропии
ΔH 0 = (ΔH 0 f , MgО(к) + ΔH 0 f ,СО 2(г)) - ΔH 0 f , MgСО 3(к) = [-601,24 + (-393,5)] – (-1096,21) = 101,46 кДж;
ΔS 0 = - S 0 MgСО 3(к) = – 112,13 = 128,41 Дж/К.
ΔG 0 = ΔH 0 – T · ΔS 0 = 101,46 – 298· 128,41 ·10 -3 = 63,19 кДж.
Так как ΔG 0 > 0, следовательно, протекание данной реакции при стандартных условиях невозможно. Поскольку ΔH > 0 и ΔS > 0, можно сделать вывод, что реакция может самопроизвольно протекать при достаточно высокой температуре.
Рассчитаем температуру, при которой начинается разложение карбоната магния:
Т = ΔH 0 / ΔS 0 = 101,46/(128,41 · 10 -3) = 790,12 К (517,12 0 С).
При температуре 790,12 К равновероятны и прямая и обратная реакции. При температуре выше 790,12 К будет протекать прямая реакция, т.е будет происходить разложение карбоната магния.
§6 Энтропия
Обычно всякий процесс, при котором система переходит из одного состояния в другое, протекает таким образом, что нельзя провести этот процесс в обратном направлении так, чтобы система проходила через те же промежуточные состояния, и при этом в окружающих телах не произошли какие-либо изменения. Это связано с тем, что в процессе часть энергии рассеивается, например, за счет трения, излучения и т. п. Т. о. практически все процессы в природе необратимы. В любом процессе часть энергии теряется. Для характеристики рассеяния энергии вводится понятие энтропии. (Величина энтропии характеризует тепловое состояние системы и определяет вероятность осуществления данного состояния тела. Чем более вероятно данное состояния, тем больше энтропия.) Все естественные процессы сопровождаются ростом энтропии. Энтропия остается постоянной только в случае идеализированного обратимого процесса, происходящего в замкнутой системе, то есть в системе, в которой не происходит обмен энергией с внешними по отношению к этой системе телами.
Энтропия и ее термодинамический смысл:
Энтропия - это такая функция состояния системы, бесконечно малое изменение которой в обратимом процессе равно отношению бесконечно малого количества теплоты, введенного в этом процессе, к температуре, при которой оно вводилось.
В конечном обратимом процессе изменения энтропии может быть подсчитано по формуле:
![]()
где интеграл берется от начального состояния 1 системы до конечного состояния 2.
Поскольку энтропия есть функция состояния, то свойством интеграла является его независимость от формы контура (пути), по которому он вычисляется, следовательно, интеграл определяется только начальным и конечным состояниям системы.
- В любом обратимом процессе изменения энтропии равно 0
(1)
- В термодинамике доказывается, что S системы совершающей необратимой цикл возрастает
Δ S > 0 (2)
Выражения (1) и (2) относятся только к замкнутым системам, если же система обменивается теплотой с внешней средой, то её S может вести себя любым образом.
Соотношения (1) и(2) можно представить в виде неравенства Клаузиуса
Δ S ≥ 0
т.е. энтропия замкнутой системы может либо возрастать (в случае необратимых процессов) либо оставаться постоянной (в случае обратимых процессов).
Если система совершает равновесный переход из состояния 1 в состояния 2, то изменения энтропии
![]()
где dU и δA записывается для конкретного процесса. По этой формуле Δ S определяется с точностью до аддитивной постоянной. Физический смысл имеет не сама энтропия, а разность энтропий. Найдем изменение энтропии в процессах идеального газа.
![]()
т.е. изменения энтропии S Δ S 1→2 идеального газа при переходе его из состояния 1 в состояния 2 не зависит от вида процесса.
Т.к. для адиабатического процесса δ Q = 0, то Δ S = 0 => S = const , то есть адиабатический обратимый процесс протекает при постоянной энтропии. Поэтому его называют изоэнтропийным.
При изотермическом процессе (T = const ; T 1 = T 2 : )
![]()
При изохорном процессе (V = const ; V 1 = V 2 ; )
![]()
Энтропия обладает свойством аддитивности: энтропия системы равна сумме энтропий тел входящих в систему. S = S 1 + S 2 + S 3 + ... Качественным отличием теплового движения молекул от других форм движения является его хаотичность, беспорядочность. Поэтому для характеристики теплового движения необходимо ввести количественную меру степени молекулярного беспорядка. Если рассмотреть какое-либо данное макроскопическое состояния тела с определенными средними значениями параметров, то оно есть нечто иное, как непрерывная смена близких микросостояний, отличающихся друг от друга распределением молекул в разных частях объема и распределяемой энергией между молекулами. Число этих непрерывно сменяющих друг друга микросостояний характеризует степень беспорядочности макроскопического состояния всей системы, w называется термодинамической вероятностью данного микросостояния. Термодинамическая вероятность w состояния системы — это число способов, которыми может быть реализовано данное состояния макроскопической системы, или число микросостояний, осуществляющих данное микросостояния (w ≥ 1, а математическая вероятность ≤ 1 ).
За меру неожиданности события условились принимать логарифм его вероятности, взятый со знаком минус: неожиданность состояния равна = -
Согласно Больцману, энтропия S системы и термодинамическая вероятность связаны между собой следующим образом:
S =
где
- постоянная Больцмана (![]() ). Таким образом, энтропия определяется логарифмом числа состояния, с помощью которых может быть реализовано данное микросостояние. Энтропия может рассматриваться как мера вероятности состояния т/д системы. Формула Больцмана позволяет дать энтропии следующее статистическое толкования. Энтропия является мерой неупорядоченности системы. В самом деле, чем больше число микросостояний реализующих данное микросостояние, тем больше энтропия. В состоянии равновесия системы - наиболее вероятного состояния системы - число микросостояний максимально, при этом максимальна и энтропия.
). Таким образом, энтропия определяется логарифмом числа состояния, с помощью которых может быть реализовано данное микросостояние. Энтропия может рассматриваться как мера вероятности состояния т/д системы. Формула Больцмана позволяет дать энтропии следующее статистическое толкования. Энтропия является мерой неупорядоченности системы. В самом деле, чем больше число микросостояний реализующих данное микросостояние, тем больше энтропия. В состоянии равновесия системы - наиболее вероятного состояния системы - число микросостояний максимально, при этом максимальна и энтропия.
Т.к. реальные процессы необратимы, то можно утверждать, что все процессы в замкнутой системе ведут к увеличению ее энтропии - принцип возрастания энтропии. При статистическом толковании энтропии это означает, что процессы в замкнутой системе идут в направлении увеличения числа микросостояний, иными словами, от менее вероятных состояний к более вероятным, до тех пор, пока вероятность состояния не станет максимальной.
§7 Второе начало термодинамики
Первое начало термодинамики, выражая закон сохранения энергии и превращения энергии, не позволяет установить направление протекания т/д процессов. Кроме того, можно представить множество процессов, не противоречащих I началу т/д, в которых энергия сохраняется, а в природе они не осуществляются. Возможные формулировки второго начало т/д:
1) закон возрастания энтропии замкнутой системы при необратимых процессах: любой необратимой процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает Δ S ≥ 0 (необратимый процесс) 2) Δ S ≥ 0 (S = 0 при обратимом и Δ S ≥ 0 при необратимом процессе)
В процессах, происходящих в замкнутой системе, энтропия не убывает.
2) Из формулы Больцмана S = , следовательно, возрастание энтропии означает переход системы из менее вероятного состояния в более вероятное.
3) По Кельвину: не возможен круговой процесс, единственным результатом которого является превращения теплоты, полученной от нагревателя в эквивалентную ей работу.
4) По Клаузиусу: не возможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
Для описания т/д систем при 0 К используют теорему Нернста-Планка (третье начало т/д): энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к 0 К
Из теоремы Нернста-Планка следует, что C p = C v = 0 при 0 К
§8 Тепловые и холодильные машины.
Цикл Карно и его к.п.д.
Из формулировки второго начала т/д по Кельвину следует, что вечный двигатель второго рода невозможен. (Вечный двигатель - это периодически действующий двигатель, совершающий работу за счет охлаждения одного источника теплоты.)
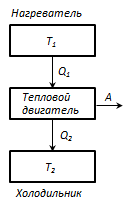 Термостат
- это т/д система, которая может обмениваться теплотой с телами без изменения температуры.
Термостат
- это т/д система, которая может обмениваться теплотой с телами без изменения температуры.
Принцип действия теплового двигателя: от термостата с температурой Т 1 - нагревателя, за цикл отнимается количество теплоты Q 1 , а термостату с температурой Т 2 (Т 2 < Т 1) -холодильнику, за цикл передается количество теплоты Q 2 , при этом совершается работа А = Q 1 - Q 2
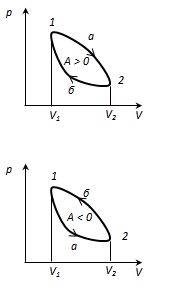 Круговым процессом или циклом
называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. На диаграмме состояний цикл изображается замкнутой кривой. Цикл, совершаемый идеальным газом, можно разбить на процессы расширения (1-2) и сжатия (2-1), работа расширения положительна А
1-2 > 0, т.к.
V
2
>
V
1
, работа сжатия отрицательна А
1-2 < 0, т.к.
V
2
<
V
1
. Следовательно, работа совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой 1-2-1. Если за цикл совершается положительная работа (цикл по часовой стрелке), то цикл называется прямым, если - обратный цикл (цикл происходит в направлении против часовой стрелки).
Круговым процессом или циклом
называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. На диаграмме состояний цикл изображается замкнутой кривой. Цикл, совершаемый идеальным газом, можно разбить на процессы расширения (1-2) и сжатия (2-1), работа расширения положительна А
1-2 > 0, т.к.
V
2
>
V
1
, работа сжатия отрицательна А
1-2 < 0, т.к.
V
2
<
V
1
. Следовательно, работа совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой 1-2-1. Если за цикл совершается положительная работа (цикл по часовой стрелке), то цикл называется прямым, если - обратный цикл (цикл происходит в направлении против часовой стрелки).
Прямой цикл используется в тепловых двигателях - периодически действующих двигателях, совершающих работу за счет полученной извне теплоты. Обратный цикл используется в холодильных машинах - периодически действующих установках, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой.
В результате кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии равно нулю. Тогда І начало т/д для кругового процесса
Q = Δ U + A = A ,
Т. е. работа, совершаемая за цикл равна количеству полученной извне теплоты, но
Q = Q 1 - Q 2
Q 1 - количество теплоты, полученное системой,
Q 2 - количество теплоты, отданное системой.
Термический к.п.д. для кругового процесса равен отношению работы, совершенной системой, к количеству теплоты, подведенному к системе:
![]()
Чтобы η = 1, должно выполняться условие Q 2 = 0, т.е. тепловой двигатель должен иметь один источник теплоты Q 1 , но это противоречит второму началу т/д.
Процесс обратный происходящему в тепловом двигателе, используется в холодильной машине.
 От термостата с температурой Т
2 отнимается количество теплоты
Q
2
и передается термостату с температурой
T
1
, количество теплоты
Q
1
.
От термостата с температурой Т
2 отнимается количество теплоты
Q
2
и передается термостату с температурой
T
1
, количество теплоты
Q
1
.
Q = Q 2 - Q 1 < 0, следовательно A < 0.
Без совершения работы нельзя отбирать теплоту от менее нагретого тела и отдавать ее более нагретому.
Основываясь на втором начале т/д, Карно вывел теорему.
Теорема Карно: из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей (Т 1) и холодильников (Т 2), наибольшим к.п.д. обладают обратимые машины. К.П.Д. обратимых машин при равных Т 1 и Т 2 равны и не зависят от природы рабочего тела.
Рабочее тело - тело, совершающее круговой процесс и обменивающиеся энергией с другими телами.
Цикл Карно - обратимый наиболее экономичный цикл, состоящий из 2-х изотерм и 2-х адиабат.
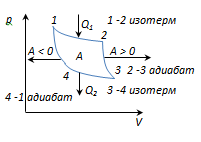 1-2-изотермическое расширения при Т
1 нагревателя; к газу подводится теплота
Q
1
и совершается работа
1-2-изотермическое расширения при Т
1 нагревателя; к газу подводится теплота
Q
1
и совершается работа
![]()
2-3 - адиабат. расширение, газ совершает работу A 2-3 >0 над внешними телами.
3-4-изотермическое сжатие при Т
2 холодильника; отбирается теплота
Q
2
и совершается работа
![]() ;
;
4-1-адиабатическое сжатие, над газом совершается работа A 4-1 <0 внешними телами.
При изотермическом процессе U = const , поэтому Q 1 = A 12
![]() 1
1
При адиабатическом расширении Q 2-3 = 0, и работа газа A 23 совершается за счет внутренней энергии A 23 = - U
![]()
Количество теплоты Q 2 , отданное газом холодильнику при изотермическом сжатии равно работе сжатия А 3-4
![]() 2
2
Работа адиабатического сжатия
![]()
Работа, совершаемая в результате кругового процесса
A = A 12 + A 23 + A 34 + A 41 = Q 1 + A 23 - Q 2 - A 23 = Q 1 - Q 2
и равна площади кривой 1-2-3-4-1.
Термический к.п.д. цикла Карно
![]()
Из уравнения адиабаты для процессов 2-3 и 3-4 получим
Тогда
![]()
![]()
т.е. к.п.д. цикла Карно определяется только температурами нагревателя и холодильника. Для увеличения к.п.д. нужно увеличивать разность Т 1 - Т 2 .
******************************************************* ******************************************************






