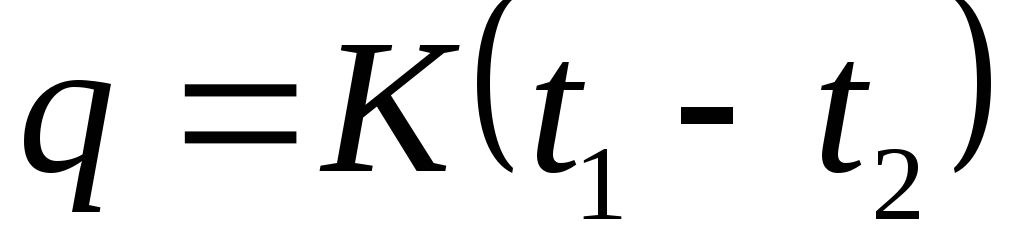Какой газовый процесс происходит при постоянном давлении. Теплоёмкость. Термодинамические процессы с идеальным газом
Основные термодинамические свойства идеальных газов
При исследовании термодинамических процессов используется уравнение состояния
и математическое выражение первого закона термодинамики
При изучении термодинамических процессов идеальных газов, в общем случае требуется определить уравнение кривой процесса в PV , PT , VT диаграмме, установить связь между термодинамическими параметрами и определить следующие величины:
− изменение внутренней энергии рабочего тела
![]()
(формула справедлива не только для V = const , но и для любого процесса)
− определить внешнюю (термодинамическую) удельную работу
и располагаемую удельную работу
−количество теплоты, участвующей в термодинамическом процессе
Где – теплоемкость процесса
–изменение энтальпии в термодинамическом процессе
(формула справедлива не только при p = const , но и в любом процессе)
– доля теплоты, которая расходуется на изменение внутренней энергии в данном процессе:
–доля теплоты, превращается в полезную работу в данном процессе
В общем случае любые два термодинамических параметра из трех (P , V , T ) могут изменяться произвольно. Для практики наибольший интерес представляют следующие процессы:
Процессы при постоянном объеме (V = const ) – изохорный.
При постоянном давлении (P = const ) – изобарный.
При постоянной температуре (T = const ) – изотермический.
Процесс dq =0 (протекающий без теплообмена рабочего тела с окружающей средой) – адиабатный процесс.
Политропный процесс, который, при определенных условиях, можно рассматривать как обобщающий по отношению ко всем основным процессам.
В дальнейшем будем рассматривать 1-й закон термодинамики и величины, входящие в него, как отнесенные к 1кг массы.
Процесс при постоянном объеме
(изохорный процесс)
Такой процесс может совершается рабочим телом, например, находящимся в сосуде не меняющем свой объем, если к рабочему телу подводится теплота от источника теплоты или отводится теплота от рабочего тела к холодильнику.
При изохорном процессе V = const и dV =0 . Уравнение изохорного процесса получается из уравнения состояния при V = const .
– закон Шарля (*)
То есть при V = const давление газа пропорционально абсолютной температуре. При подводе теплоты давление увеличивается, при отводе уменьшается.
Изобразим процесс при V = const в pV , pT и VT диаграммах.


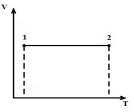
В p V – диаграмме изохора 1-2– вертикальная прямая, параллельная оси p . В процессе 1-2 теплота подводится к газу, давление увеличивается, а следовательно из уравнения (*) увеличивается температура. В обратном процессе 2-1 теплота отводится от газа, в результате чего уменьшается внутренняя энергия газа и понижается его температура, т.е. процесс 1-2 – нагревание, 2-1 – охлаждение газа.
В p T –диаграмме изохоры – прямые линии, выходящие из начала координат с угловым коэффициентом (коэффициент пропорциональности)
Причем чем выше уровень объема, тем ниже лежит изохора.
В VT – диаграмме изохоры – прямые параллельные оси T .
Внешняя работа газа в изохорном процессе:
поскольку
Располагаемая удельная работа
![]()
Изменение внутренней энергии газа в изохорном процессе, если
![]()
Удельная теплота, подводимая к рабочему телу, при
![]()
Поскольку при V = const газ не совершает работы (dl =0 ), то уравнение первого закона термодинамики примет вид:
![]()
То есть в процессе при V = const вся теплота, подводимая к рабочему телу, расходуется на увеличение внутренней энергии, то есть на повышение температуры газа. При охлаждении газа его внутренняя энергия уменьшается на величину отводимой теплоты.
Доля теплоты, расходуемой на изменение внутренней энергии
Доля теплоты, расходуемой на совершение работы
Процесс при постоянном давлении
(изобарный процесс)
Изобарный процесс, например, может протекать в цилиндре под поршнем, который перемещается без трения так, что давление в цилиндре остается постоянным.
При изобарном процессе p = const , dp =0
Уравнение изобарного процесса получается при p = const из уравнения состояния:
– закон Гей-Люссака (*)
В процессе при p = const объем газа пропорционален температуре, то есть при расширении газа температура, а следовательно и внутренняя энергия, увеличивается, а при сжатии – уменьшается.
Изобразим процесс в pV , pT , VT – диаграммах.
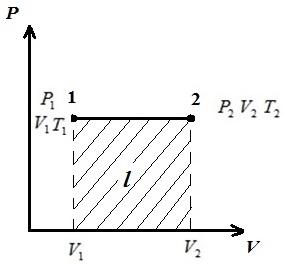
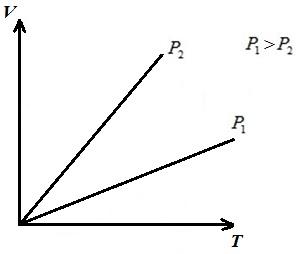

В pV –диаграмме процессы при p = const изображаются прямыми, параллельными оси V . Площадь прямоугольника 12дает в соответствующем масштабе работу газа l . В процессе 1-2 к газу подводится теплота, поскольку удельный объем увеличивается, а следовательно по уравнению (*) увеличивается температура. В обратном процессе 2-1 теплота отводится от газа, в результате уменьшается внутренняя энергия и температура газа, т.е. процесс 1-2– нагревание, а 2-1– охлаждение газа.
В VT – диаграмме изобары представляют собой прямые линии, выходящие из начала координат, с угловым коэффициентом .
В pT – диаграмме изобары представляют собой прямые, параллельные оси T .
Работа газа в изобарном процессе (p = const )
![]()
Поскольку, то
То есть если температура газа увеличивается, то работа положительна.
Располагаемая работа
поскольку ,.
Изменение внутренней энергии газа, если
![]()
Количество теплоты, сообщенное газу при нагревании (или отдаваемое им при охлаждении), если
![]()
То есть теплота, подведенная к рабочему телу в изобарном процессе, идет на увеличение его энтальпии, т.е. в изобарном процессе является полным дифференциалом.
Уравнение первого закона термодинамики имеет вид
![]()
Доля теплоты, расходуемая на изменение внутренней энергии в изобарном процессе,
![]()
где k – показатель адиабаты.
Доля теплоты, расходуемая на выполнение работы при p = const ,
![]()
В МКТ , n –число степеней свободы.
Для одноатомного газа n =3 и тогда φ=0.6, ψ=0.4, то есть на выполнение внешней работы идет 40% сообщаемой газу теплоты, а 60% − на изменение внутренней энергии тела.
Для двухатомного газа n =5 и тогда φ=0.715, ψ=0.285, то есть на выполнение внешней работы идет ≈28,5% сообщаемой газу теплоты и 71,5% на изменение внутренней энергии.
Для трехатомного газа n =6 и тогда φ=0.75, ψ=0.25, то есть на выполнение внешней работы идет 25% теплоты (паровой двигатель).
Процесс при постоянной температуре
(изотермический процесс)
Такой термодинамический процесс может протекать в цилиндре поршневой машины, если по мере подвода теплоты к рабочему телу поршень машины перемещается, увеличивая объем настолько, что температура рабочего тела остается постоянной.
При изотермическом процессе T = const , dT =0.
Из уравнения состояния
−закон Бойля-Мариотта.
Следовательно, в процессе при постоянной температуре давление газа обратно пропорционально объему, т.е. при изотермическом расширении давление падает, а при сжатии увеличивается.
Изобразим изотермический процесс в pV , pT , VT − диаграммах.
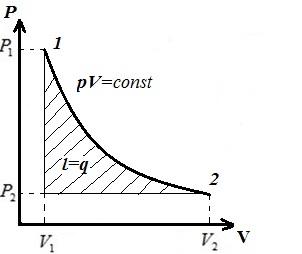
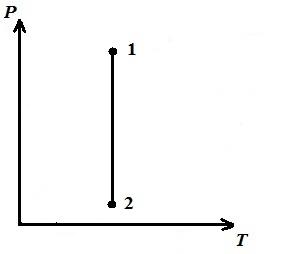
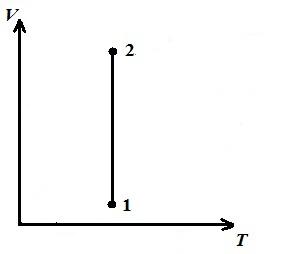
В pV − диаграмме − изотермический процесс изображается равносторонней гиперболой, причем, чем выше температура, тем выше располагается изотерма.
В pT − диаграмме – изотермы – прямые, параллельные оси p .
В VT − диаграмме – прямые, параллельные оси V .
dT =0, то
То есть U = const , i = const – внутренняя энергия и энтальпия не изменны.
Уравнение первого закона термодинамики принимает вид (T = const )
То есть вся сообщаемая газу теплота в изотермическом процессе расходуется на работу расширения. В обратном процессе – в процессе сжатия от газа отводится теплота, равная внешней работе сжатия.
Удельная работа в изотермическом процессе
Удельная располагаемая работа
Из последних двух уравнений следует, что в изотермическом процессе для идеального газа располагаемая работа равна работе процесса.
Теплота, сообщаемая газу в процессе 1-2,
1-й закон термодинамики
Отсюда следует, что при T = const l = l 0= q , т.е. работа, располагаемая работа и количество теплоты, получаемая системой, равны.
Поскольку в изотермическом процессе dT =0, q = l = какой-то конечной величине, то из
![]()
получаем, что в изотермическом процессе C =∞. Поэтому, определить количество теплоты, сообщаемое газу в изотермическом процессе, при помощи удельной теплоемкости невозможно.
Доля теплоты, расходуемая на изменение внутренней энергии при T = const
а доля теплоты, расходуемая на выполнение работы,
Процесс без теплообмена с внешней средой
(адиабатный процесс)
При адиабатном процессе энергообмен рабочего тела с окружающей средой происходит только в форме работы. Рабочее тело предполагается теплоизолированным от окружающей среды, т.е. передача тепла между ним и окружающей средой отсутствует, т.е.
q =0, а следовательно dq =0
Тогда, уравнение первого закона термодинамики примет вид
Таким образом изменение внутренней энергии и работа в адиабатном процессе эквивалентны по величине и противоположны по знаку.
Следовательно, работа адиабатного процесса расширения совершается вследствие уменьшения внутренней энергии газа и, следовательно, температура газа уменьшатся. Работа адиабатного сжатия полностью идет на увеличение внутренней энергии, т.е. на повышение его температуры.
Получим уравнение адиабаты для идеального газа. Из первого закона термодинамики
при dq =0 получим ( du = CV dT )
Теплоемкость , откуда
Дифференцируя уравнение состояния pV = RT получим
Подставляя RdT из (**) в (*)
или, разделив на pV ,
Интегрируя при k = const , получим
![]()
Последнее уравнение называется уравнением Пуассона и является уравнением адиабаты при .
Из уравнения Пуассона следует, что
то есть при адиабатном расширении давление падает, а при сжатии возрастает.
Изобразим изохорный процесс в pV , pT и VT – диаграммах
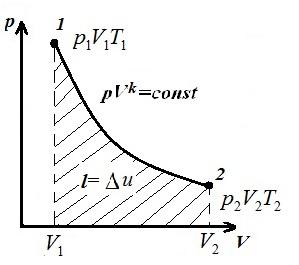
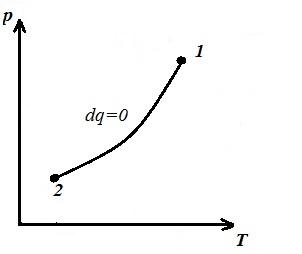
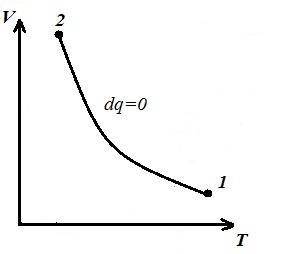
Площадь V 1 12 V 2 под адиабатой 1-2 на pV – диаграмме дает работу l равную изменению внутренней энергии газа
Сравнивая уравнение адиабаты с законом Бойля-Мариотта (T = const ) можем сделать вывод, что, поскольку k >1, то при расширении по адиабате давление падает сильнее, чем по изотерме, т.е. в pV – диаграмме адиабата больше изотермы, т.е. адиабата – неравносторонняя гипербола, не пересекающее координатных осей.
Получим уравнение адиабаты в pT и VT − диаграммах. В адиабатном процессе изменяются все три параметра (p , V , T ).
Получим зависимость между T и V . Уравнения состояния для точек 1 и 2
откуда, разделив второе уравнение на первое
Подставляя отношение давление из уравнения адиабаты Пуассона
или TVk -1= const – уравнение адиабаты в VT - диаграмме.
Подставляя в (*) (3) отношение объемов из уравнения адиабаты (Пуассона)
или − уравнение адиабаты в pT - диаграмме. Эти уравнения получены в предположении, что k = const .
Работа в адиабатном процессе при CV = const
Учитывая соотношение между температурой T и V
![]()
Учитывая соотношение между T и p

Изменение внутренней энергии u =- l .
Располагаемая работа, с учетом того, что
![]() ,
,
Т.е. располагаемая работа в k раз больше работы адиабатного процесса l .
φ и ψ не находим.
Политропный процесс
Политропный процесс – это любой произвольный процесс, протекающий при постоянной теплоемкости, т.е.
Тогда, уравнение 1-го закона термодинамики примет вид
![]() (*)
(1)
(*)
(1)
Таким образом, если C = const и CV = const , то количественное распределение теплоты между внутренней энергией и работой в политропном процессе остается постоянным (например 1:2).
Доля теплоты, расходуемой на изменение внутренней энергии рабочего тела
![]()
Доля теплоты, расходуемая на внешнюю работу,
![]()
Получим уравнение политропного процесса. Для этого воспользуемся уравнением 1-го закона термодинамики (*)
Отсюда, из (*) и (**)
Разделив второе уравнение (4) на первое (3)
Введем величину , называемою показателем политропы. Тогда,
Интегрируя это выражение, получим
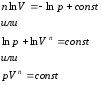
Это уравнение является уравнением политропы в pV − диаграмме. Показатель потлитропы n является постоянным для конкретного процесса, и может изменяться от -∞ до +∞.
Пользуясь уравнением состояния, можем получить уравнение политропы в VT и pT – диаграммах.
Из
![]() - уравнение политропы в VT
-
диаграмме.
- уравнение политропы в VT
-
диаграмме.
Из
![]()
− уравнение политропы в pT - диаграмме.
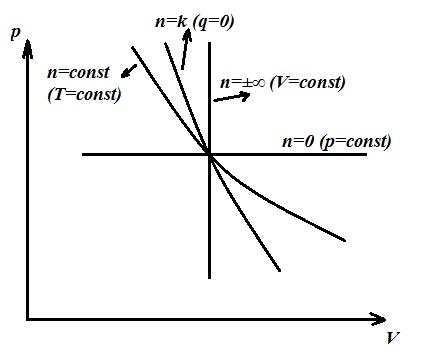
Политропный процесс является обобщающим, а основные процессы (изохорный, изотермический, адиабатный) – частные случаи политропного процесса, каждому из которых соответствует свое значение n . Так, для каждого изохорного процесса n =±∞, изобарного n =0, изотермического n =1, адиабатного n = k .
Поскольку уравнение политропы и адиабаты одинаковы по форме и отличаются только величиной n (показатель политропы вместо k − показателя адиабаты), то можем записать
работа политропного процесса
![]()
располагаемая работа политропного процесса
Теплоемкость газа из , откуда
![]()
Причем, в зависимости от n теплоемкость процесса может быть положительной, отрицательной, равной нулю и изменяется от -∞ до +∞.
В процессах C<0 всегда l > q т.е. на выполнение работы расширения, кроме подведенной теплоты расходуется часть внутренней энергии газа.
Изменение внутренней энергии политропного процесса
![]()
Теплота, сообщаемая газу в политропном процессе
![]()
Изменение энтальпии рабочего тела
![]()
Второй закон термодинамики
Первый закон термодинамики характеризирует процессы превращения энергии с количественной стороны, т.е. он утверждает, что теплота может превращаться в работу, а работа в теплоту, не устанавливая условий, при которых возможны эти превращения. Таким образом, он только устанавливает эквивалентность различных форм энергии.
Второй закон термодинамики устанавливает направленность и условия протекания процесса
Как первый закон термодинамики второй закон был выведен на основе экспериментальных данных.
Опыт показывает, что превращение теплоты в полезную работу может происходить только при переходе теплоты от нагретого тела к холодному, т.е. при наличии разности температур между теплоотдачиком и теплоприемником. Изменить естественное направление передачи теплоты на обратное можно только за счет затраты работы (например, в холодильных машинах).
Согласно 2-му закону термодинамики
Невозможен процесс, при котором теплота переходила бы самопроизвольно от холодных тел к телам нагретым.
Не вся теплота, полученная от теплоотдачика, может перейти в работу, а только ее часть. Часть теплоты должна перейти в теплоприемник.
Таким образом, создания устройства, которое без компенсации полностью превращала бы в работу теплоту какого-либо источника, и называемого вечным двигателем второго рода, невозможно!
Обратимые и необратимые процессы
Для любой термодинамической системы можно представить два состояния, между которыми будет (рис) происходить два процесса: один от первого состояния ко второму и другой наоборот, от второго состояния к первому.
Первый процесс называют прямым процессом, а второй – обратным.
Если после прямого процесса следует обратный и при этом термодинамическая система возвращается в исходное состояние, то такие процессы принято считать обратимыми .
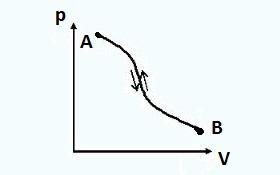
При обратимых процессах система в обратном процессе проходит через те же равновесные состояния, что и в прямом процессе. При этом ни в окружающей среде, ни в самой системе не возникает никаких остаточных явлений, (нет изменения параметров, выполненной работы и т.д.). В результате прямого процесса AB , а затем обратного BA конечное состояние системы будет тождественно начальному состоянию.
На рисунке показана установка механически обратимого процесса. Установка состоит из цилиндра 1, поршня 2 со столиком 3 и песком на нем. Под поршнем в цилиндре содержится газ, который испытывает давление от песка, находящегося на столике.
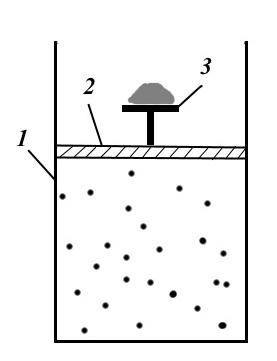
Для создания обратимого процесса необходимо бесконечно медленно снимать одну песчинку за другой. Тогда процесс будет изотермическим, а давление будет равным внешнему давлению и система будет постоянно в равновесном состоянии. Если процесс осуществляется в обратном направлении, т.е. бесконечно медленно бросать песчинки на столик 3, то система будет последовательно проходить через те же равновесные состояния и возвратится к исходному состоянию (в случае если нет трения).
При расширении рабочее тело в обратимом процессе производит максимальную работу.
Краткая теоретическая часть
Отношение теплоты δq, полученной единицей количества вещества к изменению температуры dt называют удельной теплоемкостью.
(1.1)Поскольку количество теплоты δq зависит от характера процесса, то и теплоемкость системы CX также зависит от условий протекания процесса.
Теплоемкость в зависимости от количества вещества может быть массовой – С, объемной – С" и мольной µC. Связь между ними:
Физический смысл теплоемкостей идеального вещества при V = const и P = const следует из рассмотрения дифференциальных соотношений термодинамики вида:
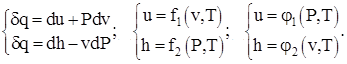 (1.3)
(1.3)
После соответствующих преобразований с учётом свойств идеального газа получим:
(1.4)Это свидетельствует о том, что изменения внутренней энергии и энтальпии определяются как:
(1.5)т.е. независимо от характера процесса.
Соотношения между CP и CV:
В соответствии с молекулярно-кинетической теорией газов мольная теплоемкость при V = Const пропорциональна числу их степеней свободы, выраженному в джоулевом эквиваленте и для одного моля газа равна µСV = 3 × 4,19 = 12,5 Дж/(моль×К). Тогда в соответствии с законом Майера, µСP = 5 × 4,19 = 20,8 Дж/(моль×К), что позволяет в зависимости от атомности газа и их степеней свободы представить значения мольных теплоёмкостей в следующем виде:
Таблица № 1.1.
Теплоемкость, определяемая по уравнению (4.1) при заданных параметрах состояния (P, v, Т) называемая истинной и может быть выражена как:
CX = CX0 + ΔCX,(1.7)
где СX0 – теплоемкость газа в разряженном состоянии (при P " 0) и зависит только от температуры, а ΔСX – определяет зависимость теплоемкости от давления и объема.
Средняя теплоемкость СXm в интервале температур от T1 до T2 выражается как:
 (1.8)
(1.8)
Если принять что один из пределов, например T1 = 273,15 К, то можно рассчитать средние теплоемкости газов в интервале температур от t1 = 0 °C до t2 = х °C и представить их значения в табличной форме, см. приложение, таблицы №2 – №4.
Количество теплоты, передаваемое системе согласно уравнению (4.8) и используя данные теплоемкостей, таблицы №2 – №4, с учетом (4.2), в зависимости от процесса рассчитывается по формулам:
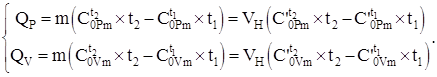 (1.9)
(1.9)
Для приближенных расчетов количества теплоты при не очень высоких температурах можно принять C = Const и тогда уравнения (1.14) с учетом (1.2) – (1.4) и значений таблицы №4.1. будут иметь вид:
 (1.15)
(1.15)
Задача № 1-1. Воздух имеющий объем V = 15 м3 при температуре t1 = = 1500 °C и давлении Р = 760 ммHg, охлаждается изобарически до температуры t2 = 250 °C. Определить отводимое тепло QP, если: а) считать теплоемкость постоянной, б) использовать формулу µСP = 6,949 + + 0,000576×t.
Задача № 1-2. Расход воздуха измеряется с помощью электрического нагревателя, установленного в воздухопроводе. Температура воздуха перед нагревателем и за ним измеряется с помощью двух термометров. Определить часовой расход воздуха G кг/ч, если при включении электрического нагревателя мощностью 0,75 кВт температура воздуха перед нагревателем Т1 = 288 К, а за нагревателем Т2 = 291,1 К. Определить также скорость потока воздуха за нагревателем, если давление его (принимаемое нами неизменным) Р = 870 ммHg, а диаметр воздухопровода d = 90 мм.
Задача № 1-3. В результате полного сгорания углерода в атмосфере чистого кислорода в сосуде образовался углекислый газ СО2 при давлении Р = 6,04 бар и температуре Т1 = 1673 К. Какое количество тепла выделится при остывании СО2 до температуры Т2 = 293 К. Определить также, какое давление установиться при этом в сосуде и какое давление имел кислород в сосуде до сгорания, если температура его равнялась 10 °C. Объем сосуда принять неизменным и равным 5 литров.
Задача № 1-4. Найти количество тепла, необходимое для нагревания 1 нм3 газовой смеси состава τ(CO2) = 14,5%; τ(O2) = 6,5%; τ(N2) = 79,0% от 200 до 1200 °C при P = Const и нелинейной зависимости теплоемкости от температуры.
Пример. Воздух в количестве 6 м3 при давлении Р1 = 3 бар и температуре t1 = 25 °C нагревается в процессе P = Const до t2 = 130 °C. Определить количество подведенного тепла, считая С = Const и С = f(T).
QP = m × CP × (t2 – t1) = VН × C"P × (t2 – t1);
QP = m × (CPm × t2 – CPm × t1) = VН × (C"Pm × t2 – C"Pm × t1).
m = (Р1 × V1 × µ) /(R × T1) = (3×105 × 6 × 2,896×10–2) /(8,314 × 298,15) = 21,03 кг.
VН = (Р1 × V1 × TН) /(РН × T1) = (3×105 × 6 × 273,15) /(101325 Па × 298,15) = 16,28 нм3.
QP = 21,03 × (29,33/2,896 × 10–2) × (130 – 25) = 16,28 × (29,33/2,24 × 10–2) × (130 – 25) = 2236,4 кДж.
QP = 21,03 кг × (1,0079 × 130 – 1,0042 × 25) = 16,28 × (1,3026 × 130 – 1,298 × 25) = 2227,5 кДж.
Расхождение 0,40%.
Задача № 1-5. В закрытом сосуде ёмкостью V = 0,5 м5 содержится диоксид углерода при Р = 6 бар и Т = 800 К. Как изменится давление газа, если от него отнять 100 ккал? Принять зависимость C = f(T) линейной.
Задача № 1-6. Сосуд емкостью 90 л содержит воздух при давлении 8 бар и температуре 303 К. Определить количество тепла, которое необходимо сообщить воздуху, чтобы повысить его давление при V = Const до 16 бар. Принять зависимость C = f(T) нелинейной. Ответ дать в ккал.
Задача № 1-7. Какое количество тепла необходимо затратить, чтобы нагреть 2 м3 воздуха при постоянном избыточном давлении РМ = 2 бар от t1 = 100 °C до t2 = 500 °C? какую работу при этом совершит воздух? Давление воздуха по барометру принять равным 760 ммHg.
Задача № 1-8. При изобарическом нагревании от Т1 = 313 К до Т2 = 1023 К однородный газ совершает работу l = 184 кДж/кг. Определить, какой это газ, какое количество тепла ему сообщено и как при этом изменилось его давление.
Задача № 1-9. В процессе подвода тепла при постоянном давлении температура 0,9 нм3 азота повышается от Т1 = 288 К до Т2 = 1873 К. Определить изменения энтальпии азота и долю тепла, пошедшую на увеличение внутренней энергии.
Задача № 1-10. В цилиндре с подвижным поршнем заключен кислород в количестве VН = 0,3 нм3 при Т1 = 318 К и Р1 = 776 ммHg. Некоторое количество тепла сообщается кислороду при Р = Const, а затем производится охлаждение до начальной температуры (318 К) при V = Const. Определить количество подведенного тепла, изменения энтальпии, внутренней энергии и произведенную работу для обоих процессов, если известно, что в конце изохорического охлаждения давление кислорода Р3 = 0,588 бар. Изобразите состояния газа в P – V и T – S координатах.
Термодинамические процессы с идеальным газом.
Краткая теоретическая часть
Под термодинамическим процессом понимается взаимодействие ТС с окружающей средой, в результате которого ТС переводится из определенного начального состояния в определенное конечное состояние.
Если ТС, в которой протекает процесс, можно вернуть в начальное состояние так, что во внешней среде не произойдет каких либо изменений, то процесс называется обратимым. Если начальное состояние ТС без изменений во внешней среде невосстановимо, то процесс называется необратимым.
Только обратимые процессы могут быть изображены графически на диаграммах состояния, так как на них каждая точка представляет равновесное состояние.
Принцип сохранения энергии, сформулированный первым законом термодинамики (формулы (2.1) – (2.3)), приводит в конечном счете к энергетическому балансу, связывающему изменение запаса энергии ТС (внутренней энергии) с энергией, переходящей границы системы при совершении процесса в форме работы или теплоты.
Группа процессов, являющаяся при определенных условиях обобщающей для всех процессов и характеризующаяся постоянством теплоемкости называются политропными.
Для всех процессов устанавливается общий метод исследования, заключающийся в следующем:
· выводится уравнение процесса;
· устанавливается зависимость между основными параметрами состояния ТС;
· определяется теплоемкость процесса;
· определяются изменения функций состояния: внутренней энергии, энтальпии, энтропии;
· вычисляются функции процесса: теплота и работа;
· дается графическая интерпретация термодинамических процессов в P – V и T – S координатах.
Рассматриваемые процессы считаются обратимыми.
Основные соотношения согласно пунктам 1 – 5 даны в таблицах № 2.1 – № 2.3.
Таблица № 2.1
Таблица № 2.2
Таблица № 2.3
Теплоёмкость при политропном процессе равна:
На рисунке ниже приведены политропные процессы в P – V и T – S координатах.

Пример. Воздух, имеющий объем V = 0,01 м3, при Р1 = 10 бар и Т1 = = 298 К расширяется в цилиндре с подвижным поршнем до давления Р2 = 1 бар. Определить конечный объем, температуру, работу расширения, подведенное тепло, изменение внутренней энергии, энтальпии и энтропии, если расширение происходит: 1. изотермически; 2. адиабатически; 3. политропно с показателем политропы n = 1,3. Изобразить процесс в P – V и T – S координатах.
Изотермическое расширение.
Объем в конце расширения:
V2 = V1 × (P1/P2) = 0,01 × (10/1) = 0,1 м3.
Работа расширения:
L = P1 × V1 × ln(P1/P2) = 106 × 0,01 × ln(10/1) = 23 кДж.
QT = L = 23 кДж.
Так как Т1 = Т2 = 298 К, то Δh = 0 и Δu = 0.
Изменение энтропии:
ΔS = Q/T = 23/298 = 0,07718 кДж/К.
Адиабатное расширение.
Масса газа в цилиндре:
m = (P1 × V1 × μ) /R × T1 = (106 × 0,01 × 2,896×10–2) /(8,314 × 298 К) = 0,117 кг.
Конечный объем:
V2 = V1 × (P1/P2) 1/k = 0,01 × (10/1) 1/1,4 = 0,0518 м3.
Температура воздуха в конце процесса:
T2 = T1 × (P2/P1) (k – 1) /k = 298 × (1/10) (1,4 – 1) /1,4 = 154,35 К.
Работа газа при расширении:
L = (P1 × V1 – P2 × V2) /(k – 1) = (106 × 0,01 – 105 × 0,0518) /(1,4 – 1) = 12 кДж.
Энтальпии:
Δh = CP × (T2 – T1) = 1,0189 × (154,35 – 298) = – 146,36 кДж/кг;
ΔH = m × Δh = 0,117 × (– 146,36) = – 17,12 кДж.
Внутренней энергии:
Δu = CV × (T2 – T1) = 0,7317 × (154,35 – 298) = – 105,11 кДж/кг;
ΔU = m × Δu = 0,117 × (– 105,11) = – 12,30 кДж.
При определении изменения функций состояния, ввиду значительного изменения температуры в процессе (298 – 154,35 = 146,65 К), пользуемся зависимостью теплоемкости от температуры C = f(T) (см. таблицу №3 приложения).
Политропное расширение с n = 1,3.
Конечный объем:
V2 = V1 × (P1/P2) 1/n = 0,01 × (10/1) 1/1,3 = 0,0588 м3.
Конечная температура:
T2 = T1 × (V1/V2) n – 1 = 298 × (0,01/0,0588) 1,3 – 1 = 175,15 K.
Работа газа при расширении:
L = (P1 × V1 – P2 × V2) /(n – 1) = (106 × 0,01 – 105 × 0,0588) /(1,3 – 1) = 13,7 кДж.
Количество подведенного тепла:
qП = CV × [(n – k) /(n – 1)] × (T2 – T1) = 0,7317 × [(1,3 – 1,4) /(1,3 – 1)] × (175,15 – – 298) = 29,96 кДж/кг;
QП = m × qП = 0,117 × 29,96 = 3,51 кДж.
Изменение в процессе составило:
Энтальпии:
Δh = CP × (T2 – T1) = 1,0189 × (175,15 – 298) = – 125,17 кДж/кг;
ΔH = m × Δh = 0,117 × (–125,17) = – 14,64 кДж.
Внутренней энергии:
Δu = CV × (T2 – T1) = 0,7317 × (175,15 – 298) = – 89,89 кДж/кг;
ΔU = m × Δu = 0,117 × (–89,89) = – 10,52 кДж.
Задачи для самостоятельного решения.
Задача № 2-1. В замкнутом помещении объемом V = 25 м3 находится воздух при давлении Р1 = 730 ммHg и температуре Т1 = 283 К. В результате подвода тепла давление возросло до Р2 = 2,3 бар. Определить количество подведенного тепла QV, изменение внутренней энергии ΔU и энтальпии ΔH.
Задача № 2-2.6. кг азота совершают в процессе изобарического расширения работу LР = 343 кДж. Определить изменения внутренней энергии азота, если начальная температура его равна Т1 = 373 К.
Задача № 2-3. Оксид углерода находится при избыточном давлении РМ = 3,92 бар и занимает объем V = 5 м3, барометрическое давление при этом равно РБ = 755 ммHg. Определить изменение внутренней энергии и величину затраченной работы, если оксид углерода будет изобарически охлажден от Т1 = 573 К до Т2 = 373 К.
Задача № 2-4. Как изменится внутренняя энергия и энтальпия 20 нм3 кислорода при изобарическом нагревании от 373 К до 1173 К, если давление Р = 9,8 бар. Какова совершенная газом работа?
Задача № 2-5.0,6 нм3 воздуха при изобарическом подводе тепла совершает работу LР = 15,68 кДж. Определить температуру Т2 и объем воздуха V, если в начальном состоянии его температура и давление были соответственно равны Р1 = 4,42 бар и Т1 = 293 К.
Задача № 2-6. Кислород при температуре Т1 = 353 К и давлении РВ равном 320 ммHg сжимается при Т = Const до избыточного давления РМ = 12 бар. Во сколько раз уменьшается объем кислорода, если барометрическое давление РБ = 745 ммHg?
Задача № 2-7. 10 кг кислорода расширяются при Т = 423 К = Const от начального давления Р1 = 14,7 бар и производят работу LT = 2969,4 кДж. Определить давление в конце расширения и изобразить процесс в P – V и T – S координатах.
Задача № 2-8. В цилиндре с подвижным поршнем заключено 3,5 м3 азота при давлении Р1 = 1,47 бар. В процессе изотермического сжатия отводится 461 кДж тепла. Определить давление Р2 и объем V2 азота в конце сжатия.
Задача № 2-9. 0,4 кг воздуха при Т1 = 573 К и Р1 = 1,98 бар расширяются изотермически до V2 = 1,68 м3/кг, а затем сжимаются изобарически и, наконец, путем изохорического нагревания, снова возвращаются в исходное состояние. Определить для каждого процесса ΔH, ΔS, ΔU, а также тепло и работу L. Определить также параметры (P, v, T) для всех точек и изобразить процессы в P – V и T – S координатах.
Задача № 2-10. 0,3 нм3 воздуха изотермически сжимаются от начального состояния Р1 = 7,35 бар, Т1 = 573К до некоторого конечного состояния Р2, V2. Определить значения Р2 и V2, если известно, что в процессе изотермического сжатия было отведено 167,6 кДж тепла. Определить также изменение внутренней энергии и энтальпии воздуха.
Задача № 2-11. 1. нм3 воздуха адиабатически расширяется от начального состояния 1 (Р1 = 6 ата, t1 = 300 °C) до состояния, причем V2 = 3V3; затем он сжимается изотермически до начального значения удельного объема V3 = V1. Определить параметры (P, v, T) точек 1, 2 и 3 и суммарную работу, произведенную газом. Представить процесс в P – V и T – S координатах.
Задача № 2-12. Работа затраченная на адиабатное сжатие 3 кг воздуха, составляет (– 471) кДж. Начальное состояние воздуха характеризуется параметрами Т1 = 288 К и Р1 = 1 бар. Определить конечную температуру и изменение внутренней энергии.
Задача № 2-13. 1. кг воздуха при давлении Р1 = 4 бар и температуре Т1 = 373 К расширяется до давления Р2 = 1 бар. Определить конечную температуру, количество тепла и совершенную работу, если расширение происходит: а) изохорно, б) изотермически, в) адиабатно и г) политропно с показателем n = 1,2. Изобразить процесс в P – V и T – S координатах.
Задача № 2-14. В баллоне емкостью 100 л находится воздух при давлении Р1 = 50 бар и температуре Т1 = 293 К. Давление окружающей среды Р2 = 1 бар. Определить полезную работу, которая может быть произведена воздухом при его расширении до давления окружающей среды по изотерме и по адиабате, а также конечную температуру воздуха в баллоне после адиабатного расширения.
Задача № 2-15. 1 кг воздуха при температуре Т1 = 290 К сжимается адиабатически до объема, составляющего 1/5 начального, а затем расширяется изотермически до первоначального объема. Определить работу, произведенную воздухом в результате обоих процессов. Изобразить процесс в P – V и T – S координатах.
Задача № 2-16. При политропном расширении 1 киломоля газа его объем увеличился на 20%, а абсолютная температура уменьшилась на 12%. Определить показатель политропы, величину работы lП кДж/моль, если Т1 = = 490 К.
Задача № 2-17. К 1 кг воздуха при его сжатии в политропном процессе подведено 50 кДж/кг тепла. Определить показатель политропы, изменение внутренней энергии и работу сжатия, если температура воздуха увеличилась в процессе на 100 К.
Задача № 2-18. 1 кг азота в начальном состоянии имеет параметры Р1 = 25 бар и Т1 = 973 К. После политропного расширения (n = 1,18) давление азота становится равным Р2 = 105 Н/м2. Определить ΔU, ΔН в процессе, а также количество тепла qП и работу расширения lП.
1. Процесс, протекающий при постоянном объеме, называется ___изохорным ________
2. Процесс, протекающий при постоянном давлении, называется ___изобарным______
3. Процесс, протекающий при постоянной температуре, называется ___изотермическим___
4. Процесс, протекающий без теплообмена с внешней средой, называется _______________адиабатным___________________________
5. Обобщающий термодинамический процесс, в котором доля теплоты, идущая на изменение внутренней энергии системы, остается постоянной, называется _________политропным______________
6. Количество теплоты, которое нужно сообщить телу, чтобы изменить его температуру на один кельвин или градус Цельсия называется ____теплоемкостью _______
7. Для цикла теплового двигателя отношение работы, совершаемой за цикл, к количеству подводимой теплоты представляет собой ______кпд цикла ______
8. Количество теплоты, необходимое для превращения 1кг жидкости, нагретой до температуры кипения, при постоянном давлении в сухой насыщенный пар, называется ________________теплотой парообразования ____________
9. Молекулярный способ переноса теплоты в сплошной среде при наличии градиента температуры называется ____________теплопроводностью_______________________
10. Теплообмен, осуществляемый совместным действием теплопроводности и конвекции, носит название ___________конвективного теплообмена ___________________________
11. Количество теплоты, передаваемое через какую либо поверхность в единицу времени называется ____________тепловым потоком __________
12. Тепловой поток, приходящийся на единицу площади поверхности, через которую он проходит, называется _____плотностью_теплового потока __________________________
13. Параметрами состояния термодинамической системы являются
15. Система, которая может обмениваться с окружающей средой и веществом и энергией, называется
|
1) открытой |
3) адиабатной |
|
2) закрытой |
4) замкнутой |
16. Система, которая может обмениваться с окружающей средой энергией но не веществом, называется
18. Уравнение состояния для произвольного количества идеального газа имеет вид
В вариантах ответов приняты следующие обозначения:
p- давление
v- удельный объём
m- масса газа
Т- термодинамическая температура
t- температура по Цельсию
М- количество киломолей газа
R- газовая постоянная
Универсальная газовая постоянная
19. В термомеханических системах происходит взаимное превращение
20. Процесс без теплообмена с окружающей средой называется
21. Процесс, протекающий при постоянной температуре, называется
|
1) изохорным |
4) адиабатным |
|
2) изобарным |
5) изоэнтропийным |
|
3) изотермическим |
22. Процесс, протекающий при постоянном объеме, называется
24. Фактором, оказывающим наибольшее влияние на удельную теплоемкость газа, является
25. Условным топливом называется
1) топливо, наиболее подходящее для конкретных условий использования
2) каменный уголь среднего качества
3) топливо, имеющее низшую теплоту сгорания 29,31 МДж/кг
4) топливо, имеющее низшую теплоту сгорания 35,0 МДж/кг
26. На рисунках представлены схемы установок
1) а) паросиловая; б) газотурбинная; в) парокомпрессорная холодильная
2) а) парокомпрессорная холодильная; б) газотурбинная; в) паросиловая
3) а) абсорбционная холодильная; б) газотурбинная; в) паросиловая
4) а) газотурбинная; б) парокомпрессорная холодильная; в) паросиловая
27. Тепловой насос – это
1) холодильная машина, используемая для целей теплоснабжения (отопления)
2) насос любой конструкции, используемой для перекачки жидких
теплоносителей
3) устройство для переноса теплоты от «горячего» источника к «холодному»
4) устройство для перекачки температуры от одного теплового источника к
28. Плотность теплового потока при теплопередаче рассчитывается по формуле
|
1)
|
3)
|
|
2)
|
4)
|
В приведенных вариантах ответа использованы следующие обозначения:
 –коэффициент
теплопроводности
–коэффициент
теплопроводности
 –коэффициент
теплопередачи
–коэффициент
теплопередачи
 –коэффициент
теплоотдачи
–коэффициент
теплоотдачи
 –толщина стенки
–толщина стенки
 и
и
 –
температуры теплоносителей
–
температуры теплоносителей
 и
и
 –
температуры поверхностей стенки
–
температуры поверхностей стенки
|
Установите соответствие ответов |
29. В представленном на диаграммах цикле Отто
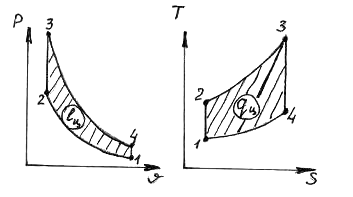
обозначения процессы
1) 1-2 А) изохорный подвод теплоты
2) 2-3 Б) изобарный подвод теплоты
3) 3-4 В) изохорный отвод теплоты
4) 4-1 Г) изобарный отвод теплоты
Д) изотермический подвод теплоты
Е) изотермический отвод теплоты
Ж) адиабатное расширение
З) адиабатное сжатие
1.__з___; 2.__а___; 3.__ж___; 4.__в___