Elementarne čestice i njihove glavne karakteristike. Struktura atoma i karakteristike elementarnih čestica
Sva tijela, uključujući i nas same, sastavljena su od sićušnih građevnih blokova zvanih atomi. Postoji onoliko vrsta takvih "cigli" koliko ih ima u prirodi hemijski elementi. Hemijski element je skup atoma istog tipa.
Ideju da je materija izgrađena od najsitnijih "čestica" izrazili su drevni grčki naučnici. Oni su te čestice nazvali atomima (od grčke riječi koja znači "nedjeljiv"). Stari Grci su vjerovali da su atomi oblikovani pravilni poliedri: kocka ("atomi zemlje"), tetraedar ("atomi vatre"), oktaedar ("atomi vazduha"), ikosaedar ("atomi vode"). Prošlo je više od dvadeset stoljeća prije nego što je dobijena eksperimentalna potvrda ideje o atomističkoj strukturi materije. Ova ideja je konačno uspostavljena u nauci u drugoj polovini 19. veka zahvaljujući uspesima hemije i molekularno-kinetičke teorije. Početkom 20. stoljeća fizičari su već znali da atomi imaju dimenzije reda 10-10 m i masu od 10-27 kg. U to vrijeme postalo je jasno da atomi uopće nisu "nedjeljivi", da imaju određenu unutarnju strukturu, čije rješenje će objasniti periodičnost svojstava kemijskih elemenata, koje je identificirao Dmitrij Ivanovič Mendeljejev (1834-1907) .
Godine 1903., ubrzo nakon otkrića elektrona, engleski fizičar Joseph John Thomson (1856-1940) predložio je model atoma u obliku pozitivno nabijene sfere prečnika oko 10-10 m, unutar koje se nalaze elektroni. isprepletene (vidi Elementarne čestice). negativni naboj kompenzirani elektroni pozitivan naboj sfere. Kada elektroni vibriraju oko centra sfere, atom emituje svjetlost. Thomson je vjerovao da su elektroni grupirani u slojeve oko centra.
U modelu koji je predložio Thomson, masa atoma je ravnomjerno raspoređena po njegovom volumenu. Pogrešnost ove pretpostavke ubrzo je dokazao engleski fizičar Ernest Rutherford (1871-1937). 1908-1911, pod njegovim vodstvom, izvedeni su eksperimenti na raspršivanju a-čestica (jezgri helijuma) metalnom folijom, a čestica je slobodno prolazila kroz tanku foliju, doživljavajući samo manja odstupanja; međutim, u nekim rijetkim slučajevima (otprilike jedan od 10.000) uočeno je raspršivanje a-čestica pod uglom većim od 90°.
"Bilo je gotovo jednako nevjerovatno," kasnije se prisjetio Rutherford, "kao da ispalite projektil od 15 inča na list papirne maramice, a projektil bi se vratio i pogodio vas."
Eksperimenti o rasejanju a-čestica su ubedljivo pokazali da je skoro cela masa atoma koncentrisana u vrlo maloj zapremini - atomskom jezgru, čiji je prečnik približno
10.000 puta manji od prečnika atoma. Većina a-čestica leti pored masivnog jezgra ne dodirujući ga, samo se povremeno sudarajući s njim i "odbijajući" nazad.
Rutherfordovi eksperimenti poslužili su kao osnova za stvaranje proton-neutronskog modela atoma. Ovaj model određuje moderne ideje o strukturi atoma.
Dakle, u centru atoma nalazi se atomsko jezgro (njegove dimenzije su oko 10 "14 m); ostatak zapremine atoma su elektroni. Unutar jezgra nema elektrona (ovo je postalo jasno početkom 30-ih godina ); jezgro se sastoji od pozitivno nabijenih protona i nema naboj neutrona. Broj elektrona u atomu jednak je broju protona u jezgru; ovo je atomski broj datog kemijskog elementa (njegov serijski broj u periodični sistem). Masa elektrona je oko 2000 puta manja od mase protona ili neutrona, tako da je skoro sva masa atoma koncentrisana u jezgru. Različiti elektroni su vezani za jezgro u različitim stepenima;
neki od njih se relativno lako "gube", pri čemu se atom pretvara u pozitivni ion. Pribavljanjem dodatnih elektrona, atom postaje negativni ion.
U stvaranju svog modela atoma, Rutherford je sugerirao da Coulombove sile djeluju između negativno nabijenih elektrona i pozitivno nabijenog jezgra. Jasno je da elektroni ne mogu mirovati unutar atoma, jer bi tada pali na jezgro, pa se, prema Rutherfordovoj pretpostavci, elektroni kreću oko jezgra, baš kao što se planete okreću oko Sunca. Stoga je Rutherfordov model atoma nazvan planetarnim.
Jednostavan i vizualan planetarni model atoma ima direktno eksperimentalno opravdanje. Apsolutno je neophodan za objašnjenje eksperimenta rasejanja a-čestica. Ali takav model je u suprotnosti sa zakonima mehanike i elektrodinamike. Ne dozvoljava objašnjenje postojanja atoma, njegove stabilnosti. Uostalom, kretanje elektrona u orbitama događa se ubrzanjem, i to vrlo velikim. Prema Maksvelovim zakonima elektrodinamike, ubrzani naboj mora zračiti elektromagnetne talase sa frekvencijom jednakom broju njegovih obrtaja oko jezgra u sekundi. Zračenje je praćeno gubitkom energije. Gubeći energiju, elektroni bi se trebali približiti jezgru, baš kao što se satelit približava Zemlji prilikom kočenja u gornjim slojevima atmosfere. Kao što pokazuju potpuno rigorozni proračuni zasnovani na Newtonovoj mehanici i Maksvelovoj elektrodinamici, elektron mora pasti na jezgro u zanemarljivom vremenu (oko 10-8 s), a atom mora prestati da postoji.
U stvarnosti se ništa slično ne dešava. Atomi su stabilni i u nepobuđenom stanju mogu postojati beskonačno bez da emituju elektromagnetne talase. Ovo dovodi do najvažnijeg zaključka: zakoni klasične fizike su neprimjenjivi na fenomene atomskih razmjera.
Izlaz iz izuzetno teške situacije pronašao je 1913. veliki danski fizičar Niels Bohr (1885-1962) koji je uveo svoje čuvene kvantne postulate koji određuju strukturu atoma i uslove za njegovu emisiju i apsorpciju. elektromagnetno zračenje. Evo ih:
Prvi postulat: atomski sistem može biti samo u posebnim stacionarnim ili kvantnim stanjima, od kojih svako odgovara određenoj energiji En. U stacionarnom stanju, atom ne zrači.
Ovaj postulat je u jasnoj suprotnosti sa klasičnom mehanikom, prema kojoj energija pokretnih elektrona može biti bilo koja. Takođe je u suprotnosti sa Maksvelovom elektrodinamikom, jer dozvoljava mogućnost ubrzanog kretanja bez zračenja elektromagnetnih talasa.
Drugi postulat: prilikom prijelaza atoma iz jednog stacionarnog stanja u drugo, emituje se ili apsorbira kvant elektromagnetne energije.
Drugi postulat je takođe u suprotnosti sa Maksvelovom elektrodinamikom, prema kojoj je frekvencija emitovane svetlosti jednaka frekvenciji orbite elektrona. Prema Bohrovoj teoriji, frekvencija je povezana samo s promjenom energije atoma.
ATOMSKA NUKLUS
Prema proton-neutronskom modelu, atomska jezgra se sastoje od elementarnih čestica dva tipa: protona i neutrona (vidi i Atom).
Poznato je da je naelektrisanje protona pozitivno i jednak naboju elektron.
Neutron nema električni naboj, njegova masa je 1,00867 a.m.u. 1 jedinica atomske mase (a.m.u.) jednaka je 1/12 mase atoma ugljika i povezana je s kilogramom omjerom 1 a.m.u. =1,6605 10-27 kg; 1 amu odgovara energiji od 931,5 MeV).
Broj protona u jezgru naziva se nuklearni naboj i jednak je broju elektrona u atomska školjka, pošto je atom generalno neutralan, pa je broj protona u jezgru jednak atomskom broju elementa ZB u periodnom sistemu.
Maseni broj jezgra A je zbir broja protona Z i broja neutrona N u jezgru: A=Z+N.
Pošto su mase protona i neutrona bliske jedna drugoj, maseni broj A je vrlo blizak relativnoj atomskoj masi elementa. Maseni brojevi mogu se odrediti grubim mjerenjem masa jezgara instrumentima koji nemaju veliku preciznost.
Međutim, rođak atomske mase neki elementi su veoma različiti od celog broja. Dakle, za bor je 10,81, za hlor - 35,45. Zašto? Ispada da se jezgra istog hemijskog elementa mogu razlikovati po broju neutrona sa istim brojem protona u jezgru i elektrona u elektronskoj ljusci,
Ova jezgra imaju isto Hemijska svojstva i nalaze se u jednoj ćeliji periodnog sistema. Ovo su izotopi. Hemijski jednostavne prirodne tvari su mješavina izotopa. Dakle, bor se sastoji od mješavine dva izotopa: 20% je izotop sa maseni broj 10 (5 protona, 5 neutrona), i 80% - sa masenim brojem 11 (5 protona i 6 neutrona).
Elementarne čestice su čestice koje imaju ovog trenutka nije pronađena unutrašnja struktura. Čak iu prošlom veku atomi su se smatrali elementarnim česticama. Njihova unutrašnja struktura - jezgra i elektroni - otkrivena je početkom 20. stoljeća. u eksperimentima E. Rutherforda. Veličina atoma je oko 10 -8 cm, jezgra su desetine hiljada puta manja, a veličina elektrona je vrlo mala. To je manje od 10 -16 cm, kako slijedi iz modernih teorija i eksperimenata.
Dakle, sada je elektron elementarna čestica. Što se tiče jezgara, njihova unutrašnja struktura otkrivena je ubrzo nakon njihovog otkrića. Sastoje se od nukleona - protona i neutrona. Jezgra su prilično guste: prosječna udaljenost između nukleona je samo nekoliko puta veća od njihove vlastite veličine. Da bi se saznalo od čega se sastoje nukleoni, trebalo je oko pola stoljeća, međutim, u isto vrijeme pojavile su se i riješile druge misterije prirode.
Nukleoni se sastoje od tri kvarka, koji su elementarni sa istom tačnošću kao i elektron, tj. njihov radijus je manji od 10 -16 cm. Radijus nukleona - veličina površine koju zauzimaju kvarkovi - je oko 10 -13 cm. čestice - barioni, sastavljeni od tri različita (ili identična) kvarka. Kvarkovi mogu formirati trojke na različite načine, a to određuje razlike u svojstvima bariona, na primjer, može imati drugačiji spin.
Osim toga, kvarkovi se mogu kombinovati u parove - mezone, koji se sastoje od kvarka i antikvarka. Spin mezona uzima cjelobrojne vrijednosti, dok za barione uzima polucijele vrijednosti. Barioni i mezoni zajedno se nazivaju hadroni.
Kvarkovi nisu pronađeni u slobodnom obliku, a prema trenutno prihvaćenim konceptima mogu postojati samo u obliku hadrona. Prije otkrića kvarkova, hadroni su se neko vrijeme smatrali elementarnim česticama (i ovaj naziv je još uvijek prilično čest u literaturi).
Prva eksperimentalna indikacija kompozitne strukture adrona bili su eksperimenti raspršenja elektrona protonima na linearnom akceleratoru Stanford (SAD), što se moglo objasniti samo pretpostavkom o prisutnosti nekih točkastih objekata unutar protona.
Ubrzo je postalo jasno da se radi o kvarkovima, čije su postojanje pretpostavili još ranije teoretičari.
Evo tabele modernih elementarnih čestica. Pored šest tipova kvarkova (do sada se u eksperimentima pojavilo samo pet, ali teoretičari sugerišu da postoji i šesta), u ovoj tabeli su navedeni leptoni - čestice kojima pripada i elektron. U ovoj porodici otkriveni su i mion i (sasvim nedavno) t-lepton. Svaki od njih ima svoj neutrino, tako da se leptoni prirodno dijele na tri para e, n e; m, n m ;t, n t .
Svaki od ovih parova se kombinuje sa odgovarajućim parom kvarkova u četvorku, koja se naziva generacijom. Svojstva čestica se ponavljaju iz generacije u generaciju, kao što se može vidjeti iz tabele. Samo se mase razlikuju. Druga generacija je teža od prve, a treća generacija je teža od druge.
U prirodi se uglavnom nalaze čestice prve generacije, a ostale se stvaraju umjetno na akceleratorima nabijenih čestica ili pri interakciji kosmičkih zraka u atmosferi.
Pored spin 1/2 kvarkova i leptona, koji se zajednički nazivaju čestice materije, u tabeli su navedene čestice sa spinom 1. Ovo su kvanti polja koje stvaraju čestice materije. Od njih, najpoznatija čestica je foton, kvant elektromagnetnog polja.
Takozvani srednji bozoni W+ i W- , koji imaju veoma velike mase, nedavno su otkriveni u eksperimentima na šalteru R-zraci na energijama od nekoliko stotina GeV. To su nosioci slabih interakcija između kvarkova i leptona. I konačno, gluoni su nosioci jakih interakcija između kvarkova. Kao i sami kvarkovi, gluoni nisu pronađeni u slobodnom obliku, već se pojavljuju u srednjim fazama reakcija stvaranja i anihilacije adrona. Nedavno su otkriveni hadronski mlazovi generisani gluonima. Budući da se sva predviđanja teorije kvarkova i gluona – kvantne hromodinamike – slažu sa iskustvom, gotovo da nema sumnje u postojanje gluona.
Čestica sa spinom 2 je graviton. Njegovo postojanje proizilazi iz Ajnštajnove teorije gravitacije, principa kvantna mehanika i teorija relativnosti. Biće izuzetno teško eksperimentalno detektovati graviton, pošto on veoma slabo reaguje sa materijom.
Konačno, tabela sa upitnikom pokazuje čestice sa spinom 0 (H-mezoni) i 3/2 (gravitinos); nisu pronađeni eksperimentalno, ali se njihovo postojanje pretpostavlja u mnogim modernim teorijskim modelima.
Elementarne čestice
| spin | 0? | 1/2 | 1 | 3/2 | 2? | ||||||
| naslov | Čestice materije | Kvanti polja | |||||||||
| kvarkovi | leptons | foton | vektorski bozoni | gluon | gravitino | graviton | |||||
| simbol | H | u | d | ne | e | g | Z | W | g | ||
| (težina) | (?) | (?) | (0,5) | (0) | (~95 GeV) | (~80 GeV) | (?) | (?) | |||
| simbol | With | s | n m | m | |||||||
| (težina) | (0?) | (106) | |||||||||
| simbol | t | b | n t | t | |||||||
| (težina) | (0?) | (1784) | |||||||||
|
barionski |
0 | 1/3 | 1/3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
Električni |
0,±1 | 2/3 | 1/3 | 0 | -1 | 0 | 0 | ±1 | 0 | 0 | 0 |
| boja | - | 3 | 3 | - | - | - | - | - | 8 | - | - |
Hadroni - uobičajeno ime za čestice koje učestvuju u jakim interakcijama . Ime dolazi od grčke riječi koja znači "snažan, velik". Svi hadroni su podijeljeni u dvije velike grupe - mezone i barione.
barioni(od grčke riječi koja znači "težak") su hadroni sa polucijelim spinom . Najpoznatiji barioni su proton i neutron . Barioni takođe uključuju određeni broj čestica sa kvantnim brojem, jednom nazvanim oddity. Jedinicu neobičnosti posjeduju lambda barion (L°) i porodica sigma bariona (S - , S+ i S°). Indeksi +, -, 0 označavaju predznak električnog naboja ili neutralnost čestice. Barioni xy (X - i X°) imaju dvije jedinice neobičnosti. Baryon W - ima neobičnost jednaku tri. Mase navedenih bariona su oko jedan i po puta veće od mase protona, a njihov karakteristični životni vijek je oko 10 -10 s. Podsjetimo da je proton praktično stabilan, dok neutron živi više od 15 minuta. Čini se da su teži barioni vrlo kratkog vijeka, ali na skali mikrokosmosa to nije tako. Takva čestica, čak i relativno sporo, brzinom jednakom, recimo, 10% brzine svjetlosti, uspijeva preći put od nekoliko milimetara i ostaviti trag u detektoru elementarnih čestica. Jedno od svojstava bariona koje ih razlikuju od drugih vrsta čestica može se smatrati prisustvom očuvanog barionskog naboja. Ova vrijednost je uvedena da opiše eksperimentalnu činjenicu konstantnosti u svim poznatim procesima razlike između broja bariona i antibariona.
Proton- stabilna čestica iz klase hadrona, jezgra atoma vodonika. Teško je reći koji događaj treba smatrati otkrićem protona: na kraju krajeva, kao vodikov ion, poznat je već dugo vremena. Stvaranje planetarnog modela atoma od strane E. Rutherforda (1911) i otkriće izotopa (F. Soddy, J. Thomson, F. Aston, 1906-1919), te promatranje jezgara vodika koje je izbacila alfa čestice iz jezgara dušika su imale ulogu u otkriću protona (E. Rutherford, 1919). Godine 1925. P. Blackett je dobio prve fotografije tragova protona u komori oblaka (vidi Detektori nuklearnog zračenja), potvrđujući otkriće umjetne transformacije elemenata. U ovim eksperimentima, a-čestica je zarobljena jezgrom dušika, koje je emitiralo proton i pretvorilo se u izotop kisika.
Zajedno sa neutronima, protoni formiraju atomska jezgra svih hemijskih elemenata, a broj protona u jezgru određuje atomski broj datog elementa. Proton ima pozitivan električni naboj jednak elementarnom naboju, odnosno apsolutnoj vrijednosti naboja elektrona. Ovo je eksperimentalno potvrđeno sa tačnošću od 10 -21. masa protona m p = (938,2796 ± 0,0027) MeV ili ~ 1,6-10 -24 g, tj. proton je 1836 puta teži od elektrona! Sa moderne tačke gledišta, proton nije istinit elementarna čestica: sastoji se od dva u-kvarkovi sa električnim nabojem +2/3 (u jedinicama elementarnog naboja) i jedan d-kvark sa električnim nabojem -1/3. Kvarkovi su međusobno povezani razmjenom drugih hipotetičkih čestica - gluona, kvanta polja koje nosi snažne interakcije. Podaci eksperimenata u kojima su razmatrani procesi rasejanja elektrona protonima zaista ukazuju na prisustvo tačaka rasejanja centara unutar protona. Ovi eksperimenti su u određenom smislu vrlo slični Rutherfordovim, koji su doveli do otkrića atomskog jezgra. Kao kompozitna čestica, proton ima konačnu veličinu od ~ 10 -13 cm, iako se, naravno, ne može predstaviti kao čvrsta lopta. Umjesto toga, proton liči na oblak sa nejasnom granicom, koji se sastoji od virtuelnih čestica koje se pojavljuju i uništavaju.
Proton, kao i svi hadroni, učestvuje u svakoj od osnovnih interakcija. Dakle. jake interakcije vezuju protone i neutrone u jezgrima, elektromagnetne interakcije - protone i elektrone u atomima. Primjeri slabih interakcija su beta raspad neutrona ili intranuklearna transformacija protona u neutron uz emisiju pozitrona i neutrina (za slobodni proton takav proces je nemoguć zbog zakona održanja i konverzije energije, jer neutron ima nešto veću masu). Spin protona je 1/2. Hadroni sa polucijelim spinom nazivaju se barioni (od grčke riječi za "teški"). Barioni uključuju proton, neutron, razne hiperone (L, S, X, W) i brojne čestice s novim kvantni brojevi, od kojih većina tek treba biti otkrivena. Za karakterizaciju bariona uveden je poseban broj - barionski naboj, jednak 1 za barione, - 1 - za antibarione i O - za sve ostale čestice. Barionski naboj nije izvor barionskog polja, već je uveden samo da opiše pravilnosti uočene u reakcijama sa česticama. Ove pravilnosti su izražene u obliku zakona održanja naelektrisanja bariona: razlika između broja bariona i antibariona u sistemu je očuvana u bilo kojoj reakciji. Očuvanje naboja bariona onemogućava raspad protona, jer je najlakši od bariona. Ovaj zakon je empirijske prirode i, naravno, mora biti testiran eksperimentalno. Tačnost zakona održanja barionskog naboja karakteriše stabilnost protona, čija eksperimentalna procjena za životni vijek daje vrijednost od najmanje 1032 godine.
Istovremeno, u teorijama koje kombinuju sve vrste fundamentalnih interakcija, predviđaju se procesi koji dovode do narušavanja barionskog naboja i do raspada protona. Životni vijek protona u takvim teorijama nije baš precizno naznačen: otprilike 1032 ± 2 godine. Ovo vrijeme je ogromno, višestruko je duže od vremena postojanja Univerzuma (~ 2·10 10 godina). Stoga je proton praktično stabilan, što je omogućilo stvaranje hemijskih elemenata i, na kraju, nastanak inteligentnog života. Međutim, potraga za raspadom protona danas je jedan od najvažnijih problema u eksperimentalnoj fizici. Sa životnim vijekom protona od ~ 1032 godine u zapremini vode od 100 m3 (1 m3 sadrži ~ 1030 protona), treba očekivati da će se jedan proton godišnje raspasti. Ostaje samo da se registruje ovo raspadanje. Otkriće raspada protona bit će važan korak ka ispravnom razumijevanju jedinstva prirodnih sila.
Neutron- neutralna čestica koja pripada klasi hadrona. Otvoren 1932. od strane engleskog fizičara J. Chadwicka. Uz protone, dio su i neutroni atomska jezgra. Električno punjenje neutron q n je jednak nuli. To potvrđuju direktna mjerenja naboja od skretanja neutronskog snopa u jakom električna polja, pokazujući da |q n |<10 -20 e(ovdje e- elementarni električni naboj, odnosno apsolutna vrijednost naboja elektrona). Procjena indirektnih podataka |q n |< 2*10 -22 е. Спин нейтрона равен 1/2. Как адрон с полуцелым спином, он относится к группе барионов. У каждого бариона есть античастица; антинейтрон был открыт в 1956 г. в опытах по рассеянию антипротонов на ядрах. Антинейтрон отличается от нейтрона знаком барионного заряда; у нейтрона, как и у протона, барионный заряд равен +1.
Poput protona i drugih hadrona, neutron nije prava elementarna čestica: sastoji se od jedne u-kvark sa električnim nabojem +2/3 i dva d-kvarkovi sa nabojem od -1/3, međusobno povezani gluonskim poljem.
Neutroni su stabilni samo u stabilnim atomskim jezgrama. Slobodni neutron je nestabilna čestica koja se raspada na proton (p), elektron (e-) i elektronski antineutrino. Životni vijek neutrona je (917 ± 14) s, odnosno oko 15 min. Neutroni postoje u slobodnoj formi u materiji još manje zbog jake apsorpcije od strane njihovih jezgara. Stoga nastaju u prirodi ili se dobivaju u laboratoriju samo kao rezultat nuklearnih reakcija.
Prema energetskom bilansu različitih nuklearnih reakcija određuje se vrijednost masene razlike između neutrona i protona: m n- m p (1,29344 ±0,00007) MeV. Upoređujući je sa masom protona, dobijamo masu neutrona: m n = 939,5731 ± 0,0027 MeV; odgovara m n ~ 1,6-10 -24.
Neutron učestvuje u svim vrstama fundamentalnih interakcija. Snažne interakcije vezuju neutrone i protone u atomskim jezgrama. Primjer slabe interakcije je beta raspad neutrona.
Da li ova neutralna čestica učestvuje u elektromagnetnim interakcijama? Neutron ima unutrašnju strukturu, a u slučaju opće neutralnosti u njemu postoje električne struje, što posebno dovodi do pojave magnetskog momenta u neutronu. Drugim riječima, u magnetskom polju, neutron se ponaša kao igla kompasa. Ovo je samo jedan primjer njegove elektromagnetne interakcije. Potraga za električnim dipolnim momentom neutrona, za koju je dobijena gornja granica, izazvala je veliki interes. Ovde su naučnici Lenjingradskog instituta za nuklearnu fiziku Akademije nauka SSSR uspeli da izvedu najefikasnije eksperimente; Potraga za dipolnim momentom neutrona važna je za razumijevanje mehanizama narušavanja invarijantnosti u odnosu na promjenu vremena u mikroprocesima.
Gravitacione interakcije neutrona su posmatrane direktno iz njihovog upada u Zemljino gravitaciono polje.
Sada je usvojena uslovna klasifikacija neutrona prema njihovoj kinetičkoj energiji:
spori neutroni (<10 5 эВ, есть много их разновидностей), быстрые нейтроны (10 5 ¸10 8 эВ), высокоэнергичные (>10 8 eV). Veoma spori neutroni imaju veoma interesantna svojstva.
(10 -7 eV), koji se nazivaju ultrahladni. Pokazalo se da se ultrahladni neutroni mogu akumulirati u "magnetnim zamkama", pa čak i njihovi spinovi tamo mogu biti orijentisani u određenom pravcu. Koristeći magnetna polja posebne konfiguracije, ultrahladni neutroni se izoluju od upijajućih zidova i mogu "živjeti" u zamci dok se ne raspadnu. Ovo omogućava mnoge suptilne eksperimente za proučavanje svojstava neutrona. Druga metoda skladištenja ultrahladnih neutrona zasniva se na njihovim valnim svojstvima. Takvi neutroni se jednostavno mogu pohraniti u zatvorenu "banku". Ovu ideju izneo je sovjetski fizičar Ya. B. Zeldovich kasnih 1950-ih, a prvi rezultati su dobijeni u Dubni na Institutu za nuklearna istraživanja skoro deceniju kasnije.
Nedavno su naučnici uspjeli da naprave posudu u kojoj ultrahladni neutroni žive do svog prirodnog raspadanja.
Slobodni neutroni mogu aktivno stupati u interakciju s atomskim jezgrama, uzrokujući nuklearne reakcije. Kao rezultat interakcije sporih neutrona sa materijom, mogu se uočiti efekti rezonancije, difrakcijsko rasipanje u kristalima itd. Zbog ovih karakteristika neutroni se široko koriste u nuklearnoj fizici i fizici čvrstog stanja. Oni igraju važnu ulogu u nuklearnoj energetici, u proizvodnji transuranijumskih elemenata i radioaktivnih izotopa, te nalaze praktičnu primjenu u kemijskoj analizi i geološkim istraživanjima.
Mezoni- hadroni sa cjelobrojnim spinom Naziv potiče od grčke riječi koja znači "srednji, srednji", budući da su mase prvih otkrivenih mezona imale srednje vrijednosti između masa protona i elektrona. Barionski naboj mezona je jednak nuli. Najlakši od mezona su pioni, ili pi-mezoni p - , p + i p °. Njihove mase su oko 6-7 puta manje od mase protona.Čudni mezoni - kaoni K+, K- i K° su masivniji. Njihove mase su skoro dva puta manje od mase protona. Karakteristično vrijeme života ovih mezona je 10 -8 s.
Gotovo svi hadroni imaju antičestice. Dakle, barion sigma-minus S - ima anti-sigma-plus antičesticu S`+, koja se razlikuje od S+. Isto se može reći i za druge barione. Kod mezona je situacija nešto drugačija: negativni pion je antičestica pozitivnom pionu, a neutralni pion uopće nema antičesticu, jer je sam sebi antičestica. Istovremeno, neutralni kaon K° ima antičesticu K'°. Ove činjenice su objašnjene u kvarkovom modelu adrona.
Svijet adrona je ogroman - uključuje više od 350 čestica. Većina njih je vrlo nestabilna: raspadaju se na lakše hadrone u vremenu od 10-23 s. Ovo je karakteristično vrijeme jakih interakcija; u tako kratkom intervalu, čak i svjetlost ima vremena da pređe udaljenost jednaku polumjeru protona (10 - 13 cm). Jasno je da takve kratkotrajne čestice ne mogu ostaviti tragove u detektorima. Obično se njihovo rođenje otkriva po indirektnim znakovima. Na primjer, proučavaju reakciju anihilacije elektrona i pozitrona s naknadnim rođenjem hadrona. Promjenom energije sudara elektrona i pozitrona, utvrđeno je da pri određenoj vrijednosti energije prinos hadrona naglo raste. Ova se činjenica može objasniti činjenicom da je čestica rođena u srednjem stanju, čija je masa jednaka odgovarajućoj energiji (do faktora c 2). Ova čestica trenutno se raspada na druge hadrone, a jedini trag njene pojave je vrh na grafu vjerovatnoće nastanka adrona u odnosu na energiju sudara.
Takve kratkovječne čestice nazivaju se rezonancije. Većina bariona i mezona su rezonancije. Ne ostavljaju "autograme" u kamerama i fotografijama, a fizičari ipak uspijevaju proučiti njihova svojstva: odrediti masu, vijek trajanja, spin, paritet, metode raspada itd.
Prema modernim konceptima, hadroni nisu zaista elementarne čestice. Imaju konačne dimenzije i složenu strukturu. Barioni se sastoje od tri kvarka. Prema tome, antibarion se sastoji od tri antikvarka i uvijek se razlikuje od bariona. Mezoni su građeni od kvarka i antikvarka. Jasno je da mezoni, koji uključuju parove kvarkova i antikvarkova iste vrste, neće imati antičestice. Kvarkovi se drže unutar adrona pomoću polja gluona. U principu, teorija dopušta postojanje drugih hadrona izgrađenih od većeg broja kvarkova ili, obrnuto, iz jednog polja gluona. Nedavno su se pojavili neki eksperimentalni podaci o mogućem postojanju takvih hipotetskih čestica. Dinamička teorija kvarkova, koja opisuje njihove interakcije, počela se razvijati relativno nedavno. Prvobitno je predložen model kvarka da "dovede stvari u red" u previše brojnoj porodici hadrona. Ovaj model je uključivao tri vrste kvarkova ili, kako kažu, aroma. Uz pomoć kvarkova bilo je moguće uvesti red u brojnu porodicu hadrona, raspoređujući ih u grupe čestica koje se nazivaju multipleti. Čestice istog multipleta imaju bliske mase, ali ne samo to je poslužilo kao osnova za njihovu klasifikaciju; pored eksperimentalnih podataka, u ovom slučaju je korišten i poseban matematički aparat teorije grupa.
Kasnije se ispostavilo da tri arome kvarka nisu dovoljna da se opišu svi hadroni. Godine 1974. otkriveni su takozvani psi-mezoni, koji se sastoje od kvarka i nove vrste antikvarka (cc¢). Ovaj miris je nazvan šarmom. Ispostavilo se da je novi šarmantni kvark c mnogo teži od svoje "braće": najlakša od psi-čestica, J/y mezon, ima masu od 3097 MeV, odnosno 3 puta teža od protona. Njegov životni vijek je oko 10-20 s. Otkrivena je čitava porodica psi-mezona sa istim sastavom kvarka cc¢, ali u pobuđenim stanjima i, kao rezultat, sa velikim masama.
Leptoni- grupa čestica koje ne učestvuju u 1 jakoj interakciji (ime dolazi od grčke riječi "leptos" - "svjetlost").
Svi leptoni imaju spin 1/2. Razlikovati nabijene leptone - elektron e -, mion m - , teški lepton t - i odgovarajuće antičestice e + , m + i t + i neutralne - razne vrste neutrina.
Prvi naelektrisani lepton otkrio je elektron - 1897. godine engleski naučnik J. J. Thomson. Njegovu antičesticu, pozitron, pronašao je 1932. u kosmičkim zracima američki fizičar K. Anderson. Godine 1936. otkriveni su i mioni u emisiji kosmičkih zraka (K. Anderson i S. Neddermeyer). U početku je došlo do male zabune: pokušali su da identifikuju mione sa česticom, koja je, prema teoriji japanskog fizičara X. Yukawe, nosila snažne interakcije. Ubrzo je, međutim, postalo jasno da mion nema nikakve veze sa jakim interakcijama (čestice koje je predvideo Yukawa ispostavilo se da su n-mezoni otkriveni 1947.) A onda je nastala misterija miona. Činjenica je da je mion iznenađujuće sličan elektronu: imaju isti električni naboj, spin, oba
učestvuju samo u slabim i elektromagnetnim interakcijama, i to na sličan način. Njihova jedina vidljiva razlika leži u njihovoj masi: mion je 206,8 puta teži od elektrona (trenutna vrijednost njegove mase je m = 105,65943 MeV/c 2 @ 1,88-10 –25 g).
Zbog veće mase, mion je izgubio stabilnost, životni vijek mu je @2,2 10 -6 s.
Elektron je stabilan jer jednostavno nema na šta da se raspadne. Doista, zbog očuvanja električnog naboja, raspad elektrona bio bi moguć samo emisijom lakše nabijenih čestica, ali postojanje takvih čestica je još uvijek nepoznato. Ako zakon održanja naboja nije potpuno tačan zakon prirode, tada bi se elektron mogao raspasti, na primjer, na neutrino i foton. Potraga za takvim raspadima, međutim, nije bila uspješna i pokazala je da je životni vijek elektrona najmanje više od 1022 godine (za poređenje: naš Univerzum postoji "samo" oko 2 10 -10 godina). Stoga se u modernim teorijama elektron smatra stabilnom česticom. Imajte na umu, međutim, da eksperimentalne granice za životni vijek protona izgledaju još impresivnije (najmanje 1032 godine), ali teorije u kojima se on može raspasti nedavno su postale vrlo popularne.
S raspadom miona situacija je jednostavnija, on se može raspasti i zapravo se raspada na elektron i par neutrina različitih tipova: m - ® e - + n e `+ n m . Slabe interakcije su odgovorne za ovo raspadanje. Eksperimentalna vrijednost životnog vijeka miona dobro se slaže s teorijskim proračunima. Naravno, raspad pozitivno nabijenog miona događa se na sličan način:
m + ®e + + n e +n m `.
Prije nego što su uspjeli odgonetnuti zagonetku miona, fizičari su otkrili treći nabijeni lepton t (tau - lepton). Otkrila ga je 1975. godine u eksperimentima na sudaranju snopa elektrona i pozitrona na Stanfordu (SAD) grupa fizičara predvođena M. Pearlom tokom anihilacije elektrona i pozitrona vrlo visokih energija. Teški tau lepton ima masu skoro 3500 puta veću od mase elektrona ( m e ~1784 MeV/s 2). Čak je skoro 2 puta teži od protona. Životni vijek t-leptona izmjeren je sa dovoljnom tačnošću tek 1981. godine - 3,4 10 - 13 s. Takav životni vijek pokazuje da su slabe interakcije t-leptona vrlo slične slabim interakcijama elektrona i miona (treba imati na umu da što je čestica teža, to se brže, pod drugim identičnim uvjetima, raspada na lakše. Dostupni podaci sugeriraju da je i inače t-lepton poput elektrona i miona.
Nabijene leptone objedinjuje još jedno svojstvo: u modernim teorijama svi su predstavljeni kao točkasti objekti, koji, za razliku od hadrona, nemaju unutrašnju strukturu. Eksperimenti na najsnažnijim akceleratorima pri maksimalnim trenutno dostižnim energijama pokazuju da je to tačno, barem do udaljenosti od 10 - 16 cm.
Promatrajući reakcije koje uključuju leptone, naučnici su otkrili da razlika između broja leptona i antileptona uvijek ostaje konstantna. Za opis ove osobine uveden je poseban kvantni broj - leptonski naboj L, uslovno dodjeljujući vrijednost L= 1 na negativno nabijene leptone i njihove prateće neutrine, i vrijednost L.= -1 - na njihove antičestice. Tada se ovaj fenomen svodi na zakon održanja leptonskog naboja. Kasnije je ustanovljeno da elektronski i mionski neutrino nisu međusobno identični, te je bilo potrebno uvesti različita, nezavisno očuvana leptonska naboja. Očigledno, postoji i treći tip leptonskog naboja povezan sa teškim leptonom i njegovim neutrinima.
Do sada nije uočen nijedan slučaj kršenja zakona održanja leptonskog naboja. Recimo, ovaj zakon zabranjuje raspad miona bez neutrina. Omjer vjerovatnoća zabranjenog i običnog raspada miona procijenjen je u eksperimentima i pokazao se manjim od 10 -9 -10 -10 . Potraga za zabranjenim raspadima je od velikog interesa, jer nije isključena mogućnost detekcije neočuvanja leptonskog naboja. Treba naglasiti da leptonski naboj nije izvor nekakvog "leptonskog" polja, već je uveden isključivo radi objašnjenja eksperimentalno uočenih zakona reakcija koje uključuju leptone.
Teorije koje su se nedavno pojavile, bazirane na konceptu jedinstva prirodnih sila, predviđaju nestabilnost protona i, istovremeno, narušavanje očuvanja leptonskog naboja. Koji je razlog postojanja različitih tipova leptona sa sličnim svojstvima i vrlo različitim masama? Kakva je priroda leptonskih naboja? A ima li još nekih leptona koji su nam još uvijek nepoznati? Ova pitanja su trenutno bez odgovora. Njihovo rješenje je povezano ne samo s leptonima, već i sa drugim istinski elementarnim česticama-kvarkovima, koji su glavni strukturni elementi svijeta čestica koje su u jakoj interakciji. Kvarkovi se jako razlikuju po masi i imaju svoje specifične "naboje". Parovi kvarkova se kombinuju zajedno sa parovima leptona (nabijeni lepton i odgovarajući neutrino) u takozvane generacije elementarnih čestica. Mnoga svojstva čestica se ponavljaju iz generacije u generaciju, a mase generacija uvelike se razlikuju: druga generacija (uključuje mione) je teža od prve (sa elektronima), a treća generacija (uključujući t-leptone) je teža od drugi. Istraživanje mnogih misterija ovih generacija tek počinje.
Elektron je negativno nabijena elementarna čestica, nosilac najmanje poznate mase i najmanjeg električnog naboja u prirodi. Otvoren 1897. godine od strane engleskog naučnika J. J. Thomson.
Elektron je komponenta atoma, broj elektrona u neutralnom atomu jednak je atomskom broju, tj. broj protona u jezgru.
Prva tačna mjerenja naelektrisanja elektrona izvršena su 1909-1913. Američki fizičar R. Milliken. Moderna vrijednost apsolutne vrijednosti elementarnog naboja je
e =(4,803242±0,000014)*10 -10 ili približno 1,6*10 -19 C. vjeruje se da je ovaj naboj zaista "elementaran", tj. da se ne može podijeliti na dijelove, a naboji bilo kojeg objekta su njegovi cjelobrojni višekratnici. Zajedno sa Planckovom konstantom H i brzinom svjetlosti c, elementarni naboj formira bezdimenzijsku konstantu a = e 2 / hc ~ 1/ 137. Konstanta fine strukture a jedan je od najvažnijih parametara kvantne elektrodinamike, ona određuje intenzitet elektromagnetnih interakcija. Masa elektrona m e \u003d (9,109534 ± 0,000047) * 10 -28 g (u energetskim jedinicama ~ 0,5 MeV / s 2). Ako vrijede zakoni održanja energije i električnog naboja, tada je zabranjeno svako raspadanje elektrona. Prema tome, elektron je stabilan; eksperimentalno je dobiveno da vrijeme njegovog života nije manje od 1022 godine.
Godine 1925. američki fizičari S. Goudsmit i J. Uhlenbeck uveli su unutrašnji ugaoni moment elektrona - spin (s) da bi objasnili karakteristike atomskih spektra. Spin elektrona je polovina Plankove konstante (H - 1,055*10 -34 J/s), ali fizičari obično jednostavno kažu da je spin elektrona 1/2:5 = 1/2. Spin elektrona povezan je s njegovim vlastitim magnetskim momentom. Magnetski moment elektrona morao je biti jednak tačno jednom Borovom magnetonu.
Međutim, 1947. godine u eksperimentima je ustanovljeno da je magnetni moment otprilike 0,1% veći od Bohrovog magnetona. Objašnjenje ove činjenice dato je uzimajući u obzir polarizaciju vakuuma u kvantnoj elektrodinamici. Veoma mukotrpni proračuni dali su teorijsku vrijednost g e = 2*(1,001159652460 ± 0,0000000000148), koja se može uporediti sa eksperimentalnim podacima: za elektron g e = 2-(1,001159652200 ± 0,0000000000148) i a50000000000148: za elektron g e = 2-(1,001159652200 ± 0,00000 g ± 0,000000 ± 0,00000 g ± 0,00000 0,000000000050). Vrijednosti se izračunavaju i mjere sa tačnošću do dvanaest decimala, a tačnost eksperimentalnog rada je veća
"tačnosti teorijskih proračuna. Ovo su najtačnija mjerenja u fizici čestica.
Osobine kretanja elektrona u atomima, koje se povinuju jednadžbi kvantne mehanike, određuju optička, električna, magnetska, hemijska i mehanička svojstva supstanci.
Elektroni učestvuju u elektromagnetnim, slabim i gravitacionim interakcijama.
Slabe interakcije elektrona manifestiraju se, na primjer, u nekonzervacijskim procesima u atomskim spektrima ili u reakcijama između elektrona i neutrina.
Nema podataka o unutrašnjoj strukturi elektrona. Moderne teorije polaze od koncepta leptona kao tačkastih čestica. Trenutno je ovo eksperimentalno potvrđeno do udaljenosti od 10 -16 cm Novi podaci se mogu pojaviti samo sa povećanjem energije sudara čestica u budućim akceleratorima.
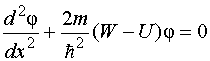 Drugim riječima, vjerovatnoća pronalaska elektrona izvan "kutije" je nula. Problem kretanja elektrona u pravokutnoj potencijalnoj "kutiji" s beskonačno visokim zidovima svodi se na rješavanje jednadžbe
Drugim riječima, vjerovatnoća pronalaska elektrona izvan "kutije" je nula. Problem kretanja elektrona u pravokutnoj potencijalnoj "kutiji" s beskonačno visokim zidovima svodi se na rješavanje jednadžbe 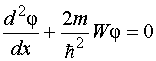 Druga značenja W energije elektrona su nemoguće: vjerovatnoća pronalaženja elektrona unutar "kutije" s energijom različitom od W n, jednako nuli. Fizičke veličine koje uzimaju samo određene diskretne vrijednosti nazivaju se kvantizirano. Kvantizirane vrijednosti W n pozvao nivoi energije, i brojevi n, koji određuju nivoe energije elektrona, - kvantni brojevi. Dakle, elektron u potencijalnoj „kutiji“ može biti na određenom energetskom nivou W n. U ovom slučaju je u određenom kvantnom stanju n. Nivoi energije u ovom slučaju su toliko raspoređeni da se mogu uzeti u obzir kvazi-kontinuirano. Za takvu potencijalnu „kutiju“, kvantizacija energije daje rezultate koji se ne razlikuju toliko značajno od rezultata klasične fizike kao u slučaju „kutije“ veličine atoma. Proračuni pokazuju da s povećanjem kvantnog broja n vrijednost postaje mala u odnosu na W n, tj. postoji relativna konvergencija nivoa energije. Za velike kvantne brojeve n kvantizacija energije daje rezultate bliske onima iz klasičnog tretmana. Ovo izražava važno princip usaglašenosti, najpotpunije formulisano Borom 1923: za velike kvantne brojeve, zaključci i rezultati kvantne mehanike moraju odgovarati klasičnim rezultatima. 82) Rutherfordov nuklearni model. Borovi postulati Iz radioaktivnog izvora zatvorenog u olovni kontejner, α-čestice su bile usmjerene na tanku metalnu foliju. Raštrkane čestice udaraju u ekran prekriven slojem kristala cink sulfida koji su sposobni da svijetle pod udarom brzo naelektrisanih čestica. Scintilacije (bljeskovi) na ekranu su uočene okom uz pomoć mikroskopa. Posmatranja raspršenih α-čestica u Rutherfordovom eksperimentu mogu se izvesti pod različitim uglovima φ u odnosu na početni smjer zraka. Utvrđeno je da većina alfa čestica prolazi kroz tanak sloj metala sa malo ili bez otklona. Međutim, mali dio čestica se skreće pod značajnim uglovima većim od 30°. Vrlo rijetke alfa čestice (otprilike jedna od deset hiljada) bile su odbijene pod uglovima blizu 180°. Tako su eksperimenti Rutherforda i njegovih saradnika doveli do zaključka da se u centru atoma nalazi gusto pozitivno nabijeno jezgro, čiji prečnik ne prelazi 10–14–10–15 m. Ovo jezgro zauzima samo 10– 12 ukupne zapremine atoma, ali sadrži cijeli pozitivni naboj i ne manje od 99,95% njegove mase. Supstanci koja čini jezgro atoma trebalo je pripisati kolosalnu gustinu reda c ≈ 10 15 g/cm 3 . Naboj jezgra mora biti jednak ukupnom naboju svih elektrona koji čine atom. Nakon toga je utvrđeno da ako se naboj elektrona uzme kao jedinica, onda je naboj jezgra tačno jednak broju ovog elementa u periodnom sistemu. Rutherford je predložio planetarni model atoma. Prema ovom modelu, u središtu atoma nalazi se pozitivno nabijeno jezgro, u kojem je koncentrisana gotovo cijela masa atoma. Atom kao celina je neutralan. Elektroni rotiraju oko jezgra, poput planeta, pod uticajem Kulonovih sila iz jezgra (slika 6.1.4). Elektroni ne mogu mirovati, jer bi pali na jezgro. Borovi postulati Borovi postulati su osnovne pretpostavke koje je formulirao Niels Bohr 1913. godine kako bi objasnio pravilnosti linijskog spektra atoma vodika i vodikovih iona (Balmer-Rydbergova formula) i kvantne prirode emisije i apsorpcije svjetlosti. Bohr je pošao od Rutherfordovog planetarnog modela atoma. Postulati: 10 Atom može biti samo u posebnim stacionarnim ili kvantnim stanjima, od kojih svako odgovara određenoj energiji. U stacionarnom stanju, atom ne zrači elektromagnetne talase. 2) Elektron u atomu, bez gubitka energije, kreće se duž određenih diskretnih kružnih orbita, za koje je ugaoni moment kvantovan: , gdje su prirodni brojevi, a Plankova konstanta. Boravak elektrona u orbiti određuje energiju ovih stacionarnih stanja. 3) Kada se elektron kreće iz orbite (energetski nivo) u orbitu, kvant energije se emituje ili apsorbuje, gde su energetski nivoi između kojih se vrši prelaz. Prilikom prelaska sa gornjeg nivoa na donji, energija se emituje, a kada se kreće sa donjeg na gornji, apsorbuje se. Koristeći ove postulate i zakone klasične mehanike, Bohr je predložio model atoma, koji se sada naziva Borov model atoma. Kasnije je Sommerfeld proširio Borovu teoriju na slučaj eliptičnih orbita. Zove se Bohr-Sommerfeld model. 83) Kvantni brojevi. Paulijev princip. Maksimalni broj elektrona
kvantni brojevi
- energetski parametri koji određuju stanje elektrona i vrstu atomske orbitale u kojoj se nalazi. Paulijev princip
(princip isključenja) - jedan od osnovnih principa kvantne mehanike, prema kojem dva ili više identičnih fermiona (čestica sa polucijelim spinom) ne mogu istovremeno biti u istom kvantnom stanju. Paulijev princip pomaže u objašnjavanju raznih fizičkih pojava. Posljedica principa je prisustvo elektronskih ljuski u strukturi atoma, što zauzvrat podrazumijeva različite kemijske elemente i njihove spojeve. Broj elektrona u jednom atomu jednak je broju protona. Pošto su elektroni fermioni, Paulijev princip im zabranjuje da zauzmu ista kvantna stanja. Kao rezultat toga, svi elektroni ne mogu biti u istom kvantnom stanju s najnižom energijom (za nepobuđeni atom), već sekvencijalno popunjavaju kvantna stanja najnižom ukupnom energijom (istovremeno, ne zaboravite da se elektroni ne mogu razlikovati, i nemoguće je reći u kojem se kvantnom stanju nalazi dati elektron). Primjer je neuzbuđeni atom litija (Li), u kojem su dva elektrona u 1S orbitali (najniže energije), dok se njihov vlastiti impuls razlikuje i treći elektron ne može zauzeti 1S orbitu, jer će Paulijeva zabrana biti prekršena. Stoga, treći elektron zauzima 2S orbitalu (sljedeću orbitalu najniže energije nakon 1S). Maksimalni broj elektrona
Druga značenja W energije elektrona su nemoguće: vjerovatnoća pronalaženja elektrona unutar "kutije" s energijom različitom od W n, jednako nuli. Fizičke veličine koje uzimaju samo određene diskretne vrijednosti nazivaju se kvantizirano. Kvantizirane vrijednosti W n pozvao nivoi energije, i brojevi n, koji određuju nivoe energije elektrona, - kvantni brojevi. Dakle, elektron u potencijalnoj „kutiji“ može biti na određenom energetskom nivou W n. U ovom slučaju je u određenom kvantnom stanju n. Nivoi energije u ovom slučaju su toliko raspoređeni da se mogu uzeti u obzir kvazi-kontinuirano. Za takvu potencijalnu „kutiju“, kvantizacija energije daje rezultate koji se ne razlikuju toliko značajno od rezultata klasične fizike kao u slučaju „kutije“ veličine atoma. Proračuni pokazuju da s povećanjem kvantnog broja n vrijednost postaje mala u odnosu na W n, tj. postoji relativna konvergencija nivoa energije. Za velike kvantne brojeve n kvantizacija energije daje rezultate bliske onima iz klasičnog tretmana. Ovo izražava važno princip usaglašenosti, najpotpunije formulisano Borom 1923: za velike kvantne brojeve, zaključci i rezultati kvantne mehanike moraju odgovarati klasičnim rezultatima. 82) Rutherfordov nuklearni model. Borovi postulati Iz radioaktivnog izvora zatvorenog u olovni kontejner, α-čestice su bile usmjerene na tanku metalnu foliju. Raštrkane čestice udaraju u ekran prekriven slojem kristala cink sulfida koji su sposobni da svijetle pod udarom brzo naelektrisanih čestica. Scintilacije (bljeskovi) na ekranu su uočene okom uz pomoć mikroskopa. Posmatranja raspršenih α-čestica u Rutherfordovom eksperimentu mogu se izvesti pod različitim uglovima φ u odnosu na početni smjer zraka. Utvrđeno je da većina alfa čestica prolazi kroz tanak sloj metala sa malo ili bez otklona. Međutim, mali dio čestica se skreće pod značajnim uglovima većim od 30°. Vrlo rijetke alfa čestice (otprilike jedna od deset hiljada) bile su odbijene pod uglovima blizu 180°. Tako su eksperimenti Rutherforda i njegovih saradnika doveli do zaključka da se u centru atoma nalazi gusto pozitivno nabijeno jezgro, čiji prečnik ne prelazi 10–14–10–15 m. Ovo jezgro zauzima samo 10– 12 ukupne zapremine atoma, ali sadrži cijeli pozitivni naboj i ne manje od 99,95% njegove mase. Supstanci koja čini jezgro atoma trebalo je pripisati kolosalnu gustinu reda c ≈ 10 15 g/cm 3 . Naboj jezgra mora biti jednak ukupnom naboju svih elektrona koji čine atom. Nakon toga je utvrđeno da ako se naboj elektrona uzme kao jedinica, onda je naboj jezgra tačno jednak broju ovog elementa u periodnom sistemu. Rutherford je predložio planetarni model atoma. Prema ovom modelu, u središtu atoma nalazi se pozitivno nabijeno jezgro, u kojem je koncentrisana gotovo cijela masa atoma. Atom kao celina je neutralan. Elektroni rotiraju oko jezgra, poput planeta, pod uticajem Kulonovih sila iz jezgra (slika 6.1.4). Elektroni ne mogu mirovati, jer bi pali na jezgro. Borovi postulati Borovi postulati su osnovne pretpostavke koje je formulirao Niels Bohr 1913. godine kako bi objasnio pravilnosti linijskog spektra atoma vodika i vodikovih iona (Balmer-Rydbergova formula) i kvantne prirode emisije i apsorpcije svjetlosti. Bohr je pošao od Rutherfordovog planetarnog modela atoma. Postulati: 10 Atom može biti samo u posebnim stacionarnim ili kvantnim stanjima, od kojih svako odgovara određenoj energiji. U stacionarnom stanju, atom ne zrači elektromagnetne talase. 2) Elektron u atomu, bez gubitka energije, kreće se duž određenih diskretnih kružnih orbita, za koje je ugaoni moment kvantovan: , gdje su prirodni brojevi, a Plankova konstanta. Boravak elektrona u orbiti određuje energiju ovih stacionarnih stanja. 3) Kada se elektron kreće iz orbite (energetski nivo) u orbitu, kvant energije se emituje ili apsorbuje, gde su energetski nivoi između kojih se vrši prelaz. Prilikom prelaska sa gornjeg nivoa na donji, energija se emituje, a kada se kreće sa donjeg na gornji, apsorbuje se. Koristeći ove postulate i zakone klasične mehanike, Bohr je predložio model atoma, koji se sada naziva Borov model atoma. Kasnije je Sommerfeld proširio Borovu teoriju na slučaj eliptičnih orbita. Zove se Bohr-Sommerfeld model. 83) Kvantni brojevi. Paulijev princip. Maksimalni broj elektrona
kvantni brojevi
- energetski parametri koji određuju stanje elektrona i vrstu atomske orbitale u kojoj se nalazi. Paulijev princip
(princip isključenja) - jedan od osnovnih principa kvantne mehanike, prema kojem dva ili više identičnih fermiona (čestica sa polucijelim spinom) ne mogu istovremeno biti u istom kvantnom stanju. Paulijev princip pomaže u objašnjavanju raznih fizičkih pojava. Posljedica principa je prisustvo elektronskih ljuski u strukturi atoma, što zauzvrat podrazumijeva različite kemijske elemente i njihove spojeve. Broj elektrona u jednom atomu jednak je broju protona. Pošto su elektroni fermioni, Paulijev princip im zabranjuje da zauzmu ista kvantna stanja. Kao rezultat toga, svi elektroni ne mogu biti u istom kvantnom stanju s najnižom energijom (za nepobuđeni atom), već sekvencijalno popunjavaju kvantna stanja najnižom ukupnom energijom (istovremeno, ne zaboravite da se elektroni ne mogu razlikovati, i nemoguće je reći u kojem se kvantnom stanju nalazi dati elektron). Primjer je neuzbuđeni atom litija (Li), u kojem su dva elektrona u 1S orbitali (najniže energije), dok se njihov vlastiti impuls razlikuje i treći elektron ne može zauzeti 1S orbitu, jer će Paulijeva zabrana biti prekršena. Stoga, treći elektron zauzima 2S orbitalu (sljedeću orbitalu najniže energije nakon 1S). Maksimalni broj elektrona
Core charge jednaki Ze, gdje e je naelektrisanje protona, Z– broj punjenja jednak serijski broj hemijski element u Mendeljejevljevom periodičnom sistemu elemenata, tj. broj protona u jezgru. Broj neutrona u jezgru je označen N. Obično Z > N.
AT sastav atomskog jezgra uključuje elementarne čestice : protona i neutroni (nukleoni od latinske reči jezgro - jezgro). Takav proton-neutronski model jezgra predložio je sovjetski fizičar 1932. D.D. Ivanenko. Proton ima pozitivan naboj e + = 1,06 10 -19 C i masu mirovanja m str\u003d 1,673 10 -27 kg \u003d 1836 ja. neutron ( n) je neutralna čestica sa masom mirovanja m n= 1.675 10 -27 kg = 1839 ja(gdje je masa elektrona ja, je jednako 0,91 10 -31 kg). Na sl. 9.1 prikazuje strukturu atoma helijuma prema idejama s kraja XX - početka XXI vijeka.
Broj nukleona u jezgru A = Z + N pozvao maseni broj . jezgra sa istim Z, ali drugačije ALI pozvao izotopi. Jezgra, koja istovremeno A imaju drugačije Z, su pozvani izobare.
86 ) Energija vezivanja jezgra. defekt mase. Potencijal jonizacije.
Energija vezivanja jezgra
Energija vezivanja jezgra jednaka je minimalnoj energiji koja se mora utrošiti za potpuno cijepanje jezgra na pojedinačne čestice. Iz zakona održanja energije proizilazi da je energija veze jednaka energiji koja se oslobađa prilikom formiranja jezgra iz pojedinih čestica.
Energija vezivanja bilo kojeg jezgra može se odrediti preciznim mjerenjem njegove mase. U ovom trenutku, fizičari su naučili da mjere mase čestica - elektrona, protona, neutrona, jezgara itd. - sa vrlo visokom preciznošću. Ova mjerenja to pokazuju masa bilo kog jezgra M i je uvijek manji od zbira masa njegovih sastavnih protona i neutrona:
| M I< Zm p+ Nm n. |
Masovna razlika
| Ova energija se oslobađa tokom formiranja jezgra u obliku zračenja γ-kvanta |
| Jonizacijski potencijal atoma- minimalna potencijalna razlika U, do koje elektron mora proći u ubrzanom električnom polju da bi dobio kinetičku energiju dovoljnu da ionizira atom. |
Potencijal jonizacije U je usko povezan sa energijom jonizacije relacijom:
E=Ue,gdje e-elementarni električni naboj.
Energija jonizacije atoma je unutrašnje svojstvo čestice i ne zavisi od metode jonizacije, dok se za potencijal ionizacije može reći da je karakteristika istorijski prve metode jonizacije.
87 ) Radioaktivno zračenje. Vrste nuklearnih raspada. Zakon radioaktivnog raspada. Njegove karakteristike.
Trenutno ispod radioaktivnost razumjeti sposobnost nekih atomskih jezgara da se spontano (spontano) transformišu u druga jezgra emisijom različitih vrsta radioaktivnog zračenja i elementarnih čestica. Radioaktivnost se deli na prirodno(uočeno u nestabilnim izotopima koji postoje u prirodi) i vještački(opaženo u izotopima dobijenim nuklearnim reakcijama). Ne postoji suštinska razlika između ove dvije vrste radioaktivnosti, jer su zakoni radioaktivne transformacije isti u oba slučaja.
Postoje tri vrste radioaktivnog zračenja: -, - i -zračenje.
Predmeti proučavanja i zadaci poljoprivredne radiobiologije. Istorija razvoja radiobiologije.
Osnovni zadatak koji je predmet radiobiologije, je otkrivanje opštih obrazaca biološkog odgovora na efekte jonizujućeg zračenja, koji su naučna osnova za higijensko regulisanje faktora zračenja i ovladavanje veštinom kontrole radijacionih reakcija organizma.
Razvoj radiobiologije podijeljen je u tri faze:
Faza 1 Razvoj radiobiologije karakterišu radovi deskriptivne prirode, kada naučnici pokušavaju da objasne ranije opisane efekte.
Prvi naučnici koji su skrenuli pažnju na dejstvo radijuma na kožu bili su Nemci G. Walchow i Gisel.
Glavna otkrića su:
1. Otkriće da je dioba ćelija inhibirana pod djelovanjem jonizujućeg zračenja.
2. Bergagnier-Tribondo zakon (1903-1906): ćelija je što je radiosenzitivnija, što više ima sposobnost reprodukcije (dijele) i što je manje jasno izražena njihova morfologija i funkcije, tj. nego su manje diferencirani.
Faza 2 Razvoj radiobiologije povezan je s razvojem teorije "doza-efekat". S jedne strane, utvrđeno je da se povećanjem doze zračenja povećava štetni učinak.
Značajno otkriće 1922. godine bila je teorija jonizacijskih događaja u osjetljivom volumenu.
Faza 3 počela je 1940-ih i 1950-ih godina. Metode kvantitativne atomske radiobiologije su veoma razvijene.
Konkretno, utvrđeno je da od samog početka radioaktivne emisije nisu iste, a 1903. godine pojavio se crtež u disertaciji Marije Skladowske-Curie.
1998. Becquerel je dokazao da su β-zraci tok brzih elektrona nabijenih negativno.
1988-1899, Paul Villard je ustanovio da je elektromagnetno zračenje koje ne reaguje na naelektrisanje i slično je rendgenskim zracima γ-zračenje; oni su električno neutralni (nemaju naboj), nemaju masu mirovanja i sastoje se od pojedinačnih dijelova energije.
Godine 1899. Ernest Rutherford je dokazao da su α-zraci tok jezgri helijuma, pozitivno nabijenih zbog protona, koji imaju pozitivan naboj zbog skupa kvarkova.
Prvi reaktor za proizvodnju plutonijuma za oružje izgrađen je 1940-1945.
Poreklo prirodnih radioaktivnih atoma.
Jedenje. radioaktivni atomi postoje otkako se Zemlja pojavila.
Godine 1896. Becquerel je otkrio da neke soli urana emituju prodorno zračenje slično onome koje je otkrio Roentgen godinu dana ranije. Ogroman značaj ovog otkrića nije odmah shvaćen. Nekoliko godina kasnije, Pjer i Marija Kiri dali su dalji podsticaj proučavanju ove nove oblasti fizike. Iz mješavine uranijumske smole uspjeli su izolirati dvije supstance, čija je radioaktivnost mnogo intenzivnija od radioaktivnosti uranijuma. Rutherford i Soddy, istražujući fenomen koji je otkrio Becquerel, ubrzo su otkrili da se fenomen radioaktivnosti može objasniti pretpostavkom da atomi uranijuma i radijuma nisu stabilni, već se raspadaju karakterističnom brzinom za svaki od njih. U tom slučaju nastaju atomi drugih elemenata. Radioaktivne transformacije se odvijaju spontano. Na brzinu njihovog protoka ne utiču promene temperature i pritiska, prisustvo električnih i magnetnih polja, vrsta hemijskog jedinjenja datog radioaktivnog elementa i njegovo agregacijsko stanje. Radioaktivni raspad je svojstvo samog atomskog jezgra i zavisi samo od njegovog unutrašnjeg stanja. Nemoguće je utjecati na tok procesa radioaktivnog raspada bez promjene stanja atomskog jezgra. Radioaktivnost je sposobnost nekih atomskih jezgara da se spontano (spontano) raspadnu emisijom α-, β-, γ-zraka, a ponekad i drugih čestica.
Radioaktivno zračenje proizvodi efekat jonizacije. Radioaktivni element neprestano oslobađa energiju, pa je njegova temperatura uvijek nešto viša od temperature okoline. Već prve studije su pokazale da radioaktivnost elementa ne zavisi od toga da li je u svom čistom obliku ili u sastavu bilo kakvog hemijskog jedinjenja.
Struktura atoma i karakteristike elementarnih čestica.
Najmanja čestica hemijskog elementa, koja je nosilac njegovih hemijskih svojstava - naziva se atom.
Atom se sastoji od atomskog jezgra i elektronske ljuske.
Jezgro atoma sastoji se od protona (p+) i neutrona (n0).
Broj protona N(p+) jednak je naboju jezgra (Z) i serijskom broju elementa u prirodnom nizu elemenata (i u periodičnom sistemu elemenata).
Zbir broja neutrona N(n0), koji se jednostavno označava slovom N, i broja protona Z naziva se maseni broj i označava se slovom A.
Elektronski omotač atoma sastoji se od elektrona (e-) koji se kreću oko jezgra.
Broj elektrona N(e-) u elektronskoj ljusci neutralnog atoma jednak je broju protona Z u njegovom jezgru.
Atom bilo kojeg elementa može se podijeliti na subatomske (elementarne) čestice, ali u ovom slučaju one neće imati svojstva atoma.
U slobodnom stanju, elementarne čestice karakteriziraju masa, električni naboj i vlastita rotacija (spin).
Elementarne čestice su podijeljene u klase:
1. Fotoni (quanta) su kvanti elektromagnetnog polja. Nemaju električni naboj i masu mirovanja.
2. Leptoni("pluća"). To uključuje: elektrona (e -); pozitrona (e+) - to su antičestice elektrona, postoje u jezgru, kada uđu u jezgro i sretnu se u elektronu dolazi do anihilacije, tj. međusobno uništavanje; mioni (µ–, µ+) – manje čestice, mogu imati pozitivan i negativan naboj; tau leptons (t - , t +); neutrina i antineutrina - posljednje dvije čestice nemaju električni naboj, razlikuju se po spinu (kretanju).
3. Mezoni("srednja") - nestabilne čestice. π mezona može imati pozitivan, negativan i neutralan naboj i postojati u pokretu iu obliku materijalnih čestica (masa materijalnih čestica je oko 270 puta veća od mase elektrona). K-mezoni imaju pozitivan i negativan naboj, njihova masa je 970 puta veća od mase elektrona. Životni vijek je vrlo kratak (10–8 sekundi), nisu stabilni i raspadaju se formiranjem π mezona i leptona ili samo leptona. Eta mezon (η) - 1074 puta teži od elektrona, životni vek 10 -19 sekundi, raspada se na π mezon i fotone.
4. barion klasa okuplja protona , neutroni , antiprotona , antineutroni , i nestabilne, čija je masa veća od mase nukleona - nazivaju se hiperoni . Sa izuzetkom protona i antiprotona, svi barioni su nestabilni. Kada se barion raspadne, barion (obično proton) nužno nastaje.
Pored ovih, pronađen je veliki broj kratkoživih čestica - rezonancije.
Fanatični matematičari, koji vole da broje sve na svetu, dugo su želeli da znaju odgovor na fundamentalno pitanje: koliko čestica ima u svemiru? Uzimajući u obzir da otprilike 5 triliona atoma vodika može stati samo na glavu igle, a svaka od njih se sastoji od 4 elementarne čestice (1 elektron i 3 kvarka u protonu), može se sa sigurnošću pretpostaviti da je broj čestica u vidljivom univerzum je izvan ljudske reprezentacije.
U svakom slučaju, profesor fizike Tony Padilla sa Univerziteta u Nottinghamu razvio je način za procjenu ukupnog broja čestica u svemiru bez uzimanja u obzir fotona ili neutrina, budući da one nemaju (ili bolje rečeno, gotovo da nemaju) masu:
Za svoje proračune, naučnik je koristio podatke dobijene teleskopom Planck, koji je korišten za mjerenje CMB, koji je najstarija vidljiva svjetlost u svemiru i tako čini privid njegove granice. Zahvaljujući teleskopu, naučnici su uspeli da procene gustinu i radijus vidljivog univerzuma.
Druga neophodna varijabla je udio materije sadržan u barionima. Ove čestice se sastoje od tri kvarka, a danas najpoznatiji barioni su protoni i neutroni, pa ih stoga Padilla razmatra u svom primjeru. Konačno, za proračun je potrebno znati mase protona i neutrona (koje se približno međusobno podudaraju), nakon čega možete nastaviti s proračunima.
Šta radi fizičar? On uzima gustinu vidljivog univerzuma, množi je samo sa delićem gustine bariona, a zatim množi rezultat sa zapreminom univerzuma. On podijeli rezultujuću masu svih bariona u svemiru masom jednog bariona i dobije ukupan broj bariona. Ali nas barioni ne zanimaju, naš cilj su elementarne čestice.
Poznato je da se svaki barion sastoji od tri kvarka - oni su upravo ono što nam treba. Štaviše, ukupan broj protona (kao što svi znamo iz školskog kursa hemije) jednak je ukupnom broju elektrona, koji su takođe elementarne čestice. Osim toga, astronomi su otkrili da je 75% materije u svemiru vodonik, a preostalih 25% helijum, dok se ostali elementi mogu zanemariti u proračunima ove veličine. Padilla izračunava broj neutrona, protona i elektrona, a zatim množi prve dvije pozicije sa tri - i konačno imamo konačni rezultat.
3,28x10 80. Više od tri vigintiliona.
328.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.
Najzanimljivije je da, s obzirom na razmjere svemira, ove čestice ne ispunjavaju ni veliki dio njegovog ukupnog volumena. Kao rezultat, postoji samo jedna (!) elementarna čestica po kubnom metru Univerzuma.






