Organik kimya örneklerinde kimyasal reaksiyon türleri. Konuyla ilgili kimyada organik kimya ders planında (10. sınıf) kimyasal reaksiyon türleri. Organik reaksiyonların mekanizmalara göre sınıflandırılması. Örnekler
Birçok ikame reaksiyonu, ekonomik uygulamalara sahip çeşitli bileşiklerin üretiminin yolunu açar. Elektrofilik ve nükleofilik ikame kimya bilimi ve endüstrisinde büyük bir rol oynar. Organik sentezde bu süreçlerin dikkat edilmesi gereken bir takım özellikleri vardır.
Çeşitli kimyasal olaylar. İkame reaksiyonları
Maddelerin dönüşümüyle ilişkili kimyasal değişiklikler bir takım özelliklerle ayırt edilir. Nihai sonuçlar ve termal etkiler değişiklik gösterebilir; Bazı işlemler tamamlanır, bazılarında ise maddelerde bir değişiklik meydana gelir ve buna sıklıkla oksidasyon derecesinde bir artış veya azalma eşlik eder. Kimyasal olayları nihai sonuçlarına göre sınıflandırırken reaktifler ve ürünler arasındaki niteliksel ve niceliksel farklılıklara dikkat edilir. Bu özelliklere dayanarak, aşağıdaki şemayı takip eden ikame de dahil olmak üzere 7 tür kimyasal dönüşüm ayırt edilebilir: A-B + C A-C + B. Bütün bir kimyasal fenomen sınıfının basitleştirilmiş gösterimi, başlangıç maddeleri arasında bir maddenin olduğu fikrini verir. reaktifteki bir atomun, iyonun veya fonksiyonel grubun yerini alan bir parçacığa "saldırı" denir. İkame reaksiyonu sınırlamanın karakteristiğidir ve
İkame reaksiyonları çift değişim şeklinde meydana gelebilir: A-B + C-E A-C + B-E. Alt türlerden biri, örneğin bakırın bir bakır sülfat çözeltisinden demir ile yer değiştirmesidir: CuS04 + Fe = FeS04 + Cu. “Saldıran” parçacık atomlar, iyonlar veya fonksiyonel gruplar olabilir

Homolitik ikame (radikal, SR)
Kovalent bağların kırılması şeklindeki radikal mekanizmayla, farklı elementlerde ortak olan bir elektron çifti, molekülün "parçaları" arasında orantılı olarak dağıtılır. Serbest radikaller oluşur. Bunlar, stabilizasyonu sonraki dönüşümlerin bir sonucu olarak ortaya çıkan kararsız parçacıklardır. Örneğin metandan etan üretilirken ikame reaksiyonuna katılan serbest radikaller ortaya çıkar: CH4CH3. + .N; CH 3. + .CH3 → C2H5; N. + .N → N2. Yukarıdaki ikame mekanizmasına göre homolitik bağ bölünmesi zincir niteliğindedir. Metanda H atomları art arda klor ile değiştirilebilir. Brom ile reaksiyon benzer şekilde gerçekleşir, ancak iyot alkanlardaki hidrojenin yerini doğrudan alamaz; flor onlarla çok kuvvetli reaksiyona girer.

Heterolitik bağ kırma yöntemi
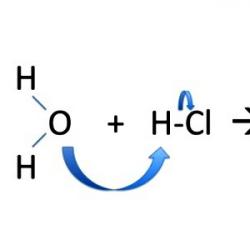
İyonik ikame reaksiyonları mekanizmasıyla, elektronlar yeni oluşan parçacıklar arasında eşit olmayan bir şekilde dağıtılır. Bağlanan elektron çifti tamamen "parçalardan" birine, çoğunlukla da polar moleküldeki negatif yoğunluğun kaydığı bağ ortağına gider. İkame reaksiyonları, metil alkol CH30H oluşumunu içerir. Bromometan CH3Br'de molekülün bölünmesi heterolitiktir ve yüklü parçacıklar stabildir. Metil pozitif bir yük kazanır ve brom negatif bir yük alır: CH3Br → CH3++ Br -; NaOH → Na++ OH-; CH3++ OH- → CH3OH; Na + + Br - ↔ NaBr.

Elektrofiller ve nükleofiller
Elektronları olmayan ve onları kabul edebilen parçacıklara "elektrofiller" denir. Bunlar haloalkanlardaki halojenlere bağlı karbon atomlarını içerir. Nükleofiller elektron yoğunluğunu arttırmışlardır; kovalent bir bağ oluştururken bir çift elektronu “bağışlarlar”. İkame reaksiyonlarında, negatif yük bakımından zengin nükleofiller, elektron açlığı çeken elektrofiller tarafından saldırıya uğrar. Bu fenomen, bir atomun veya başka bir parçacığın (bir ayrılan grubun) hareketi ile ilişkilidir. Başka bir ikame reaksiyonu türü, bir elektrofilin bir nükleofil tarafından saldırısıdır. Moleküllerden hangisinin substrat, hangisinin reaktif olduğunu doğru bir şekilde belirtmek zor olduğundan, iki proses arasında ayrım yapmak ve ikameyi bir türe veya diğerine atfetmek bazen zordur. Tipik olarak bu gibi durumlarda aşağıdaki faktörler dikkate alınır:
- ayrılan grubun doğası;
- nükleofil reaktivitesi;
- çözücünün doğası;
- alkil kısmının yapısı.
Nükleofilik ikame (SN)
Organik bir moleküldeki etkileşim süreci sırasında polarizasyonda bir artış gözlenir. Denklemlerde kısmi pozitif veya negatif yük, Yunan alfabesinin bir harfiyle gösterilir. Bağ polarizasyonu, kopmasının doğasını ve molekülün "parçalarının" diğer davranışını değerlendirmeyi mümkün kılar. Örneğin iyodometandaki karbon atomu kısmi pozitif yüke sahiptir ve elektrofilik bir merkezdir. Su dipolünün oksijenin fazla miktarda elektrona sahip olduğu kısmını çeker. Bir elektrofil, bir nükleofilik reaktifle etkileşime girdiğinde metanol oluşur: CH3I + H2O → CH3OH + HI. Nükleofilik ikame reaksiyonları, negatif yüklü bir iyonun veya molekülün, kimyasal bir bağın oluşturulmasında yer almayan serbest elektron çiftine katılımıyla gerçekleşir. İyodometanın SN2 reaksiyonlarına aktif katılımı, nükleofilik saldırıya açık olması ve iyotun hareketliliği ile açıklanmaktadır.

Elektrofilik ikame (SE)
Organik bir molekül, aşırı elektron yoğunluğu ile karakterize edilen bir nükleofilik merkez içerebilir. Negatif yükleri olmayan elektrofilik bir reaktifle reaksiyona girer. Bu tür parçacıklar, serbest yörüngelere sahip atomları ve düşük elektron yoğunluğuna sahip alanlara sahip molekülleri içerir. “-” yükü olan B karbon, su dipolünün pozitif kısmı ile hidrojen ile etkileşime girer: CH3Na + H20 → CH4 + NaOH. Bu elektrofilik ikame reaksiyonunun ürünü metandır. Heterolitik reaksiyonlarda, organik moleküllerin zıt yüklü merkezleri etkileşime girer ve bu da onları inorganik maddelerin kimyasındaki iyonlara benzer hale getirir. Organik bileşiklerin dönüşümüne nadiren gerçek katyon ve anyon oluşumunun eşlik ettiği göz ardı edilmemelidir.

Monomoleküler ve bimoleküler reaksiyonlar
Nükleofilik ikame monomolekülerdir (SN1). Bu mekanizma, önemli bir organik sentez ürününün (üçüncül bütil klorür) hidrolize edilmesi için kullanılır. İlk aşama yavaştır; karbonyum katyonuna ve klorür anyonuna kademeli ayrışma ile ilişkilidir. İkinci aşama daha hızlı ilerler, karbonyum iyonunun suyla reaksiyonu gerçekleşir. alkandaki halojenin bir hidroksi grubu ile değiştirilmesi ve birincil alkolün elde edilmesi: (CH3)3C—Cl → (CH3)3C++Cl-; (CH3)3C+ + H20 → (CH3)3C—OH + H+. Birincil ve ikincil alkil halojenürlerin tek aşamalı hidrolizi, karbon-halojen bağının eşzamanlı olarak yok edilmesi ve bir C-OH çiftinin oluşmasıyla karakterize edilir. Bu bir nükleofilik bimoleküler ikame (SN2) mekanizmasıdır.
Heterolitik değiştirme mekanizması
İkame mekanizması elektron transferi ve ara komplekslerin yaratılmasıyla ilişkilidir. Reaksiyon ne kadar hızlı gerçekleşirse, karakteristik ara ürünleri de o kadar kolay ortaya çıkar. Çoğu zaman süreç aynı anda birkaç yöne gider. Avantaj genellikle oluşumları için en az enerjiye ihtiyaç duyan parçacıkların kullanıldığı yoldur. Örneğin, bir çift bağın varlığı, CH3+ iyonuna kıyasla bir alilik katyon CH2=CH—CH2+'nın ortaya çıkma olasılığını artırır. Bunun nedeni, molekül boyunca dağılmış pozitif yükün delokalizasyonunu etkileyen çoklu bağın elektron yoğunluğunda yatmaktadır.
Benzen ikame reaksiyonları
Elektrofilik ikame ile karakterize edilen grup, arenlerdir. Benzen halkası elektrofilik saldırı için uygun bir hedeftir. İşlem, ikinci reaktifteki bağ polarizasyonuyla başlar ve benzen halkasının elektron bulutuna bitişik bir elektrofil oluşumuyla sonuçlanır. Sonuç olarak bir geçiş kompleksi ortaya çıkar. Elektrofilik parçacık ile karbon atomlarından biri arasında henüz tam bir bağlantı yoktur, "aromatik altı" elektronun tüm negatif yükü tarafından çekilir. Sürecin üçüncü aşamasında, halkanın elektrofil ve bir karbon atomu ortak bir elektron çifti (kovalent bağ) ile bağlanır. Ancak bu durumda, "aromatik altı" yok edilir ve bu, istikrarlı, istikrarlı bir enerji durumuna ulaşma açısından elverişsizdir. “Proton püskürmesi” olarak adlandırılabilecek bir olay gözleniyor. H+ ortadan kaldırılır ve arenelerin kararlı iletişim sistemi özelliği yeniden sağlanır. Yan ürün, benzen halkasından bir hidrojen katyonu ve ikinci reaktiften bir anyon içerir.

Organik kimyadan ikame reaksiyonlarına örnekler
Alkanlar özellikle bir ikame reaksiyonuyla karakterize edilir. Sikloalkanlar ve arenler için elektrofilik ve nükleofilik dönüşümlere örnekler verilebilir. Organik madde moleküllerindeki benzer reaksiyonlar normal koşullar altında meydana gelir, ancak daha çok ısıtıldığında ve katalizörlerin varlığında meydana gelir. Yaygın ve iyi çalışılmış işlemler aromatik halkadaki elektrofilik ikameyi içerir. Bu türün en önemli reaksiyonları:
- Benzenin H2S04 varlığında nitrasyonu şu şemaya göre ilerler: C6H6 → C6H5-NO2.
- Benzenin katalitik halojenasyonu, özellikle klorlama, aşağıdaki denkleme göre: C6H6 + Cl2 → C6H5Cl + HCl.
- Aromatik süreç “dumanlı” sülfürik asit ile ilerler, benzensülfonik asitler oluşur.
- Alkilasyon, benzen halkasındaki bir hidrojen atomunun bir alkil ile değiştirilmesidir.
- Asilasyon - ketonların oluşumu.
- Formilasyon, hidrojenin bir CHO grubu ile değiştirilmesi ve aldehitlerin oluşmasıdır.
İkame reaksiyonları, halojenlerin erişilebilir bir C-H bağına saldırdığı alkanlar ve sikloalkanlardaki reaksiyonları içerir. Türevlerin oluşumu, doymuş hidrokarbonlar ve sikloparafinlerdeki bir, iki veya tüm hidrojen atomlarının değiştirilmesini içerebilir. Küçük moleküler ağırlığa sahip haloalkanların çoğu, farklı sınıflara ait daha karmaşık maddelerin üretiminde kullanılmaktadır. İkame reaksiyonlarının mekanizmalarının incelenmesinde elde edilen ilerleme, alkanlar, sikloparafinler, arenler ve halojenlenmiş hidrokarbonlara dayalı sentezlerin geliştirilmesine güçlü bir ivme kazandırmıştır.
CH3 -CH3 + Cl2 – (hv) ---- CH3 -CH2Cl + HCl
C 6 H 5 CH 3 + Cl 2 --- 500 C --- C 6 H 5 CH 2 Cl + HCl
İlave reaksiyonları
Bu tür reaksiyonlar çoklu (çift veya üçlü) bağ içeren organik bileşikler için tipiktir. Bu tip reaksiyonlar halojenlerin, hidrojen halojenürlerin ve suyun alkenlere ve alkinlere eklenmesi reaksiyonlarını içerir.
CH3 -CH=CH2 + HC1 ---- CH3 -CH(Cl)-CH3
Eliminasyon reaksiyonları
Bunlar çoklu bağların oluşumuna yol açan reaksiyonlardır. Hidrojen halojenürleri ve suyu ortadan kaldırırken, daha az hidrojen atomunun bulunduğu karbon atomundan bir hidrojen atomunun elimine edildiği Zaitsev kuralıyla açıklanan reaksiyonun belirli bir seçiciliği gözlenir. Örnek reaksiyon
CH3-CH(Cl)-CH2-CH3 + KOH →CH3 -CH=CH-CH3 + HC1
Polimerizasyon ve polikondensasyon
n(CH2 =CHCl) (-CH2-CHCl)n
Redoks
Oksidatif reaksiyonların en yoğun olanı, tüm organik bileşik sınıflarının reaksiyon özelliği olan yanmadır. Bu durumda yanma koşullarına bağlı olarak karbon, C (kurum), CO veya CO2'ye oksitlenir ve hidrojen suya dönüştürülür. Ancak organik kimyacılar için yanmadan çok daha ılıman koşullar altında gerçekleştirilen oksidasyon reaksiyonları büyük ilgi görmektedir. Kullanılan oksitleyici maddeler: su içinde Br2 veya CCl4 içinde Cl2 çözeltileri; su veya seyreltik asit içinde KMnO 4; bakır oksit; taze çökeltilmiş gümüş(I) veya bakır(II) hidroksitler.
3C 2 H 2 + 8KMnO 4 +4H 2 O→3HOOC-COOH + 8MnO 2 + 8KOH
Esterleşme (ve bunun ters hidroliz reaksiyonu)
R 1 COOH + HOR 2 H+ R 1 COOR 2 + H 2 O
Döngüsel yükleme
Y R Y-R
‖ + ‖ → ǀ ǀ
R Y R-Y
‖ + →
11. Organik reaksiyonların mekanizmalara göre sınıflandırılması. Örnekler.
Reaksiyon mekanizması, kimyasal reaksiyonların ayrıntılı adım adım açıklamasını içerir. Aynı zamanda hangi kovalent bağların, hangi sırayla ve ne şekilde kırıldığı da tespit edilir. Reaksiyon işlemi sırasında yeni bağların oluşumu da dikkatlice anlatılmıştır. Reaksiyon mekanizmasını değerlendirirken öncelikle reaksiyona giren moleküldeki kovalent bağın kırılma yöntemine dikkat edin. Böyle iki yol var - homolitik ve heterolitik.
Radikal reaksiyonlar kovalent bir bağın homolitik (radikal) bölünmesiyle ilerleyin:

Polar olmayan veya düşük polariteli kovalent bağlar (C–C, N–N, C–H), yüksek sıcaklıklarda veya ışığın etkisi altında radikal bölünmeye uğrar. CH3 radikalindeki karbonun 7 dış elektronu vardır (CH4'teki kararlı sekizli kabuk yerine). Radikaller kararsızdır; eksik elektronu (bir çifte veya bir oktete kadar) yakalama eğilimindedirler. Kararlı ürünler oluşturmanın yollarından biri dimerizasyondur (iki radikalin birleşimi):
CH 3 + CH 3 CH 3 : CH 3,
N + N N : N.
Radikal reaksiyonlar - bunlar örneğin alkanların klorlama, brominasyon ve nitrasyon reaksiyonlarıdır:

İyonik reaksiyonlar Heterolitik bağ bölünmesiyle meydana gelir. Bu durumda, karbon atomu üzerinde bir yüke sahip kısa ömürlü organik iyonlar (karbokatyonlar ve karbanyonlar) ara olarak oluşur. İyonik reaksiyonlarda, bağlayıcı elektron çifti ayrılmaz, ancak tamamen atomlardan birine geçerek onu bir anyona dönüştürür:

Güçlü polar (H–O, C–O) ve kolayca polarize olabilen (C–Br, C–I) bağlar, heterolitik bölünmeye eğilimlidir.
Ayırt etmek nükleofilik reaksiyonlar (nükleofil– elektronların bulunmadığı bir yer olan çekirdeği aramak) ve elektrofilik reaksiyonlar (elektrofil– elektron aramak). Belirli bir reaksiyonun nükleofilik veya elektrofilik olduğu ifadesi her zaman reaktife atıfta bulunur. Reaktif– Daha basit bir yapıya sahip reaksiyona katılan bir madde. Yüzey– daha karmaşık yapıya sahip bir başlangıç maddesi. Giden grup karbona bağlı değiştirilebilir bir iyondur. Reaksiyon ürünü– yeni karbon içeren madde (reaksiyon denkleminin sağ tarafında yazılıdır).
İLE nükleofilik reaktifler(nükleofiller) negatif yüklü iyonları, yalnız elektron çiftlerine sahip bileşikleri, çift karbon-karbon bağlarına sahip bileşikleri içerir. İLE elektrofilik reaktifler(elektrofiller) pozitif yüklü iyonları, doldurulmamış elektron kabuklarına sahip bileşikleri (AlCl 3, BF 3, FeCl 3), karbonil gruplarına sahip bileşikleri, halojenleri içerir. Elektrofiller, yeni bir bağ oluşturma sürecinde bir çift elektron ekleyebilen herhangi bir atom, molekül veya iyondur. İyonik reaksiyonların itici gücü, zıt yüklü iyonların veya farklı moleküllerin kısmi yüklü (+ ve -) parçalarının etkileşimidir.
Farklı türdeki iyonik reaksiyonların örnekleri.
Nükleofilik ikame :
Elektrofilik ikame :
Nükleofilik ekleme (Önce CN – eklenir, ardından H+):

Elektrofilik bağlantı (Önce H + eklenir, ardından X – eklenir):

Nükleofillerin (bazların) etkisiyle eliminasyon :
Eylem üzerine eleme elektrofiller (asitler) :
Organik reaksiyonlar iki genel tipte sınıflandırılabilir.
Hemolitik reaksiyonlar. Bu reaksiyonlar radikal bir mekanizma ile ilerler. Bir sonraki bölümde bunlara daha ayrıntılı olarak bakacağız. Bu tip reaksiyonların kinetiği ve mekanizması Bölüm 2'de tartışılmıştır. 9.
Heterolitik reaksiyonlar. Bu reaksiyonlar esas olarak iyonik reaksiyonlardır. Bunlar sırasıyla ikame, ekleme ve eliminasyon reaksiyonlarına bölünebilir.
İkame reaksiyonları
Bu reaksiyonlarda bir atom veya atom grubunun yerini başka bir atom veya grup alır. Bu tip reaksiyonlara örnek olarak, klorometanın metanol oluşumuyla hidrolizini veriyoruz:
Hidroksil iyonu bir nükleofildir. Bu nedenle söz konusu yer değiştirmeye nükleofilik yer değiştirme adı verilir. SN sembolü ile gösterilir. Değiştirilen parçacığa (bu durumda bir klor iyonu) ayrılan grup adı verilir.
Nükleofili sembolle ve ayrılan grubu sembolle belirtirsek, R alkil grubundaki doymuş bir karbon atomunda nükleofilik ikame reaksiyonunun genelleştirilmiş denklemini aşağıdaki gibi yazabiliriz:
Bu tip reaksiyonların hızına ilişkin bir çalışma, reaksiyonların aşağıdakilere bölünebileceğini göstermektedir:
Türdeki reaksiyonlar SN tipindeki bazı reaksiyonlar için, reaksiyon hızının kinetik denklemi (bkz. Bölüm 9.1) şu şekildedir:
Dolayısıyla, bu reaksiyonlar substratta birinci dereceden fakat reaktantta sıfır derecededir Birinci dereceden bir reaksiyonun kinetik karakteristiği, reaksiyonun hız sınırlayıcı adımının tek moleküllü bir süreç olduğunun güvenilir bir göstergesidir. Bu nedenle bu tür reaksiyonlar sembolüyle gösterilir.
Reaksiyonun hızı reaktifin konsantrasyonuna bağlı olmadığından reaktife göre sıfır derecelidir. Bu nedenle şunu yazabiliriz:
Nükleofil reaksiyonun hız sınırlayıcı adımına katılmadığından böyle bir reaksiyonun mekanizması en az iki adım içermelidir. Bu tür reaksiyonlar için aşağıdaki mekanizma önerilmiştir:

İlk aşama, karbokatyon oluşumu ile iyonlaşmadır.Bu aşama sınırlayıcıdır (yavaş).
Bu tür reaksiyonun bir örneği, tersiyer alkil halojenürlerin alkalin hidrolizidir. Örneğin
Söz konusu durumda reaksiyon hızı denklemle belirlenir.
Türün reaksiyonları Nükleofilik ikame SN'nin bazı reaksiyonları için hız denklemi şu şekildedir:
Bu durumda reaksiyon nükleofilde birinci dereceden, nükleofilde birinci derecedendir. Genel olarak ikinci dereceden bir reaksiyondur. Bu, reaksiyonun hız sınırlayıcı aşamasının iki moleküllü bir süreç olduğuna inanmak için yeterli nedendir. Bu nedenle, söz konusu türün reaksiyonu sembolüyle gösterilir. Hem nükleofil hem de substrat, reaksiyonun hız sınırlayıcı aşamasına aynı anda katıldıklarından, bu reaksiyonun bir geçiş durumu yoluyla tek aşamada ilerlediğini düşünebiliriz (bkz. Bölüm). 9.2):
Primer alkil halojenürlerin alkali ortamda hidrolizi şu mekanizmaya göre ilerler:

Bu reaksiyon aşağıdaki kinetik denkleme sahiptir:
Şu ana kadar nükleofilik yer değiştirmeyi yalnızca doymuş karbon atomunda ele aldık. Doymamış bir karbon atomunda nükleofilik ikame de mümkündür:

Bu tip reaksiyonlara nükleofilik asil ikamesi denir.
Elektrofilik ikame. Benzen halkalarında elektrofilik ikame reaksiyonları da meydana gelebilir. Bu tür yer değiştirmede benzen halkası elektrofilin iki delokalize elektronunu sağlar. Bu durumda, bir ara bileşik oluşur - bir elektrofil ve bir ayrılan grubun kararsız bir kompleksi. Bu tür komplekslerin şematik gösterimi için, iki elektronun kaybını gösteren açık bir daire kullanılır:

Elektrofilik ikame reaksiyonlarına bir örnek benzenin nitrasyonudur:

Benzenin nitrasyonu, bir nitratlama karışımı kullanılarak 55 ila 60 ° C sıcaklıkta bir geri akış kondansatörlü bir tesiste gerçekleştirilir. Bu karışım eşit miktarda konsantre nitrik ve sülfürik asit içerir. Bu asitler arasındaki reaksiyon bir nitroil katyonu oluşumuna yol açar
İlave reaksiyonları
Bu tip reaksiyonlarda doymamış bir karbon atomuna bir elektrofil veya nükleofil eklenir. Burada elektrofilik katılma ve nükleofilik katılmanın birer örneğini ele alacağız.
Elektrofilik eklemenin bir örneği, hidrojen bromür ile bir alken arasındaki reaksiyondur. Laboratuvarda hidrojen bromür elde etmek için konsantre sülfürik asit ile sodyum bromür arasındaki reaksiyon kullanılabilir (bkz. Bölüm 16.2). Hidrojen bromür molekülleri polardır çünkü brom atomu hidrojen üzerinde negatif bir endüktif etkiye sahiptir. Bu nedenle hidrojen bromür molekülü güçlü bir asitin özelliklerine sahiptir. Modern görüşlere göre hidrojen bromürün alkenlerle reaksiyonu iki aşamada gerçekleşir. İlk aşamada pozitif yüklü bir hidrojen atomu, elektron kaynağı görevi gören çift bağa saldırır. Sonuç olarak, aktifleştirilmiş bir kompleks ve bir bromür iyonu oluşur:

Bromür iyonu daha sonra bu komplekse saldırarak bir alkil bromürün oluşmasına neden olur:

Nükleofilik eklemenin bir örneği, herhangi bir aldehit veya ketona hidrojen siyanürün eklenmesidir. İlk olarak aldehit veya keton, sulu bir sodyum siyanür çözeltisi ile muamele edilir, daha sonra fazla miktarda herhangi bir mineral asit eklenir, bu da hidrojen siyanür HCN oluşumuna yol açar. Siyanür iyonu bir nükleofildir. Aldehit veya ketonun karbonil grubu üzerindeki pozitif yüklü karbon atomuna saldırır. Karbonil grubunun pozitif yükü ve polaritesi yukarıda açıklanan mezomerik etkiden kaynaklanmaktadır. Reaksiyon aşağıdaki diyagramla temsil edilebilir:

Eliminasyon reaksiyonları
Bu reaksiyonlar katılma reaksiyonlarının tersidir. Basit bir kovalent bağ ile birbirine bağlanan iki karbon atomundan herhangi bir atomun veya atom grubunun çıkarılmasına yol açarak aralarında çoklu bir bağ oluşmasına neden olurlar.
Böyle bir reaksiyonun bir örneği, hidrojen ve halojenin alkil halojenürlerden uzaklaştırılmasıdır:
Bu reaksiyonu gerçekleştirmek için alkil halojenür, 60 °C sıcaklıkta alkol içerisinde potasyum hidroksit ile işleme tabi tutulur.
Bir alkil halojenürün hidroksit ile işlenmesinin aynı zamanda nükleofilik ikameye de yol açtığı belirtilmelidir (yukarıya bakınız). Sonuç olarak, iki rakip ikame ve eliminasyon reaksiyonu aynı anda meydana gelir ve bu da ikame ve eliminasyon ürünlerinin bir karışımının oluşmasına yol açar. Bu reaksiyonlardan hangisinin baskın olacağı, reaksiyonun gerçekleştirildiği ortam da dahil olmak üzere bir dizi faktöre bağlıdır. Alkil halojenürlerin nükleofilik ikamesi suyun varlığında gerçekleştirilir. Bunun tersine eliminasyon reaksiyonları suyun yokluğunda ve daha yüksek sıcaklıklarda gerçekleştirilir.
O halde tekrar söyleyelim!
1. Bir bağın hemolitik bölünmesi sırasında, paylaşılan iki elektron atomlar arasında eşit olarak dağıtılır.
2. Heterolitik bağ bölünmesi sırasında, paylaşılan iki elektron atomlar arasında eşit olmayan şekilde dağıtılır.
3. Karbanyon, negatif yüklü bir karbon atomu içeren bir iyondur.
4. Karbokasyon, pozitif yüklü bir karbon atomu içeren bir iyondur.
5. Çözücü etkileri kimyasal prosesler ve bunların denge sabitleri üzerinde önemli bir etkiye sahip olabilir.
6. Bir molekül içindeki fonksiyonel grubun kimyasal ortamının, o fonksiyonel grubun reaktivitesi üzerindeki etkisine yapısal etki denir.
7. Elektronik etkiler ve sterik etkiler topluca yapısal etkiler olarak adlandırılır.
8. En önemli iki elektronik etki, endüktif etki ve mezomerik (rezonans) etkidir.
9. İndüktif etki, elektron yoğunluğunun bir atomdan diğerine kaymasıdır, bu da iki atom arasındaki bağın polarizasyonuna yol açar. Bu etki olumlu ya da olumsuz olabilir.
10. Çoklu bağa sahip moleküler parçacıklar, iki veya daha fazla rezonans yapısı arasında rezonans hibritleri formunda mevcut olabilir.
11. Mezomerik (rezonans) etkisi, -elektronların delokalizasyonu nedeniyle rezonans hibritlerin stabilizasyonundan oluşur.
12. Bir moleküldeki hacimli gruplar reaksiyonu mekanik olarak engellediğinde sterik engelleme meydana gelebilir.
13. Nükleofil, bir karbon atomuna saldıran ve ona elektron çifti sağlayan bir parçacıktır. Nükleofil bir Lewis bazıdır.
14. Elektrofil, bir karbon atomuna saldıran ve onun elektron çiftini kabul eden bir parçacıktır. Nükleofil bir Lewis asididir.
15. Hemolitik reaksiyonlar radikal reaksiyonlardır.
16. Heterolitik reaksiyonlar esas olarak iyonik reaksiyonlardır.
17. Bir moleküldeki herhangi bir grubun nükleofilik bir reaktifle değiştirilmesine nükleofilik ikame denir. Bu durumda değiştirilen gruba ayrılan grup denir.
18. Bir benzen halkasındaki elektrofilik ikame, iki delokalize elektronun bir elektrofile bağışlanmasını içerir.
19. Elektrofilik katılma reaksiyonlarında, doymamış bir karbon atomuna bir elektrofil eklenir.
20. Aldehitlere veya ketonlara hidrojen siyanürün eklenmesi, nükleofilik eklemenin bir örneğidir.
21. Eliminasyon (eliminasyon) reaksiyonlarında, bazı atomlar veya atom grupları, basit bir kovalent bağ ile birbirine bağlı iki karbon atomundan ayrılır. Sonuç olarak bu karbon atomları arasında çoklu bağ oluşur.

Aromatik bileşiklerde ikame teorisi. Elektrofilik yer değiştirme reaksiyonları. 2. türden yönlendiriciler (meta yönlendiriciler).
Negatif bir endüktif etkiye veya negatif hem endüktif hem de mezomerik etkilere sahip olan ikame ediciler, elektrofilik ikameyi benzen halkasının meta pozisyonuna yönlendirir ve ikinci türden yönlendiriciler olarak adlandırılır.
İnorganik olanlar gibi organik reaksiyonlar da 3 ana türe ayrılır:
1) ikame reaksiyonu: CH4 + CI2 → CH3CI + HC1;
2) eliminasyon reaksiyonu: CH3CH2Br → CH2 = CH2 + HBr;
3) ekleme reaksiyonu: CH2 = CH2 + HBr → CH3CH2Br.( polimerizasyon reaksiyonları)
Sınıflandırmak reaksiyona giren moleküllerdeki kovalent bağların kırılma mekanizması ile.
Kovalent bağları kırmanın iki yolu.
1. Ortak bir elektron çifti atomlar arasında paylaşılarak radikaller oluşturulur. Radikaller-eşleşmemiş elektronlara sahip parçacıklar. Bu kopukluğa denir radikal (homolitik).tuhaflık Bu bağlantı, oluşan radikallerin reaksiyon sisteminde bulunan moleküllerle veya birbirleriyle etkileşime girmesidir.
Ortaya çıkan radikaller, reaksiyon sisteminde bulunan moleküllerle veya birbirleriyle etkileşime girer: CH3 + CI2 → CH3CI + CI.
Radikal mekanizmaya göre, düşük polariteli bağların (C-C, C-H, N-N) yüksek sıcaklıklarda, ışık veya radyoaktif radyasyonun etkisi altında kırıldığı reaksiyonlar meydana gelir.
2. Bir bağ koptuğunda bir atomda ortak bir elektron çifti kalırsa, o zaman iyonlar – katyon ve anyon. Bu mekanizmaya denir iyonik veya heterolitik. Organik oluşumuna yol açar katyonlar veya anyonlar: 1) metil klorür bir metil katyonu ve bir klorür anyonu oluşturur; 2) metil lityum, lityum katyonu ve metil anyonu oluşturur.
Organik iyonlar daha fazla dönüşüme uğrar. Bu durumda katyonlar etkileşime girer. nükleofilik(“çekirdeği seven”) parçacıklar ve organik anyonlar elektrofilik(“elektron seven”) parçacıklar (metal katyonlar, halojenler vb.).
İyonik mekanizma, polar bir kovalent bağ kırıldığında (karbon - halojen, karbon - oksijen vb.) gözlenir.
Organik iyonik parçacıklar inorganik kimyadaki iyonlara benzer; karşılık gelen yüklere sahiptirler. Bununla birlikte, bunlar oldukça farklıdır: inorganik bileşiklerin iyonları sulu çözeltilerde sürekli olarak bulunur ve organik iyonik parçacıklar yalnızca reaksiyon anında ortaya çıkar.
Bu nedenle çoğu durumda serbest organik iyonlardan değil, yüksek oranda polarize moleküllerden bahsetmek gerekir.
Polar olmayan veya düşük polariteli bir kovalent bağ (karbon-karbon, karbon-hidrojen vb.) kırıldığında radikal mekanizma gözlemlenir.
Organik iyonik parçacıklar inorganik kimyadaki iyonlara benzer; karşılık gelen yüklere sahiptirler.