Что значит "критическая точка"
Что такое критические точки стали
Критические точки стали или точки Чернова - критические температуры, при которых происходит изменение фазового состояния и структуры стали при нагреве или охлаждении её в твёрдом виде. Установлены Черновым Дмитрием Константиновичем в 1868 году.
Критические точки обозначают буквой А. Нижняя критическая точка соответствует линии PSK диаграммы состояния железо-углерод. Эта точка называется А1 и соответствует превращению аустенита в перлит при охлаждении или перлита в аустенит при нагреве. Верхняя критическая точка называется А3. Критическая точка А3 для доэвтектоидных сталей лежит на линии GS диаграммы железо-углерод и соответствует началу выделения феррита при охлаждении или концу его растворения при нагреве. Критическая точка А3 для заэвтектоидных сталей лежит на линии SE и соответствует началу выделения вторичного цементита при охлаждении или концу его растворения при нагреве.
В зависимости от того, при нагреве или при охлаждении определяется критическая точка, к букве А добавляется индекс “с” при нагреве (от французского слова chauffage – нагрев) и индекс ”r” (от французского слова refroidissement – охлаждение) при охлаждении с оставлением цифры, характеризующей данное превращение.
Таким образом, например, нагрев доэвтектоидной стали выше соответствующей точки на линии GS обозначается как нагрев выше точки Аc3 . При охлаждении же этой стали первое превращение должно быть обозначено как Аr3 , второе (на линии РSК) - как Аr1 . Точку А3 для заэвтектоидных сталей обычно обозначают Аcm .
Точка Mn в таблице обозначает температуру начала мартенситного превращения.
При термической обработке сталей, значения критических точек чаще всего используют чтобы определить температуру нагрева под закалку.
Как выбрать температуру нагрева под закалку
Для доэвтектоидных сталей (содержание углерода в стали менее 0.8%) обычно выбирают температуру закалки по формуле Ас3+30...50°C . На практике встречаются случаи, когда доэвтектоидные стали закаливают с интервала температур между Ас1 и Ас3. В этом случае структура стали будет состоять из мартенсита и нерастворенного феррита. Такой процесс называется неполной закалкой и теоретически является браком. На практике к такую схему используют, чтобы снизить коробление деталей или исключить трещинообразование в высоколегированных сталях.
Заэвтектоидные стали обычно нагревают под закалку до температур Ас1+30...50°C . После закалки, структура стали будет состоять из мартенсита и вторичного нерастворённого цементита, который повышает твердость и износостойкость изделий.
критическая точка
изображает на диаграммах состояния критическое состояние вещества. Критическая точка заканчивается, напр., кривая фазового равновесия жидкость - пар в системе координат: температура T, давление p.
Критическая точка
точка на диаграмме состояния, соответствующая критическому состоянию. К. т. двухфазного равновесия жидкость ≈ пар является конечной точкой на кривой равновесия и характеризуется критическими значениями температуры Тк, давления рк и объёма Vк (табл.). К. т. представляет собой частный случай точки фазового перехода и характеризуется потерей термодинамической устойчивости по плотности или составу вещества. По одну сторону от К. т. вещество однородно (обычно при Т > Тк), а по другую ≈ расслаивается на фазы. У смесей или растворов следует различать К. т. равновесия жидкость ≈ пар и К. т. равновесия фаз различного состава, находящихся в одном агрегатном состоянии (жидкость ≈ жидкость, газ ≈ газ). В связи с этим К. т. смесей (растворов) дополнительно характеризуется критической концентрацией хк. В результате увеличения числа параметров, определяющих состояние системы, у смесей имеется не К. т., а критическая кривая, точки которой различаются значениями Тк, рк, Vк и хк. В окрестности К, т. наблюдаются критические явления . Параметры критической точки жидкость ≈ пар некоторых веществ
Вещество
Кислород
Двуокись углерода
Спирт (этиловый)
* 1 amм = 1,01×105 н/м2.
Википедия
Критическая точка
Критическая точка - многозначный термин:
- Критическая точка - точка, где производная равна нулю, либо неопределена.
- Критическая точка - температура, при которой две фазы находятся в равновесии.
- « Критическая точка » - Программа журналистских расследований телеканале Украина
Критическая точка (термодинамика)
Критическая температура фазового перехода - значение температуры в критической точке. При температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Критическая точка (математика)
Критической точкой дифференцируемой функции $f:D\to\R$, где D - область в $\R^n$, называется точка, в которой все её частные производные обращаются в нуль. Это условие эквивалентно обращению в ноль дифференциала функции в данной точке, а также равносильно горизонтальности касательной гиперплоскости к графику функции. Это условие является необходимым для того, чтобы внутренняя точка области могла быть точкой локального минимума или максимума дифференцируемой функции.
Значение функции в критической точке называется критическим значением . Согласно лемме Сарда, множество критических значений любой C-гладкой функции $f: \to\R$ имеет нулевую меру Лебега (хотя критических точек при этом может быть сколько угодно, например, для функции f = c o n s t любая точка является критической).
Понятие критической точки допускает обобщение на случай дифференцируемых отображений $f:\R^n\to\R^m$, и на случай дифференцируемых отображений произвольных многообразий f : N → M . В этом случае определение критической точки состоит в том, что ранг матрицы Якоби отображения f в ней меньший максимального (равного числу min{n , m }).
Критические точки функций и отображений играют важную роль в таких областях математики, как дифференциальные уравнения , вариационное исчисление , теория устойчивости, а также в механике и физике. Исследование критических точек гладких отображений составляет один из главных вопросов теории катастроф.
Понятие критической точки обобщается также на случай функционалов, определенных на бесконечномерных функциональных пространствах. Поиск критических точек таких функционалов является важной частью вариационного исчисления. Критические точки функционалов называются экстремалями .
Кривая фазового равновесия (в плоскости Р, Т) может в некоторой точке окончиться (рис. 16); такая точка называется критической, а соответствующие ей температура и давление - критической температурой и критическим давлением. При температурах выше и при давлениях, больших не существует различных фаз, и тело всегда однородно.
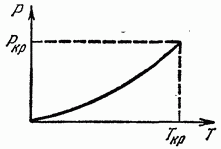
Можно сказать, что в критической точке исчезает различие между обеими фазами. Понятие о критической точке было впервые введено Д. И. Менделеевым (1860).
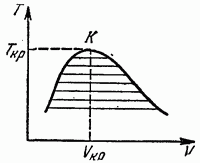
В координатах Т, V диаграмма равновесия при наличии критической точки выглядит так, как это изображено на рис. 17. По мере приближения температуры к ее критическому значению удельные объемы находящихся друг с другом в равновесии фаз сближаются и в критической точке (К на рис. 17) совпадают. Аналогичный вид имеет диаграмма в координатах Р, V.
При наличии критической точки между всякими двумя состояниями вещества может быть произведен непрерывный переход, при котором ни в какой момент не происходит расслоения на две фазы - для этого надо менять состояние вдоль какой-либо кривой, огибающей критическую точку и нигде не пересекающей кривую равновесия. В этом смысле при наличии критической точки становится условным самое понятие о различных фазах, и невозможно во всех случаях указать, какие состояния являются одной фазой, а какие - другой. Строго говоря, можно говорить о двух фазах лишь тогда, когда они существуют обе одновременно, соприкасаясь друг с другом, т. е. в точках, лежащих на кривой равновесия.
Ясно, что критическая точка может существовать лишь для таких фаз, различие между которыми имеет лишь чисто количественный характер. Таковы жидкость и газ, отличающиеся друг от друга лишь большей или меньшей ролью взаимодействия между молекулами.
Такие же фазы, как жидкость и твердое тело (кристалл) или различные кристаллические модификации вещества, качественно различны между собой, так как отличаются своей внутренней симметрией. Ясно, что о всяком свойстве (элементе) симметрии можно сказать только либо, что оно есть, либо, что его нет; оно может появиться или исчезнуть лишь сразу, скачком, а не постепенно. В каждом состоянии тело будет обладать либо одной, либо другой симметрией, и потому всегда можно указать, к которой из двух фаз оно относится. Критическая точка, следовательно, для таких фаз не может существовать, и кривая равновесия должна либо уходить на бесконечность, либо заканчиваться, пересекаясь с кривыми равновесия других фаз.
Обычная точка фазового перехода не представляет собой в математическом отношении особенности для термодинамических величин вещества. Действительно, каждая из фаз может существовать (хотя бы как метастабильная) и по другую сторону от точки перехода; термодинамические неравенства в этой точке не нарушаются. В точке перехода химические потенциалы обеих фаз равны друг другу: ; для каждой же из функций эта точка ничем не замечательна.
Изобразим в плоскости Р, V какую-либо изотерму жидкости и газа, т. е. кривую зависимости Р от V при изотермическом расширении однородного тела на рис. 18). Согласно термодинамическому неравенству есть убывающая функция V. Такой наклон изотерм должен сохраниться и на некотором протяжении за точками их пересечения с кривой равновесия жидкости и газа (точки b и участки изотерм соответствуют метастабильным перегретой жидкости и переохлажденному пару, в которых термодинамические неравенства по-прежнему соблюдаются (полностью же равновесному изотермическому изменению состояния между точками b не отвечает, конечно, горизонтальный отрезок на котором происходит расслоение на две фазы).
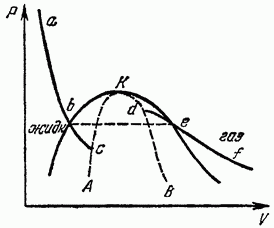
Если учесть, что точки имеют одинаковую ординату Р, то ясно, что обе части изотермы не могут перейти друг в друга непрерывным образом, и между ними должен быть разрыв. Изотермы заканчиваются в точках (с и d), в которых нарушается термодинамическое неравенство, т. е.
Построив геометрическое место точек окончания изотерм жидкости и газа, мы получим кривую АКБ, на которой нарушаются (для однородного тела) термодинамические неравенства; она ограничивает область, в которой тело ни при каких условиях не может существовать как однородное. Области между этой кривой и кривой равновесия фаз отвечают перегретой жидкости и переохлажденному пару. Очевидно, что в критической точке обе кривые должны касаться друг друга. Из точек же, лежащих на самой кривой АКБ, реально существующим состояниям однородного тела отвечает лишь критическая точка К - единственная, в которой эта кривая соприкасается с областью устойчивых однородных состояний.
В противоположность обычным точкам фазового равновесия критическая точка является в математическом отношении особой точкой для термодинамических функций вещества (то же самое относится ко всей кривой АКВ, ограничивающей область существования однородных состояний тела). Характер этой особенности и поведение вещества вблизи критической точки будут рассмотрены в § 153.






