Удельная энтальпия пара. Большая энциклопедия нефти и газа
Cтраница 1
Плотности насыщенных паров при одной и той же температуре резко различны для разных веществ. При комнатной температуре плотность насыщенных паров воды равна 13 мм, а плотность насыщенных паров ртути - всего лишь 0 005 мм.
Плотность насыщенного пара, находящегося в равновесии с твердым телом, растет с увеличением температуры.
Плотность насыщенных паров продукта в зависимости от температуры определяют по таблицам.
Значение плотности насыщенного пара зависит только от температуры (таблица) и не зависит от занимаемого объема.
Значение плотности насыщенного пара при избыточном давлении в сепараторе 0 7 кгс / сж2 взято по таблицам, допускаемое напряжение парового пространства сепаратора - среднее в пределах рекомендуемых величин. Принят сепаратор объемом 0 7 м3, диаметром 600 мм Бийского котельного завода - 1 шт.
Давление и плотность насыщенного пара в направлении оси х до поверхности жидкости не меняется, между тем в бесконечно тонком слог пара, прилегающем непосредственно к жидкости, количество молекул все время убывает вследствие конденсации. Для восполнения этой убыли должно иметь место молярное или молекулярное движение частиц пара к жидкости, однако то и другое возможно лишь при наличии какого-то перепада плотности или давления в направлении оси х, но ни того ни другого нет.
Зависит ли плотность насыщенного пара от температуры.
Процесс образования пара из жидкой или твердой фазы называют парообразованием. В случае, если пар образует противоположным путем, то процесс носит название конденсация.
Пар можно рассматривать как идеальный газ, если он находится в условиях низкого давления и высокой температуры. Практически в 99 случаев из 100, при употреблении слова «пар» понимают или имеют ввиду водяной пар, во всех остальных случаях обычно имеется уточнение.
Различают два вида состояний пара химических соединений, не содержащих примесные компоненты:
— пар ненасыщенный, т.е. пар, который пока не находится в состоянии динамического равновесия с жидкостью. Если на поверхности жидкости находится ненасыщенный пар, то процесс парообразования преобладает над процессом конденсации. Именно поэтомув данном случае объем жидкости в сосуде будет постепенно уменьшаться.
— пар насыщенный, т.е. пар, который находится в динамическом равновесии с жидкостью, что по-простому означает следующее: ни один из процессов - парообразование или конденсация не преобладает один над другим. Если объем фиксирован, а температура одинакова в двух случаях, тов данном сосуде не будет находиться больше пара, чем изначально. Данное равновесие можно нарушить, если сжимать пар, находящийся над жидкостью при помощи поршня: конденсация станет преобладать над парообразованием. Стоит помнить, что данный процесс - явление временное и он будет продолжаться до тех пор, пока динамическое равновесие снова не установится.
Время установления динамического равновесия между паром и жидкостью значительно зависит от плотности пара, что связано с различием сил межмолекулярного взаимодействия.
Зависимость изменения плотности, а также других физических характеристик водяного пара (насыщенный) от температуры приведены в таблице:
Примеры решения задач
ПРИМЕР 1
| Задание | Вычислите плотность а) по кислороду; б) по азоту; в) по воздуху следующих газов: фтористого бора BF 3 и оксида азота (V). |
| Решение |
M r (BF 3) = A r (B) + 3 ×A r (F) = 11 + 3 ×19 = 11 + 57 = 68. D air (BF 3) = M r (BF 3) / M r (air) = 68 / 29 = 2,345; D O2 (BF 3) = M r (BF 3) / M r (O 2) = 68 / 32 = 0,875; D N2 (BF 3) = M r (BF 3) / M r (N 2) = 68 / 28 = 1. M r (N 2 O 5) = 2 ×A r (N) + 5 ×A r (O) = 2 ×14 + 5 ×16 = 28 + 80 = 108. D air (N 2 O 5) = M r (N 2 O 5) / M r (air) = 108 / 29 = 3,724; D O2 (N 2 O 5) = M r (N 2 O 5) / M r (O 2) = 108 / 32 = 3,375; D N2 (N 2 O 5) = M r (N 2 O 5) / M r (N 2) = 108 / 28 = 3,857. |
| Ответ | Плотности фтористого бора по воздуху, кислороду и азоту соответственно равны 2,345, 0,875 и 1; плотности оксида азота (V) по воздуху, кислороду и азоту соответственно равны 3,724, 3,375 и 3,857. |
ПРИМЕР 2
| Задание | Вычислите плотность а) по кислороду; б) по азоту; в) по воздуху следующих газов: оксида углерода (IV) и бромоводорода HBr. |
| Решение | Для того, чтобы вычислить относительную плотность одного газа по другому, надо относительную молекулярную массу первого газа разделить на относительную молекулярную массу второго газа.
Относительную молекулярную массу воздуха принимают равной 29 (с учетом содержания в воздухе азота, кислорода и других газов). Следует отметить, что понятие «относительная молекулярная масса воздуха» употребляется условно, так как воздух - это смесь газов. M r (HBr) = A r (H) + A r (Br) = 1 + 80 = 81. D air (HBr) = M r (HBr) / M r (air) = 81 / 29 = 2,7931; D O2 (HBr) = M r (HBr) / M r (O 2) = 81 / 32 = 2,5313; D N2 (HBr) = M r (HBr) / M r (N 2) = 81 / 28 = 2,8929. M r (O 2) = 2 ×A r (O) = 2 × 16 = 32. M r (N 2) = 2 ×A r (N) = 2 × 14 = 28. M r (CO 2) = A r (C) + 2 ×A r (O) = 12 + 2 ×16 = 12 + 32 = 44. D air (CO 2) = M r (CO 2) / M r (air) = 44 / 29 = 1,5172; D O2 (CO 2) = M r (CO 2) / M r (O 2) = 44 / 32 = 1,375; D H2 (CO 2) = M r (CO 2) / M r (N 2) = 44 / 28 = 1,5714. |
| Ответ | Плотности бромоводорода по воздуху, кислороду и азоту соответственно равны 2,7931, 2,5313 и 2,8929; плотности оксида углерода (IV) по воздуху, кислороду и азоту соответственно равны 1,5172, 1,375 и 1,5714. |
Мы уже отмечали, что при увеличении температуры возрастает плотность насыщенного пара (см. §6.3). Плотность жидкости, находящейся в равновесии со своим паром, наоборот, уменьшается вследствие ее расширения при нагревании.
В таблице 2 приведены значения плотности воды и ее насыщенного пара для разных температур.
Таблица 2
Если на одном рисунке начертить кривые зависимости плотности жидкости и ее насыщенного пара от температуры, то для жидкости кривая пойдет вниз, а для пара - вверх (рис. 6.6). При критической температуре обе кривые сливаются, т. е. плотность жидкости становится равной плотности пара. Различие между жидкостью и паром исчезает.
Газ и пар
Мы много раз употребляли слова «газ» и «пар». Эти термины возникли в те времена, когда считалось, что пар может быть превращен в жидкость, а газ нет. После того как все газы были сконденсированы (см. § 6.7), для такой двойственной терминологии не осталось оснований. Пар и газ - это одно и то же, между ними принципиальной разницы нет. Когда говорят о паре какой-нибудь жидкости, то обычно имеют в виду, что его температура меньше критической и сжатием его можно превратить в жидкость. Только по привычке мы говорим о водяном паре, а не о водяном газе, о насыщенном паре, а не о насыщенном газе и т. д.
Экспериментальное исследование критического состояния
Эксперименты по изучению критического состояния выполнил в 1863 г. русский ученый М. П. Авенариус. Прибор, с помощью которого можно наблюдать критическое состояние (прибор Авенариуса), состоит из воздушной ванны (рис. 6.7) и находящейся внутри ванны запаянной стеклянной трубочки (ампулы) с жидким эфиром. Объем ампулы (ее вместимость) равен критическому объему эфира, налитого в трубочку. Пространство над эфиром в ампуле заполнено насыщенным паром эфира.
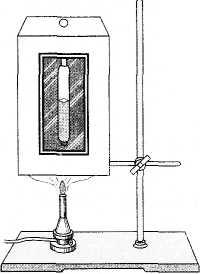
При помощи газовой горелки или другого нагревателя воздушную ванну подогревают. За состоянием эфира наблюдают через стеклянное окошко в приборе.
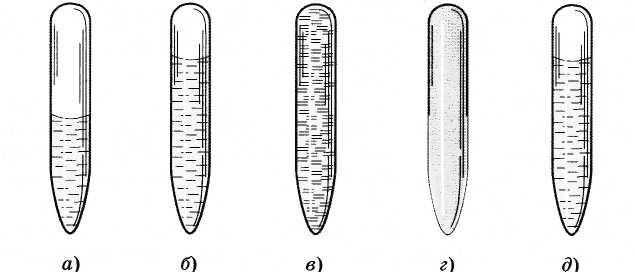
При комнатной температуре можно отчетливо видеть границу между жидкостью и паром (рис. 6.8, а). По мере приближения к критической температуре объем жидкого эфира увеличивается, а граница раздела жидкость - пар становится слабовыраженной, неустойчивой (рис. 6.8, б).
При подходе к критическому состоянию граница между ними исчезает совсем (рис. 6.8, в).
При охлаждении появляется плотный туман, заполняющий всю трубочку (рис. 6.8, г). Это образуются капельки жидкости. Далее они сливаются вместе, и опять возникает граница раздела между жидкостью и паром (рис. 6.8, д).
Для опыта выбран эфир, так как он имеет сравнительно низкое критическое давление (около 36 атм). Критическая температура его тоже невелика: 194 °С.
Если сжимать газ, поддерживая его температуру выше критической (см. рис. 6.4, изотерма Т3), причем, как и раньше, начать с очень больших объемов, то уменьшение объема приведет к возрастанию давления в соответствии с уравнением состояния идеального газа. Однако если при температуре ниже критической при определенном давлении происходила конденсация пара, то теперь образования жидкости в сосуде наблюдаться не будет. При температуре выше критической газ нельзя обратить в жидкость ни при каких давлениях.
В этом и состоит основное значение понятия критической температуры.






