Тройная точка
Точка соответствует самому низкому давлению, при котором еще возможно превращение вещества из твердого состояния в жидкое и обратно, т. е. равновесное состояние между твердой и жидкой фазами; при меньших давлениях жидкое состояние не существует. На этом же чертеже нанесена кривая зависимости давления насыщенного пара от температуры, о которой упоминалось в § 13 ч. II (см. рис. 11.25) и в § 17 (см. формулу (3.32)). Слева от этой кривой вещество находится при температурах, которые меньше температуры кипения, т. е. в жидком состоянии; точки, расположенные справа от этой кривой, соответствуют более высоким температурам и, следовательно, состояниям ненасыщенного пара. Вдоль самой кривой жидкость и насыщенный пар существуют одновременно, т. е. каждая точка этой кривой соответствует равновесному состоянию между кипящей жидкостью и ее насыщенным паром. Точка этой кривой соответствует самой низкой температуре и дамому низкому давлению, при которых еще может существовать жидкость в равновесии со своим насыщенным паром. Точка называется тройной точкой данного вещества. В этой точке одновременно существуют в равновесии друг с другом все три фазы или агрегатные состояния вещества: твердое, жйдкое и газообразное (насыщенный пар). Для каждого вещества имеются определенные
значения давления и температуры тройной точки. При меньших давлениях могут существовать только твердое и газообразное состояния. Кривая показывает зависимость между давлением и температурой насыщенного пара, находящегося в равновесии с твердой фазой.
Непосредственное испарение твердых тел (называемое «возгонкой», или сублимацией) происходит при температурах, меньших, чем температура тройной точки.
Для многих веществ (металлы и др.) нормальная температура (15° С) значительно ниже температуры их тройных точек. Согласно кривой эти вещества при нормальной температуре имеют очень маленькое давление насыщенных паров. Очевидно, чем больше давление насыщенного пара над поверхностью твердого тела, тем интенсивнее может протекать процесс испарения этих тел. Например, легко испаряется йод, который в своей тройной точке (114° С) имеет давление насыщенных паров, равное 90 мм рт. ст. Высыхание мокрого белья на морозе объясняется тем, что находящаяся в нем вода сначала замерзает, а образующийся лед затем испаряется, так как на морозе температура льда меньше, чем температура тройной точки воды а давление насыщенных водяных паров достигает нескольких миллиметров ртутного столба (при -10° С это давление равно
Заметим, что удельная теплота возгонки, т. е. теплота, необходимая для превращения вещества из твердого состояния непосредственно в газообразное, оказывается равной сумме удельных теплот плавления и парообразования.
Температура тройной точки воды используется как реперная температура термодинамической шкалы Кельвина. Допустим, что идеальное рабочее тело, совершая идеальный цикл Карно, получает теплоту при температуре и отдает теплоту при температуре Измеряя можно, согласно § найти отношение температур Для того чтобы построить температурную шкалу, необходимо придать определенные («реперные») значения. В качестве таких реперных температур можно взять температуры кипения воды и таяния льда при нормальных условиях, приняв их разность за 100° С. Тогда по измеренному отношению и выбранной разности можно определить всю температурную шкалу. Очевидно, реперные точки должны воспроизводиться с очень большой точностью, так как они определяют величину градуса. Поэтому В. Томсон (Кельвин) и независимо от него Д. И. Менделеев предложили создать шкалу с одной реперной температурой, в качестве которой выбрана очень точно воспроизводимая (с ошибкой, не превышающей градуса) тройная точка воды. В Международной системе единиц физических величин дано следующее определение градуса: кельвин - единица температуры по термодинамической температурной шкале, в которой для температуры тройной точки воды установлено значение 273,16° (точно).
Допустим, что число фаз химически однородного вещества, находящихся в равновесии друг с другом, равно трем. Примером может служить система, состоящая из твердой фазы, жидкости и ее пара. Для равновесия необходимо соблюдение трех условий:
j 1 (P,T) =j 2 (P,T),
j 2 (P,T) =j 3 (P,T), (2)
j 3 (P,T) =j 1 (P,T).
Первое есть условие равновесия между жидкостью и ее паром; второе - между жидкостью и твердой фазой; третье - между твердой фазой и паром. Эти три условия не независимы. Каждое из них является следствием двух остальных. Первое уравнение системы (2) изображает на плоскости Т-Р кривую равновесия между газом и жидкостью, т.е. кривую испарения 1-2 на рис. 2. Второе изображает кривую равновесия твердой и жидкой фаз 2-3. Она называется кривой плавления. Кривая плавления пересекается с кривой испарения в точке А, называемой тройной точкой. Через тройную точку должна проходить и кривая возгонки 3-1, т.е. кривая равновесия между твердой и газообразной фазами. Это непосредственно следует из третьего уравнения системы (2).
Таким образом, три фазы могут находиться в равновесии друг с другом в одной точке, а именно в тройной точке, т.е. при вполне определенных значениях температуры и давления.
Рис.2 Диаграмма состояний трех фаз вещества
Для воды тройная точка лежит примерно на 0.008 0 С выше точки плавления при нормальном атмосферном давлении. Давление в тройной точке составляет около 4.58 мм. рт. ст. Тройная точка воды является основной реперной точкой при построении абсолютной термодинамической шкалы температур Кельвина, а также практической международной шкалы температур Цельсия.
Кривые испарения, плавления и возгонки делят плоскость Т-Р на три области (рис. 2). Точкам области 1 соответствует газообразное, области 2 - жидкое, области 3 - твердое состояние вещества. Плоскость Т-Р с указанными тремя кривыми равновесия называется диаграммой состояний.
Диаграмма состояний позволяет судить, какие будут происходить фазовые превращения при том или ином процессе. Допустим, например, что производится нагревание при постоянном давлении. На диаграмме состояний такой процесс представляется горизонтальной прямой. Если эта прямая проходит выше тройной точки, то в точке B (рис.2) она пересекает кривую плавления, а в точке С - кривую испарения. Значит, при нагревании твердое тело сначала расплавится, а затем жидкость испарится.
В случае четырех фаз для равновесия необходимо выполнение шести уравнений типа (2), из которых, однако, независимы только три. Геометрически задача сводится к нахождению общей точки пересечения трех кривых равновесия фаз. Но три кривые пересекаются, вообще говоря, в трех, а не в одной точке. Пересечение в одной точке является исключительным случаем, с которым практически можно не считаться. Физически это означает, что четыре и большее число фаз химически однородного вещества не могут находиться в равновесии между собой ни при каких давлениях и температурах. Максимальное число фаз, находящихся в равновесии друг с другом, не может превышать трех.
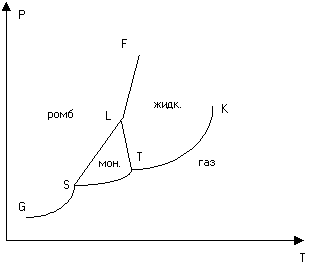
Рис. 3. Диаграмма состояний серы
Если число фаз, в которых может находиться химически однородное вещество при всевозможных значениях температуры и давления, превышает три, то плоскость Т-Р разбивается на ряд областей (рис. 3). Каждая точка плоскости Т-Р, если она не лежит на границе области, изображает однофазное состояние вещества. Области граничат между собой вдоль кривых, каждая из которых является кривой равновесия соответствующих двух фаз. Всякая точка, лежащая на кривой равновесия, изображает двухфазное состояние вещества, причем в этом состоянии фазы могут быть представлены в любых пропорциях. Кривые равновесия фаз могут пересекаться по три в отдельных точках. Это тройные точки, в которых находятся в равновесии три граничащие друг с другом фазы.
В качестве примера на рис. 3 представлена в упрощенном виде диаграмма состояний серы. Сера может существовать в двух кристаллических модификациях - моноклинной и ромбической. В соответствии с этим на диаграмме состояний имеются три тройных точки S, T и L. Область моноклинной модификации ограничена треугольником STL. Область ромбической модификации лежит выше кривой GSLF.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Дайте определение фазы вещества и фазового превращения.
2. Сформулируйте условия равновесия нескольких фаз.
3. Как строится диаграмма фазовых состояний вещества? Рассмотрите фазовую диаграмму для процесса испаарение-конденсация и диаграмму состояний трех фаз вещества.
4. Какое максимальное число фаз может находиться в равновесии друг с другом?
Из предложенных Вам ответов на данный вопрос выберите правильный.
1. Сколько имеется агрегатных состояний вещества?
г) четыре.
2. Какие состояния вещества являются конденсированными?
а) твердое и газообразное,
б) жидкое и газообразное,
в) твердое и жидкое,
г) твердое, жидкое и газообразное.
3.Какова единица измерения термодинамического потенциала в СИ?
а) джоуль,
- (для элемента, представляющего собой разновидность сосуда Дьюара) [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN triple point of waterTPW … Справочник технического переводчика
Тройная точка - воды; p давление; t температура. ТРОЙНАЯ ТОЧКА, состояние равновесного сосуществования трех фаз вещества, обычно твердой, жидкой и газообразной. Температура тройной точки воды (точки сосуществования льда, воды и пара) 0,01°C (273,16 К) при… … Иллюстрированный энциклопедический словарь
Состояние равновесного сосуществования. Тройная точка воды трех фаз вещества, обычно твердой, жидкой и газообразной. Температура тройной точки воды (точки сосуществования льда, воды и пара, рис.) равна 0,01 .С (273,16 К) при давлении 6,1 гПа… … Большой Энциклопедический словарь
Тройная точка - точка на термодинамической диаграмме состояния, соответствующая равновесию трех фаз рассматриваемой термодинамической системы. Например, тройная точка воды соответствует равновесию системы, состоящей из льда, воды и водяного пара. Температуpa… …
ТРОЙНАЯ ТОЧКА - точка на термодинамической диаграмме состояния, соответствующая равновесию трех фаз рассматриваемой термодинамической системы. Например, тройная точка воды соответствует равновесию системы, состоящей из льда, воды и водяного пара. Темпеpaтура… … Металлургический словарь
Состояние равновесного сосуществования трёх фаз вещества, обычно твёрдой, жидкой и газообразной. Температура тройной точки воды (точки сосуществования льда, воды и пара, рис.) равна 0,01°C (273,16 К) при давлении 6,1 гПа (4,58 мм рт. ст.). * * * … Энциклопедический словарь
Типичные виды фазовых диаграмм. Зелёная линия из точек показывает аномальное поведение воды Тройная точка точка на фазовой диаграмме, где сходятся три линии фазовых … Википедия
тройная точка - точка на диаграммы состояния, соответствующая сосуществованию трех фаз вещества. Из правила фаз следует, что у химически индивидуального вещества (однокомпонентная система) при равновесии не может быть больше трех фаз. Эти три… … Энциклопедический словарь по металлургии
В термодинамике, точка на диаграмме состояния, соответствующая равновесному сосуществованию трёх фаз в ва. Из Гиббса правила фаз следует, что химически индивидуальное в во (однокомпонентная система) в равновесии не может иметь больше трёх фаз.… … Физическая энциклопедия
ТРОЙНАЯ ТОЧКА, температура и давление, при которых все три состояния вещества (твердое, жидкое, газообразное) могут существовать одновременно. Для воды тройная точка находится при температуре 273,16 К и давлении 610 Ра … Научно-технический энциклопедический словарь






