Joni su nabijeni atomi i atomske grupe. Pojam ionskih reakcija i naboja jona
Uputstvo
Atom bilo koje supstance sastoji se od elektronske ljuske i jezgra. Jezgro se sastoji od dvije vrste čestica - neutrona i protona. Neutroni nemaju elektricitet naplatiti da, električni naplatiti neutrona je nula. Protoni su pozitivno nabijene čestice i imaju električnu energiju naplatiti jednako +1. Broj protona karakterizira atomski broj datog atoma.
Elektronski omotač atoma sastoji se od elektronskih orbitala koje sadrže različit broj elektrona. Elektron - negativno naelektrisan elementarna čestica. Njen električni naplatiti jednako -1.
Atomi se također mogu povezati s molekulima putem veza.
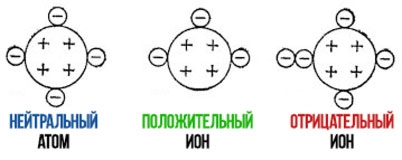
U neutralnom atomu, broj protona je jednak broju elektrona. Stoga je naplatiti jednako nuli.
Kako bi se utvrdilo naplatiti i ona, potrebno je poznavati njegovu strukturu, odnosno broj protona u jezgru i broj elektrona u elektronskim orbitalama.
Ukupno naplatiti i ona dobijeno kao rezultat algebarskog zbrajanja naplatiti s protona i elektrona uključenih u njega. Broj elektrona u jonu može biti veći od broja protona i tada će ion biti negativan. Ako je broj elektrona manji od broja protona, tada će ion biti pozitivan.
Poznavajući hemijski element, koristeći periodni sistem, možemo odrediti njegov atomski broj, koji je jednak broju protona u jezgri atoma ovog elementa (na primjer, 11 za natrij). Ako je jedan od elektrona napustio atom natrija, tada atom natrija više neće imati 11, već 10 elektrona. Atom natrija postaje pozitivno nabijeni ion sa naplatiti ohm Z = 11+(-10) = +1.
Takav ion će biti označen simbolom Na sa plusom na vrhu, u kućištu naplatiti i +2 - dva plusa itd. Shodno tome, za negativan i ona koristi se znak minus.
Atom hemijski element obuhvata jezgra i elektronska školjka. Jezgro je središnji dio atoma, u kojem je koncentrirana gotovo sva njegova masa. Za razliku od elektronske ljuske, jezgro ima pozitivno naplatiti.
Trebaće ti
- Atomski broj hemijskog elementa, Moseleyjev zakon
Uputstvo
Jezgro atoma sastoji se od dvije vrste čestica - protona i neutrona. Neutroni su električno neutralne čestice, odnosno njihove električne naplatiti jednako nuli. Protoni su pozitivno nabijene čestice i njihova električna energija naplatiti je +1.
Na ovaj način, naplatiti jezgra jednak broju protona. Zauzvrat, broj protona u jezgru jednak je atomskom broju hemijskog elementa. Na primjer, atomski broj vodonika je 1, to jest, jezgro vodika se sastoji od jednog protona naplatiti+1. Atomski broj natrijuma je 11, naplatiti njegov jezgra jednako +11.
U alfa raspadu jezgra njegov atomski broj se smanjuje za dva emisijom alfa čestice ( jezgra atom helijuma). Dakle, broj protona u jezgri koja je pretrpjela alfa raspad je također smanjen za dva.
Beta raspad se može dogoditi u tri razne vrste. U slučaju beta-minus raspada, neutron se pretvara u proton emitujući elektron i antineutrino. Onda naplatiti jezgra povećava za jedan.
U slučaju beta-plus raspada, proton se pretvara u neutron, pozitron i neutrino, naplatiti jezgra smanjuje se za jedan.
U slučaju elektronskog snimanja naplatiti jezgra takođe se smanjuje za jedan.
Napunite jezgra može se odrediti i frekvencijom spektralne linije karakteristično zračenje atoma. Prema Moseleyjevom zakonu: sqrt(v/R) = (Z-S)/n, gdje je v spektralna frekvencija karakterističnog zračenja, R je Rydbergova konstanta, S je screening konstanta, n je glavni kvantni broj.
Dakle, Z = n*sqrt(v/r)+s.
Povezani video zapisi
Izvori:
- Kako se mijenja nuklearni naboj?
naprijed laboratorijski rad, a potrebne vještine i sposobnosti za prepoznavanje hemikalija nisu razvijene. Ili možda unutra hemijska laboratorija naljepnice s nazivima jedinjenja slučajno su oljuštene. Sposobnost ispravne identifikacije hemikalija zbog njihove specifičnosti možda više neće biti potrebna nakon diplomiranja. obrazovne institucije. Ali s druge strane, ovo znanje može biti potrebno i vašem vlastitom djetetu koje će doći po pomoć. Šta mu onda odgovoriti?

Trebaće ti
- Stalak sa epruvetama, reagensima za određivanje supstanci, špiritusom, žicom sa omčom, indikatorima
Uputstvo
Hemijske supstance sastoje se od pozitivno i negativno nabijenih jona, formirajući općenito električno neutralno jedinjenje. Da bi se odredio sastav tvari, potrebno je voditi se kvalitativnim reakcijama na različite joni. I nije ih potrebno naučiti napamet, ali dovoljno je znati da postoje takvi reagensi pomoću kojih možete odrediti gotovo svaki kemijski spoj.
Kiseline. Svim kiselinama je zajedničko to što sadrže vodikov jon. Njegovo prisustvo određuje kisela svojstva. Indikatori se mogu smatrati kvalitativnom reakcijom na ovu grupu tvari, odnosno u kiseloj sredini lakmus postaje crven, a metilnarandžasta postaje ružičasta.
Temelji. Supstance ove grupe mogu se odrediti i pomoću indikatora. Karakterističnu reakciju daje fenolftalein, koji postaje grimiz u alkalnoj sredini. To je zbog prisustva hidroksidnih jona.
Metali. Kako bi se utvrdilo joni metala, za to trebate koristiti alkoholnu lampu ili gorionik. Uzmite bakarnu žicu, napravite petlju prečnika 6-10 mm na jednom kraju i stavite je u plamen. Gotovo odmah ćete vidjeti da je poprimila prekrasnu zelenu boju. Ovo se dešava samo zbog jona bakra. Isti rezultat će se primijetiti ako se žica prvo umoči u bakrene soli (bakar hlorid, bakar nitrat, bakar sulfat), a zatim zapali.
Odrediti prisustvo jona alkalni metali(natrijum i kalijum) i zemnoalkalne (kalcijum i barijum), morate dodati i odgovarajuće rastvore soli u plamen špiritne lampe. Joni natrijuma će obojiti plamen jarko žuto, joni kalcijum - cigla crvena. Joni barija, koji su dio tvari, dat će žuto-zelenu boju, i joni kalijum - ljubičasta.
Za određivanje jona kiselih ostataka postoji niz kvalitativne reakcije. Sulfatni ion se može odrediti odabirom reagensa klorovog jona, što će rezultirati bijelim talogom. Da biste saznali da se u epruveti nalazi karbonatni jon, uzmite bilo koju razrijeđenu kiselinu i na kraju ćete vidjeti šumenje. Dodatno, propuštati rezultirajući ugljični dioksid kroz krečnu vodu, promatrajući zamućenost.
Već smo ukratko razmatrali, u kojoj, zbog male razlike u elektronegativnosti atoma (0,4-2,0), elektronski par nije ravnomjerno raspoređen između njih. Za one koji su zaboravili, podsjećam elektronegativnost je sposobnost atoma da privuče elektrone sebi.

Međutim, ako se elektronegativnost atoma razlikuje za više od 2 prema tablici elektronegativnosti, tada elektronski par u potpunosti prelazi na elektronegativniji atom, i kao rezultat, jonska hemijska veza. Jonska kemijska veza nastaje samo između atoma tipičnih metala (jer lako gube vanjske elektrone) i nemetala (jer imaju visoku elektronegativnost).

pozitivni i negativni joni
Dobar primjer ionske kemijske veze je kuhinjska sol NaCl, koja je prisutna u svakoj kuhinji. Atomi natrija (i općenito svi metali) slabo zadržavaju vanjske elektrone, dok atomi klora, naprotiv, imaju vrlo visoku sposobnost privlačenja elektrona k sebi, odnosno imaju visoku elektronegativnost.
Stoga, tokom formiranja molekule NaCl, svaki atom Na gubi jedan elektron (e-), formirajući pozitivni jon natrijum Na +, a svaki atom Cl, naprotiv, dobija ovaj izgubljeni natrijev elektron, formirajući negativni ion hlor Cl - . Ovo je napisano kao dve reakcije:
- Na → Na + + e - i ½Cl 2 + e - → Cl -
Bilo je potrebno zapisati ½Cl 2 jer se plinoviti klor u prirodi sastoji od dvoatomskih molekula, a ne slobodnih pojedinačni atomi hlor.
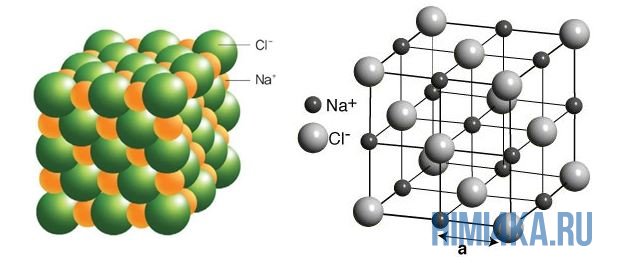
Na gornjoj slici prikazana je kristalna rešetka NaCl, gdje je svaki hloridni jon Cl- okružen sa svih strana susjednim pozitivnim jonima natrijuma Na+; joni natrijuma Na + su takođe okruženi najbližim hloridnim jonima Cl - na isti način. Ovaj raspored jona je veoma stabilan.
Pozitivno nabijeni joni se nazivaju katjoni. To su uglavnom metali, jer lako doniraju od jednog do tri elektrona. Slijede primjeri kationa:

Anioni su nemetali, jer rado vezuju elektrone za sebe, pretvarajući se u negativno nabijene ione. Primjeri aniona:

Naboj jednostavnog, jednoatomnog jona, kao što je Mg 2+ ili F 2- , naziva se njegovo oksidaciono stanje. Oksidacijsko stanje- ovo je broj elektrona koji se moraju dodati (reducirati) jonu ili oduzeti (oksidirati) od njega tako da se on ponovo pretvori u neutralni atom.
- Reakcija oporavka: Mg 2+ + 2e - → Mg
- Reakcija oksidacije: F 2- → F + 2e -
Proces vezivanja elektrona na atom ili jednostavnog pomicanja prema datom atomu naziva se reakcija redukcije, a povlačenje elektrona iz atoma ili njihovo potpuno uklanjanje naziva se reakcija oksidacije. Evo sjajne varalice sa oksidacijskim stanjima jednostavnih jona:

Primjer 12.
Da li se klor oksidira ili reducira kada se formira kloridni ion? Koje je oksidaciono stanje ovog jona?
Rješenje: Klor se reducira jer jedan elektron mora biti vezan za svaki atom hlora da bi se formirao hloridni jon. Hloridni jon, Cl-, ima oksidaciono stanje od -1.
Primjer 13
Da li se metali oksidiraju ili reduciraju kada formiraju ione? Koje je oksidaciono stanje jona aluminijuma?
Rješenje: Kada se formiraju ioni metala, potonji se oksidiraju, jer se u ovom slučaju elektroni uklanjaju iz atoma metala. Aluminijumski jon, Al 3+, ima oksidaciono stanje +3.
Valencija hemijskih elemenata
Valency naziva se broj hemijskih veza koje dati atom formira sa drugim atomima u molekulu. Međutim, ako se govori jednostavnim riječima, tada se valencija smatra istim oksidacijskim stanjem, ali za razliku od njega, valencija nema predznak i nije jednaka nuli.
Naziv jona
Metalni joni koji imaju različita (varijabilna) oksidaciona stanja zapisuju se na sledeći način:
- Fe 2+ gvožđe(II) ili fero jon
- Fe 3+ gvožđe(III) ili feri jon
- Cu + bakar(I) ili monovalentni ion bakra
- Cu 2+ bakar (II) ili dvovalentni ion bakra
- Sn 2+ kalaj(II) ili dvovalentni kalaj
- Sn 4+ kalaj (IV) ili tetravalentni jon kalaja
Primjer 2: Do oksidacije ili redukcije dolazi kada se feri jon pretvori u ion željeza? Zapišite jednačinu za ovaj proces.
Rješenje: Jednačina reakcije ima sljedeći oblik: Fe 3+ + e - → Fe 2+. To je proces redukcije, budući da je elektron vezan za originalni ion.
Nadam se da je lekcija 6 "" bila razumljiva i korisna za vas. Ako imate bilo kakvih pitanja, napišite ih u komentarima. Ako nema pitanja, idite na lekciju 7 "".
Informativan video na temu
Termin "jon" je prvi put uveden 1834. godine, a zaslužan je Michael Faraday. Nakon proučavanja uticaja električne struje na rastvore soli, alkalija i kiselina, došao je do zaključka da one sadrže čestice koje imaju određeni naboj. Faraday je katione nazvao jonima koji su se u električnom polju kretali do katode, koja ima negativan naboj. Anioni su negativno nabijene neelementarne jonske čestice koje se kreću u električnom polju prema plus - anodi.
Ova terminologija se i danas koristi, a čestice se dalje proučavaju, što nam omogućava da smatramo da je hemijska reakcija rezultat elektrostatičke interakcije. Mnoge reakcije se odvijaju po ovom principu, što je omogućilo razumijevanje njihovog toka i odabir katalizatora i inhibitora koji će ubrzati njihov tok i inhibirati sintezu. Takođe je postalo poznato da su mnoge supstance, posebno u rastvorima, uvek u obliku jona.
Nomenklatura i klasifikacija jona
Joni su nabijeni atomi ili grupa atoma koja u toku hemijska reakcija izgubljeni ili stečeni elektroni. Oni čine vanjske slojeve atoma i mogu se izgubiti zbog niske privlačne sile jezgra. Tada je rezultat odvajanja elektrona pozitivan ion. Također, ako atom ima jak nuklearni naboj i usku elektronsku ljusku, jezgro je akceptor dodatnih elektrona. Kao rezultat, formira se negativna ionska čestica.
Ioni sami po sebi nisu samo atomi sa viškom ili nedostatkom elektronska školjka. To može biti i grupa atoma. U prirodi najčešće postoje grupni joni koji su prisutni u rastvorima, biološkim tečnostima tela organizama i u morska voda. Postoji ogroman broj vrsta jona, čija su imena prilično tradicionalna. Kationi su pozitivno nabijeni ioni, a negativno nabijeni ioni su anioni. U zavisnosti od sastava, nazivaju se različito. Na primjer, natrijum kation, cezijev kation i drugi. Anioni se nazivaju drugačije, jer se najčešće sastoje od mnogo atoma: sulfatni anion, ortofosfatni anion i drugi.
Mehanizam stvaranja jona
Hemijski elementi u spojevima rijetko su električno neutralni. To jest, oni gotovo nikada nisu u stanju atoma. U formiranju kovalentne veze, koja se smatra najčešćom, atomi također imaju određeni naboj, a gustoća elektrona se pomjera duž veza unutar molekula. Međutim, ovdje se ne formira naboj jona, jer energija kovalentna veza manja od energije jonizacije. Stoga, unatoč različitoj elektronegativnosti, neki atomi ne mogu u potpunosti privući elektrone vanjskog sloja drugih.
U ionskim reakcijama, gdje je razlika u elektronegativnosti između atoma dovoljno velika, jedan atom može uzeti elektrone iz vanjskog sloja od drugog atoma. Tada je stvorena veza snažno polarizirana i prekinuta. Energija koja se na to troši, a koja stvara naboj jona, naziva se energija ionizacije. Za svaki atom je različit i naznačen je u standardnim tabelama.

Ionizacija je moguća samo kada je atom ili grupa atoma sposobna ili donirati elektrone ili ih prihvatiti. To se najčešće opaža u kristalima rastvora i soli. Kristalna rešetka također sadrži gotovo nepokretne nabijene čestice, lišene kinetičke energije. A kako u kristalu nema mogućnosti kretanja, reakcija iona se najčešće odvija u rastvorima.
Joni u fizici i hemiji
Fizičari i hemičari aktivno proučavaju jone iz nekoliko razloga. Prvo, ove čestice su prisutne u svim poznatim agregatnim stanjima materije. Drugo, energija odvajanja elektrona od atoma može se izmjeriti kako bi se koristila u praktičnim aktivnostima. Treće, joni se ponašaju drugačije u kristalima i rastvorima. I četvrto, joni omogućavaju provođenje struja, a fizičko-hemijska svojstva rastvora variraju u zavisnosti od koncentracije jona.
Jonske reakcije u rastvoru
Same otopine i kristale treba detaljnije razmotriti. U kristalima soli nalaze se zasebno pozitivni joni, na primjer, kationi natrija i negativni, klorni anioni. Struktura kristala je nevjerovatna: zbog sila elektrostatičkog privlačenja i odbijanja, joni su orijentirani na poseban način. U slučaju natrijum hlorida, oni formiraju takozvanu dijamantsku kristalnu rešetku. Ovdje je svaki kation natrijuma okružen sa 6 hloridnih anjona. Zauzvrat, svaki hloridni anion okružuje 6 hloridnih anjona. Zbog toga je jednostavna kuhinjska so u hladnim i vruća voda rastvara se skoro istom brzinom.

U rastvoru takođe nema cele molekule natrijum hlorida. Svaki od jona je okružen vodenim dipolima i nasumično se kreće u svojoj debljini. Prisutnost naboja i elektrostatičkih interakcija dovodi do činjenice da se otopine slane vode smrzavaju na temperaturi nešto nižoj od nule, a ključaju na temperaturi iznad 100 stupnjeva. Štaviše, ako su u otopini prisutne druge tvari koje mogu ući hemijska veza, tada se reakcija odvija ne uz sudjelovanje molekula, već iona. Ovo je stvorilo doktrinu o insceniranju hemijske reakcije.
Oni proizvodi koji se dobiju na kraju ne nastaju odmah tokom interakcije, već se postepeno sintetiziraju iz međuproizvoda. Proučavanje jona omogućilo je razumijevanje da se reakcija odvija upravo prema principima elektrostatičkih interakcija. Njihov rezultat je sinteza iona koji elektrostatički stupaju u interakciju s drugim ionima, stvarajući konačni ravnotežni proizvod reakcije.
Sažetak
Čestica kao što je jon je električno nabijen atom ili grupa atoma, koja se dobija gubitkom ili akvizicijom elektrona. Najjednostavniji ion je vodonik: ako izgubi jedan elektron, onda je to samo jezgro sa nabojem od +1. Prouzrokuje kiselu sredinu rastvora i medija, što je važno za funkcionisanje bioloških sistema i organizama.
Joni mogu biti ili pozitivni ili negativnih naboja. Zbog toga u rastvorima svaka čestica ulazi u elektrostatičku interakciju sa vodenim dipolima, što takođe stvara uslove za život i prenos signala ćelijama. Štaviše, jonske tehnologije se dalje razvijaju. Na primjer, stvoreni su jonski motori koji su već opremljeni sa 7 NASA svemirskih misija.






