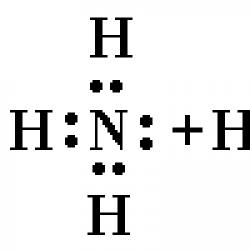Reagira li vodik sa solima? Vodik. Struktura i svojstva vodika. Vodikovi spojevi metala i nemetala. Značajke elektroničke strukture elementa
VISOKA ŠKOLA ZA TEHNOLOGIJU I DIZAJN LAKE INDUSTRIJE U MINSKU
Esej
disciplina: Kemija
Tema: “Vodik i njegovi spojevi”
Pripremio: Student 1. godine 343 grupe
Viskup Elena
Provjereno: Alyabyeva N.V.
Minsk 2009
Struktura atoma vodika u periodnom sustavu
Oksidacijska stanja
Rasprostranjenost u prirodi
Vodik kao jednostavna tvar
Vodikovi spojevi
Bibliografija
Struktura atoma vodika u periodnom sustavu
Prvi element periodnog sustava (1. period, redni broj 1). Nema potpunu analogiju s drugim kemijskim elementima i ne pripada niti jednoj skupini, stoga se u tablicama uvjetno stavlja u skupinu IA i/ili skupinu VIIA.
Atom vodika je najmanji i najlakši od atoma svih elemenata. Elektronska formula atoma je 1s 1. Uobičajeni oblik postojanja elementa u slobodnom stanju je dvoatomna molekula.
Oksidacijska stanja
Atom vodika u spojevima s više elektronegativnih elemenata pokazuje oksidacijsko stanje +1, na primjer HF, H 2 O, itd. A u spojevima s metalnim hidridima, oksidacijsko stanje atoma vodika je -1, na primjer NaH, CaH 2, itd. Ima vrijednost elektronegativnosti koja je posredna između tipičnih metala i nemetala. Sposoban katalitičke redukcije mnogih organskih spojeva u organskim otapalima kao što su octena kiselina ili alkohol: nezasićene spojeve u zasićene, neke natrijeve spojeve u amonijak ili amine.
Rasprostranjenost u prirodi
Prirodni vodik sastoji se od dva stabilna izotopa - protija 1 H, deuterija 2 H i tricija 3 H. Deuterij se inače označava kao D, a tricij kao T. Moguće su razne kombinacije, npr. NT, HD, TD, H 2, D 2 , T2. Vodik je u prirodi češći u obliku raznih spojeva sa sumporom (H 2 S), kisikom (u obliku vode), ugljikom, dušikom i klorom. Rjeđe u obliku spojeva s fosforom, jodom, bromom i drugim elementima. Ulazi u sastav svih biljnih i životinjskih organizama, nafte, fosilnog ugljena, prirodnog plina, niza minerala i stijena. U slobodnom stanju nalazi se vrlo rijetko u malim količinama - u vulkanskim plinovima i produktima raspadanja organskih ostataka. Vodik je najrasprostranjeniji element u svemiru (oko 75%). Sastavni je dio Sunca i većine zvijezda, kao i planeta Jupitera i Saturna koji se uglavnom sastoje od vodika. Na nekim planetima vodik može postojati u čvrstom obliku.
Vodik kao jednostavna tvar
Molekula vodika sastoji se od dva atoma povezana kovalentnom nepolarnom vezom. Fizička svojstva- plin bez boje i mirisa. Širi se brže od ostalih plinova u prostoru, prolazi kroz male pore, a pri visokim temperaturama relativno lako prodire u čelik i druge materijale. Ima visoku toplinsku vodljivost.
Kemijska svojstva. U normalnom stanju na niskim temperaturama je neaktivan, reagira s fluorom i klorom bez zagrijavanja (u prisutnosti svjetla).
H2 + F2 2HF H2 + Cl 2 hv 2HClAktivnije je u interakciji s nemetalima nego s metalima.
U interakciji s različitim tvarima može pokazivati i oksidirajuća i redukcijska svojstva.
Vodikovi spojevi
Jedan od vodikovih spojeva su halogeni. Nastaju kada se vodik spaja s elementima VIIA skupine. HF, HCl, HBr i HI su bezbojni plinovi, vrlo topljivi u vodi.
Cl2 + H2OHClO + HCl; HClO-klorna vodaBudući da su HBr i HI tipični redukcijski agensi, ne mogu se dobiti reakcijom izmjene poput HCl.
CaF2 + H2SO4 = CaSO4 + 2HF
Voda je najčešći spoj vodika u prirodi.
2H2 + O2 = 2H2O
Nema boju, okus, miris. Vrlo slab elektrolit, ali aktivno reagira s mnogim metalima i nemetalima, bazičnim i kiselim oksidima.
2H2O + 2Na = 2NaOH + H2
H 2 O + BaO = Ba(OH) 2
3H 2 O + P 2 O 5 = 2H 3 PO 4
Teška voda (D 2 O) je izotopska vrsta vode. Topljivost tvari u teškoj vodi znatno je manja nego u običnoj vodi. Teška voda je otrovna jer usporava biološke procese u živim organizmima. Akumulira se u ostatku elektrolize tijekom ponovljene elektrolize vode. Koristi se kao rashladno sredstvo i moderator neutrona u nuklearnim reaktorima.
Hidridi su interakcija vodika s metalima (pri visokim temperaturama) ili nemetalima manje elektronegativnim od vodika.
Si + 2H 2 = SiH 4
Sam vodik otkriven je u prvoj polovici 16. stoljeća. Paracelzus. Godine 1776. G. Cavendish prvi je istražio njegova svojstva, 1783.-1787. A. Lavoisier je pokazao da je vodik dio vode, uključio ga u popis kemijskih elemenata i predložio naziv "vodik".
Bibliografija
1. M.B. Volovich, O.F. Kabardin, R.A. Lidin, L.Yu. Alikberova, V.S. Rokhlov, V.B. Pyatunin, Yu.A. Simagin, S.V. Simonovich/Priručnik za školarce/Moskva “AST-PRESS BOOK” 2003.
2. I.L. Knunyats / Kemijska enciklopedija / Moskva “Sovjetska enciklopedija” 1988.
3. Tj. Shimanovich / Kemija 11 / Minsk “Narodna Asveta” 2008.
4. F. Cotton, J. Wilkinson / Moderna anorganska kemija / Moskva “Mir” 1969.
Vodik H je kemijski element, jedan od najčešćih u našem svemiru. Masa vodika kao elementa u sastavu tvari je 75% ukupnog sadržaja atoma drugih vrsta. Dio je najvažnijeg i vitalnog spoja na planetu – vode. Posebnost vodika također je da je prvi element u periodnom sustavu kemijskih elemenata D. I. Mendeljejeva.
Otkriće i istraživanje
Prvi spomen vodika u spisima Paracelsusa datira iz šesnaestog stoljeća. Ali njegovu izolaciju iz plinske mješavine zraka i proučavanje zapaljivih svojstava proveo je već u sedamnaestom stoljeću znanstvenik Lemery. Vodik je temeljito proučavao engleski kemičar, fizičar i prirodoslovac koji je eksperimentalno dokazao da je masa vodika najmanja u usporedbi s drugim plinovima. U kasnijim fazama razvoja znanosti s njim su radili mnogi znanstvenici, a posebno Lavoisier koji ga je nazvao “roditeljem vode”.
Obilježja po poziciji u PSHE
Element koji otvara periodni sustav D. I. Mendeljejeva je vodik. Fizikalna i kemijska svojstva atoma pokazuju stanovitu dvojnost, budući da se vodik istovremeno svrstava u prvu skupinu, glavnu podskupinu, ako se ponaša kao metal i u procesu kemijske reakcije odaje jedan elektron, a do sedme - u slučaju potpunog popunjavanja valentne ljuske, odnosno prihvaćanja negativne čestice, što ga karakterizira kao sličnog halogenima.

Značajke elektroničke strukture elementa
Svojstva složenih tvari u koje se ubraja i najjednostavnije tvari H2 primarno su određena elektronskom konfiguracijom vodika. Čestica ima jedan elektron sa Z= (-1), koji se okreće u svojoj orbiti oko jezgre koja sadrži jedan proton jedinične mase i pozitivnog naboja (+1). Njegova elektronička konfiguracija zapisana je kao 1s 1, što znači prisutnost jedne negativne čestice u prvoj i jedinoj s-orbitali vodika.
Kada se elektron ukloni ili preda, a atom ovog elementa ima takvo svojstvo da je srodan metalima, dobiva se kation. U biti, vodikov ion je pozitivna elementarna čestica. Stoga se vodik lišen elektrona jednostavno naziva proton.

Fizička svojstva
Da ukratko opišemo vodik, to je bezbojan, slabo topiv plin s relativnom atomskom masom od 2, 14,5 puta lakši od zraka, s temperaturom ukapljivanja od -252,8 stupnjeva Celzijusa.
Iz iskustva možete lako potvrditi da je H 2 najlakši. Da biste to učinili, dovoljno je napuniti tri kuglice različitim tvarima - vodikom, ugljičnim dioksidom, običnim zrakom - i istovremeno ih pustiti iz ruke. Onaj ispunjen CO 2 najbrže će stići do tla, za njim će se onaj napuhan smjesom zraka spustiti, a onaj koji sadrži H 2 dići će se do stropa.
Mala masa i veličina čestica vodika opravdavaju njegovu sposobnost prodiranja u različite tvari. Na primjeru iste lopte to je lako provjeriti; nakon nekoliko dana ona će se sama ispuhati, jer će plin jednostavno proći kroz gumu. Vodik se također može akumulirati u strukturi nekih metala (paladija ili platine), te ispariti iz nje kada temperatura poraste.
Svojstvo niske topljivosti vodika koristi se u laboratorijskoj praksi za njegovu izolaciju istiskivanjem vodika (donja tablica sadrži glavne parametre) kako bi se odredio opseg njegove primjene i metode proizvodnje.
| Parametar atoma ili molekule jednostavne tvari | Značenje |
| Atomska masa (molarna masa) | 1,008 g/mol |
| Elektronička konfiguracija | 1s 1 |
| Kristalna ćelija | Heksagonalni |
| Toplinska vodljivost | (300 K) 0,1815 W/(m K) |
| Gustoća na n. u. | 0,08987 g/l |
| Temperatura vrenja | -252,76 °C |
| Specifična toplina izgaranja | 120,9 106 J/kg |
| Temperatura topljenja | -259,2 °C |
| Topivost u vodi | 18,8 ml/l |
Izotopni sastav
Kao i mnogi drugi predstavnici periodnog sustava kemijskih elemenata, vodik ima nekoliko prirodnih izotopa, odnosno atoma s istim brojem protona u jezgri, ali različitim brojem neutrona - čestica s nultim nabojem i jediničnom masom. Primjeri atoma sa sličnim svojstvom su kisik, ugljik, klor, brom i drugi, uključujući radioaktivne.
Fizička svojstva vodika 1H, najčešćeg predstavnika ove skupine, značajno se razlikuju od istih karakteristika njegovih kolega. Osobito se razlikuju karakteristike tvari koje sadrže. Dakle, postoji obična i deuterirana voda, koja umjesto atoma vodika s jednim protonom sadrži deuterij 2 H - njegov izotop s dvije elementarne čestice: pozitivnom i nenabijenom. Ovaj je izotop dvostruko teži od običnog vodika, što objašnjava dramatičnu razliku u svojstvima spojeva koje čine. U prirodi se deuterij nalazi 3200 puta rjeđe od vodika. Treći predstavnik je tricij 3H, koji u svojoj jezgri ima dva neutrona i jedan proton.

Metode proizvodnje i izolacije
Laboratorijske i industrijske metode dosta se razlikuju. Dakle, plin se proizvodi u malim količinama uglavnom reakcijama koje uključuju mineralne tvari, dok se u proizvodnji velikih razmjera u većoj mjeri koristi organska sinteza.
U laboratoriju se koriste sljedeće kemijske interakcije:

U industrijske svrhe plin se proizvodi sljedećim metodama:
- Toplinska razgradnja metana u prisutnosti katalizatora na njegove sastavne jednostavne tvari (vrijednost takvog pokazatelja kao što je temperatura doseže 350 stupnjeva) - vodik H2 i ugljik C.
- Prolazak zaparene vode kroz koks na 1000 stupnjeva Celzijusa da se dobije ugljični dioksid CO 2 i H 2 (najčešća metoda).
- Pretvorba plina metana na katalizatoru od nikla na temperaturama koje dosežu 800 stupnjeva.
- Vodik je nusproizvod elektrolize vodenih otopina kalijevih ili natrijevih klorida.
Kemijske interakcije: opće odredbe
Fizikalna svojstva vodika uvelike objašnjavaju njegovo ponašanje u reakcijskim procesima s određenim spojem. Valencija vodika je 1, budući da se nalazi u prvoj skupini u periodnom sustavu, a stupanj oksidacije varira. U svim spojevima, osim hidrida, vodik u d.o. = (1+), u molekulama tipa CN, CN 2, CN 3 - (1-).
Molekula plinovitog vodika, nastala stvaranjem generaliziranog elektronskog para, sastoji se od dva atoma i energetski je prilično stabilna, zbog čega je u normalnim uvjetima donekle inertna i reagira kada se normalni uvjeti promijene. Ovisno o stupnju oksidacije vodika u sastavu drugih tvari, on može djelovati i kao oksidacijsko sredstvo i kao redukcijsko sredstvo.

Tvari s kojima vodik reagira i nastaje
Interakcije elemenata za stvaranje složenih tvari (često na povišenim temperaturama):
- Alkalijski i zemnoalkalijski metal + vodik = hidrid.
- Halogen + H 2 = halogenovodik.
- Sumpor + vodik = sumporovodik.
- Kisik + H 2 = voda.
- Ugljik + vodik = metan.
- Dušik + H 2 = amonijak.
Interakcija sa složenim tvarima:
- Proizvodnja sinteznog plina iz ugljičnog monoksida i vodika.
- Redukcija metala iz njihovih oksida pomoću H2.
- Zasićenje nezasićenih alifatskih ugljikovodika vodikom.
Vodikova veza
Fizikalna svojstva vodika su takva da mu dopuštaju da, kada je u kombinaciji s elektronegativnim elementom, tvori posebnu vrstu veze s istim atomom iz susjednih molekula koje imaju usamljene elektronske parove (na primjer, kisik, dušik i fluor). Najjasniji primjer u kojem je bolje razmotriti ovaj fenomen je voda. Može se reći da je spojen vodikovim vezama, koje su slabije od kovalentnih ili ionskih, ali zbog toga što ih ima mnogo, značajno utječu na svojstva tvari. U osnovi, vodikova veza je elektrostatska interakcija koja veže molekule vode u dimere i polimere, što dovodi do njezine visoke točke vrenja.
Vodik u mineralnim spojevima
Svi sadrže proton, kation atoma kao što je vodik. Tvar čiji kiselinski ostatak ima oksidacijsko stanje veće od (-1) naziva se polibazičnim spojem. Sadrži nekoliko atoma vodika, što disocijaciju u vodenim otopinama čini višestupanjskom. Svaki sljedeći proton postaje sve teže ukloniti iz kiselinskog ostatka. Kiselost medija određena je kvantitativnim sadržajem vodika u mediju.

Primjena u ljudskim djelatnostima
Cilindri s tvari, kao i spremnici s drugim ukapljenim plinovima, poput kisika, imaju specifičan izgled. Obojeni su tamnozelenom bojom s riječju "Hidrogen" ispisanom jarko crvenom bojom. Plin se upumpava u cilindar pod tlakom od oko 150 atmosfera. Fizička svojstva vodika, posebice lakoća plinovitog agregatnog stanja, koriste se za punjenje balona, balona i sl. njime pomiješanim s helijem.
Vodik, čija su fizikalna i kemijska svojstva ljudi naučili koristiti prije mnogo godina, trenutno se koristi u mnogim industrijama. Najveći dio odlazi na proizvodnju amonijaka. Vodik također sudjeluje u (hafnij, germanij, galij, silicij, molibden, volfram, cirkonij i drugi) oksidima, djelujući u reakciji kao redukcijski agens, cijanovodična i klorovodična kiselina, kao i umjetno tekuće gorivo. Prehrambena industrija ga koristi za pretvaranje biljnih ulja u čvrste masti.
Utvrđena su kemijska svojstva i uporaba vodika u različitim procesima hidrogenacije i hidrogenacije masti, ugljena, ugljikovodika, ulja i loživog ulja. Koristi se za izradu dragog kamenja, žarulja sa žarnom niti, kovanje i zavarivanje metalnih proizvoda pod utjecajem plamena kisika i vodika.
Industrijske metode dobivanja jednostavnih tvari ovise o obliku u kojem se odgovarajući element nalazi u prirodi, odnosno što može biti sirovina za njegovu proizvodnju. Dakle, kisik, koji je dostupan u slobodnom stanju, dobiva se fizički - izdvajanjem iz tekućeg zraka. Vodik je gotovo sav u obliku spojeva, pa se za njegovo dobivanje koriste kemijske metode. Posebno se mogu koristiti reakcije razgradnje. Jedan od načina za proizvodnju vodika je razgradnja vode električnom strujom.
Glavna industrijska metoda za proizvodnju vodika je reakcija metana, koji je dio prirodnog plina, s vodom. Provodi se na visokoj temperaturi (lako je provjeriti da pri prolasku metana čak i kroz kipuću vodu ne dolazi do reakcije):
CH 4 + 2H 2 0 = CO 2 + 4H 2 - 165 kJ
U laboratoriju za dobivanje jednostavnih tvari ne koriste nužno prirodne sirovine, već biraju one polazne tvari iz kojih je lakše izolirati traženu tvar. Primjerice, u laboratoriju se kisik ne dobiva iz zraka. Isto vrijedi i za proizvodnju vodika. Jedna od laboratorijskih metoda za dobivanje vodika, koja se ponekad koristi u industriji, je razgradnja vode električnom strujom.
Obično se vodik proizvodi u laboratoriju reakcijom cinka s klorovodičnom kiselinom.
U industriji
1.Elektroliza vodenih otopina soli:
2NaCl + 2H 2 O → H 2 + 2NaOH + Cl 2
2.Prolazak vodene pare preko vrućeg koksa na temperaturama oko 1000°C:
H 2 O + C ⇄ H 2 + CO
3.Od prirodnog plina.
Pretvorba vodene pare: CH 4 + H 2 O ⇄ CO + 3H 2 (1000 °C) Katalitička oksidacija s kisikom: 2CH 4 + O 2 ⇄ 2CO + 4H 2
4. Krekiranje i reforming ugljikovodika tijekom rafiniranja nafte.
U laboratoriju
1.Djelovanje razrijeđenih kiselina na metale. Za izvođenje ove reakcije najčešće se koriste cink i klorovodična kiselina:
Zn + 2HCl → ZnCl 2 + H 2
2.Interakcija kalcija s vodom:
Ca + 2H 2 O → Ca(OH) 2 + H 2
3.Hidroliza hidrida:
NaH + H 2 O → NaOH + H 2
4.Učinak lužina na cink ili aluminij:
2Al + 2NaOH + 6H 2 O → 2Na + 3H 2 Zn + 2KOH + 2H 2 O → K 2 + H 2
5.Korištenje elektrolize. Tijekom elektrolize vodenih otopina lužina ili kiselina na katodi se oslobađa vodik, npr.
2H 3 O + + 2e - → H 2 + 2H 2 O
- Bioreaktor za proizvodnju vodika
Fizička svojstva
Plinoviti vodik može postojati u dva oblika (modifikacije) - u obliku orto - i para-vodika.
U molekuli ortovodika (tt. −259,10 °C, t.k. −252,56 °C) jezgri su spinovi usmjereni identično (paralelno), a kod paravodika (tt. −259,32 °C, t.k. vrelište -252,89 °C) - jedan nasuprot drugom (antiparalelan).
Alotropni oblici vodika mogu se odvojiti adsorpcijom na aktivnom ugljenu pri temperaturi tekućeg dušika. Pri vrlo niskim temperaturama, ravnoteža između ortovodika i paravodika gotovo je potpuno pomaknuta prema potonjem. Na 80 K omjer oblika je približno 1:1. Zagrijavanjem se desorbirani paravodik pretvara u ortovodik sve dok ne nastane smjesa koja je u ravnoteži na sobnoj temperaturi (orto-para: 75:25). Bez katalizatora, transformacija se odvija sporo, što omogućuje proučavanje svojstava pojedinih alotropskih oblika. Molekula vodika je dvoatomna - H₂. Pod normalnim uvjetima, to je plin bez boje, mirisa i okusa. Vodik je najlakši plin, njegova gustoća je mnogo puta manja od gustoće zraka. Očito, što je manja masa molekula, to je veća njihova brzina pri istoj temperaturi. Kao najlakše molekule, molekule vodika se kreću brže od molekula bilo kojeg drugog plina i stoga mogu brže prenositi toplinu s jednog tijela na drugo. Slijedi da vodik ima najveću toplinsku vodljivost među plinovitim tvarima. Njegova toplinska vodljivost približno je sedam puta veća od toplinske vodljivosti zraka.
Kemijska svojstva
Molekule vodika H₂ su prilično jake, a da bi vodik reagirao potrebno je utrošiti mnogo energije: H 2 = 2H - 432 kJ Stoga vodik na uobičajenim temperaturama reagira samo s vrlo aktivnim metalima, na primjer kalcijem, pri čemu nastaje kalcij. hidrid: Ca + H 2 = CaH 2 i s jedinim nemetalom - fluorom, tvoreći fluorovodik: F 2 + H 2 = 2HF S većinom metala i nemetala vodik reagira na povišenim temperaturama ili pod drugim utjecajima, npr. , rasvjeta. Može “oduzeti” kisik nekim oksidima, na primjer: CuO + H 2 = Cu + H 2 0 Napisana jednadžba odražava reakciju redukcije. Reakcije redukcije su procesi u kojima se kisik uklanja iz spoja; Tvari koje oduzimaju kisik nazivaju se reducenti (sami oksidiraju). Nadalje, bit će dana još jedna definicija pojmova "oksidacija" i "redukcija". I ova definicija, povijesno prva, zadržava svoje značenje i danas, posebice u organskoj kemiji. Reakcija redukcije je suprotna reakciji oksidacije. Obje ove reakcije uvijek se odvijaju istovremeno kao jedan proces: kada se jedna tvar oksidira (reducira), redukcija (oksidacija) druge nužno se događa istovremeno.
N 2 + 3H 2 → 2 NH 3
Forme s halogenima vodikovi halogenidi:
F 2 + H 2 → 2 HF, reakcija se odvija eksplozivno u mraku i na bilo kojoj temperaturi, Cl 2 + H 2 → 2 HCl, reakcija se odvija eksplozivno, samo na svjetlu.
Interakcija s čađom pod visokom temperaturom:
C + 2H 2 → CH 4
Interakcija s alkalijskim i zemnoalkalijskim metalima
Vodik se stvara s aktivnim metalima hidridi:
Na + H 2 → 2 NaH Ca + H 2 → CaH 2 Mg + H 2 → MgH 2
Hidridi- čvrste tvari slične soli, lako hidrolizirane:
CaH 2 + 2H 2 O → Ca(OH) 2 + 2H 2
Interakcija s metalnim oksidima (obično d-elementima)
Oksidi se reduciraju u metale:
CuO + H 2 → Cu + H 2 O Fe 2 O 3 + 3H 2 → 2 Fe + 3H 2 O WO 3 + 3H 2 → W + 3H 2 O
Hidrogenacija organskih spojeva
Kada vodik djeluje na nezasićene ugljikovodike u prisutnosti katalizatora nikla i na povišenim temperaturama, dolazi do reakcije hidrogeniranje:
CH 2 =CH 2 + H 2 → CH 3 -CH 3
Vodik reducira aldehide u alkohole:
CH 3 CHO + H 2 → C 2 H 5 OH.
Geokemija vodika
Vodik je glavni građevni materijal svemira. To je najčešći element, a svi elementi nastaju od njega kao rezultat termonuklearnih i nuklearnih reakcija.
Slobodni vodik H2 je relativno rijedak u kopnenim plinovima, ali u obliku vode ima izuzetno važnu ulogu u geokemijskim procesima.
Vodik može biti prisutan u mineralima u obliku amonijevog iona, hidroksilnog iona i kristalne vode.
U atmosferi se kontinuirano proizvodi vodik kao rezultat razgradnje vode sunčevim zračenjem. Migrira u gornju atmosferu i bježi u svemir.
Primjena
- Energija vodika
Za zavarivanje atomskim vodikom koristi se atomski vodik.
U prehrambenoj industriji vodik je registriran kao dodatak hrani E949, poput plina za pakiranje.
Značajke liječenja
Vodik pomiješan sa zrakom stvara eksplozivnu smjesu – takozvani detonirajući plin. Ovaj plin je najeksplozivniji kada je volumni omjer vodika i kisika 2:1, odnosno vodika i zraka približno 2:5, budući da zrak sadrži približno 21% kisika. Vodik također predstavlja opasnost od požara. Tekući vodik može uzrokovati ozbiljne ozebline ako dođe u dodir s kožom.
Eksplozivne koncentracije vodika i kisika javljaju se od 4% do 96% volumena. Kada se pomiješa sa zrakom od 4% do 75(74)% po volumenu.
Upotreba vodika
U kemijskoj industriji vodik se koristi u proizvodnji amonijaka, sapuna i plastike. U prehrambenoj industriji margarin se proizvodi od tekućih biljnih ulja pomoću vodika. Vodik je vrlo lagan i uvijek se diže u zrak. Nekada su se zračni brodovi i baloni punili vodikom. Ali u 30-ima. XX. stoljeća Nekoliko strašnih katastrofa dogodilo se kada su zračni brodovi eksplodirali i izgorjeli. Danas su zračni brodovi napunjeni plinovitim helijem. Vodik se također koristi kao raketno gorivo. Jednog dana vodik bi se mogao široko koristiti kao gorivo za automobile i kamione. Motori na vodik ne zagađuju okoliš i ispuštaju samo vodenu paru (iako sama proizvodnja vodika dovodi do određenog onečišćenja okoliša). Naše Sunce uglavnom je izgrađeno od vodika. Sunčeva toplina i svjetlost rezultat su oslobađanja nuklearne energije iz fuzije jezgri vodika.
Korištenje vodika kao goriva (isplativ)
Najvažnija karakteristika tvari koje se koriste kao gorivo je njihova toplina izgaranja. Iz tečaja opće kemije poznato je da se reakcija između vodika i kisika odvija uz oslobađanje topline. Ako uzmemo 1 mol H 2 (2 g) i 0,5 mol O 2 (16 g) pod standardnim uvjetima i pobudimo reakciju, tada prema jednadžbi
H2 + 0,5 O2 = H2O
nakon završetka reakcije nastaje 1 mol H 2 O (18 g) uz oslobađanje energije od 285,8 kJ/mol (za usporedbu: toplina izgaranja acetilena je 1300 kJ/mol, propana - 2200 kJ/mol) . 1 m³ vodika teži 89,8 g (44,9 mol). Dakle, za proizvodnju 1 m³ vodika bit će utrošeno 12832,4 kJ energije. Uzimajući u obzir da je 1 kWh = 3600 kJ, dobivamo 3,56 kWh električne energije. Poznavajući tarifu za 1 kWh električne energije i cijenu 1 m³ plina, možemo zaključiti da je preporučljivo prijeći na vodikovo gorivo.
Primjerice, eksperimentalni model Honde FCX 3. generacije sa spremnikom vodika od 156 litara (sadrži 3,12 kg vodika pod tlakom od 25 MPa) prijeđe 355 km. Prema tome, iz 3,12 kg H2 dobiva se 123,8 kWh. Na 100 km potrošnja energije iznosit će 36,97 kWh. Poznavajući cijenu električne energije, cijenu plina ili benzina i njihovu potrošnju za automobil na 100 km, lako je izračunati negativan ekonomski učinak prelaska automobila na vodikovo gorivo. Recimo (Rusija 2008), 10 centi po kWh električne energije dovodi do činjenice da 1 m³ vodika dovodi do cijene od 35,6 centi, a uzimajući u obzir učinkovitost razgradnje vode od 40-45 centi, ista količina kWh od izgaranja benzina košta 12832,4 kJ/42000 kJ/0,7 kg/l*80 centi/l=34 centa po maloprodajnim cijenama, dok smo za vodik izračunali idealnu opciju, ne uzimajući u obzir transport, amortizaciju opreme itd. Za metan s energije izgaranja od oko 39 MJ po m³ rezultat će biti dva do četiri puta niži zbog razlike u cijeni (1 m³ za Ukrajinu košta 179 USD, a za Europu 350 USD). Odnosno, ekvivalentna količina metana koštat će 10-20 centi.
No, ne treba zaboraviti da spaljivanjem vodika dobivamo čistu vodu iz koje je on izdvojen. Odnosno, imamo obnovljivi tvrdica energije bez štete za okoliš, za razliku od plina ili benzina koji su primarni izvori energije.
Php na liniji 377 Upozorenje: zahtijeva (http://www..php): nije uspjelo otvoriti stream: nije moguće pronaći odgovarajući omot u /hsphere/local/home/winexins/site/tab/vodorod.php na liniji 377 Fatalno pogreška: require(): Neuspješno otvaranje zahtijeva "http://www..php" (include_path="..php na liniji 377
Predavanje 29
Vodik. Voda
Okvirni sadržaj predavanja:
Voda. Kemijska i fizikalna svojstva
Uloga vodika i vode u prirodi
Vodik kao kemijski element
Vodik je jedini element periodnog sustava D. I. Mendelejeva, čiji je položaj dvosmislen. Njegov kemijski simbol dvaput je zapisan u periodnom sustavu: u IA i VIIA skupini. To se objašnjava činjenicom da vodik ima niz svojstava koja ga povezuju s alkalijskim metalima i halogenima (tablica 14).
Tablica 14
Usporedba svojstava vodika sa svojstvima alkalnih metala i halogena
| Sličnosti s alkalijskim metalima | Sličnost s halogenima |
| Na vanjskoj energetskoj razini atomi vodika sadrže jedan elektron. Vodik je s element | Prije završetka vanjske i jedine razine, atomima vodika, kao i atomima halogena, nedostaje jedan elektron |
| Vodik pokazuje redukcijska svojstva. Kao rezultat oksidacije, vodik dobiva oksidacijsko stanje koje se najčešće nalazi u njegovim spojevima +1 | Vodik, kao i halogeni, u spojevima s alkalijskim i zemnoalkalijskim metalima ima oksidacijsko stanje -1, što potvrđuje njegova oksidacijska svojstva. |
| Pretpostavlja se da čvrsti vodik s metalnom kristalnom rešetkom postoji u svemiru. | Poput fluora i klora, vodik je plin u normalnim uvjetima. Njegove su molekule, kao i molekule halogena, dvoatomne i formirane kovalentnom nepolarnom vezom |
U prirodi vodik postoji u obliku tri izotopa masenih brojeva 1, 2 i 3: protij 1 1 H, deuterij 2 1 D i tricij 3 1 T. Prva dva su stabilni izotopi, a treći je radioaktivan. U prirodnoj mješavini izotopa prevladava protij. Kvantitativni omjeri između izotopa H: D: T su 1: 1,46 10 -5: 4,00 10 -15.
Spojevi izotopa vodika međusobno se razlikuju po svojstvima. Na primjer, točke ključanja i ledišta lake protijske vode (H 2 O) jednake su – 100 o C i 0 o C, a deuterijske vode (D 2 O) – 101,4 o C i 3,8 o C. Brzina reakcije koja uključuje laka voda je viša od teške vode.
U Svemiru je vodik najčešći element - čini oko 75% mase Svemira ili preko 90% svih njegovih atoma. Vodik je dio vode u njezinoj najvažnijoj geološkoj ljusci Zemlje – hidrosferi.
Vodik tvori, zajedno s ugljikom, sve organske tvari, odnosno dio je žive ljuske Zemlje - biosfere. U zemljinoj kori - litosferi - maseni sadržaj vodika je samo 0,88%, tj. nalazi se na 9. mjestu među svim elementima. Zračni omotač Zemlje – atmosfera sadrži manje od milijuntog dijela ukupnog volumena, koliki je udio molekularnog vodika. Nalazi se samo u gornjim slojevima atmosfere.
Proizvodnja i uporaba vodika
Vodik je u 16. stoljeću prvi dobio srednjovjekovni liječnik i alkemičar Paracelsus, uranjanjem željezne ploče u sumpornu kiselinu, a 1766. engleski kemičar Henry Cavendish dokazao je da vodik ne nastaje samo interakcijom željeza sa sumpornom kiselinom, nego ali i drugi metali s drugim kiselinama. Cavendish je također prvi put opisao svojstva vodika.
U laboratorija uvjetima, vodik se dobiva:
1. Interakcija metala s kiselinom:
Zn + 2HCl → ZnCl 2 + H 2
2. Međudjelovanje alkalnih i zemnoalkalijskih metala s vodom
2Na + 2H 2 O → 2NaOH + H 2
Ca + 2H 2 O → Ca(OH) 2 + H 2
U industrija Vodik se dobiva na sljedeće načine:
1. Elektroliza vodenih otopina soli, kiselina i lužina. Najčešće korištena otopina je kuhinjska sol:
2NaCl + 2H2O →el. struja H 2 + Cl 2 + NaOH
2. Redukcija vodene pare vrućim koksom:
C + H 2 O → t CO + H 2
Dobivena smjesa ugljičnog monoksida i vodika naziva se vodeni plin (sintetski plin), i široko se koristi za sintezu raznih kemijskih proizvoda (amonijak, metanol, itd.). Za odvajanje vodika od vodenog plina, ugljični monoksid se pretvara u ugljični dioksid kada se zagrijava vodenom parom:
CO + H 2 → t CO 2 + H 2
3. Grijanje metana u prisutnosti vodene pare i kisika. Ova metoda je trenutno glavna:
2CH 4 + O 2 + 2H 2 O → t 2CO 2 + 6H 2
Vodik se široko koristi za:
1. industrijska sinteza amonijaka i klorovodika;
2. dobivanje metanola i sintetičkog tekućeg goriva u sklopu sinteznog plina (2 volumena vodika i 1 volumen CO);
3. hidroobrada i hidrokreking frakcija nafte;
4. hidrogenizacija tekućih masti;
5. rezanje i zavarivanje metala;
6. dobivanje volframa, molibdena i renija iz njihovih oksida;
7. svemirski motori kao gorivo.
8. U termonuklearnim reaktorima izotopi vodika se koriste kao gorivo.
Fizikalna i kemijska svojstva vodika
Vodik je plin bez boje, okusa i mirisa. Gustoća na br. 0,09 g/l (14 puta lakši od zraka). Vodik je slabo topljiv u vodi (samo 2 volumena plina na 100 volumena vode), ali ga dobro apsorbiraju d-metali - nikal, platina, paladij (u jednom volumenu paladija otopljeno je do 900 volumena vodika).
U kemijskim reakcijama vodik pokazuje i redukcijska i oksidacijska svojstva. Najčešće vodik djeluje kao redukcijsko sredstvo.
1. Interakcija s nemetalima. Vodik tvori hlapljive vodikove spojeve s nemetalima (vidi predavanje 25).
S halogenima brzina reakcije i uvjeti variraju od fluora do joda: s fluorom, vodik reagira eksplozivno čak iu mraku, s klorom reakcija teče sasvim mirno uz malo zračenja svjetlom, s bromom i jodom reakcije su reverzibilne i događaju se samo kada se zagriju:
H 2 + F 2 → 2HF
H 2 + Cl 2 → hν 2HCl
H 2 + I 2 → t 2HI
S kisikom i sumpor vodik reagiraju uz lagano zagrijavanje. Smjesa kisika i vodika u omjeru 1:2 naziva se eksplozivan plin:
H 2 + O 2 → t H 2 O
H 2 + S → t H 2 S
S dušikom, fosforom i ugljikom reakcija se odvija pod toplinom, povišenim tlakom iu prisutnosti katalizatora. Reakcije su reverzibilne:
3H 2 + N 2 → kat., p, t2NH 3
2H 2 + 3P → kat., p, t3PH 3
H 2 + C → kat., p, t CH 4
2. Interakcija sa složenim tvarima. Na visokim temperaturama vodik reducira metale iz njihovih oksida:
CuO + H 2 → t Cu + H 2 O
3. Na interakcija s alkalijskim i zemnoalkalijskim metalima Vodik pokazuje oksidacijska svojstva:
2Na + H 2 → 2NaH
Ca + H 2 → CaH 2
4. Interakcija s organskim tvarima. Vodik aktivno komunicira s mnogim organskim tvarima; takve se reakcije nazivaju reakcijama hidrogenacije. O takvim reakcijama bit će detaljnije riječi u III. dijelu zbornika “Organska kemija”.
Tekućina
Vodik(lat. Hidrogenij; označen simbolom H) je prvi element periodnog sustava elemenata. Široko rasprostranjen u prirodi. Kation (i jezgra) najčešćeg izotopa vodika, 1H, je proton. Svojstva jezgre 1H omogućuju široku primjenu NMR spektroskopije u analizi organskih tvari.
Tri izotopa vodika imaju svoja imena: 1H - protij (H), 2H - deuterij (D) i 3H - tricij (radioaktivni) (T).
Jednostavna tvar vodik - H 2 - je lagani bezbojni plin. Kada se pomiješa sa zrakom ili kisikom, zapaljiv je i eksplozivan. Netoksičan. Topljiv u etanolu i nizu metala: željezo, nikal, paladij, platina.
Priča
Oslobađanje zapaljivog plina tijekom interakcije kiselina i metala uočeno je u 16. i 17. stoljeću u zoru formiranja kemije kao znanosti. Mihail Vasiljevič Lomonosov također je izravno ukazivao na njegovu izoliranost, ali je već tada bio definitivno svjestan da se ne radi o flogistonu. Engleski fizičar i kemičar Henry Cavendish ispitivao je ovaj plin 1766. godine i nazvao ga "zapaljivim zrakom". Kada je sagorijevao, "zapaljivi zrak" proizvodio je vodu, ali Cavendishovo pridržavanje teorije o flogistonu spriječilo ga je da donese točne zaključke. Francuski kemičar Antoine Lavoisier, zajedno s inženjerom J. Meunierom, pomoću posebnih gasometara, 1783. godine izvodi sintezu vode, a potom i njezinu analizu, razlažući vodenu paru vrućim željezom. Tako je utvrdio da je “zapaljivi zrak” dio vode i da se iz nje može dobiti.
porijeklo imena
Lavoisier je vodiku dao ime hydrogène - "rađa vodu". Ruski naziv "vodik" predložio je kemičar M. F. Solovjev 1824. godine - po analogiji sa Slomonosovljevim "kisikom".
Prevalencija
Vodik je najrasprostranjeniji element u svemiru. Čini oko 92% svih atoma (8% su atomi helija, udio svih ostalih elemenata zajedno manji je od 0,1%). Dakle, vodik je glavni sastojak zvijezda i međuzvjezdanog plina. U uvjetima zvjezdanih temperatura (npr. površinska temperatura Sunca je ~ 6000 °C) vodik postoji u obliku plazme; u međuzvjezdanom prostoru ovaj element postoji u obliku pojedinačnih molekula, atoma i iona i može tvoriti molekularni oblaci koji se značajno razlikuju po veličini, gustoći i temperaturi.
Zemljina kora i živi organizmi
Maseni udio vodika u zemljinoj kori je 1% – to je deseti najzastupljeniji element. Međutim, njegova uloga u prirodi nije određena masom, već brojem atoma, čiji je udio među ostalim elementima 17% (drugo mjesto nakon kisika, čiji je udio atoma ~ 52%). Stoga je važnost vodika u kemijskim procesima koji se odvijaju na Zemlji gotovo jednako velika kao i kisika. Za razliku od kisika, koji na Zemlji postoji i u vezanom i u slobodnom stanju, gotovo sav vodik na Zemlji je u obliku spojeva; U atmosferi se nalazi samo vrlo mala količina vodika u obliku jednostavne tvari (0,00005% volumena).
Vodik je dio gotovo svih organskih tvari i prisutan je u svim živim stanicama. U živim stanicama vodik čini gotovo 50% broja atoma.
Priznanica
Industrijske metode dobivanja jednostavnih tvari ovise o obliku u kojem se odgovarajući element nalazi u prirodi, odnosno što može biti sirovina za njegovu proizvodnju. Dakle, kisik, koji je dostupan u slobodnom stanju, dobiva se fizički - izdvajanjem iz tekućeg zraka. Vodik je gotovo sav u obliku spojeva, pa se za njegovo dobivanje koriste kemijske metode. Posebno se mogu koristiti reakcije razgradnje. Jedan od načina za proizvodnju vodika je razgradnja vode električnom strujom.
Glavna industrijska metoda za proizvodnju vodika je reakcija metana, koji je dio prirodnog plina, s vodom. Provodi se na visokoj temperaturi (lako je provjeriti da pri prolasku metana čak i kroz kipuću vodu ne dolazi do reakcije):
CH 4 + 2H 2 O = CO 2 + 4H 2 −165 kJ
U laboratoriju za dobivanje jednostavnih tvari ne koriste nužno prirodne sirovine, već biraju one polazne tvari iz kojih je lakše izolirati traženu tvar. Primjerice, u laboratoriju se kisik ne dobiva iz zraka. Isto vrijedi i za proizvodnju vodika. Jedna od laboratorijskih metoda za dobivanje vodika, koja se ponekad koristi u industriji, je razgradnja vode električnom strujom.
Obično se vodik proizvodi u laboratoriju reakcijom cinka s klorovodičnom kiselinom.
U industriji
1. Elektroliza vodenih otopina soli:
2NaCl + 2H 2 O → H 2 + 2NaOH + Cl 2
2. Propuštanje vodene pare preko vrućeg koksa na temperaturi od oko 1000 °C:
H2O+C? H2+CO
3. Iz prirodnog plina.
Steam konverzija:
CH4 + H2O? CO + 3H 2 (1000 °C)
Katalitička oksidacija s kisikom:
2CH4 + O2? 2CO + 4H2
4. Krekiranje i reforming ugljikovodika tijekom rafiniranja nafte.
U laboratoriju
1.Djelovanje razrijeđenih kiselina na metale. Za izvođenje ove reakcije najčešće se koriste cink i razrijeđena klorovodična kiselina:
Zn + 2HCl → ZnCl 2 + H 2
2.Interakcija kalcija s vodom:
Ca + 2H 2 O → Ca(OH) 2 + H 2
3.Hidroliza hidrida:
NaH + H 2 O → NaOH + H 2
4.Učinak lužina na cink ili aluminij:
2Al + 2NaOH + 6H 2 O → 2Na + 3H 2
Zn + 2KOH + 2H 2 O → K 2 + H 2
5.Korištenje elektrolize. Tijekom elektrolize vodenih otopina lužina ili kiselina na katodi se oslobađa vodik, npr.
2H 3 O + + 2e − → H 2 + 2H 2 O
Fizička svojstva
Vodik može postojati u dva oblika (modifikacije) - u obliku orto- i para-vodika. U molekuli ortovodika o-H 2 (t.t. −259,10 °C, t.t. −252,56 °C) nuklearni spinovi usmjereni su identično (paralelno), a za paravodik str-H 2 (talište −259,32 °C, vrelište −252,89 °C) - međusobno nasuprot (antiparalelni). Ravnotežna smjesa o-H2 i str-H 2 pri određenoj temperaturi naziva se ravnotežni vodik e-H2.
Modifikacije vodika mogu se odvojiti adsorpcijom na aktivnom ugljenu pri temperaturi tekućeg dušika. Pri vrlo niskim temperaturama, ravnoteža između ortovodika i paravodika gotovo je potpuno pomaknuta prema potonjem. Na 80 K omjer oblika je približno 1:1. Zagrijavanjem se desorbirani paravodik pretvara u ortovodik sve dok ne nastane smjesa koja je u ravnoteži na sobnoj temperaturi (orto-para: 75:25). Bez katalizatora, transformacija se odvija sporo (u uvjetima međuzvjezdanog medija - s karakterističnim vremenima do kozmoloških), što omogućuje proučavanje svojstava pojedinih modifikacija.
Vodik je najlakši plin, 14,5 puta je lakši od zraka. Očito, što je manja masa molekula, to je veća njihova brzina pri istoj temperaturi. Kao najlakše molekule, molekule vodika se kreću brže od molekula bilo kojeg drugog plina i stoga mogu brže prenositi toplinu s jednog tijela na drugo. Slijedi da vodik ima najveću toplinsku vodljivost među plinovitim tvarima. Njegova toplinska vodljivost približno je sedam puta veća od toplinske vodljivosti zraka.
Molekula vodika je dvoatomna - H2. Pod normalnim uvjetima, to je plin bez boje, mirisa i okusa. Gustoća 0,08987 g/l (n.s.), vrelište −252,76 °C, specifična toplina izgaranja 120,9×10 6 J/kg, slabo topljiv u vodi - 18,8 ml/l. Vodik je visoko topljiv u mnogim metalima (Ni, Pt, Pd, itd.), posebno u paladiju (850 volumena po 1 volumenu Pd). Topljivost vodika u metalima povezana je s njegovom sposobnošću difuzije kroz njih; Difuziju kroz leguru ugljika (na primjer, čelik) ponekad prati razaranje legure zbog interakcije vodika s ugljikom (tzv. dekarbonizacija). Praktički netopljiv u srebru.
Tekući vodik postoji u vrlo uskom temperaturnom području od −252,76 do −259,2 °C. To je bezbojna tekućina, vrlo lagana (gustoća na −253 °C 0,0708 g/cm3) i tekućina (viskoznost na −253 °C 13,8 spuaz). Kritični parametri vodika su vrlo niski: temperatura −240,2 °C i tlak 12,8 atm. To objašnjava poteškoće u ukapljivanju vodika. U tekućem stanju, ravnotežni vodik sastoji se od 99,79% para-H2, 0,21% orto-H2.
Čvrsti vodik, talište −259,2 °C, gustoća 0,0807 g/cm 3 (pri −262 °C) - masa poput snijega, heksagonalni kristali, prostorna skupina P6/mmc, parametri ćelije a=3,75 c=6,12. Pri visokom tlaku vodik prelazi u metalno stanje.
Izotopi
Vodik se javlja u obliku tri izotopa, koji imaju pojedinačne nazive: 1 H - protij (H), 2 H - deuterij (D), 3 H - tricij (radioaktivni) (T).
Procij i deuterij su stabilni izotopi s masenim brojevima 1 i 2. Njihov sadržaj u prirodi je 99,9885 ± 0,0070%, odnosno 0,0115 ± 0,0070%. Ovaj omjer može malo varirati ovisno o izvoru i metodi proizvodnje vodika.
Izotop vodika 3H (tricij) je nestabilan. Njegov poluživot je 12,32 godine. Tricij se prirodno javlja u vrlo malim količinama.
Literatura također pruža podatke o izotopima vodika s masenim brojevima od 4 - 7 i poluživotima od 10 -22 - 10 -23 s.
Prirodni vodik sastoji se od molekula H 2 i HD (deuterijev vodik) u omjeru 3200:1. Sadržaj čistog deuterijevog vodika D 2 je još manji. Omjer koncentracija HD i D 2 je približno 6400:1.
Od svih izotopa kemijskih elemenata fizikalna i kemijska svojstva izotopa vodika najviše se međusobno razlikuju. To je zbog najveće relativne promjene atomskih masa.
|
Temperatura |
Temperatura |
Utrostručiti |
Kritično |
Gustoća |
|
Deuterij i tricij također imaju orto- i para-modifikacije: str-D 2, o-D 2, str-T 2, o-T 2 . Heteroizotop vodika (HD, HT, DT) nema orto- i para-modifikacije.
Kemijska svojstva
Frakcija disociranih molekula vodika
Molekule vodika H2 su prilično jake, a da bi vodik reagirao, mora se potrošiti puno energije:
H 2 = 2H − 432 kJ
Stoga, pri uobičajenim temperaturama, vodik reagira samo s vrlo aktivnim metalima, poput kalcija, tvoreći kalcijev hidrid:
Ca + H 2 = CaH 2
i s jedinim nemetalom - fluorom, tvoreći fluorovodik:
Vodik reagira s većinom metala i nemetala na povišenim temperaturama ili pod drugim utjecajima, na primjer, svjetlom:
O 2 + 2H 2 = 2H 2 O
Može "oduzeti" kisik nekim oksidima, na primjer:
CuO + H 2 = Cu + H 2 O
Napisana jednadžba odražava redukcijska svojstva vodika.
N 2 + 3H 2 → 2NH 3
S halogenima stvara halogenide:
F 2 + H 2 → 2HF, reakcija se odvija eksplozivno u mraku i na bilo kojoj temperaturi,
Cl 2 + H 2 → 2HCl, reakcija se odvija eksplozivno, samo na svjetlu.
Interakcija s čađom pod visokom temperaturom:
C + 2H 2 → CH 4
Interakcija s alkalijskim i zemnoalkalijskim metalima
U interakciji s aktivnim metalima vodik stvara hidride:
2Na + H 2 → 2NaH
Ca + H 2 → CaH 2
Mg + H 2 → MgH 2
Hidridi- čvrste tvari slične soli, lako hidrolizirane:
CaH 2 + 2H 2 O → Ca(OH) 2 + 2H 2
Interakcija s metalnim oksidima (obično d-elementima)
Oksidi se reduciraju u metale:
CuO + H 2 → Cu + H 2 O
Fe 2 O 3 + 3H 2 → 2Fe + 3H 2 O
WO 3 + 3H 2 → W + 3H 2 O
Hidrogenacija organskih spojeva
Molekularni vodik naširoko se koristi u organskoj sintezi za redukciju organskih spojeva. Ti se procesi nazivaju reakcije hidrogenacije. Ove se reakcije provode u prisutnosti katalizatora pri povišenom tlaku i temperaturi. Katalizator može biti ili homogen (npr. Wilkinsonov katalizator) ili heterogen (npr. Raney nikal, paladij na ugljiku).
Tako posebno tijekom katalitičke hidrogenacije nezasićenih spojeva kao što su alkeni i alkini nastaju zasićeni spojevi - alkani.
Geokemija vodika
Slobodni vodik H2 je relativno rijedak u kopnenim plinovima, ali u obliku vode ima izuzetno važnu ulogu u geokemijskim procesima.
Vodik može biti prisutan u mineralima u obliku amonijevog iona, hidroksilnog iona i kristalne vode.
U atmosferi se kontinuirano proizvodi vodik kao rezultat razgradnje vode sunčevim zračenjem. Uz malu masu, molekule vodika imaju veliku brzinu difuzijskog gibanja (blizu je drugoj kozmičkoj brzini) i kada uđu u gornje slojeve atmosfere, mogu letjeti u svemir.
Značajke liječenja
Vodik pomiješan sa zrakom stvara eksplozivnu smjesu – takozvani detonirajući plin. Ovaj plin je najeksplozivniji kada je volumni omjer vodika i kisika 2:1, odnosno vodika i zraka približno 2:5, budući da zrak sadrži približno 21% kisika. Vodik također predstavlja opasnost od požara. Tekući vodik može uzrokovati ozbiljne ozebline ako dođe u dodir s kožom.
Eksplozivne koncentracije vodika i kisika javljaju se od 4% do 96% volumena. Kada se pomiješa sa zrakom od 4% do 75(74)% po volumenu.
Ekonomija
Cijena vodika za velike veleprodajne zalihe kreće se od 2-5 USD po kg.
Primjena
Za zavarivanje atomskim vodikom koristi se atomski vodik.
Kemijska industrija
- U proizvodnji amonijaka, metanola, sapuna i plastike
- U proizvodnji margarina iz tekućih biljnih ulja
- Registriran kao dodatak prehrani E949(plin za pakiranje)
Industrija hrane
Zrakoplovna industrija
Vodik je vrlo lagan i uvijek se diže u zrak. Nekada su se zračni brodovi i baloni punili vodikom. Ali u 30-ima. XX. stoljeća Bilo je nekoliko katastrofa tijekom kojih su zračni brodovi eksplodirali i gorjeli. Danas se zračni brodovi pune helijem, unatoč znatno većoj cijeni.
Gorivo
Vodik se koristi kao raketno gorivo.
U tijeku su istraživanja korištenja vodika kao goriva za automobile i kamione. Motori na vodik ne zagađuju okoliš i ispuštaju samo vodenu paru.
Gorivne ćelije vodik-kisik koriste vodik za izravno pretvaranje energije kemijske reakcije u električnu energiju.
"Tekući vodik"("LH") je tekuće stanje vodika, niske specifične gustoće od 0,07 g/cm³ i kriogenih svojstava s točkom smrzavanja od 14,01 K (−259,14 °C) i vrelištem od 20,28 K (−252,87 °C) ). To je bezbojna tekućina bez mirisa, koja se pomiješana sa zrakom klasificira kao eksplozivna s rasponom zapaljivosti od 4-75%. Omjer spina izomera u tekućem vodiku je: 99,79% - paravodik; 0,21% - ortovodik. Koeficijent širenja vodika pri promjeni agregatnog stanja u plinovito je 848:1 pri 20°C.
Kao i kod svakog drugog plina, ukapljivanje vodika dovodi do smanjenja njegovog volumena. Nakon ukapljivanja, tekuća tekućina se skladišti u toplinski izoliranim spremnicima pod pritiskom. Tekući vodik Tekući vodik, LH2, LH 2) aktivno se koristi u industriji, kao oblik skladištenja plina, iu svemirskoj industriji, kao raketno gorivo.
Priča
Prvu dokumentiranu upotrebu umjetnog hlađenja izveo je engleski znanstvenik William Cullen 1756., Gaspard Monge prvi je dobio tekuće stanje sumporovog oksida 1784., Michael Faraday prvi je dobio ukapljeni amonijak, američki izumitelj Oliver Evans je prvi razvio rashladni kompresor 1805., Jacob Perkins je prvi patentirao rashladni stroj 1834., a John Gorey je prvi patentirao klima uređaj u Sjedinjenim Državama 1851. Werner Siemens predložio je koncept regenerativnog hlađenja 1857., Karl Linde patentirao je opremu za proizvodnju tekućeg zraka korištenjem kaskade "Joule-Thomsonov učinak ekspanzije" i regenerativno hlađenje 1876. Godine 1885. poljski fizičar i kemičar Zygmunt Wroblewski objavio je kritičnu temperaturu vodika od 33 K, kritični tlak od 13,3 atm. i vrelište na 23 K. Vodik je prvi ukapljio James Dewar 1898. pomoću regenerativnog hlađenja i njegovog izuma, Dewarove tikvice. Prvu sintezu stabilnog izomera tekućeg vodika, paravodika, izveli su Paul Harteck i Carl Bonhoeffer 1929. godine.
Spinski izomeri vodika
Vodik na sobnoj temperaturi sastoji se prvenstveno od spinskog izomera, ortovodika. Nakon proizvodnje, tekući vodik je u metastabilnom stanju i mora se pretvoriti u paravodikov oblik kako bi se izbjegla eksplozivna egzotermna reakcija koja se javlja kada se mijenja na niskim temperaturama. Pretvorba u paravodikovu fazu obično se postiže upotrebom katalizatora kao što su željezni oksid, krom oksid, aktivni ugljen, azbest obložen platinom, rijetki zemni metali ili upotrebom aditiva urana ili nikla.
Korištenje
Tekući vodik može se koristiti kao oblik skladištenja goriva za motore s unutarnjim izgaranjem i gorivne ćelije. Razne podmornice (projekti "212A" i "214", Njemačka) i koncepti transporta vodika stvoreni su korištenjem ovog agregatnog oblika vodika (vidi na primjer "DeepC" ili "BMW H2R"). Zbog blizine dizajna, kreatori LHV opreme mogu koristiti ili samo modificirati sustave koji koriste ukapljeni prirodni plin (LNG). Međutim, zbog niže volumetrijske gustoće energije, izgaranje zahtijeva veći volumen vodika od prirodnog plina. Ako se tekući vodik koristi umjesto "CNG-a" u klipnim motorima, obično je potreban glomazniji sustav goriva. S izravnim ubrizgavanjem, povećani gubici u usisnom traktu smanjuju punjenje cilindra.
Tekući vodik također se koristi za hlađenje neutrona u eksperimentima raspršenja neutrona. Mase neutrona i jezgre vodika gotovo su jednake, pa je izmjena energije pri elastičnom sudaru najučinkovitija.
Prednosti
Prednost korištenja vodika je "nula emisija" njegove uporabe. Produkt njegove interakcije sa zrakom je voda.
Prepreke
Jedna litra "ZhV" teži samo 0,07 kg. To jest, njegova specifična težina je 70,99 g/l na 20 K. Tekući vodik zahtijeva tehnologiju kriogenog skladištenja, kao što su posebni toplinski izolirani spremnici i zahtijeva posebno rukovanje, što je tipično za sve kriogene materijale. Po tom pitanju je blizak tekućem kisiku, ali zahtijeva veći oprez zbog opasnosti od požara. Čak i s izoliranim spremnicima, teško ga je držati na niskim temperaturama potrebnim da ostane tekući (obično isparava brzinom od 1% dnevno). Pri rukovanju s njim također morate slijediti uobičajene mjere opreza pri radu s vodikom - dovoljno je hladan da ukapljuje zrak, što je eksplozivno.
Raketno gorivo
Tekući vodik je uobičajena komponenta raketnih goriva koja se koristi za pogon lansirnih vozila i svemirskih letjelica. U većini raketnih motora na tekući vodik prvo se koristi za regenerativno hlađenje mlaznice i ostalih dijelova motora prije nego što se pomiješa s oksidansom i spali za stvaranje potiska. Moderni motori koji koriste komponente H 2 /O 2 troše smjesu goriva pretjerano obogaćenu vodikom, što dovodi do određene količine neizgorenog vodika u ispušnim plinovima. Osim povećanja specifičnog impulsa motora smanjenjem molekularne težine, ovo također smanjuje eroziju mlaznice i komore za izgaranje.
Takve prepreke za korištenje LH u drugim područjima, kao što su kriogena priroda i niska gustoća, također su ograničavajući faktor za upotrebu u ovom slučaju. Od 2009. postoji samo jedna raketa-nosač (nosač Delta-4), koja je u potpunosti raketa na vodik. U osnovi, "ZhV" se koristi ili na gornjim stupnjevima raketa ili na blokovima, koji obavljaju značajan dio posla lansiranja korisnog tereta u svemir u vakuumu. Kao jedna od mjera za povećanje gustoće ove vrste goriva, postoje prijedlozi korištenja muljnog vodika, odnosno polusmrznutog oblika “tekućeg vodika”.