Prezentacija o kemiji "kemijski elementi u vojnim poslovima". Kemija u vojnim poslovima
METALI U VOJNIM POSLOVIMA
Učiteljica kemije Bessudnova Yu.V.
Bakar, br.29 . Tijekom Velikog Domovinskog rata, glavni potrošač bakar postojala je ratna industrija. Legura bakra (90%) i kositra (10%) - metal za oružje. Čahure patrona i topničkih granata obično su žute boje. Izrađene su od mesinga - legure bakra (68%) i cinka (32%). Većina topničkih mjedenih granata koristi se opetovano. Tijekom rata, u svakoj topničkoj diviziji postojala je osoba (obično časnik) odgovorna za pravovremeno prikupljanje istrošenih patrona i njihovo slanje na ponovno punjenje. Visoka otpornost na korozivne učinke slane vode karakteristična je za brodske mjedi. Ovo je mjed s dodatkom kositra.
Molibden, br. 42 . Molibden se naziva “vojnim” metalom, jer se 90% koristi za vojne potrebe. Čelici s dodatkom molibdena (i drugih mikroaditiva) vrlo su čvrsti, od njih se izrađuju cijevi oružja, puške, sačmarice, dijelovi zrakoplova i automobila. Uvođenje molibdena u čelike u kombinaciji s kromom ili volframom neobično povećava njihovu tvrdoću ( oklop tenka).
Srebro, br. 47. Srebro u legurama s indijem služilo je za izradu reflektora (za protuzračnu obranu). Tijekom rata zrcala reflektora pomogla su u otkrivanju neprijatelja u zraku, na moru i kopnu; ponekad su se taktički i strateški problemi rješavali uz pomoć reflektora. Tako su tijekom napada trupa Prvog bjeloruskog fronta na Berlin 143 reflektora golemog otvora zaslijepila naciste u njihovoj obrambenoj zoni, što je pridonijelo brzom ishodu operacije.
Aluminij, br. 13. Aluminij se naziva "krilati" metal, jer se njegove legure s Mg, Mn, Be, Na, Si koriste u konstrukciji zrakoplova. Za proizvodnju zapaljivih i eksplozivnih smjesa korišten je najfiniji aluminijski prah. Punjenje zapaljivih bombi sastojalo se od mješavine praha aluminija, magnezija i željeznog oksida, a živin fulminat služio je kao detonator. Kada je bomba udarila u krov, aktivirao se detonator koji je zapalio zapaljivu smjesu i sve okolo počelo je gorjeti. Zapaljivi zapaljivi sastav ne može se ugasiti vodom, jer vrući magnezij reagira s njim. Stoga je za gašenje požara korišten pijesak.

Titanij ima jedinstvena svojstva: gotovo dvostruko lakši od željeza, samo jedan i pol puta teži od aluminija. Istodobno je jedan i pol puta jači od čelika, topi se na višoj temperaturi i ima visoku otpornost na koroziju. Idealan metal za mlazne zrakoplove.
Magnezij, br. 12. Svojstvo magnezija da gori bijelim, blistavim plamenom naširoko se koristi u vojnoj opremi za proizvodnju rasvjetnih i signalnih raketa, metaka i granata za praćenje i zapaljivih bombi. Metalurzi koriste magnezij za deoksidaciju čelika i legura.
Nikal, br. 28. Kad je Sovjetski tenkovi T-34 pojavio na bojnim poljima, njemački stručnjaci bili su zadivljeni neranjivošću njihovog oklopa. Po nalogu iz Berlina, prvi zarobljeni T-34 isporučen je Njemačkoj. Ovdje su to preuzeli kemičari. Otkrili su da ruski oklop sadrži visok postotak nikla, što ga čini super čvrstim. Tri kvalitete ovog stroja - vatrena moć, brzina, snaga oklopa- morali su se kombinirati na način da nijedan od njih nije žrtvovan drugima. Naši dizajneri, predvođeni M. I. Koshkinom, uspjeli su stvoriti najbolji tenk Drugog svjetskog rata. Kupola tenka vrtjela se rekordnom brzinom: puni krug je napravila za 10 sekundi umjesto uobičajenih 35 sekundi. Zahvaljujući maloj težini i veličini, tenk je bio vrlo pokretljiv. Oklop s visokim sadržajem nikla ne samo da se pokazao najizdržljivijim, već je imao i najpovoljnije kutove nagiba, pa je stoga bio neranjiv.
Vanadij, br. 23 . Vanadij nazvan "automobilski" metal. Vanadijski čelik omogućio je olakšanje automobila, jačanje novih automobila i poboljšanje njihovih voznih performansi. Od ovog čelika izrađuju se vojničke kacige, kacige i oklopne ploče na topovima. Krom-vanadij čelik još je jači. Stoga se počeo naširoko koristiti u vojnoj opremi: za proizvodnju radilica brodskih motora, pojedinačnih dijelova torpeda, zrakoplovnih motora i granata za probijanje oklopa.
Litij, br. 3. Tijekom Velikog Domovinskog rata, litij hidrid je postao strateški. Burno reagira s vodom, oslobađajući veliku količinu vodika, koji se koristi za punjenje balona i opreme za spašavanje tijekom nesreća zrakoplova i brodova na otvorenom moru. Dodatak litijeva hidroksida alkalnim baterijama produžio im je radni vijek za 2-3 puta, što je bilo prijeko potrebno partizanskim odredima. Praćeći meci dopirani litijem ostavljali su plavo-zeleno svjetlo tijekom leta.Wolfram, br.74. Volfram je jedan od najvrjednijih strateških materijala. Volframovi čelici i legure koriste se za izradu oklopa tenkova, školjki za torpeda i granate, najvažnijih dijelova i motora zrakoplova.
Olovo, br. 82. Izumom vatrenog oružja počelo se koristiti mnogo olova za izradu metaka za sačmarice, pištolje i sačmu za topništvo. Olovo je teški metal i ima veliku gustoću. Upravo je ta okolnost uzrokovala masovnu upotrebu olova u vatrenom oružju. Olovni projektili korišteni su u antičko doba: praćkaši Hanibalove vojske bacali su olovne kugle na Rimljane. I sada se meci lijevaju od olova, samo im je čaura napravljena od drugih, tvrđih metala.
Kobalt, br. 27. Kobalt se naziva metal prekrasnih legura (otporan na toplinu, velike brzine). Kobaltni čelik korišten je za izradu magnetskih mina.
Lantan, br.57. Tijekom Drugog svjetskog rata lantanova stakla korištena su u terenskim optičkim instrumentima. Legura lantana, cerija i željeza proizvodi takozvani "kremen", koji se koristio u vojničkim upaljačima. Od njega su napravljene posebne topničke granate koje iskre tijekom leta pri trenju o zrak
Tantal, br. 73. Stručnjaci za vojnu tehnologiju smatraju da je preporučljivo neke dijelove navođenih projektila i mlaznih motora izrađivati od tantala. Tantal je najvažniji strateški metal za proizvodnju radarskih instalacija i radio odašiljača; metalna rekonstruktivna kirurgija.
Disciplina: Kemija i fizika
Vrsta posla: Esej
Tema: Kemikalije u ratovanju
Uvod.
Otrovne tvari.
Anorganske tvari u službi vojske.
Doprinos sovjetskih kemičara pobjedi u Drugom svjetskom ratu.
Zaključak.
Književnost.
Uvod.
Živimo u svijetu različitih tvari. U principu, čovjeku za život nije potrebno mnogo: kisik (zrak), voda, hrana, osnovna odjeća, stanovanje. Međutim
osoba, ovladavajući svijetom oko sebe, stječući sve više znanja o njemu, neprestano mijenja svoj život.
U drugom poluvremenu
stoljeća kemijska je znanost dosegla razinu razvoja koja je omogućila stvaranje novih tvari koje nikada prije nisu postojale u prirodi. Međutim,
Stvaranjem novih tvari koje bi trebale poslužiti za dobro, znanstvenici su stvorili i tvari koje su postale prijetnja čovječanstvu.
O tome sam razmišljao dok sam studirao povijest
svjetskog rata, to sam saznao 1915. god. Nijemci su koristili napade plinom s otrovnim tvarima za pobjedu na francuskoj fronti. Što bi ostale zemlje mogle učiniti?
Prije svega, stvoriti plinsku masku, što je uspješno postigao N.D. Zelinsky. Rekao je: “Izumio sam to ne da napadam, nego da zaštitim mlade živote
patnje i smrti." E, onda su se poput lančane reakcije počele stvarati nove tvari – početak ere kemijskog oružja.
Što mislite o ovome?
S jedne strane, tvari "stoje" za zaštitu zemalja. Više ne možemo zamisliti svoj život bez mnogih kemikalija, jer su one stvorene za dobrobit civilizacije
(plastika, guma, itd.). S druge strane, neke tvari mogu poslužiti za uništavanje, one donose “smrt”.
Svrha mog eseja: proširiti i produbiti znanje o korištenju kemikalija.
Ciljevi: 1) Razmotriti kako se kemikalije koriste u ratovanju.
2) Upoznati doprinos znanstvenika pobjedi u Drugom svjetskom ratu.
Organska tvar
Godine 1920. – 1930. god prijetila je opasnost od izbijanja Drugog svjetskog rata. Velike svjetske sile grozničavo su se naoružavale, ulažući u to najveće napore.
Njemačka i SSSR. Njemački znanstvenici stvorili su novu generaciju otrovnih tvari. Međutim, Hitler se nije usudio započeti kemijski rat, vjerojatno shvaćajući da njegove posljedice za
relativno mala Njemačka i golema Rusija bit će nemjerljive.
Nakon Drugog svjetskog rata utrka u kemijskom naoružanju nastavila se na višoj razini. Razvijene zemlje trenutno ne proizvode kemijsko oružje, ali
Na planetu su se nakupile ogromne rezerve smrtonosnih otrovnih tvari koje predstavljaju ozbiljnu opasnost za prirodu i društvo
Iperit, luizit, sarin, soman,
Plinovi, cijanovodična kiselina, fosgen i drugi proizvod koji je obično prikazan u fontu "
" Pogledajmo ih pobliže.
je bezbojan
tekućina je gotovo bez mirisa, što otežava otkrivanje
znakovi. On
primjenjuje se
u klasu živčanih agenasa. Sarin je namijenjen
prvenstveno za onečišćenje zraka parama i maglom, odnosno kao nestabilan agens. U nekim slučajevima, međutim, može se koristiti u obliku kapaljke za
kontaminacija područja i vojne opreme koja se na njemu nalazi; u ovom slučaju, postojanost sarina može biti: ljeti - nekoliko sati, zimi - nekoliko dana.
djeluje kroz kožu u kapljično-tekućem i parovitom stanju, ne izazivajući nikakve
ovaj lokalni poraz. Stupanj oštećenja sarinom
ovisi o njegovoj koncentraciji u zraku i vremenu provedenom u kontaminiranoj atmosferi.
Kada je izložena sarinu, pogođena osoba osjeća slinjenje, obilno znojenje, povraćanje, vrtoglavicu, gubitak svijesti i napadaje.
teške konvulzije, paralizu i, kao posljedicu teškog trovanja, smrt.
Formula sarina:
b) Soman je tekućina bez boje i gotovo bez mirisa. Odnosi se na
u klasu živčanih agenasa
Svojstva
na tijelu
osoba
oko 10 puta je jači.
Somanova formula:
predstaviti
slabo isparljiv
tekućine
s vrlo visokom temperaturom
kipuće, dakle
trajnost im je višestruko veća
duže od sarina. Poput sarina i somana, klasificirani su kao nervni otrovi. Prema podacima iz inozemnog tiska, V-plinovi u 100 - 1000
puta toksičniji od drugih živčanih agenasa. Vrlo su učinkoviti kada djeluju kroz kožu, posebno u kapljičnom tekućem stanju: kontakt s
ljudska koža male kapi
V-plinovi obično uzrokuju smrt kod ljudi.
d) Iperit je tamnosmeđa uljasta tekućina sa svojstvom
miris koji podsjeća na češnjak ili senf. Spada u klasu sredstava za mjehuriće. Iperit polako isparava
Trajnost na tlu mu je: ljeti od 7 do 14 dana, zimi mjesec i više. Iperit ima višestruki učinak na tijelo:
u kapljično-tekućem i parovitom stanju djeluje na kožu i
para - dišne putove i pluća, unesena s hranom i vodom djeluje na probavne organe. Učinak iperita se ne pojavljuje odmah, već kasnije
neko vrijeme, koje se naziva razdoblje latentnog djelovanja. U dodiru s kožom, kapi iperita se brzo upijaju u nju ne uzrokujući bol. Nakon 4 - 8 sati pojavljuje se na koži
crvenilo i svrbež. Do kraja prvog i početkom drugog dana stvaraju se mali mjehurići, ali
spajaju se
u pojedinačne velike mjehuriće ispunjene jantarnožutom
tekućina koja s vremenom postaje mutna. Pojava
praćen malaksalošću i vrućicom. Nakon 2-3 dana mjehurići probiju i otkriju čireve ispod njih koji dugo ne zacjeljuju.
hitovi
infekcija, zatim dolazi do gnojenja i vrijeme ozdravljenja se produžava na 5 - 6 mjeseci. Organi
su pogođeni
tada se pojavljuju znakovi oštećenja: osjećaj pijeska u očima, fotofobija, suzenje. Bolest može trajati 10 - 15 dana, nakon čega nastupa oporavak. Poraz
probavnih organa nastaje gutanjem kontaminirane hrane i vode
U teškim
trovanje
zatim opća slabost, glavobolja i
slabljenje refleksa; pražnjenje
dobiti neugodan miris. Nakon toga, proces napreduje: opaža se paraliza, pojavljuje se teška slabost
iscrpljenost.
Ako je tijek nepovoljan, smrt nastupa između 3. i 12. dana kao posljedica potpunog gubitka snage i iscrpljenosti.
U slučaju teških ozljeda, obično nije moguće spasiti osobu, a ako je oštećena koža, žrtva gubi radnu sposobnost na duže vrijeme.
Formula senfa:
d) cijanovodik
kiselina - bezbojna
tekućina
osebujnim mirisom koji podsjeća na
u niskim koncentracijama miris se teško razlikuje.
Sinilnaya
isparava
a djelotvoran je samo u parovitom stanju. Odnosi se na opće otrovne agense. Karakteristično
znakovi oštećenja cijanovodičnom kiselinom su: metal
usta, iritacija grla, vrtoglavica, slabost, mučnina. Zatim
pojavljuje se bol...
Podignite datotekuOpćinska državna obrazovna ustanova
"Chkalovskaya srednja škola"
Kemija u vojnoj službi.
Posvećeno Danu pobjede.
Razvoj integriranog
izvannastavna aktivnost
Učitelji kemije i sigurnosti života
MKOU "Chkalovskaya Srednja škola"
Sheveleva V.B.
Lidžijev D.D.
Interaktivni usmeni časopis “Kemija u vojnoj službi”
Posvećeno Danu pobjede.
Ciljevi:
1. Proširiti znanja učenika o kemijskim elementima i tvarima koje se koriste u vojnim poslovima.
2.Razvijati međupredmetno povezivanje, sposobnost rada s različitim izvorima informacija, multimedijske prezentacije.
3. Formiranje međunarodnih osjećaja, osjećaja patriotizma. Popularizacija kemijskih znanja.
Oprema: Računalo, multimedijski projektor.
Plan organizacije pripreme za vođenje usmenog časopisa.
1. Podijelite razred u grupe, zadajte zadatak: pronaći materijal i napraviti prezentaciju:
1. grupa: o kemijskim elementima i tvarima koje se koriste u vojnim poslovima
2. grupa: o kemijskim bojnim agensima, o eksplozivima, o polimerima.
2. Pripremite test ili pitanja na svoju temu za igru za nagradu časopisa - “Najbolji slušatelj”.
Napredak događaja.
Uvodni govor nastavnika o relevantnosti teme.
Kemija u vojnoj službi
Posvećeno Danu pobjede
Slajd br. 2-3 glazba “Sveti rat”.
Vodeći: "Kemija širi svoje ruke u ljudske poslove" - ove riječi M. V. Lomonosova nikada neće izgubiti svoju važnost. Slajd broj 4. U suvremenom društvu, možda, nema grane proizvodnje koja nije na ovaj ili onaj način povezana s ovom znanošću. Kemija je također potrebna onima koji su svoj život posvetili važnoj profesiji, čija je bit obrana domovine.
Materijali usmenog časopisa omogućit će vam da saznate što kemijska znanost daje vojsci.
Slajd broj 6. Stranica 1.
Kemijski elementi u ratovanju
Pred vama je periodni sustav kemijskih elemenata D. I. Mendeljejeva. Mnogi elementi tvore tvari koje se široko koriste u ratovanju.
Slajd broj 7. Element broj 1. Djelovanje vodikove bombe temelji se na energiji termonuklearne reakcije uz sudjelovanje vodikovih izotopa - deuterija i tricija, koja se javlja s stvaranjem helija i oslobađanjem neutrona. Hidrogenska bomba jača je od atomske.
Slajd broj 8. Element br. 2. Cepelini su napunjeni helijem. ispunjeno,
Letjelice punjene helijem, za razliku od onih punjenih vodikom, sigurnije su.
Podmorničari također trebaju helij. Ronioci udišu ukapljeni zrak. Prilikom rada na dubini od 100 m ili više, dušik se počinje otapati u krvi. Pri izranjanju iz velikih dubina brzo se oslobađa, što može dovesti do poremećaja u organizmu. To znači da porast mora biti vrlo spor. Kod zamjene dušika helijem takve pojave se ne događaju. Helijev zrak koriste mornaričke specijalne snage, kojima je glavna stvar brzina i iznenađenje.
Slajd broj 9. Element br. 6. Ugljik je dio organskih tvari koje čine osnovu goriva, maziva, eksploziva i otrovnih tvari. Ugljen je dio baruta i koristi se u plinskim maskama.
Slajd broj 10. Element broj 8. Tekući kisik se koristi kao oksidans goriva za rakete i mlazne zrakoplove. Kada se porozni materijali impregniraju tekućim kisikom, dobiva se snažan eksploziv - oxyliquit.
Slajd broj 11. Element broj 10. Neon je inertni plin koji puni električne svjetiljke. Neonska svjetlost je daleko vidljiva iu magli, zbog čega se neonske svjetiljke koriste u svjetionicima i signalnim instalacijama raznih vrsta.
Slajd broj 12. Element broj 12. Magnezij gori zasljepljujućim bijelim plamenom, oslobađajući veliku količinu topline. Ovo se svojstvo koristi za izradu zapaljivih bombi i baklji. Magnezij je dio ultralakih i čvrstih legura koje se koriste u konstrukciji zrakoplova.
Slajd broj 13. Element broj 13. Aluminij je nezaobilazan metal za proizvodnju lakih i čvrstih legura koje se koriste u zrakoplovnoj i raketnoj proizvodnji.
Slajd broj 14. Element broj 14. Silicij je vrijedan poluvodički materijal, s povećanjem temperature povećava se njegova električna vodljivost, što omogućuje upotrebu silicijskih uređaja na visokim temperaturama.
Slajd broj 15. Element br. 15: Fosfor se koristi za izradu napalma i otrovnih organskih spojeva fosfora.
Slajd broj 16. Element broj 16. Sumpor se od davnina koristio u ratovanju kao zapaljiva tvar, također je dio crnog baruta.
Slajd broj 17. Element broj 17. Klor je dio mnogih otrovnih tvari. Element br. 35. Brom je dio suznih otrovnih tvari - lakrimatora. Element br. 33. Arsen je dio kemijskih bojnih otrova.
Slajd broj 18. Element br. 22. Titan daje čeliku tvrdoću, elastičnost i visoku otpornost na koroziju. Ova svojstva su nezamjenjiva za opremu ratnih brodova i podmornica.
Slajd broj 19. Element br. 23. Vanadijski čelik, elastičan, otporan na abraziju i trganje, otporan na koroziju, koristi se za konstrukcijumali brzi morski brodovi, hidroavioni, jedrilice.
Slajd broj 20. Element broj 24. Krom se koristi u proizvodnji specijalnih čelika, u izradi cijevi za oružje i oklopnih ploča. Čelici koji sadrže više od 10% kroma teško hrđaju i koriste se za izradu trupova podmornica.
Slajd broj 21. Element broj 26. U antici i srednjem vijeku željezo je prikazano u obliku boga rata, Marsa. Tijekom rata željezo se troši u ogromnim količinama u granatama, bombama, minama, granatama i drugim proizvodima. Element br. 53. Jod je dio polaroid naočala kojima su spremnici opremljeni. Takvo staklo omogućuje vozaču da vidi bojno polje, gaseći zasljepljujući odsjaj plamena. Element br. 42. Legure molibdena koriste se za proizvodnju oružja s ultra oštrim oštricama. Dodatak 1,5-2% ovog metala čeliku čini oklopne ploče tenkova neranjivima na granate, a oplatu brodova kemijski otpornom na morsku vodu.
Slajd broj 22. Element broj 29. Bakar je prvi metal koji je čovjek koristio. Od njega su se izrađivali vrhovi kopalja. Kasnije je postao poznat kao metal za oružje: legura od 90% bakra i 10% kositra korištena je za izlijevanje cijevi oružja. A sada je glavni potrošač bakra vojna industrija: dijelovi zrakoplova i brodova, mjedena kućišta, remeni za projektile, električni dijelovi - sve to i još mnogo više se izrađuje od bakra. Element broj 30. Cink, zajedno s bakrom, ulazi u sastav mesinga - legura potrebnih za vojno inženjerstvo. Od njega se izrađuju topničke čahure.
Slajd broj 23. Element br. 82. Izumom vatrenog oružja olovo se počelo u velikim količinama koristiti za izradu metaka za puške i pištolje, te sačme za topništvo. Olovo štiti od štetnog radioaktivnog zračenja.
Slajd broj 24. Elementi br. 88, 92 itd. Spojevi radioaktivnih elemenata radija, urana i njihovih srodnika- sirovine za proizvodnju nuklearnog oružja.
Broj slajda 25-26. Test. 1. Proizvodnja hidrogenske bombe temelji se na korištenju:
a) izotopi vodika b) izotopi kisika
b) izotopi helija d) izotopi dušika
2. Zračni brodovi proizvode:
a) vodik b) dušik
b) helij d) smjesa vodika i helija
3) Neon se koristi za punjenje električnih svjetiljki koje se koriste u svjetionicima i signalnim instalacijama jer se
a) lijep b) daleko svijetli c) jeftin d) inertan
4. Radi zaštite od korozije, trupovi podmornica izrađeni su od čelika koji sadrži 10%:
a) Cu b) Zn c) Al d) Cr
5. Koji se oksidans goriva koristi za rakete i zrakoplove:
a) tekući kisik b) benzin c) kerozin d) vodik
Vodeći. stranica 2.
Slajd br. 27-28. Kemijska bojna sredstva
Inicijativa za korištenje kemijskih bojnih agenasa (CW) kao oružja za masovno uništenje pripada Njemačkoj. Otrovni plin klor prvi put je upotrijebljen 22. travnja 1915. godine na zapadnoj bojišnici kod belgijskog grada Ypresa protiv anglo-francuskih trupa. Prvi plinski napad onesposobio je cijelu diviziju koja je branila ovaj sektor: 15 tisuća ljudi izbačeno je iz stroja, od toga 5 tisuća trajno.
Otprilike mjesec dana kasnije, napad plinom ponovljen je na Istočnom frontu protiv ruskih trupa. U noći 31. svibnja 1915. na području poljskog grada Bolimova, na prednjem dijelu od 12 km, s vjetrom koji je puhao prema ruskim položajima, iz 12.000 cilindara ispušteno je 150 tona otrovnog plina. Prednje linije područja napadnutog plinovima, koje je predstavljalo neprekinuti labirint rovova i komunikacijskih pravaca, bile su zatrpane leševima i umirućim ljudima. 9 tisuća ljudi bilo je izvan stroja.
Engleski pjesnik Wilfred Owen, koji je poginuo u Prvom svjetskom ratu, ostavio je pjesmu napisanu pod dojmom plinskog napada:
Slajd broj 29 - Gas! Plin! požuri! - Nespretni pokreti, Navlačenje maski u jedkoj tami...
Jedan je oklijevao, gušio se i posrtao,
Koprcajući se kao u vatrenom katranu,
U prazninama mutne zelene magle.
Nemoćan, kao u snu, intervenirati i pomoći,
Sve što sam vidio je da je teturao,
Pojurio je i klonuo - nije se više mogao boriti.
U spomen na prvi plinski napad, otrovna tvar diklorodietil sulfid S(CH 2 CH 2 C1) 2 nazvan iperit. Klor je također sadržan u difosgenu CC1 3 OS(O)C1. Ali krdo (CH 3 ) 2 NP(O)(OC 2 H 5 )CN je tekućina jakog voćnog mirisa - derivat cijanofosforne kiseline.
Otrovne tvari koje sadrže arsen, za razliku od drugih, mogu prodrijeti kroz primitivne plinske maske. Uzrokujući nepodnošljivu iritaciju dišnih putova, izraženu kihanjem i kašljanjem, tjeraju osobu da skine masku i izloži se zagušljivom plinu.
Posebnu skupinu kemijskih sredstava čine suzne tvari koje uzrokuju suzenje i kihanje. Tako je 1918. godine američki kemičar R. Adams predložio tvar adamsit, koja sadrži i arsen i klor. Nadražuje gornje dišne putove, a može se i zapaliti, stvarajući fini, otrovni dim.
Većina lakrimatora sadrži klor i brom.
Moderni borbeni agenti još su strašniji i nemilosrdniji.
Za samoobranu, kao i tijekom protuterorističkih operacija, koriste se manje otrovne tvari.
Slajd broj 30. Stranica 3.
Zaštita od otrovnih tvari
Godine 1785. pomoćnik ljekarnika (kasnije ruski akademik) Toviy Yegorovich Lovitz otkrio je da je ugljen sposoban zadržati (adsorbirati) različite tekuće i plinovite tvari na svojoj površini. Istaknuo je mogućnost korištenja ovog svojstva u praktične svrhe, poput pročišćavanja vode. Od 1794%. aktivni ugljen počeo se koristiti za pročišćavanje sirovog šećera. Fenomen adsorpcije našao je izvornu primjenu u Engleskoj, gdje je ugljen korišten za pročišćavanje zraka koji se dovodio u zgradu Parlamenta.
No, tek tijekom Prvog svjetskog rata ovo se imanje počelo masovnije koristiti. Razlog tome bila je uporaba otrovnih tvari za masovno uništavanje ljudstva zaraćenih armija.
Izbijanje kemijskog rata pripremalo je nebrojene žrtve i patnje čovječanstvu. Stvaranje zaštite od kemijskih sredstava omogućeno je korištenjem jedne od varijanti amorfnog ugljika - drvenog ugljena.
Slajd br. 31-32. Izvanredni kemičar, profesor N.D. Zelinsky (kasnije akademik) razvio je, testirao i u srpnju 1915. predložio plinsku masku koja radi na temelju fenomena adsorpcije koja se javlja na površini čestica ugljena. Prolazak zatrovanog zraka kroz ugljen potpuno ga je oslobodio od nečistoća i zaštitio vojnike plinskom maskom od kemijskih bojnih otrova.
Izum N. D. Zelinskog spasio je mnoge ljudske živote.
Kako su razvijene nove otrovne tvari, tako je poboljšana i plinska maska. Zajedno s aktivnim ugljenom, moderne plinske maske također koriste aktivnije adsorbente.
Slajd br. 33-34. stranica 4.
Eksplozivi
Ne postoji konsenzus o izumu baruta: vjeruje se da je vatreni prah došao do nas od starih Kineza, Arapa, ili ga je možda izumio srednjovjekovni alkemičarski redovnik Roger Bacon.
U Rusiji su se stručnjaci za proizvodnju "topovskog napitka" nazivali izrađivačima napitaka.
Crni barut naziva se dimljeni. Dugi niz godina obavijao je bojna polja oblacima dima, čineći ljude i strojeve nerazlučivima.
Korak naprijed bila je uporaba eksplozivnih organskih tvari u ratovanju: pokazalo se da su snažnije i proizvode manje dima.
Među organskim tvarima postoji skupina nitro spojeva čije molekule sadrže skupinu -NO atoma 2 . Te se tvari lako razgrađuju, često eksplozivno. Povećanje broja nitro skupina u molekuli povećava sposobnost tvari da eksplodira. Moderni eksplozivi proizvode se na bazi nitro spojeva.
Derivat fenola, trinitrofenol ili pikrinska kiselina, može eksplodirati nakon detonacije i koristi se za punjenje topničkih granata pod nazivom "melinit".
Derivat toluena, trinitrotoluen (TNT, tol) jedan je od najvažnijih eksploziva za drobljenje. Koristi se u ogromnim količinama za proizvodnju topničkih granata, mina i bombi za rušenje. Snaga ostalih eksploziva uspoređuje se sa snagom TNT-a i izražava u TNT ekvivalentu.
Derivat višehidričnog alkohola glicerina, nitroglicerina, je tekućina koja eksplodira kada se zapali, detonira ili jednostavno potrese. Nitroglicerin se može razgraditi gotovo trenutno, oslobađajući toplinu i veliku količinu plinova: 1 litra proizvodi do 10 000 litara plinova. Nije pogodan za pucanje, jer bi pokidao cijevi oružja. Koristi se za radove miniranja, ali ne u čistom obliku (vrlo lako eksplodira), već u mješavini s poroznom zemljom ili piljevinom. Ova smjesa se zove dinamit. Alfred Nobel razvio je industrijsku proizvodnju dinamita. Kada se pomiješa s nitrocelulozom, nitroglicerin proizvodi želatinoznu eksplozivnu masu - eksplozivni žele.
Derivat celuloze, trinitroceluloza, inače nazvan piroksilin, također ima eksplozivna svojstva i koristi se za izradu bezdimnog baruta. Metodu proizvodnje bezdimnog baruta (pirokolodije) razvio je D. I. Mendeljejev.
Slajd br. 35-36. Stranica 5.
Čarobno staklo u vojsci
Staklo koje se koristi u vojnoj opremi mora imati određena svojstva.
Vojsci je potrebna precizna optika. Dodatak galijevih spojeva polaznim materijalima omogućuje dobivanje stakala s visokim indeksom loma svjetlosnih zraka. Takva se stakla koriste u sustavima za navođenje raketnih sustava i navigacijskih instrumenata. Staklo obloženo slojem metalnog galija reflektira gotovo svu svjetlost, do 90%, što omogućuje proizvodnju zrcala s visokom točnošću refleksije. Slična zrcala koriste se u navigacijskim instrumentima i sustavima za navođenje topova pri gađanju nevidljivih ciljeva, u sustavima svjetionika i periskopskim sustavima podmornica. Ta zrcala mogu izdržati vrlo visoke temperature, zbog čega se koriste u raketnoj tehnici. Da bi se poboljšala optička svojstva, spojevi germanija također se dodaju sirovinama za proizvodnju stakla.
Infracrvena optika ima široku primjenu: naočale koje dobro propuštaju toplinske zrake koriste se u uređajima za noćno gledanje. Ta svojstva staklu daje galijev oksid. Uređaje koriste izvidničke skupine i granične ophodnje.
Davne 1908. godine razvijena je metoda za proizvodnju tankih staklenih vlakana, no tek su nedavno znanstvenici predložili izradu dvoslojnih staklenih vlakana - svjetlovoda, koji se koriste u vojnom komunikacijskom sustavu. Dakle, kabel je debljine 7 mm. sastavljen od 300 pojedinačnih vlakana, omogućuje 2 milijuna telefonskih razgovora istovremeno.
Uvođenje metalnih oksida u različitim oksidacijskim stanjima u staklo daje staklu električnu vodljivost. Slična poluvodička stakla koriste se za televizijsku opremu u svemirskim raketama.
Staklo je amorfan materijal, ali sada se proizvode i kristalni stakleni materijali - staklokeramika. Neki od njih imaju tvrdoću usporedivu s tvrdoćom čelika, a koeficijent toplinske ekspanzije gotovo jednak kvarcnom staklu koje može podnijeti nagle promjene temperature.
Slajd br. 37-38. Stranica 6.
Upotreba polimerau vojno-industrijskom kompleksu
XX. stoljeća nazvano stoljeće polimernih materijala. Polimeri se široko koriste u vojnoj industriji. Plastika je zamijenila drvo, bakar, nikal i broncu te druge obojene metale u izradi zrakoplova i automobila. Tako u prosjeku borbeni zrakoplov sadrži 100.000 dijelova izrađenih od plastike.
Polimeri su neophodni za izradu pojedinih elemenata malog oružja (ručke, okviri, kundaci), tijela nekih mina (obično protupješačkih) i upaljača (kako bi ih detektor mina teško otkrio), te izolaciju električnih ožičenje.
Polimeri se također koriste za proizvodnju antikorozivnih i vodonepropusnih premaza za čaše silosa raketnih sustava i poklopaca spremnika za pokretne borbene raketne sustave. Kućišta mnogih električnih uređaja, uređaja za zaštitu od zračenja, kemikalija i biologije, upravljački elementi uređaja i sustava (prekidači, prekidači, tipke) izrađeni su od polimera.
Suvremena tehnologija zahtijeva materijale koji su kemijski otporni na povišene temperature. Ova svojstva posjeduju vlakna izrađena od polimera koji sadrže fluor - fluoroplastike, koji su stabilni na temperaturama od -269 do +260 ° C. Fluoroplastika se koristi za izradu spremnika baterija: uz kemijsku otpornost ima čvrstoću, što je važno u terenskim uvjetima. Visoka toplinska otpornost i kemijska otpornost omogućuju korištenje fluoroplastike kao električnog izolacijskog materijala koji se koristi u ekstremnim uvjetima: u raketnoj tehnologiji, terenskim radio stanicama, podvodnoj opremi i podzemnim silosima za projektile.
S razvojem suvremenih vrsta oružja postale su tražene tvari koje mogu izdržati visoke temperature stotinama sati. Konstrukcijski materijali izrađeni na bazi vlakana otpornih na toplinu koriste se u konstrukciji zrakoplova i helikoptera.
Polimeri se također koriste kao eksplozivi (na primjer, piroksilin). Moderni plastidi također imaju polimernu strukturu.
Voditelj: Zadnja stranica časopisa je zatvorena.
Uvjereni ste da su kemijska znanja neophodna za jačanje obrambene sposobnosti naše Domovine, a moć naše države pouzdano uporište mira.
Pitanja za nagradu najboljeg slušatelja:
- Koji je plin prvi korišten kao sredstvo?
- Kako se zvao ovaj plin?
- Koja tvar ima adsorpcijska svojstva?
- Tko je izumio prvu plinsku masku?
- Zašto se crni barut naziva dimnim?
- Koje se tvari sada koriste za proizvodnju snažnijih eksploziva?
- Tko je razvio proizvodnju bezdimnog baruta?
- Koji je eksploziv razvio Alfred Nobel?
- Koja se svojstva polimernih materijala koriste u vojno-industrijskom kompleksu?
Metodska podrška.
- Znanstveni i metodološki časopis “Kemija u školi” - M.: Tsentrkhimpress, br. 4, 2009.
- Internet resursi
Uređenje ureda. Portreti kemijskih znanstvenika, novine “Kemijsko oružje jučer, danas, sutra”, novine “Kemijski elementi u službi domovine”, izložba knjiga o ratu, reprodukcija, fotografija; oprema: grafoskop, video rekorder, magnetofon.
Učitelj, nastavnik, profesor. Danas održavamo konferenciju posvećenu 65. obljetnici pobjede našeg naroda u Drugom svjetskom ratu. Ovom konferencijom želimo pokazati da se pobjeda kovala u pozadini radom mnogih sovjetskih ljudi, istaknutih znanstvenika, govoriti o korištenju mnogih poznatih kemikalija tijekom rata, prikazati zanimljive pokuse. Dakle, "Kemija i rat".
1. učenik.
"Činilo se da je cvijeće hladno,
I lagano su izblijedjele od rose.
Zora koja je hodala kroz travu i grmlje,
Tražili smo njemačkim dalekozorom.
Cvijet, prekriven kapima rose, prilijepio se uz cvijet,
I graničar im pruži ruke.
A Nijemci, popivši kavu, u tom trenutku
Popeli su se u tenkove i zatvorili otvore.
Sve je odisalo takvom tišinom,
Činilo se da cijela zemlja još spava
Tko bi to znao između mira i rata
Još samo pet minuta."
2. učenik.Sjetimo se početka rata, 1941. Njemački tenkovi su jurili prema Moskvi, Crvena armija je doslovno grudima držala neprijatelja. Nedostajalo je uniformi, hrane i streljiva, ali što je najvažnije, katastrofalno je nedostajalo protuoklopnih sredstava. Tijekom tog kritičnog razdoblja u pomoć su priskočili entuzijastični znanstvenici: za dva dana, u jednoj od vojnih tvornica, pokrenuta je proizvodnja boca KS (Kachurin-Solodovnikov), ili jednostavno boca sa zapaljivom smjesom. Ova jednostavna kemijska naprava uništila je njemačku opremu ne samo na početku rata, već čak iu proljeće 1945. - u Berlinu.
Što su bile KS boce? Ampule koje sadrže koncentriranu sumpornu kiselinu, bertolitnu sol i šećer u prahu bile su pričvršćene gumenom trakom na običnu bocu. ( Demonstracija modela boce .) U bocu je uliven benzin, kerozin ili ulje. Čim bi se takva boca pri udaru razbila o oklop, komponente fitilja stupile su u kemijsku reakciju, došlo je do snažnog bljeska, a gorivo se zapalilo.
Reakcije koje ilustriraju djelovanje fitilja(jednadžbe reakcija se projiciraju na platno kroz grafoskop):
3KClO 3 + H 2 SO 4 = 2ClO 2 + K ClO 4 + K 2 SO 4 + H 2 O,
2ClO 2 = Cl 2 + 2O 2,
C12H22O11 + 12O2 = 12CO2 + 11H2O.
Tri komponente osigurača uzimaju se odvojeno, ne mogu se unaprijed miješati, jer nastaje eksplozivna smjesa.
Iskustvo demonstracije . Djelovanje H 2 SO 4 na smjesu KClO 3 i šećera u prahu. 1 g fino kristalni KClO 3 pažljivo se pomiješa sa 1 g šećera u prahu. Izlijte smjesu na poklopac lončića i navlažite je s 2-3 kapi koncentrirane H2SO4. Smjesa se zapali.
U pozadini se čuju prigušena pucnjava i eksplozije bombi.
3. učenik. Tijekom ratnih godina mnogi su naši vršnjaci tijekom racija dežurali na krovovima kuća gaseći zapaljive bombe. Punjenje takvih bombi bila je mješavina praha Al, Mg a željezni oksid, živin fulminat služio je kao detonator. Kada je bomba udarila u krov, aktivirao se detonator koji je zapalio zapaljivu smjesu i sve okolo počelo je gorjeti. Zaslon prikazuje jednadžbe za reakcije koje se događaju kada bomba eksplodira:
4Al + 3O 2 = 2Al 2 O 3,
2Mg + O 2 = 2MgO,
3Fe 3 O 4 + 8Al = 9Fe + 4Al 2 O 3.
Goruća zapaljiva smjesa ne može se ugasiti vodom, jer vrući magnezij reagira s vodom:
Mg + 2H 2 O = Mg(OH) 2 + H 2.
4. učenik. Aluminij se koristio ne samo u zapaljivim bombama, već i za "aktivnu" zaštitu zrakoplova. Tako su, odbijajući zračne napade na Hamburg, operateri njemačkih radarskih stanica otkrili neočekivane smetnje na zaslonima indikatora, što je onemogućilo prepoznavanje signala zrakoplova koji se približavao. Smetnje su izazvale trake od aluminijske folije koje su bacili saveznički zrakoplovi. Tijekom napada na Njemačku izbačeno je oko 20.000 tona aluminijske folije.
5. učenik.Tijekom noćnih napada bombarderi su padobranom bacali rakete kako bi osvijetlili cilj. Sastav takve rakete uključivao je magnezijev prah, prešan posebnim spojevima, i fitilj od ugljena, bertolitne soli i kalcijevih soli. Kad je baklja ispaljena, fitilj je gorio visoko iznad tla prekrasnim svijetlim plamenom; Kako se smanjivala, svjetlost je postupno postajala ravnomjernija, svjetlija i bijela - to je bio magnezij koji je svijetlio. Konačno, kada je cilj bio osvijetljen i vidljiv kao i danju, piloti su započeli ciljano bombardiranje.
Iskustvo demonstracije. Zapaljena magnezijska traka (učenik pokazuje iskustvo).
6. učenik. Magnezij se koristio ne samo za izradu rasvjetnih raketa. Glavni potrošač ovog metala bilo je vojno zrakoplovstvo. Bilo je potrebno mnogo magnezija, pa se vadio čak i iz morske vode. Tehnologija ekstrakcije magnezija je sljedeća: morska voda se miješa u ogromnim spremnicima s vapnenim mlijekom, zatim se tretiranjem taloga solnom kiselinom dobiva magnezijev klorid. Tijekom elektrolize taline MgCl2 dobiti metalni magnezij(jednadžbe reakcija se projiciraju na ekran):
7. učenik.Godine 1943. danski fizičar i dobitnik Nobelove nagrade Niels Henrik David Bohr, bježeći pred nacističkim okupatorima, bio je prisiljen napustiti Kopenhagen. Ali zadržao je dvije zlatne Nobelove medalje od svojih kolega, njemačkih antifašističkih fizičara Jamesa Franka i Maxa von Lauea (Bohrova vlastita medalja ranije je odnesena iz Danske). Ne riskirajući ponijeti medalje sa sobom, znanstvenik ih je otopio u aqua regia i stavio neuglednu bočicu malo dalje na policu gdje su mnoge slične bočice i bočice s raznim tekućinama skupljale prašinu. Vraćajući se u svoj laboratorij nakon rata, Bohr je prije svega pronašao dragocjenu bocu. Na njegov zahtjev osoblje je odvojilo zlato od otopine i ponovno izradilo obje medalje. Zaslon prikazuje jednadžbu za reakciju otapanja zlata u aqua regia:
8. učenik. Uz zlato je vezana još jedna zanimljiva priča. Na kraju rata, vladari "neovisne" slovenske države, koju je Hitler formirao na području Čehoslovačke, odlučili su sakriti dio zlatnih rezervi zemlje. Kad se linija fronte znatno približila, SS je opkolio zgradu banke, a službenik je, prijeteći zaposlenicima smaknućem, naredio da se predaju dragocjenosti. Nekoliko minuta kasnije, kutije sa zlatom prešle su iz sefova u SS kamione. Pljačkaši nisu slutili da se u kutijama nalaze poluge “zlata”, koje je razborito izradio direktor kovnice od... kositra! Pravo zlato ostalo je skriveno dočekati kraj rata.
9. učenik.Bilo bi nepravedno da se danas ne sjetimo baruta. U ratu se uglavnom koristio nitrocelulozni (bezdimni) i rjeđe crni (dimni) barut. Osnova prvog je visokomolekularni eksploziv nitroceluloza, a drugi je mješavina kalijevog nitrata (75%), ugljena (15%) i sumpora (10%). Sjajne borbene katjuše i poznati jurišni zrakoplovi IL-2 bili su naoružani raketama, čije je gorivo bio balistički (bezdimni) barut - jedna od vrsta nitroceluloznog baruta.
Eksploziv kordit koji se koristi za punjenje granata i eksplozivnih metaka sadrži približno 30% nitroglicerina i 65% piroksilina (piroksilin je trinitrat celuloze).
Iskustvo demonstracije. Izgaranje bezdimnog praha – nitroceluloze.
10. učenik. Godine 1934. u Njemačkoj je uvedena zabrana svih publikacija vezanih uz H2O2 (vodikov peroksid). Godine 1938–1942 inženjer Helmut Walter izgradio je podmornicu
U-80, koji je radio na vodikovom peroksidu visoke koncentracije. Tijekom testiranja U-80 je pokazala veliku podvodnu brzinu od 28 čvorova (52 km/h). Davne 1934. godine prva podmornica s dvije turbine na pogon H2O2 . Ukupno su Nijemci uspjeli izgraditi 11 takvih brodova. Visoko učinkovite elektrane na vodikov peroksid razvijene su ne samo za podmornice, već i za zrakoplove, a kasnije i za rakete V-1 i V-2.
11. učenik.Pogonski sustav čamca U-80 radio je po tzv. hladnom postupku. Vodikov peroksid se razgrađuje u prisutnosti natrijeva i kalcijeva permanganata. Rezultirajuća vodena para i kisik korišteni su kao radni fluid u turbini i uklonjeni u more(jednadžba reakcije projicira se na ekran):
Ca(MnO 4) 2 + 3H 2 O 2 = 2MnO 2 + Ca(OH) 2 + 2H 2 O + 3O 2.
Za razliku od U-80, motori kasnijih podmornica radili su koristeći "vrući proces": H2O2 razloženo na vodenu paru i kisik. Tekuće gorivo je spaljeno u kisiku. Vodena para pomiješana s plinovima nastalim izgaranjem goriva. Dobivena smjesa pokretala je turbinu.
Ovih je dana podmorska flota dobila strateški značaj. Nuklearne elektrane višestruko su povećale domet podmornica. Kontinuirano praćenje sastava zraka koji podmorničari udišu, njegovo čišćenje i kondicioniranje postali su važniji nego ikad. Uloga kemijskih sredstava za pročišćavanje zraka i regeneraciju još uvijek je najvažnija. Stoga podmorničari s pravom mogu reći: “Kemija je život.”
12. učenik. Pred snagama protuzračne obrane stajao je težak zadatak. U domovinu je poslano na tisuće zrakoplova čiji su piloti već imali ratna iskustva u Španjolskoj, Poljskoj, Norveškoj, Belgiji i Francuskoj. Za zaštitu gradova korištena su sva moguća sredstva. Tako je osim protuavionskih topova nebo iznad gradova bilo zaštićeno i balonima punjenim vodikom, koji su spriječili njemačke bombardere da zarone. Tijekom noćnih napada, piloti su bili zaslijepljeni posebno izbačenim spojevima koji su sadržavali soli stroncija i kalcija. Ioni Ca 2+ obojio plamen ciglasto crveno, ioni Sr 2+ - u malini.
Iskustvo demonstracije . Bojenje plamena solima stroncija i kalcija. Trake filter papira se navlaže u koncentriranim otopinama kalcijevih i stroncijevih nitrata. Osušene trake su pričvršćene na metalnu šipku. Kad se trake zapale, one gore, bojeći plamen u ciglastocrvenu (Ca 2+ kation) i grimizno (Sr 2+ kation) boju.
13. učenik.Za punjenje balona vodikom u vojsci je korištena silikonska metoda koja se temelji na interakciji silicija s otopinom natrijevog hidroksida. Reakcija slijedi jednadžbu:
Si + 2NaOH + H2O = Na2SiO3 + 2H2.
Litijev hidrid se često koristio za proizvodnju vodika. Tablete LiH služio je američkim pilotima kao prijenosni izvor vodika. U slučaju nesreća iznad mora, pod utjecajem vode, tablete su se momentalno raspadale, puneći vodikom spasilačku opremu - čamce na napuhavanje, prsluke, signalne balone-antene:
LiH + H 2 O = LiOH + H 2 .
14. učenik. Umjetno stvorene dimne zavjese pomogle su spasiti živote tisuća sovjetskih vojnika. Ove zavjese izrađene su pomoću tvari koje stvaraju dim. Pokrivanje prijelaza preko Volge kod Staljingrada i tijekom prelaska Dnjepra, zagađenje Kronstadta i Sevastopolja dimom, široka uporaba dimnih zavjesa u Berlinskoj operaciji - ovo nije potpuni popis njihove upotrebe tijekom Velikog domovinskog rata. Jedna od prvih tvari za stvaranje dima bio je bijeli fosfor. Dimna zavjesa pri korištenju bijelog fosfora sastoji se od čestica oksida(R 2 O 3, R 2 O 5) i kapi fosforne kiseline.
Iskustvo demonstracije. "Dim bez vatre." U cilindar se ulije nekoliko kapi koncentrirane klorovodične kiseline, a na staklo se nakapa nekoliko kapi 25%-tne otopine amonijaka. Cilindar je prekriven staklom. Proizvodi se bijeli dim.
15. učenik. Početkom rata, kada su mnogi brodovi potonuli od torpeda i bombi pričvršćenih na posebno obučene morske pse, javila se potreba za pouzdanim sredstvom zaštite od morskih pasa. Mnogi lovci na morske pse i znanstvenici sudjelovali su u rješavanju ovog problema. Ernest Hemingway pomogao je ovim studijama - više puta je pokazao mjesta na kojima je i sam lovio morske grabežljivce. Ispostavilo se da morski psi jednostavno ne podnose bakar(II) sulfat. Morski psi hodali su milju od mamaca tretiranih ovom supstancom i pohlepno grabili mamce bez bakrenog sulfata.
Učitelj, nastavnik, profesor. Sada će nam učenici 8. razreda dati kratke poruke.
Periodni sustav u obrani domovine
Svaki učenik drži pločicu sa simbolom elementa o kojem govori.
Poruke učenika
Tijekom Velikog domovinskog rata element litij dobio je posebnu važnost. Metalni litij burno reagira s vodom, oslobađajući veliku količinu vodika, koji je korišten za punjenje balona i opreme za spašavanje tijekom nesreća zrakoplova i brodova na otvorenom moru. Dodatak litijeva hidroksida alkalnim baterijama povećava njihov radni vijek 2-3 puta, što je bilo prijeko potrebno partizanskim odredima. Trasirajuća zrna s dodatkom Li ostavljala su plavo-zeleni trag tijekom leta. Spojevi litija korišteni su na podmornicama za pročišćavanje zraka.
Berilijska bronca (legura bakra i 1-2,5% Be s dodacima 0,2-0,5% Ni i Co) koristi se u konstrukciji zrakoplova. A legura Be, Mg, Al, Ti neophodna je u stvaranju projektila i brzih zrakoplovnih mitraljeza, prvi put korištenih tijekom rata.
Dušik je nužno uključen u sastav eksploziva. Nijedan eksploziv ne može se pripremiti bez dušične kiseline HNO 3 i njenih soli.
Na temelju Mg i Al proizvedene su jake i ultralake legure za konstrukciju zrakoplova.
Za izradu oklopa tenka koristi se legura titana (do 88%) s drugim metalima. Godine 1943. Hitler je izdao zapovijed da se sovjetski tenkovi IS-3 napadnu na udaljenosti ne većoj od 1 km. Sastav oklopa ovog tenka bio je takav da ga nisu mogle probiti fašističke granate. Titan se također koristi u radiotehnici.
Od vanadijevog čelika izrađivali su se vojnički šljemovi, šljemovi, oklopne ploče na topovima i oklopne granate.
Kromirani čelici potrebni su za proizvodnju vatrenog oružja i trupova podmornica.
Više od 90% svih metala korištenih u Drugom svjetskom ratu bilo je željezo. Fe je glavni sastojak lijevanog željeza i čelika.
Kobaltni čelik korišten je za izradu magnetskih mina.
Legura Cu (90%) i Sn (10%) – topni metal. Za izradu topničkih granata i patrona korištena je legura Cu (68%) i Zn (32%) - mesing.
Bez germanija ne bi bilo radara.
Arsen je sastavni dio otrovnih tvari.
Tantal je najvažniji strateški materijal za izradu radarskih instalacija i radio odašiljačkih postaja.
Oklop tenka, granate torpeda i granate izrađeni su od volframovih čelika i legura.
Najveće dostignuće znanosti iznjedrilo je najveću tragediju čovječanstva. Prva atomska (uranska) bomba stvorena je u SAD-u i bačena na Hirošimu 6. kolovoza 1945. godine.
Prva plutonijska bomba također je napravljena u SAD-u. 9. kolovoza 1945. izbačen je na Nagasaki. Njegova eksplozija rezultirala je desecima tisuća mrtvih i stotinama tisuća teško ozlijeđenih. Posljedice eksplozije još uvijek pogađaju nove generacije.
Učitelj, nastavnik, profesor. Riječ imaju učenici 9. razreda.
Kemijski znanstvenici tijekom tog razdoblja
Veliki domovinski rat
1. učenik. Zajedno sa svim radnim ljudima naše zemlje, sovjetski su znanstvenici aktivno sudjelovali u osiguravanju pobjede nad nacističkom Njemačkom tijekom Velikog domovinskog rata. Kemijski znanstvenici stvorili su nove metode za proizvodnju najrazličitijih materijala, eksploziva, goriva za rakete katjuše, visokooktanskog benzina, gume, materijala za izradu oklopnog čelika, lakih legura za zrakoplovstvo i lijekova. Do kraja rata proizvodnja kemijskih proizvoda približila se predratnoj razini, da bi 1945. dosegla 92% razine iz 1940. godine.
Govorit ćemo o djelovanju nekih znanstvenika kemičara tijekom rata.
Na štandu su predstavljeni portreti znanstvenika kemičara. Učenici govore o znanstvenicima i pokazuju njihove portrete.
A.E. Arbuzov
|
2. učenik. Aleksandar Erminingeldovič Arbuzov. Izvanredan znanstvenik, utemeljitelj jednog od najnovijih područja znanosti - kemije organofosfornih spojeva. Cijeli njegov život i rad neraskidivo su povezani s poznatom kazanskom školom kemičara. Arbuzovljevo istraživanje tijekom ratnih godina u potpunosti je bilo posvećeno potrebama obrane i medicine. Tako je u ožujku 1943. najistaknutiji sovjetski optički fizičar S. I. Vavilov pisao Arbuzovu: “Dragi Aleksandre Erminingeldoviču! Pišem vam s velikom molbom: proizvesti 15 g 3,6-diaminoftalimida u vašem laboratoriju. Ispostavilo se da ovaj lijek koji smo dobili od vas ima vrijedna svojstva u smislu fluorescencije i adsorpcije, a sada nam je potreban za proizvodnju novog obrambenog optičkog uređaja...” Puno kasnije Arbuzov je saznao da je lijek koji je napravio dovoljan za opskrbu tenkovskih jedinica naše vojske optikom i bio je važan za otkrivanje neprijatelja na velikoj udaljenosti. Nakon toga, Arbuzov je izvršio druge narudžbe Optičkog instituta za proizvodnju različitih reagensa.
N.D.Zelinski
|
3. učenik. Nikolaj Dmitrijevič Zelinski.
Čitava era u povijesti ruske kemije povezana je s imenom Zelinskog. Posjedujući kreativnu snagu misli i kao domoljub svoje domovine, Zelinsky je ušao u njezinu povijest kao znanstvenik koji je u kritičnim trenucima povijesnih sudbina svoje zemlje bez oklijevanja stao u njezinu obranu. Tako je bilo s plinskom maskom u Prvom svjetskom ratu, sa sintetičkim benzinom u civilnoj uporabi i zrakoplovnim gorivom u Velikom domovinskom ratu. Zelinsky u razdoblju 1941–1945 - ovo nije samo kemičar istraživač, on je već bio poznat po možda najvećoj znanstvenoj školi u zemlji, čija su istraživanja bila usmjerena na razvoj metoda za proizvodnju visokooktanskog goriva za zrakoplovstvo, monomera za sintetička
guma.
N. N. Semenov
|
4. učenik. Nikolaj Nikolajevič Semenov. Doprinos akademika Semenova osiguranju pobjede u ratu u potpunosti je određen teorijom razgranatih lančanih reakcija koju je razvio. Ta je teorija kemičarima omogućila da ubrzaju reakcije sve do stvaranja eksplozivne lavine, uspore ih, pa čak i zaustave u bilo kojoj međufazi. Istraživanje procesa eksplozije, izgaranja i detonacije koje su proveli Semenov i njegovi kolege već početkom 1940-ih. dovela do izvanrednih rezultata. Nova dostignuća tijekom rata korištena su u ovom ili onom obliku u proizvodnji patrona, topničkih granata, eksploziva i zapaljivih smjesa za bacače plamena. Provedena su istraživanja refleksije i sudara udarnih valova tijekom eksplozija. Rezultati ovih studija korišteni su već u prvom razdoblju rata za stvaranje kumulativnih granata, granata i mina za borbu protiv neprijateljskih tenkova.
Prikazan je fragment igranog filma “Oslobođenje” gdje Hitler ispituje rupe u tenkovima koje su napravile naše granate.
A.E.Fersman
|
5. učenik. Aleksandar Evgenijevič Fersman.
Iz govora akademika Fersmana na antifašističkom skupu sovjetskih znanstvenika, 1941., Moskva: „Rat je zahtijevao golemu količinu osnovnih vrsta strateških sirovina. Cijeli niz novih metala bio je potreban za zrakoplovstvo, za čelik za probijanje oklopa, magnezij i stroncij bili su potrebni za svjetleće rakete i baklje, bilo je potrebno više joda i bio je potreban širok raspon najrazličitijih tvari. A mi imamo odgovornost za osiguravanje strateških sirovina. Potrebno je svojim znanjem pomoći u stvaranju najboljih tenkova i zrakoplova kako bi se brzo oslobodili svi narodi od najezde Hitlerove bande.”
Fersman je više puta rekao da je njegov život ljubavna priča za kamen. On je pronalazač i neumorni istraživač apatita na poluotoku Kola, ruda radija u Fergani, sumpora u pustinji Karakum, nalazišta volframa u Transbaikaliji, jedan od utemeljitelja industrije rijetkih elemenata.
Od prvih dana nakon početka rata Fersman se aktivno uključio u preustroj znanosti i industrije na ratne noge. Poseban rad obavljao je na vojnoinženjerskoj geologiji, vojnoj geografiji, maskirnim bojama, te na pitanjima strateških sirovina.
S.I. Volfkovich
|
6. učenik. Semjon Isaakovič Volfkovič. Najveći sovjetski kemičar-tehnolog, bio je direktor Istraživačkog instituta za gnojiva i insekticide, i radio je na spojevima fosfora. Zaposlenici instituta na čijem je čelu stvarali su legure fosfora i sumpora za staklene boce koje su služile kao protutenkovske "bombe" i proizvodili kemijske grijače koji su se koristili za grijanje patrolnih vojnika. Sanitetskoj službi su bili potrebni lijekovi protiv ozeblina, opeklina i lijekovi. Na tome je radilo osoblje njegovog instituta.
I.L. Knunyants
|
7. učenik. Ivan Ludvigovich Knunyants. Tijekom i nakon rata bio je profesor i načelnik katedre Vojne akademije kemijske obrane. Nagrada, koju je Ivan Lyudvigovich Knunyants dobio 1943. godine, dodijeljena mu je za razvoj pouzdanog sredstva individualne zaštite ljudi od otrovnih tvari. Ivan Lyudvigovich utemeljitelj je kemije organofluornih spojeva.
M.M.Dubinin
|
1. učenik. Mihail Mihajlovič Dubinjin. Još prije početka Velikog Domovinskog rata, kao načelnik katedre i profesor na Vojnoj akademiji za kemijsku obranu, bavio se istraživanjem sorpcije plinova, para i otopljenih tvari čvrstim poroznim tijelima. Mikhail Mikhailovich je priznati autoritet za sva glavna pitanja vezana uz kemijsku zaštitu dišnih puteva.
N.N.Melnikov
|
2. učenik. Nikolaj Nikolajevič Melnikov. Znanstvenici su od samog početka rata dobili zadatak razviti i organizirati proizvodnju lijekova za suzbijanje zaraznih bolesti, prvenstveno tifusa, čiji su prijenosnici uši. Pod vodstvom Melnikova organizirana je proizvodnja prašine i raznih antiseptika za drvene dijelove zrakoplova.
A.N.Frumkin
|
3. učenik. Aleksandar Naumovič Frumkin. Izvanredan znanstvenik, jedan od utemeljitelja suvremene znanosti o elektrokemijskim procesima, utemeljitelj sovjetske škole elektrokemičara. Bavio se problematikom zaštite metala od korozije, razvio fizikalno-kemijsku metodu za pričvršćivanje tla za zračne luke i recept za protupožarnu impregnaciju drva. Zajedno sa svojim kolegama razvio je elektrokemijske osigurače. Htio bih citirati Frumkinove riječi na antifašističkom skupu sovjetskih znanstvenika 1941.: “Ja sam kemičar. Dopustite mi da danas govorim u ime svih sovjetskih kemičara. Nema sumnje da je kemija jedan od bitnih čimbenika o kojima ovisi uspjeh modernog ratovanja. Proizvodnja eksploziva, kvalitetnih čelika, lakih metala, goriva - sve su to razne namjene kemije, a da ne govorimo o posebnim oblicima kemijskog oružja. U suvremenom ratovanju njemačka kemija svijetu je do sada podarila jednu “novu stvar” – masovnu upotrebu stimulansa i narkotika koji se daju njemačkim vojnicima prije slanja u sigurnu smrt. Sovjetski kemičari pozivaju znanstvenike iz cijelog svijeta da iskoriste svoje znanje u borbi protiv fašizma.”
S.S. Nametkin
|
4. učenik. Sergej Semenovič Nametkin jedan je od utemeljitelja petrokemijske znanosti. Uspješno je radio na području sinteze novih organometalnih spojeva, otrovnih i eksplozivnih tvari. Tijekom rata Sergej Semenovič posvetio je puno truda razvoju proizvodnje motornih goriva i ulja, te se bavio pitanjima kemijske zaštite.
V.A.Kargin
|
5. učenik. Valentin Aleksejevič Kargin. Istraživanja akademika Valentina Aleksejeviča Kargina pokrivaju širok raspon pitanja vezanih uz fizikalnu kemiju, elektrokemiju i fizikalnu kemiju visokomolekularnih spojeva. Kargin je razvio posebne materijale za izradu odjeće koja štiti od utjecaja otrovnih tvari, princip i tehnologiju nove metode obrade zaštitnih tkanina, kemijske sastave koji čine cipele od filca vodootporne i posebne vrste gume za borbena vozila naše vojske .
Yu.A.Klyachko
|
6. učenik. Jurij Arkadijevič Kljačko. Profesor, zamjenik načelnika Vojne akademije kemijske obrane i načelnik Katedre za analitičku kemiju. Organizirao je bataljun iz Akademije kemijske obrane i bio šef borbenog sektora na najbližim prilazima Moskvi. Pod njegovim vodstvom pokrenut je rad na stvaranju novih sredstava kemijske obrane, uključujući dim, protuotrove i bacače plamena.
Moderni mlažnjak
|
Kemijsko oružje - kemijska bojna sredstva
Učitelj, nastavnik, profesor. Sada ćemo vam reći o modernijem i strašnijem oružju - kemijskom oružju. Dajem riječ učenicima 10. razreda.
Formule otrovnih tvari izrađuju se tintom na whatmanu, a sheme sinteze projiciraju se na platno putem grafoskopa.
1. učenik. Dana 22. travnja 1915., tijekom bitke na rijeci Ypres (Belgija), njemačke su trupe prvi put upotrijebile otrovnu tvar, pri čemu je ispušten ogroman otrovni oblak klora. Tako je započeo kemijski rat.
Wilfred Owen bio je jedan od cijenjenih pjesnika Prvog svjetskog rata. Ovdje je ulomak iz njegove pjesme koji opisuje smrt vojnika od trovanja klorom tijekom napada plinom. Naslov pjesme bio je početak stiha posuđenog od starorimskog pjesnika Horacija: "Nema veće radosti i časti nego umrijeti za svoju domovinu."
2. učenik.
Pognuti kao prosjaci s torbama,
S leđima okrenutim progonećim bljeskovima bitke,
Šepajući, žestoko kašljucajući, vukli smo se
Umorno do mjesta žuđenog mira.
Hodali su drijemajući dok su išli, gubeći cipele u blatu,
Poslušno smo se vukli kroz ovaj pakao,
Lutali smo dodirom, bez razlikovanja iza
Tihe eksplozije plinskih granata.
Plin! Plin! požuri! - Nespretni pokreti
Stavljanje maski u jedku izmaglicu.
Jedan je oklijevao, gušio se i posrtao,
Koprcajući se kao u vatrenom katranu,
U prazninama mutne zelene magle,
Nemoćan, kao u snu, intervenirati i pomoći,
Sve što sam vidio je da je teturao,
Pojurio je i klonuo - nije se više mogao boriti.
Oh, kad bi se barem kasnije vukao s nama
Iza kolica gdje su ga bacili,
Pogledao sam u lice sa ranama u očima,
Ne videći ništa drugo
Čuo sam trzaje kolica iznova i iznova
Krv je mjehurila u plućima začepljenim pjenom, -
Ne bi se usudio, prijatelju, ponoviti
Otrcane laži, raspaljivanje naivne omladine:
"Nema više radosti i časti dati život,
Umrijeti kao vojnik za domovinu!”
3. učenik. Tijekom Prvog svjetskog rata, istraživanja izvanrednih kemičara N. D. Zelinskog i N. A. Shilova dovela su do razvoja plinske maske, koja je spasila živote tisuća ljudi: gubici od kemijskog oružja daleko su premašili posljedice najtežih katastrofa u mirnodopskim uvjetima.
Godine 1920.–1930 prijetila je opasnost od izbijanja Drugog svjetskog rata. Velike svjetske sile su se grozničavo naoružavale, a najviše su se za to trudili Njemačka i SSSR. Međutim, iako je posjedovao novu generaciju otrovnih tvari, Hitler se nije usudio započeti kemijski rat, vjerojatno shvaćajući da će njegove posljedice za relativno malu Njemačku i golemu Rusiju biti nesamjerljive.
4. učenik. Nakon Drugog svjetskog rata utrka u kemijskom naoružanju nastavila se na višoj razini. Trenutačno vodeće svjetske sile ne proizvode kemijsko oružje, ali planet je nakupio ogromne rezerve smrtonosnih otrovnih tvari koje predstavljaju ozbiljnu opasnost za prirodu i društvo.
Usvojeni su i uskladišteni u skladištima sljedeći proizvodi: iperit, luizit, sarin, soman i još jedan proizvod koji se obično označava američkom šifrom “VX”. Pogledajmo ih pobliže.
5. učenik. Njemački kemičar W. Meyer otkrio je tiofen i predložio Nikolaju Dmitrijeviču Zelinskom da izvede sintezu tetrahidrotiofena. “Prateći put takve sinteze,” napisao je Zelinsky, “pripremio sam međuprodukt - diklorodietil sulfid, za koji se pokazalo da je jak otrov, od kojeg sam teško patio, dobio opekline po rukama i tijelu.”
Iperit je otrovna tvar koja djeluje na živce kože. Prodirući kroz kožu, ova tekućina uzrokuje stvaranje mjehurića i teško zacjeljujućih čireva, zahvaća dišni sustav, gastrointestinalni trakt i krvožilni sustav. U slučaju teških ozljeda, najčešće nije moguće spasiti osobu, au slučaju oštećenja kože, unesrećeni dugotrajno gubi radnu sposobnost. Postoje mnoge metode za industrijsku sintezu iperita (reakcijske jednadžbe prikazane su na ekranu):
Kao što se može vidjeti iz gornjih dijagrama, korištene sirovine i relativna jednostavnost sinteze učinili su iperit dostupnim mnogim zemljama s prilično razvijenom kemijskom industrijom.
6. učenik.Ime druge otrovne tvari je lewisite.
Sirovine za proizvodnju luizita su arsen(III) klorid i acetilen:
Ovu tvar razvili su američki znanstvenici kao alternativu njemačkom iperitu. Toksični učinak lewisita sličan je iperitu, ali je znatno slabiji, a oštećenje obično završava ozdravljenjem.
7. učenik. Značajan dio ljudi ubijenih kemijskim oružjem bili su žrtve fosgena i cijanovodične kiseline.
Fosgen i cijanovodična kiselina su veliki proizvodi kemijske industrije. Tehnologija njihove proizvodnje temelji se na reakcijama koje odgovaraju sljedećim shemama:
U normalnim uvjetima fosgen i cijanovodična kiselina su plinovite tvari, pa djeluju na čovjeka preko dišnog sustava.
8. učenik. Godine 1940.–1950 Pojavila se nova generacija otrovnih tvari - nervni otrovi. Sve tvari s ovim učinkom klasificiraju se kao organofosforni spojevi. To su esteri fosforne i alkilfosfonske kiseline.
Prva organofosfatna otrovna tvar bila je tabun. Daljnja istraživanja dovela su do razvoja skupina alkilnih estera fluorofosfonskih kiselina, među kojima su se sarin i soman pokazali najotrovnijima.
Organofosfatni otrovi uzrokuju kontrakciju mišića, konvulzije, suženje zjenica, a potom i smrt.
9. učenik. Najjednostavniji s tehnološkog gledišta je proizvodnja sarina. Dijagram prikazuje jednu od opcija za sintezu sarina, razvijenu u Njemačkoj tijekom Drugog svjetskog rata:
Soman se može dobiti na sličan način, koristeći 3,3-dimetilbutanol-2 u zadnjoj fazi umjesto izopropil alkohola.
10. učenik. Godine 1956. švedski biokemičar L. Tammelin sintetizirao je tiokolinfosfonate - tvari koje zadovoljavaju opću formulu:
Pokazalo se da su ti spojevi iznimno otrovni: jedna kap tvari koja je dospjela na kožu uzrokovala je smrtonosno trovanje. Sva istraživanja vezana uz spojeve ove klase odmah su klasificirana, a uskoro je u SAD-u organizirana industrijska proizvodnja takve organofosforne tvari pod šifrom "VX" sa sastavom: R = metil, R"= etil
R""= izopropil. Šezdesetih godina prošlog stoljeća Plinovi VX zauzeli su vodeće mjesto u arsenalima supersila. Pokazalo se da su njegove rezerve toliko velike da je industrijska proizvodnja u Sjedinjenim Državama zaustavljena 1969.
11. učenik. Danas se među zalihama kemijskog oružja u vojnim skladištima uglavnom nalaze nervni otrovi
(oko 32 tisuće tona), kožno-živčane otrovne tvari (oko 6 tisuća tona).
Upotreba kemijskog oružja u današnje vrijeme potpuno je isključena, pa je bilo potrebno riješiti pitanje njihove buduće sudbine.
Donesena je odluka da se uništi kemijsko oružje. U prvoj polovici 20.st. ili je utopljen u moru ili zakopan u zemlju. Nema potrebe objašnjavati kakvim su posljedicama takvi ukopi puni. Danas se otrovne tvari spaljuju, ali i to ima svojih nedostataka. Pri gorenju u normalnom plamenu koncentracija otrova u ispušnim plinovima desetke je tisuća puta veća od maksimalno dopuštene. Visokotemperaturno naknadno izgaranje ispušnih plinova u plazma električnoj peći (metoda koja se koristi u SAD) osigurava relativnu sigurnost.
12. učenik. Drugi pristup uništavanju kemijskog oružja je prvo neutralizirati otrovne tvari. Dobivene neotrovne mase mogu se spaliti ili se mogu pretvoriti u čvrste netopljive blokove, tako da se ti blokovi zatim mogu zakopati u posebna grobišta ili koristiti u cestogradnji.
Učitelj, nastavnik, profesor. Trenutačno se naširoko raspravlja o konceptu uništavanja otrovnih tvari izravno u streljivu, a predlaže se i prerada netoksičnih reakcijskih masa u kemijske proizvode za komercijalnu upotrebu. U međuvremenu, Vlada nema novca ne samo za uništavanje kemijskog oružja, već ni za znanstvena istraživanja na ovom području. A u 21. stoljeće ulazimo s teškim nasljeđem prošlosti. Želio bih se nadati da će trijezan um prevladati nad pohlepom. Neka snaga ove divne znanosti - kemije - ne bude usmjerena na razvoj novih otrovnih tvari, već na rješavanje globalnih ljudskih problema.
Našu konferenciju završit ćemo simboličnim vatrometom u čast onih koji su učinili sve moguće i nemoguće da približe pobjedu nad fašizmom.
Svira se pjesma “Dan pobjede”. Na laboratorijskom stolu učenici demonstriraju vatromet.
Iskustvo. Pomiješajte 3 žlice KMnO 4, ugljeni prah, željezni prah na listu papira. Dobivenu smjesu ulijte u željezni lončić i zagrijte na plamenu alkoholne lampe. Reakcija počinje, smjesa se izbacuje iz lončića u obliku mnogo iskri.
KNJIŽEVNOST
Kemija (Izdavačka kuća Prvo rujan), 2001., br. 7; 1999, broj 16;
Fremantle M. Kemija na djelu. T. 2. M.: Mir, 1998, str. 258;
Kemija u školi, 1985., br. 1, 2; 1984, broj 6; 1995, broj 4; 1996., br.1.
1. Uvod.
2. Otrovne tvari.
3. Anorganske tvari u službi vojske.
4. Doprinos sovjetskih kemičara pobjedi u Drugom svjetskom ratu.
5. Zaključak.
6. Književnost.
Uvod.
Živimo u svijetu različitih tvari. U principu, čovjeku za život nije potrebno mnogo: kisik (zrak), voda, hrana, osnovna odjeća, stanovanje. Međutim, čovjek, ovladavajući svijetom oko sebe, stječući sve više znanja o njemu, stalno mijenja svoj život.
U drugoj polovici 19. stoljeća kemijska je znanost dosegla stupanj razvoja koji je omogućio stvaranje novih tvari koje nikada prije nisu postojale u prirodi. No, stvarajući nove tvari koje bi trebale poslužiti za dobro, znanstvenici su stvorili i tvari koje su postale prijetnja čovječanstvu.
O tome sam razmišljao dok sam proučavao povijest Prvog svjetskog rata i saznao da je 1915. Nijemci su koristili napade plinom s otrovnim tvarima za pobjedu na francuskoj fronti. Što bi druge zemlje mogle učiniti da sačuvaju živote i zdravlje vojnika?
Prije svega, stvoriti plinsku masku, što je uspješno postigao N.D. Zelinsky. Rekao je: "Izumio sam to ne da napadam, već da zaštitim mlade živote od patnje i smrti." E, onda su se poput lančane reakcije počele stvarati nove tvari – početak ere kemijskog oružja.
Što mislite o ovome?
S jedne strane, tvari "stoje" za zaštitu zemalja. Više ne možemo zamisliti svoj život bez mnogih kemikalija, jer su one stvorene za dobrobit civilizacije (plastika, guma, itd.). S druge strane, neke tvari mogu poslužiti za uništavanje, one donose “smrt”.
Svrha mog eseja: proširiti i produbiti znanje o korištenju kemikalija.
Ciljevi: 1) Razmotriti kako se kemikalije koriste u ratovanju.
2) Upoznati doprinos znanstvenika pobjedi u Drugom svjetskom ratu.
Organska tvar
Godine 1920. – 1930. god prijetila je opasnost od izbijanja Drugog svjetskog rata. Velike svjetske sile su se grozničavo naoružavale, a najviše su se za to trudili Njemačka i SSSR. Njemački znanstvenici stvorili su novu generaciju otrovnih tvari. Međutim, Hitler se nije usudio započeti kemijski rat, vjerojatno shvaćajući da će njegove posljedice za relativno malu Njemačku i golemu Rusiju biti nesamjerljive.
Nakon Drugog svjetskog rata utrka u kemijskom naoružanju nastavila se na višoj razini. Trenutno razvijene zemlje ne proizvode kemijsko oružje, ali planet je nakupio ogromne rezerve smrtonosnih otrovnih tvari, koje predstavljaju ozbiljnu opasnost za prirodu i društvo
Iperit, lewisite, sarin, soman, V-plinovi, cijanovodična kiselina, fosgen i još jedan proizvod, koji se obično prikazuje fontom "VX", usvojeni su i uskladišteni u skladištima. Pogledajmo ih pobliže.
a) Sarin je bezbojna ili žuta tekućina gotovo bez mirisa, što otežava otkrivanje vanjskim znakovima. Spada u klasu nervnih agenasa. Sarin je namijenjen, prije svega, kontaminaciji zraka parama i maglom, odnosno kao nestabilan agens. U nekim slučajevima, međutim, može se koristiti u kapljičnom obliku za zarazu područja i vojne opreme koja se na njemu nalazi; u ovom slučaju, postojanost sarina može biti: ljeti - nekoliko sati, zimi - nekoliko dana.
Sarin uzrokuje oštećenja kroz dišni sustav, kožu i gastrointestinalni trakt; djeluje kroz kožu u kapljično-tekućem i parovitom stanju, ne uzrokujući lokalna oštećenja. Stupanj oštećenja od sarina ovisi o njegovoj koncentraciji u zraku i vremenu provedenom u kontaminiranoj atmosferi.
Prilikom izlaganja sarinu, žrtva doživljava slinjenje, obilno znojenje, povraćanje, vrtoglavicu, gubitak svijesti, jake konvulzije, paralizu i, kao posljedicu teškog trovanja, smrt.
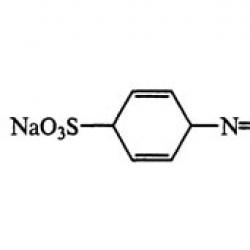
Formula sarina:
b) Soman je tekućina bez boje i gotovo bez mirisa. Spada u klasu nervnih agenasa. Po mnogim svojstvima vrlo je sličan sarinu. Postojanost somana je nešto veća od postojanosti sarina; njegov učinak na ljudski organizam je otprilike 10 puta jači.
Somanova formula:
(CH3)3C – CH (CH3) -
c) V-plinovi su slabo hlapljive tekućine s vrlo visokim vrelištem, pa je njihova otpornost višestruko veća od otpornosti sarina. Poput sarina i somana, klasificirani su kao nervni otrovi. Prema podacima iz inozemnog tiska, V-plinovi su 100 - 1000 puta otrovniji od ostalih živčanih otrova. Vrlo su učinkoviti kada djeluju kroz kožu, posebno u kapljičnom tekućem stanju: kontakt malih kapljica V-plinova s ljudskom kožom obično uzrokuje smrt.
d) Iperit je tamnosmeđa uljasta tekućina karakterističnog mirisa koji podsjeća na češnjak ili gorušicu. Spada u klasu sredstava za mjehuriće. Iperit polako isparava iz kontaminiranih područja; Trajnost na tlu mu je: ljeti od 7 do 14 dana, zimi mjesec i više. Iperit ima višestruko djelovanje na organizam: u kapljevitom i parovitom stanju djeluje na kožu i oči, u parnom obliku djeluje na dišne putove i pluća, a uneseno s hranom i vodom na probavne organe. Učinak iperita ne pojavljuje se odmah, već nakon nekog vremena, koje se naziva razdoblje latentnog djelovanja. U dodiru s kožom, kapi iperita se brzo upijaju u nju ne uzrokujući bol. Nakon 4 - 8 sati koža postaje crvena i svrbi. Krajem prvog i početkom drugog dana stvaraju se mali mjehurići, ali se zatim stapaju u pojedinačne velike mjehuriće ispunjene jantarnožutom tekućinom koja s vremenom postaje mutna. Pojava mjehurića prati malaksalost i groznica. Nakon 2-3 dana mjehurići probiju i otkriju čireve ispod njih koji dugo ne zacjeljuju. Ako infekcija uđe u čir, dolazi do gnojenja i vrijeme zacjeljivanja se povećava na 5 - 6 mjeseci. Parni iperit djeluje na organe vida čak iu neznatnim koncentracijama u zraku, a vrijeme izlaganja iznosi 10 minuta. Razdoblje skrivenog djelovanja traje od 2 do 6 sati; tada se pojavljuju znakovi oštećenja: osjećaj pijeska u očima, fotofobija, suzenje. Bolest može trajati 10 - 15 dana, nakon čega nastupa oporavak. Oštećenje probavnih organa nastaje gutanjem hrane i vode zagađene iperitom. U težim slučajevima trovanja, nakon razdoblja latentnog djelovanja (30-60 minuta), pojavljuju se znakovi oštećenja: bolovi u dnu želuca, mučnina, povraćanje; zatim se javlja opća slabost, glavobolja i slabljenje refleksa; Iscjedak iz usta i nosa poprima neugodan miris. Nakon toga proces napreduje: opaža se paraliza, teška slabost i iscrpljenost. Ako je tijek nepovoljan, smrt nastupa između 3. i 12. dana kao posljedica potpunog gubitka snage i iscrpljenosti.
U slučaju teških ozljeda, obično nije moguće spasiti osobu, a ako je oštećena koža, žrtva gubi radnu sposobnost na duže vrijeme.
Formula senfa:
CI – CH2 - CH2
CI – CH2 - CH2
e) cijanovodična kiselina je bezbojna tekućina osebujnog mirisa koji podsjeća na miris gorkog badema; u niskim koncentracijama miris se teško razlikuje. Cijanovodična kiselina lako isparava i djeluje samo u parovitom stanju. Odnosi se na opće otrovne agense. Karakteristični znakovi oštećenja od cijanovodične kiseline su: metalni okus u ustima, nadraženost grla, vrtoglavica, slabost, mučnina. Tada se javlja bolna otežano disanje, usporava se puls, otrovana osoba gubi svijest, javljaju se oštri grčevi. Konvulzije se opažaju relativno kratko vrijeme; zamjenjuju se potpunim opuštanjem mišića s gubitkom osjetljivosti, padom temperature, depresijom disanja s naknadnim prestankom. Rad srca nakon prestanka disanja traje još 3 do 7 minuta.
Formula cijanovodične kiseline:
f) Fosgen je bezbojna, vrlo hlapljiva tekućina s mirisom trulog sijena ili trule jabuke. Na tijelo djeluje u parovitom stanju. Spada u klasu sredstava za gušenje.
Fosgen ima latentno razdoblje djelovanja od 4 - 6 sati; njegovo trajanje ovisi o koncentraciji fosgena u zraku, vremenu provedenom u kontaminiranoj atmosferi, stanju osobe i ohlađenosti tijela. Kada se udahne fosgen, osoba osjeća slatkast, neugodan okus u ustima, praćen kašljem, vrtoglavicom i općom slabošću. Nakon izlaska iz kontaminiranog zraka znakovi trovanja brzo prolaze i počinje razdoblje tzv. umišljenog blagostanja. Ali nakon 4 - 6 sati, stanje oboljele osobe se naglo pogoršava: usnice, obrazi i nos brzo postaju plavkaste boje; opća slabost, glavobolja, ubrzano disanje, jaka otežano disanje, bolan kašalj s ispuštanjem tekućeg, pjenastog, ružičastog ispljuvka ukazuju na razvoj plućnog edema. Proces trovanja fosgenom doseže svoju vrhunsku fazu unutar 2-3 dana. Uz povoljan tijek bolesti, zdravstveno stanje oboljelog će se postupno početi poboljšavati, au težim slučajevima oštećenja nastupa smrt.
Formula fosgena:
e) Dimetilamid lizerginske kiseline je otrovna tvar psihokemijskog djelovanja. Nakon gutanja javlja se blaga mučnina i proširene zjenice unutar 3 minute, praćene halucinacijama sluha i vida koje traju nekoliko sati.
Anorganske tvari u vojnim poslovima.
Nijemci su prvi put upotrijebili kemijsko oružje 22. travnja 1915. godine. blizu Ypresa: pokrenuli su napad plinom protiv francuskih i britanskih trupa. Od 6 tisuća metalnih cilindara proizvedeno je 180 tona. klora preko fronte širine 6 km. Zatim su koristili klor kao sredstvo protiv ruske vojske. Samo od prvog napada plinom pogođeno je oko 15 tisuća vojnika, od kojih je 5 tisuća umrlo od gušenja. Za zaštitu od trovanja klorom počeli su koristiti zavoje natopljene otopinom potaše i sode bikarbone, a potom i plinsku masku u kojoj je za upijanje klora korišten natrijev tiosulfat.
Kasnije su se pojavile snažnije otrovne tvari koje sadrže klor: iperit, kloropikrin, cijanogen klorid, zagušljivi plin fosgen itd.
Jednadžba reakcije za proizvodnju fosgena je:
CI2 + CO = COCI2.
Nakon prodiranja u ljudsko tijelo, fosgen se podvrgava hidrolizi:
COCI2 + H2O = CO2 + 2HCI,
što dovodi do stvaranja klorovodične kiseline koja upaljuje tkiva dišnih organa i otežava disanje.
Fosgen se također koristi u miroljubive svrhe: u proizvodnji boja, u borbi protiv štetnika i bolesti poljoprivrednih usjeva.
Izbjeljivač(CaOCI2) koristi se u vojne svrhe kao oksidans tijekom otplinjavanja, uništavanja kemijskih bojnih agenasa, te u miroljubive svrhe - za bijeljenje pamučnih tkanina, papira, za kloriranje vode i dezinfekciju. Upotreba ove soli temelji se na činjenici da se pri reakciji s ugljičnim monoksidom (IV) oslobađa slobodna hipoklorična kiselina koja se razgrađuje:
2CaOCI2 + CO2 + H2O = CaCO3 + CaCI2 + 2HOCI;
Kisik u trenutku oslobađanja energetski oksidira i uništava otrovne i druge otrovne tvari, te djeluje izbjeljujuće i dezinficirajuće.
Oxiliquit je eksplozivna smjesa bilo koje zapaljive porozne mase s tekućinom kisik. Korišteni su tijekom Prvog svjetskog rata umjesto dinamita.
Glavni uvjet za odabir zapaljivog materijala za oxyliquit je njegova dovoljna drobljivost, što olakšava bolju impregnaciju tekućim kisikom. Ako je zapaljivi materijal slabo impregniran, tada će nakon eksplozije nešto od njega ostati neizgoreno. Oxyliquit uložak je dugačka vrećica ispunjena zapaljivim materijalom u koju je umetnut električni osigurač. Kao zapaljivi materijali za oksilikvite koriste se piljevina, ugljen i treset. Uložak se puni neposredno prije umetanja u rupu, uranjajući ga u tekući kisik. Patrone su se ponekad pripremale na ovaj način tijekom Velikog domovinskog rata, iako se u tu svrhu uglavnom koristio trinitrotoluen. Trenutno se oksilikviti koriste u rudarskoj industriji za miniranje.
Gledajući svojstva sumporne kiseline, značajna je njegova primjena u proizvodnji eksploziva (TNT, HMX, pikrinska kiselina, trinitroglicerin) kao sredstvo za uklanjanje vode u sastavu nitrirajuće smjese (HNO3 i H2SO4).
Otopina amonijaka(40%) koristi se za otplinjavanje opreme, vozila, odjeće itd. u uvjetima uporabe kemijskog oružja (sarin, soman, tabun).
Na temelju dušična kiselina Dobiva se niz jakih eksploziva: trinitroglicerin i dinamit, nitroceluloza (piroksilin), trinitrofenol (pikrinska kiselina), trinitrotoluen i dr.
Amonijev klorid NH4CI se koristi za punjenje dimnih bombi: kada se zapaljiva smjesa zapali, amonijev klorid se raspada, stvarajući gusti dim:
NH4CI = NH3 + HCl.
Takve dame bile su široko korištene tijekom Velikog Domovinskog rata.
Amonijev nitrat koristi se za proizvodnju eksploziva - amonita, koji sadrže i druge eksplozivne nitro spojeve, kao i zapaljive dodatke. Na primjer, ammonal sadrži trinitrotoluen i aluminij u prahu. Glavna reakcija koja se događa tijekom njegove eksplozije:
3NH4NO3 + 2AI = 3N2 + 6H2O + AI2O3 + Q.
Visoka toplina izgaranja aluminija povećava energiju eksplozije. Aluminijev nitrat pomiješan s trinitrotoluenom (tol) proizvodi eksploziv ammotol. Većina eksplozivnih smjesa sadrži oksidans (metalni ili amonijev nitrat itd.) i zapaljive tvari (dizelsko gorivo, aluminij, drveno brašno itd.).
Nitrati barija, stroncija i olova koristi u pirotehnici.
Razmatranje primjene nitrati, možete govoriti o povijesti proizvodnje i upotrebe crnog, ili dimnog, baruta - eksplozivne mješavine kalijevog nitrata sa sumporom i ugljenom (75% KNO3, 10% S, 15% C). Reakcija sagorijevanja crnog baruta izražava se jednadžbom:
2KNO3 + 3C + S = N2 + 3CO2 + K2S + Q.
Dva produkta reakcije su plinovi, a kalijev sulfid je krutina koja proizvodi dim nakon eksplozije. Izvor kisika pri izgaranju baruta je kalijev nitrat. Ako je posuda, na primjer cijev zatvorena na jednom kraju, zatvorena pokretnim tijelom - jezgrom, tada se izbacuje pod pritiskom praškastih plinova. Ovo pokazuje pogonski učinak baruta. A ako stijenke posude u kojoj se nalazi barut nisu dovoljno čvrste, tada se posuda pod djelovanjem barutnih plinova razbija u male komadiće koji lete okolo s ogromnom kinetičkom energijom. Ovo je eksplozivno djelovanje baruta. Nastali kalijev sulfid - naslage ugljika - uništava cijev oružja, stoga se nakon pucnja za čišćenje oružja koristi posebna otopina koja sadrži amonijev karbonat.
Dominacija crnog baruta u vojnim poslovima nastavila se šest stoljeća. Tijekom tako dugog vremenskog razdoblja njegov sastav ostao je gotovo nepromijenjen, samo se promijenio način proizvodnje. Tek sredinom prošlog stoljeća umjesto crnog baruta počinju se koristiti novi eksplozivi veće razorne moći. Brzo su zamijenili crni barut iz vojne opreme. Danas se koristi kao eksploziv u rudarstvu, u pirotehnici (rakete, vatrometi), a također i kao lovački barut.
Fosfor(bijelo) naširoko se koristi u vojnim poslovima kao zapaljiva tvar koja se koristi za opremanje zrakoplovnih bombi, mina i granata. Fosfor je vrlo zapaljiv i pri gorenju oslobađa veliku količinu topline (temperatura izgaranja bijelog fosfora doseže 1000 - 1200°C). Pri izgaranju fosfor se topi, širi, au dodiru s kožom uzrokuje dugotrajne opekline i čireve.
Sagorijevanjem fosfora na zraku nastaje fosforni anhidrid čije pare privlače vlagu iz zraka i tvore veo bijele magle koji se sastoji od sitnih kapljica otopine metafosforne kiseline. Na ovom se svojstvu temelji njegova uporaba kao tvari za stvaranje dima.
Na temelju orto - i metafosforna kiselina Stvorene su najotrovnije organofosforne otrovne tvari (sarin, soman, VX plinovi) živčano-paralitičkog djelovanja. Plinska maska služi kao zaštita od njihovog štetnog djelovanja.
Grafit Zbog svoje mekoće naširoko se koristi za proizvodnju maziva koja se koriste na visokim i niskim temperaturama. Ekstremna otpornost na toplinu i kemijska inertnost grafita omogućuje njegovu primjenu u nuklearnim reaktorima na nuklearnim podmornicama u obliku čahura, prstenova, kao moderator toplinskih neutrona i kao konstrukcijski materijal u raketnoj tehnici.
čađavam(čađa) koristi se kao punilo gume za opremanje oklopnih vozila, zrakoplova, automobila, topništva i druge vojne opreme.
Aktivni ugljik– dobar adsorbent plinova, pa se koristi kao apsorber otrovnih tvari u filter gas maskama. Tijekom Prvog svjetskog rata bilo je velikih ljudskih gubitaka, a jedan od glavnih razloga bio je nedostatak pouzdane osobne zaštitne opreme protiv otrovnih tvari. N. D. Zelinsky predložio je jednostavnu plinsku masku u obliku zavoja s ugljenom. Kasnije je zajedno s inženjerom E. L. Kumantom poboljšao jednostavne plinske maske. Predložili su izolacijske gumene plinske maske, zahvaljujući kojima su spašeni životi milijuna vojnika.
Ugljični monoksid (II) (ugljični monoksid) pripada skupini opće otrovnih kemijskih oružja: spaja se s hemoglobinom u krvi, stvarajući karboksihemoglobin. Zbog toga hemoglobin gubi sposobnost vezanja i prijenosa kisika, dolazi do gladovanja kisikom i osoba umire od gušenja.
U borbenoj situaciji, kada se nalazite u zoni gorenja plameno-zapaljivih sredstava, u šatorima i drugim prostorijama s pećnim grijanjem ili prilikom gađanja u zatvorenim prostorima, može doći do trovanja ugljičnim monoksidom. Budući da ugljični monoksid (II) ima visoka difuzijska svojstva, konvencionalne plinske maske s filtrom ne mogu očistiti zrak kontaminiran ovim plinom. Znanstvenici su izradili plinsku masku s kisikom u čije se posebne patrone nalaze miješani oksidanti: 50% mangan (IV) oksid, 30% bakar (II) oksid, 15% krom (VI) oksid i 5% srebrov oksid. Ugljikov monoksid (II) u zraku oksidira se u prisutnosti ovih tvari, na primjer:
CO + MnO2 = MnO + CO2.
Osoba pogođena ugljičnim monoksidom treba svjež zrak, lijekove za srce, slatki čaj, au teškim slučajevima udisanje kisikom i umjetno disanje.
Ugljični monoksid (IV)(ugljični dioksid) 1,5 puta teži od zraka, ne podržava procese izgaranja, koristi se za gašenje požara. Aparat za gašenje požara ugljičnim dioksidom puni se otopinom natrijevog bikarbonata, a staklena ampula sadrži sumpornu ili klorovodičnu kiselinu. Kada se aparat za gašenje požara uključi, počinje se događati sljedeća reakcija:
2NaHCO3 + H2SO4 = Na2SO4 + 2H2O + 2CO2.
Oslobođeni ugljični dioksid obavija vatru gustim slojem, zaustavljajući pristup kisika iz zraka predmetu koji gori. Tijekom Velikog Domovinskog rata takvi su se aparati za gašenje požara koristili za zaštitu stambenih zgrada u gradovima i industrijskih objekata.
Ugljikov (IV) monoksid u tekućem obliku dobro je sredstvo za gašenje požara za mlazne motore koji se nalaze u modernim vojnim zrakoplovima.
Silicij, kao poluvodič, naširoko se koristi u modernoj vojnoj elektronici. Koristi se u proizvodnji solarnih panela, tranzistora, dioda, detektora čestica u instrumentima za praćenje zračenja i izviđanje zračenja.
Tekuće staklo(zasićene otopine Na2SiO3 i K2SiO3) – dobra vatrootporna impregnacija za tkanine, drvo i papir.
Industrija silikata proizvodi različite vrste optičkih stakala koja se koriste u vojnim uređajima (dalekozori, periskopi, daljinomjeri); cement za izgradnju pomorskih baza, lansera mina, zaštitnih struktura.
U obliku staklenih vlakana, staklo se koristi za proizvodnju. stakloplastike, koji se koristi u proizvodnji projektila, podmornica i instrumenata.
Proučavajući metale, razmotrit ćemo njihovu upotrebu u vojnim poslovima
Zbog svoje čvrstoće, tvrdoće, otpornosti na toplinu, električne vodljivosti i mogućnosti strojne obrade, metali nalaze široku primjenu u vojnim poslovima: u proizvodnji zrakoplova i raketa, u proizvodnji malog oružja i oklopnih vozila, podmornica i ratnih brodova, granata , bombe, radio oprema itd. .d.
Aluminij Ima visoku otpornost na koroziju na vodu, ali ima nisku čvrstoću. U proizvodnji zrakoplova i raketa koriste se legure aluminija s drugim metalima: bakrom, manganom, cinkom, magnezijem, željezom. Kada se pravilno toplinski obrade, ove legure nude čvrstoću usporedivu s čvrstoćom srednje legiranog čelika.
Tako je nekada najjača raketa u SAD-u, Saturn 5, kojom je lansirana letjelica Apollo, izrađena od aluminijske legure (aluminij, bakar, mangan). Trupovi interkontinentalnih balističkih projektila Titan-2 izrađeni su od aluminijske legure. Lopatice propelera aviona i helikoptera izrađene su od legure aluminija s magnezijem i silicijem. Ova legura može raditi pod vibracijskim opterećenjima i ima vrlo visoku otpornost na koroziju.
termit (mješavinaFe3 O4 cpuderA.I.) koriste se za izradu zapaljivih bombi i granata. Kada se ova smjesa zapali, dolazi do burne reakcije pri čemu se oslobađa velika količina topline:
8AI + 3Fe3O4 = 4AI2O3 + 9Fe + Q.
Temperatura u reakcijskoj zoni doseže 3000°C. Na tako visokoj temperaturi oklop tenka se topi. Termitske granate i bombe imaju veliku razornu moć.
Natrij kao rashladno sredstvo koristi se za odvođenje topline s ventila u zrakoplovnim motorima, kao rashladno sredstvo u nuklearnim reaktorima (u leguri s kalijem).
Natrijev peroksid Na2O2 se koristi kao regenerator kisika na vojnim podmornicama. Čvrsti natrijev peroksid koji ispunjava regeneracijski sustav stupa u interakciju s ugljikovim dioksidom:
2Na2O2 + 2CO2 = 2Na2CO3 + O2.
Ova reakcija je temelj modernih izolacijskih plinskih maski (IG), koje se koriste u uvjetima nedostatka kisika u zraku i upotrebe kemijskih bojnih otrova. Posade modernih ratnih brodova i podmornica koriste izolacijske plinske maske koje osiguravaju bijeg posade iz natopljenog spremnika.
Natrijev hidroksid koristi se za pripremu elektrolita za alkalne baterije, koje se koriste za opremanje modernih vojnih radio postaja.
Litij koristi se u proizvodnji tragačkih metaka i projektila. Litijeve soli daju im svijetli plavo-zeleni trag. Litij se također koristi u nuklearnoj i termonuklearnoj tehnologiji.
Litijev hidrid služio je američkim pilotima tijekom Drugog svjetskog rata kao prijenosni izvor vodika. U slučaju nesreća nad morem pod utjecajem vode, tablete litij-hidrida trenutno se raspadaju, puneći vodikom opremu za spašavanje - čamce na napuhavanje, splavi, prsluke, signalne balone-antene:
LiH + H2O = LiOH + H2.
Magnezij koristi se u vojnoj opremi u proizvodnji rasvjetnih i signalnih raketa, metaka za praćenje, granata i zapaljivih bombi. Kada se zapali, magnezij proizvodi vrlo svijetao, blještavo bijeli plamen, zbog kojeg je moguće osvijetliti značajan dio područja noću.
Lagan i izdržljiv legure magnezija s bakrom, aluminijem, titanom, silicijem, naširoko se koriste u konstrukciji raketa, strojeva i zrakoplova. Koriste se za pripremu stajnog trapa i stajnog trapa za vojne zrakoplove, te pojedinih dijelova za tijela projektila.
Željezo i legure na njegovoj osnovi (lijevano željezo i čelik)široko korišten u vojne svrhe. Pri izradi modernih sustava naoružanja koriste se različite vrste legiranih čelika.
Molibden daje čeliku visoku tvrdoću, čvrstoću i žilavost. Poznata je sljedeća činjenica: oklop britanskih tenkova koji su sudjelovali u bitkama Prvog svjetskog rata bio je izrađen od ali krhkog manganskog čelika. Njemačke topničke granate slobodno su probijale masivnu granatu od takvog čelika debljine 7,5 cm. Ali čim je čeliku dodano samo 1,5-2% molibdena, tenkovi su postali neranjivi s debljinom oklopne ploče od 2,5 cm. Molibdenski čelik koristi se za napraviti oklop za tenkove, trupove brodova, topovske cijevi, topove, dijelove zrakoplova.
Kobalt koristi se u izradi čelika otpornih na toplinu, koji se koriste u proizvodnji dijelova za zrakoplovne motore i rakete.
Krom daje čeliku tvrdoću i otpornost na habanje. Krom se koristi za legiranje opruga i čelika za opruge koji se koriste u automobilima, oklopnim vozilima, svemirskim raketama i drugim vrstama vojne opreme.
Doprinos znanstvenih kemičara pobjedi u Drugom svjetskom ratu.
Velike su zasluge znanstvenika u prijeratnom i današnjem vremenu, a zadržat ću se na doprinosu znanstvenika pobjedi u Drugom svjetskom ratu. Jer rad znanstvenika ne samo da je pomogao pobjedi, već je i postavio temelje mirnog postojanja u poslijeratnom razdoblju.
Znanstvenici i kemičari aktivno su sudjelovali u osiguravanju pobjede nad nacističkom Njemačkom. Razvili su nove metode za proizvodnju eksploziva, raketnog goriva, visokooktanskog benzina, gume, oklopnog čelika, lakih legura za zrakoplovstvo i lijekova.
Do kraja rata obujam kemijske proizvodnje približio se predratnoj razini: 1945. godine iznosio je 92% razine iz 1940. godine.
Akademik Aleksandar Erminingeldovič Arbuzov- utemeljitelj jednog od najnovijih područja znanosti - kemije organofosfornih spojeva. Njegove su aktivnosti bile neraskidivo povezane s poznatom kazanskom školom kemičara. Istraživanja Arbuzova u potpunosti su bila posvećena potrebama obrane i medicine. Dakle, u ožujku 1943., optički fizičar S.I. Vavilov je napisao Arbuzovu: „Pišem vam s velikom molbom - da proizvedete 15 g 3,6-diaminoftolimida u vašem laboratoriju. Pokazalo se da ovaj lijek koji smo dobili od vas ima vrijedna svojstva u smislu fluorescencije i adsorpcije, a sada nam je potreban za proizvodnju novog obrambenog optičkog uređaja. Postojao je lijek, korišten je u proizvodnji optike za tenkove. To je bilo od velike važnosti za otkrivanje neprijatelja na velikim udaljenostima. Nakon toga, A.E. Arbuzov je izvršio druge narudžbe Optičkog instituta za proizvodnju različitih reagensa.
Čitava era u povijesti ruske kemije povezana je s imenom akademika Nikolaja Dmitrijeviča Zelinskog. Još u Prvom svjetskom ratu stvorio je plinsku masku. U razdoblju 1941.-1945. N. D. Zelinsky vodio je znanstvenu školu čija su istraživanja bila usmjerena na razvoj metoda za proizvodnju visokooktanskog goriva za zrakoplovstvo i monomera za sintetičku gumu.
Doprinos akademika Nikolaja Nikolajeviča Semenova osiguranju pobjede određen je teorijom razgranatih lančanih reakcija koje je razvio, a koja je omogućila kontrolu kemijskih procesa: ubrzati reakcije do stvaranja eksplozivne lavine, usporiti ih i čak zaustaviti bilo koja međustanica. Početkom 40-ih. N. N. Semenov i njegovi suradnici istraživali su procese eksplozije, izgaranja i detonacije. Rezultati ovih istraživanja korišteni su u ovom ili onom obliku tijekom rata u proizvodnji patrona, topničkih granata, eksploziva i zapaljivih smjesa za bacače plamena. Rezultati istraživanja refleksije i sudara udarnih valova tijekom eksplozija korišteni su već u prvom razdoblju rata u izradi kumulativnih granata, granata i mina za borbu protiv neprijateljskih tenkova.
Akademik Aleksandar Evgenijevič Fersman Nisam rekao da je njegov život ljubavna priča za kamen. Pionir i neumorni istraživač apatita na poluotoku Kola, ruda radija u Fergani, sumpora u pustinji Karakum, nalazišta volframa u Transbaikaliji, jedan od tvoraca industrije rijetkih elemenata, od prvih dana rata aktivno je sudjelovao u proces prelaska znanosti i industrije na vojne temelje. Obavljao je posebne poslove na vojnoinženjerskoj geologiji, vojnoj geografiji, te na proizvodnji strateških sirovina i maskirnih boja. Godine 1941. na antifašističkom skupu znanstvenika rekao je: “Rat je zahtijevao golemu količinu osnovnih vrsta strateških sirovina. Bio je potreban čitav niz novih metala za zrakoplovstvo, za oklopni čelik, bio je potreban magnezij, stroncij za baklje i baklje, bilo je potrebno više joda... A mi imamo odgovornost za osiguranje strateških sirovina, moramo pomoći s našim znanja za stvaranje boljih tenkova, aviona, kako bi brzo oslobodili sve narode od invazije Hitlerove bande.”
Najveći kemijski tehnolog Semjon Isaakovič Volfkovič proučavao spojeve fosfora, bio ravnatelj Istraživačkog instituta za gnojiva i insekticide. Zaposlenici ovog instituta stvarali su fosforno-sumporne legure za boce koje su služile kao protutenkovske "bombe", proizvodili kemijske grijače za vojnike i patrole, razvijali lijekove protiv ozeblina, opeklina i druge lijekove potrebne za sanitarnu službu.
Profesor Vojne akademije kemijske obrane Ivan Ludvigovich Knunyants razvila pouzdanu osobnu zaštitnu opremu za ljude protiv otrovnih tvari. Za te studije 1941. godine dobio je Državnu nagradu SSSR-a.
Još prije početka Velikog domovinskog rata, profesor na Vojnoj akademiji kemijske obrane Mihail Mihajlovič Dubinjin proveo istraživanja sorpcije plinova, para i otopljenih tvari čvrstim poroznim tijelima. M.M. Dubinin je predani autoritet za sva važna pitanja vezana uz kemijsku zaštitu dišnog sustava.
Znanstvenici su od samog početka rata dobili zadatak razviti i organizirati proizvodnju lijekova za suzbijanje zaraznih bolesti, prvenstveno tifusa, čiji su prijenosnici uši. Pod vodstvom Nikolaj Nikolajevič Melnikov Organizirana je proizvodnja prašine, kao i raznih antiseptika za drvene letjelice.
Akademik Aleksandar Naumovič Frumkin– jedan od utemeljitelja suvremenog učenja o elektrokemijskim procesima, utemeljitelj škole elektrokemičara. Proučavao je problematiku zaštite metala od korozije, razvio fizikalnu i kemijsku metodu za pričvršćivanje tla za zračne luke i recept za protupožarnu impregnaciju drva. Zajedno sa svojim kolegama razvio je elektrokemijske osigurače. Rekao je: “Nema sumnje da je kemija jedan od bitnih čimbenika o kojima ovisi uspjeh modernog ratovanja. Proizvodnja eksploziva, visokokvalitetnih čelika, lakih metala, goriva - sve su to razne namjene kemije, a da ne govorimo o posebnim oblicima kemijskog oružja. U suvremenom ratovanju njemačka kemija svijetu je do sada podarila jednu “novu stvar” – masovnu upotrebu stimulansa i narkotika koji se daju njemačkim vojnicima prije slanja u sigurnu smrt. Sovjetski kemičari pozivaju znanstvenike iz cijelog svijeta da iskoriste svoje znanje u borbi protiv fašizma.”
Akademik Sergej Semenovič Nametkin, jedan od utemeljitelja petrokemije, uspješno je radio na području sinteze novih organometalnih spojeva, otrovnih i eksplozivnih tvari. Za vrijeme rata radio je na pitanjima kemijske obrane. , razvoj proizvodnje motornih goriva i ulja.
Istraživanje Valentin Aleksejevič Kargin pokrivao je širok raspon pitanja iz fizikalne kemije, elektrokemije i fizikalne kemije makromolekulskih spojeva. Tijekom rata V. A. Kargin razvio je posebne materijale za izradu odjeće koja štiti od utjecaja otrovnih tvari, princip i tehnologiju nove metode obrade zaštitnih tkanina, kemijske sastave koji čine cipele od filca vodootporne i posebne vrste gume za borbena vozila naše vojske.
redoviti profesor, načelnik Vojne akademije kemijske obrane i načelnik Katedre za analitičku kemiju Jurij Arkadijevič Kljačko ustrojio bataljun iz akademije i bio šef borbenog sektora na najbližim prilazima Moskvi. Pod njegovim vodstvom pokrenut je rad na stvaranju novih sredstava kemijske obrane, uključujući istraživanje dimova, protuotrova i bacača plamena.
Dana 17. lipnja 1925. godine 37 država potpisalo je Ženevski protokol, međunarodni sporazum kojim se zabranjuje uporaba zagušljivih, otrovnih i drugih sličnih plinova u ratu. Do 1978. dokument su potpisale gotovo sve zemlje.
Zaključak.
Kemijsko oružje, naravno, treba uništiti što je prije moguće; ono je smrtonosno oružje protiv čovječanstva. Ljudi se također sjećaju kako su nacisti ubili stotine tisuća ljudi u plinskim komorama u koncentracijskim logorima i kako su američke trupe testirale kemijsko oružje tijekom Vijetnamskog rata.
Uporaba kemijskog oružja danas je zabranjena međunarodnim sporazumom. U prvoj polovici 20.st. otrovne tvari su ili utopljene u moru ili zakopane u zemlju. Nema potrebe objašnjavati što to podrazumijeva. Danas se otrovne tvari spaljuju, ali ova metoda ima i svojih nedostataka. Pri gorenju u konvencionalnom plamenu njihova koncentracija u ispušnim plinovima premašuje maksimalno dopuštenu desetke tisuća puta. Visokotemperaturno naknadno izgaranje ispušnih plinova u plazma električnoj peći (metoda usvojena u SAD) pruža relativnu sigurnost.
Drugi pristup uništavanju kemijskog oružja je prvo neutralizirati otrovne tvari. Dobivene neotrovne mase mogu se spaliti ili preraditi u čvrste netopljive blokove, koji se potom zakapaju u posebna grobišta ili koriste u cestogradnji.
Trenutačno se naširoko raspravlja o konceptu uništavanja otrovnih tvari izravno u streljivu, a predlaže se i prerada netoksičnih reakcijskih masa u kemijske proizvode za komercijalnu upotrebu. Ali uništavanje kemijskog oružja i znanstvena istraživanja na ovom području zahtijevaju velika ulaganja.
Želio bih se nadati da će problemi biti riješeni i da će se snaga kemijske znanosti usmjeriti ne na razvoj novih otrovnih tvari, već na rješavanje globalnih problema čovječanstva.
Rabljene knjige:
Kushnarev A.A. kemijsko oružje: jučer, danas, sutra //
Kemija u školi - 1996. - br.1;
Kemija u školi – 4’2005
Kemija u školi – 7’2005
Kemija u školi – 9’2005;
Kemija u školi – 8’2006
Kemija u školi – 11’2006.