Kemijska veza u amonijevom kloridu. Vrste kemijskih veza. Kemijska svojstva amonijevog klorida
§5. A za soli, tradicionalna je ionska veza
Koju će vrstu kemijske veze imati ako je tvore atomi elemenata koji imaju vrlo različitu elektronegativnost - na primjer, alkalni metal natrij i halogen klor?
Atomski elektron natrij Na, koji se nalazi na vanjskoj valentnoj razini, veliki je ljubitelj šetnje po susjedstvu i često se čak zaboravi vratiti kući u svoju rodnu atomsku jezgru. A tada atom natrija ostaje bez svojeglavog elektrona i pretvara se u kation Na+:
Na 0 − 1 e− = Na +
Sedam elektrona atoma klor Cl Naprotiv, nepopravljivi su domaći, ne vole ići u posjete, ali rado primaju goste. Ako se neki susjedni elektron okrene prema njima, to je atom klor pretvorit će se u anion Cl¯, koji se obično naziva klorid-ion:
Cl 0 + 1 e− = Cl −
Ioni suprotnog naboja će se međusobno privlačiti; formira se Na+ ionska veza ~~~~ Cl −. Tako ispada natrijev klorid NaCl, svi znaju sol.
Prirodna kuhinjska sol je mineral.
U prirodi ovaj mineral nastaje iz slane morske ili jezerske vode. Kada se ohladi pod slojem otopine soli, otkrivaju se njegovi kristali - prozirne kockice natrijev klorid. Ioni koji čine natrijev klorid, obrazac ionski kristal, koji se sastoji od kationa natrij Na+ I kloridni anioni Cl −.
Kada se čvrsta tvar formira od otopljenih iona, kationi i anioni nisu raspoređeni u kristalu slučajno, već na takav način da se pozitivni i negativni naboji međusobno izmjenjuju. Tada će biti jaka kristalna ćelija sol NaCl, koji se sastoji od iona.
Na sličan način građeni su i kristali drugih soli - natrijev karbonat Na2CO3 (soda), amonijev klorid NH4Cl (amonijak), srebrni nitrat AgNO3 (lapis) i mnogi drugi.
Je li istina da su sve soli izgrađene od pojedinačnih iona koji postoje sami? Istina, ali postoji mali "ali"...
Kation soli zadržava neki dio elektronskog oblaka, jer se čak i najzločestiji elektron s vremena na vrijeme vraća kući. Ali vrlo velik dio ovog oblaka pomaknut je prema anionu soli. Stoga se razmatra ionska veza granični slučaj kovalentne polarne veze.
DEFINICIJA
Amonij– pozitivno nabijen poliatomski ion.
Kemijska formula NH4+
Amonijev ion NH 4 + je pravilan tetraedar sa središtem i atomima na vrhovima tetraedra.
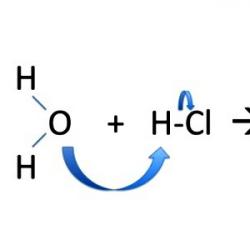
U molekuli amonijaka NH 3 tri elektronska para tvore tri N – H veze, četvrti elektronski par koji pripada atomu dušika je usamljen. Uz pomoć ovog elektronskog para nastaje veza s ionom vodika koji ima praznu orbitalu:

Dakle, u amonijevom ionu nastaju tri kovalentne veze mehanizmom izmjene, a jedna donor-akceptorskim mehanizmom. Mehanizam nastanka ne utječe na karakteristike veze; sve veze u amonijevom kationu su ekvivalentne.
Amonijevi spojevi
Amonijev kation može tvoriti amonijeve spojeve s različitim protuionima, u kojima je pozitivno nabijen atom dušika kovalentno vezan na vodikove ione i (ili) organske radikale, te ionski vezan na neki anion.
Anorganski amonijevi spojevi
Amonijak hidrat(amonijev hidroksid, amonijačna voda, amonijev hidroksid, amonijev hidroksid). Formula: NH3H2O
Nastaje kada amonijak reagira s vodom. Slaba baza disocira u vodi stvarajući amonijeve katione i hidroksidne ione:
Reakcija je reverzibilna, stoga vodene otopine amonijevog hidroksida uvijek imaju karakterističan oštar miris amonijaka.
Amonijeve soli
Sve amonijeve soli slične su svojstvima odgovarajućim natrijevim solima. Dobro se otapaju u vodi, u vodenoj otopini potpuno disociraju, a zagrijavanjem se razgrađuju:
U otopini hidroliziraju kationom:
Organski amonijevi spojevi podijeljeno brojem organskih radikala povezanih s atomom dušika na primarne (R 1 NH 3) + X –, sekundarne (R 1 R 2 NH 2) + X –, tercijarne (R 1 R 2 R 3 NH) + X – , i kvaternarni (R 1 R 2 R 3 R 4 N) + X – .
Primarni, sekundarni i tercijarni amonijevi spojevi mogu se smatrati solima odgovarajućih amina; mogu se dobiti reakcijom ovih amina s kiselinama:
gdje su R1, R2, R3 organski radikali ili vodik, X je anion kiselinskog ostatka.
Kvalitativna reakcija za amonijeve ione - interakcija s alkalijama uz oslobađanje amonijaka:
Primjeri rješavanja problema
PRIMJER 1
| Vježbajte | Koju pH vrijednost (više ili manje od 7) ima vodena otopina amonijevog klorida? Napišite molekularne i ionsko-molekulske jednadžbe hidrolize. |
| Riješenje | NH 4 Cl je sol slabe baze i jake kiseline, pa se hidroliza odvija preko kationa. Molekularna jednadžba: Puna ionska jednadžba: Kratka ionska jednadžba: Tijekom procesa hidrolize nastao je vodik (H+) pa otopina ima kiselu okolinu (pH |
| Odgovor | pH otopine amonijevog klorida manji je od 7. |
PRIMJER 2
| Vježbajte | Kolika masa soli nastaje međudjelovanjem 44,8 litara amonijaka i 33,6 litara klorovodika (normalni uvjeti)? | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Riješenje | Napišimo jednadžbu reakcije: Molarne mase amonijaka, klorovodika i nastale soli, amonijevog klorida (NH 4 Cl), jednake su. Kemijska veza. Kristalna ćelija Odgovori na zadatke su riječ, izraz, broj ili niz riječi, brojevi. Odgovor napišite bez razmaka, zareza ili drugih dodatnih znakova. Početak forme 1 Amonijev klorid sadrži kemijske veze: 1. ionski 2. kovalentni polarni 3. kovalentni nepolarni 4. vodik 5. metalni 2 Međumolekulske vodikove veze u tekućem stanju karakteristične su za: 1. vodik 2. voda 3. amonijak 4. acetaldehid 5. izobutan 3 Kovalentne nepolarne kemijske veze nalaze se u tvarima: 1. bijeli fosfor 2. fosforna kiselina 3. amonijak 4. etilni alkohol 5. rombični sumpor 4 S ponuđenog popisa odaberite dva spoja koji sadrže ionsku kemijsku vezu. 1. Ca(ClO 2 ) 2 2. HClO 3 3. NH 4 Cl 4.HClO 4 5.C l2O 7 5 S ponuđenog popisa odaberite dva spoja koji sadrže kovalentna nepolarna kemijska veza. 1. Ca 2. N 2 3. AlCl 3 4. HClO 4 5. Cl 2 6 Kalijev sulfat sadrži kemijske veze: 1. ionski 2. kovalentni nepolarni 3. kovalentni polarni 4. vodik 5. metal 7 U tvari su prisutne i ionske i kovalentne kemijske veze: 1. HCl 2. H 2 TAKO 4 3. NaOH 4. NH 4 Br 5. C 2 N 5 ON 8 S predloženog popisa odaberite dva spoja između molekula kojih a vodikova veza. 1. fenol 2. dietil eter 3. Etil acetat 4. mravlja aldehid 5. mravlja kiselina 9 S ponuđenog popisa odaberite dva spoja koji sadrže kovalent polarna kemijska veza. 1. CaCl 2 2. HCl 3. BaO 4. KSIO 4 5. Cl 2 10 Imaju nemolekularnu strukturu: 1. kalijev hidroksid 2. amonijak 3. octena kiselina 4. dušična kiselina 5. grafit 11 Ionske veze se ostvaruju u svakoj od dvije tvari: 1. Al 2 O 3 IFeCl 3 2.K 2 SINaNO 3 3. KNO 2 i NE 2 4. HF i HCl 5. NaBr i NH 4 F 12 Atomska kristalna rešetka u čvrstom stanju ima: 1. kisik 2. bijeli fosfor 3. crveni fosfor 4. dijamant 5. natrijev klorid 13 S ponuđenog popisa odaberite dva spoja u kojima se stvara kemijska veza zbog zajedničkog para elektrona. 1. ca 2. H 2 O 3. NaCl 4. CaO 5. Cl 2 14 Molekularna struktura je: 1. propanol-2 2. kalijev acetat 3. ugljikov dioksid 4. natrijev metoksid 5. kalcijev karbonat 15 Sve tvari s ionskom kristalnom rešetkom 1. tvrd 2. plastičan 3. relativno hlapljiv 4. visoko topljivi u vodi 5. imaju visoka tališta 16 S ponuđenog popisa odaberite dva spoja čije molekule tvore vodikovu vezu. 1. metan 2. silan 3. amonijak 4. fosfin 5. voda Kraj forme Amonijev klorid (amonijev klorid, amonijak) je anorganski spoj koji se široko koristi u raznim područjima. S kemijskog gledišta, to je amonijeva sol; formula NH 4 Cl. Amonijev klorid bio je poznat već u staroj Grčkoj i starom Egiptu. Jedno od njegovih imena, "amonijak", dolazi od egipatskog "nushadir" - tvari koju su svećenici skupljali na zidovima špilja kako bi udahnuli njezine pare prije ceremonije i uskladili se na komunikaciju s božanskim silama. "Amonijak" svoje ime potiče od egipatskog boga sunca Amona. U staroj Grčkoj tvar se dobivala iz čađe koja se stvarala na stjenkama dimnjaka uslijed spaljivanja devinog izmeta koji je Grcima služio kao gorivo (amonijev klorid dobiva se razgradnjom životinjskih i ljudskih izlučevina). Amonijev klorid se prirodno pojavljuje u vulkanskim špiljama i u blizini pukotina u zemljinoj kori, u obliku plaka ili kore. SvojstvaNH 4 Cl je bijeli kristalni prah (tehnički reagens može biti žućkast ili ružičast), blago higroskopan, bez mirisa i slankastog okusa. Dobro se otapa u vodi i tekućem amonijaku, s povećanjem temperature povećava se topljivost u vodi. Reagira s alkalijama i stvara sol, vodu i amonijak. Reagens se u znatno manjoj mjeri otapa u etil i metil alkoholima. Gori uz oslobađanje gustog bijelog dima. Potpuno se raspada na temperaturama iznad 338 °C, kao i pod utjecajem električne struje. Izgaranjem amonijevog klorida oslobađa se amonijak, koji iritira dišne puteve. Vodena otopina reagensa je amonijak, tekućina oštrog mirisa koja ima stimulirajući učinak na živčani sustav. Reagens se koristi kao lijek, ali liječenje amonijakom treba provoditi strogo prema preporuci liječnika, jer predoziranje može dovesti do respiratornog zastoja i kome (alkalne otopine, na primjer, natrijev bikarbonat, primjenjuju se kao protuotrov) . Osim toga, ovaj lijek ima kontraindikacije.
Amonijev klorid je klasificiran kao umjereno opasna tvar (klasa 3), s njim treba raditi u zaštitnoj opremi: gumene rukavice, zaštitne naočale i respirator, u prostoriji s dovodnom i ispušnom ventilacijom. Potrebno je paziti da reagens ne dođe u dodir s kožom i sluznicom. Spremite kemikaliju Reagens je potreban u hermetički zatvorenim višeslojnim vrećicama, u zatvorenim prostorima bez pristupa vlazi. Veza je opasna za okoliš. PrimjenaU obojenoj metalurgiji za dekapiranje metala. U trgovini Prime Chemicals Group možete kupiti 1. Najpolarnije veze u molekuli su: a) HC1 b) AsH 3 c) PH 3 r) H 2 S 2. Molekula ima linearni oblik: a) H 2 O b) H 2 S c) WeC1 2 d) OF 2 3. Geometrijski oblik molekule CH 4 metana: a) uglata b) piramidalna b) trokutasti d) tetraedarski 4. Molekula ima piramidalni oblik: a) BC1 3 b) SiBr 4 c) A1Br 3 d) PC1 3 5. Polarna molekula je: a) CO 2 b) CH 4 b) NH 3 r) N 2 6. Broj σ-veza je tri puta veći od broja π-veza u molekuli: a) klornata kiselina b) ortofosforna kiselina c) sumporna kiselina d) perklorna kiselina 7. U kojem nizu su prikazane formule spojeva samo s kovalentnom vezom? a) BaCl 2, CdC1 2, LiF c) NaCl, CuSO 4, Fe(OH) 3 b) H 2 O, SiO 2, CH3COOH d) N 2, HNO 3, NaNO 3 8. Koje vrste kemijskih veza ne postoje u amonijevom kloridu? a) kovalentni polarni b) kovalentni nepolarni c) donor-akceptor d) ionski 9. Kemijska veza nastala između atoma elemenata s atomskim brojevima 3 i 9: a) kovalentni polarni b) metalni c) kovalentni nepolarni d) ionski 10. Koliko elektrona sadrži molekula etilena? Ne sudjeluju u stvaranju kemijskih veza? a) 4 b) 8 c) 12 d) 16 11. Broj elektrona koji sudjeluju u stvaranju kemijskih veza je najveći u molekuli: a) H 2 O b) C1 2 b) H 2 S r) N 2 12. Atomska kristalna rešetka ima: a) natrijev hidroksid c) željezo b) dijamant d) led 13. Koji je tip kristalne rešetke karakterističan za spojeve s-metala s p-elementima koji imaju visoku elektronegativnost? a) metalni b) atomski b) ionski d) molekularni 14. U kojem redu su navedene tvari s atomskom, molekularnom i ionskom kristalnom rešetkom u čvrstom stanju? a) dijamant, natrijev klorid, grafit b) bijeli fosfor, voda, kreda c) silicijev (IV) oksid, bakar, dušik d) dijamant, ugljikov dioksid, kalijev fluorid 15. Što se mijenja kada iz amonijaka i klorovodika nastane amonijev klorid? a) oksidacijsko stanje atoma dušika b) oksidacijsko stanje i valenciju atoma dušika c) valencija atoma dušika d) oksidacijsko stanje atoma vodika 16. Koja je od navedenih čestica nastala donor-akceptorskim mehanizmom? a)F 2 b)HF c)BF 4 – d)BF 3 17. U kojoj tvari je oksidacijsko stanje i valencija dušika jednaka po apsolutnoj vrijednosti? a) N 2 b) NH 3 b) HNO 3 d) NH 4 C1 18. Koja je molekula najmanje stabilna? a)H 2 O 6) H 2 S B) H 2 Se d) H 2 Te 19. Koja je kemijska veza najmanje jaka? a) metalni b) vodik b) ionski d) kovalentni 20. Atom kojeg elementa pokazuje najveću sklonost stvaranju ionskih veza? a) C b) Si c) F d) P 21. Kako se mijenja polaritet i snaga veze u nizu molekula HF → HC1 → HI? a) povećavaju se i polaritet i snaga veze b) polaritet raste, snaga opada c) i polaritet i snaga veze se smanjuju d) polaritet se smanjuje, snaga raste 22. Koja se vrsta orbitala atoma vodika i klora preklapa pri formiranju molekule klorovodika? a) s I s b) s I R V) R I R G) str I s 23. U kojoj molekuli su sve veze polarne kovalentne? a) H 2 O 2 b) C 2 H 4 c) C 2 H 2 d) CO 2 24. Koji element ima najveću algebarsku vrijednost najvišeg oksidacijskog stanja? a) fluor b) krom c) ugljik d) klor 25. Koji element ima najnižu algebarsku vrijednost najnižeg oksidacijskog stanja? a) dušik b) sumpor c) vodik d) brom 26. U kojem spoju vodik ima negativno oksidacijsko stanje? a) NH 4 Cl b) CaH 2 c) H 2 O 2 d) HF 27. U spojevima BC1 3, Be1 2 i SiBr 4, valentne orbitale središnjih atoma su redom u sljedećim hibridnim stanjima: a) sp, sp 2, sp 3 V) sp, sp 3, sp 2 b) sp 2, sp, sp 3 G) sp 3 , sp 2 , sp 28. Valencija dušika u sljedećim spojevima: N 2, NH 3, NH 4 +, CH 3 NH 2, HNO 3 - jednaki su: a) 0, III, IV, V, V c) III, III, IV, III, IV b) I, III, III, IV, IV r) III, III, III, IV, V 29. Ispravna karakteristika ionske veze je: b) usmjeren, nezasićen c) usmjeren, saturabilan d) neusmjeren, saturabilan 30. Ispravna karakteristika kovalentne veze je: a) neusmjeren, nezasićen b) usmjeren, nezasićen c) usmjeren, saturabilan d) neusmjeren, saturabilan 31. Dvostruke veze između atoma postoje u svakom spoju uključenom u skupinu: a) CO, CO 2 c) S 8, C 2 H 4 b) C2H2, SO2 d) CO2, C2H4 32. Trostruke veze između atoma postoje u svakom spoju uključenom u skupinu: a) CO, N 2 b) N 2, SO 2 c) S 8, C 2 H 2 d) CO 2, C 2 H 4 33. Za koji element je najviši stupanj oksidacije veći od broja skupine u kojoj se nalazi u periodnom sustavu? a) mangan b) zlato c) bor d) dušik 34. Kvantitativna karakteristika elemenata, koja nam omogućuje prosuđivanje vrste kemijske veze između atoma tih elemenata, je: a) atomski radijus c) elektronegativnost b) naboj jezgre d) atomska masa 35. Jednostruke polarne, dvostruke nepolarne, jednostruke nepolarne i trostruke polarne veze postoje u molekulama sljedećih tvari: a) HF, C 2 H 4, Br 2, CO c) H 2, CO 2, HC1, N 2 b) HBr, SO 3, N 2, C 2 H 2 d) C1 2, O 2, C 2 H 6, CO 36. Ukupni σ-broj i π-veze u molekuli dikromne kiseline su redom: a) 10 i 4 b) 4 i 10 c) 6 i 2 d) 2 i 6 37. Zadane tvari: cezijev klorid, bakar, dijamant, rombični sumpor, led, natrijev oksid, jod, “suhi led” (kruti CO 2), grafit, platina, kalijev hidrid. Među njima je broj tvari s atomskom kristalnom rešetkom jednak: a) 4 b) 3 c) 2 d) 1 38. Zadane tvari: cezijev klorid, bakar, dijamant, rombični sumpor, led, natrijev oksid, jod, “suhi led” (kruti CO 2), grafit, platina, kalijev hidrid. Među njima je broj tvari s molekularnom kristalnom rešetkom jednak: a) 4 b) 3 c) 2 d) 1 39. Zadane tvari: cezijev klorid, bakar, dijamant, rombični sumpor, led, natrijev oksid, jod, “suhi led” (kruti CO 2), grafit, platina, kalijev hidrid. Među njima je broj tvari s ionskom kristalnom rešetkom jednak: a) 4 b) 3 c) 2 d) 1 40. Zadane tvari: cezijev klorid, bakar, dijamant, rombični sumpor, led, natrijev oksid, jod, “suhi led” (kruti CO 2), grafit, platina, kalijev hidrid. Među njima je broj tvari s metalnom kristalnom rešetkom jednak: a) 4 b) 3 c) 2 d) 1
|

 U industriji se amonijev klorid dobiva kao nusprodukt u proizvodnji sode. U laboratoriju se spoj može sintetizirati iz klora i amonijaka ili propuštanjem amonijaka i klorovodika kroz otopinu kuhinjske soli.
U industriji se amonijev klorid dobiva kao nusprodukt u proizvodnji sode. U laboratoriju se spoj može sintetizirati iz klora i amonijaka ili propuštanjem amonijaka i klorovodika kroz otopinu kuhinjske soli.