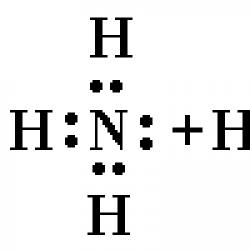Vodorod tuzlar bilan reaksiyaga kirishadimi? Vodorod. Vodorodning tuzilishi va xossalari. Metall va nometalllarning vodorod birikmalari. Elementning elektron tuzilishining xususiyatlari
MINSK TEXNOLOGIYA VA ENGIL SANOAT DIZAYNASI KOLLEJI
Insho
fan: kimyo
Mavzu: “Vodorod va uning birikmalari”
Tayyorlagan shaxs: 1-kurs talabasi 343 ta guruh
Viskup Elena
Tekshirildi: Alyabyeva N.V.
Minsk 2009 yil
Davriy sistemadagi vodorod atomining tuzilishi
Oksidlanish holatlari
Tabiatda tarqalishi
Vodorod oddiy modda sifatida
Vodorod birikmalari
Adabiyotlar ro'yxati
Davriy sistemadagi vodorod atomining tuzilishi
Davriy jadvalning birinchi elementi (1-davr, seriya raqami 1). U boshqa kimyoviy elementlar bilan to'liq o'xshashlikka ega emas va hech qanday guruhga kirmaydi, shuning uchun jadvallarda u shartli ravishda IA guruhiga va / yoki VIIA guruhiga joylashtirilgan.
Vodorod atomi barcha elementlarning atomlari ichida eng kichiki va eng yengilidir. Atomning elektron formulasi 1s 1. Elementning erkin holatda mavjudligining odatiy shakli diatomik molekuladir.
Oksidlanish holatlari
Elektromanfiy elementlar ko'proq bo'lgan birikmalardagi vodorod atomi +1 oksidlanish darajasini ko'rsatadi, masalan, HF, H 2 O va boshqalar. Metall gidridli birikmalarda esa vodorod atomining oksidlanish darajasi -1 ga teng, masalan NaH, CaH. 2 va boshqalar. U tipik metallar va metall bo'lmaganlar o'rtasida oraliq elektromanfiylik qiymatiga ega. Sirka kislotasi yoki spirt kabi organik erituvchilardagi ko'plab organik birikmalarni katalitik tarzda kamaytirishga qodir: to'yinmagan birikmalarni to'yinganlarga, ba'zi natriy birikmalarini ammiak yoki aminlarga.
Tabiatda tarqalishi
Tabiiy vodorod ikkita barqaror izotopdan iborat - protiy 1 H, deyteriy 2 H va tritiy 3 H. Aks holda deyteriy D, tritiy esa T sifatida belgilanadi. Har xil kombinatsiyalar mumkin, masalan, NT, HD, TD, H 2, D 2 , T2. Vodorod tabiatda oltingugurt (H 2 S), kislorod (suv holida), uglerod, azot va xlor bilan har xil birikmalar holida koʻproq uchraydi. Kamdan-kam hollarda fosfor, yod, brom va boshqa elementlar bilan birikmalar shaklida. U barcha o'simlik va hayvon organizmlari, neft, qazilma ko'mir, tabiiy gaz, bir qator minerallar va jinslarning bir qismidir. Erkin holatda u juda kam miqdorda - vulqon gazlarida va organik qoldiqlarning parchalanish mahsulotlarida uchraydi. Vodorod koinotdagi eng keng tarqalgan element (taxminan 75%). U Quyosh va aksariyat yulduzlarning, shuningdek, asosan vodoroddan tashkil topgan Yupiter va Saturn sayyoralarining tarkibiy qismidir. Ba'zi sayyoralarda vodorod qattiq holatda bo'lishi mumkin.
Vodorod oddiy modda sifatida
Vodorod molekulasi kovalent qutbsiz aloqa bilan bog'langan ikkita atomdan iborat. Jismoniy xususiyatlar- rangsiz va hidsiz gaz. U kosmosda boshqa gazlarga qaraganda tezroq tarqaladi, kichik teshiklardan o'tadi va yuqori haroratlarda po'lat va boshqa materiallarga nisbatan osonlik bilan kiradi. Yuqori issiqlik o'tkazuvchanligiga ega.
Kimyoviy xossalari. Oddiy holatda past haroratlarda u faol emas, u ftor va xlor bilan qizdirmasdan (yorug'lik borligida) reaksiyaga kirishadi.
H 2 + F 2 2HF H 2 +Cl 2 hv 2HClMetalllarga qaraganda metall bo'lmaganlar bilan faolroq o'zaro ta'sir qiladi.
Turli moddalar bilan o'zaro ta'sirlashganda, u ham oksidlovchi, ham qaytaruvchi xususiyatlarni namoyon qilishi mumkin.
Vodorod birikmalari
Vodorod birikmalaridan biri galogenlardir. Ular vodorod VIIA guruhi elementlari bilan birlashganda hosil bo'ladi. HF, HCl, HBr va HI rangsiz gazlar, suvda yaxshi eriydi.
Cl 2 + H 2 OHClO + HCl; HClO-xlorli suvHBr va HI odatiy qaytaruvchi moddalar bo'lganligi sababli, ularni HCl kabi almashinuv reaktsiyasi orqali olish mumkin emas.
CaF 2 + H 2 SO 4 = CaSO 4 + 2HF
Suv tabiatda eng keng tarqalgan vodorod birikmasidir.
2H 2 + O 2 = 2H 2 O
Uning rangi, ta'mi va hidi yo'q. Juda zaif elektrolit, lekin ko'plab metallar va metall bo'lmaganlar, asosiy va kislotali oksidlar bilan faol reaksiyaga kirishadi.
2H 2 O + 2Na = 2NaOH + H 2
H 2 O + BaO = Ba(OH) 2
3H 2 O + P 2 O 5 = 2H 3 PO 4
Og'ir suv (D 2 O) suvning izotopik navidir. Og'ir suvda moddalarning eruvchanligi oddiy suvga qaraganda ancha past. Og'ir suv zaharli hisoblanadi, chunki u tirik organizmlardagi biologik jarayonlarni sekinlashtiradi. Suvni takroriy elektroliz qilish jarayonida elektroliz qoldig'ida to'planadi. Yadro reaktorlarida sovutish suvi va neytron moderatori sifatida ishlatiladi.
Gidridlar - vodorodning metallar (yuqori haroratda) yoki vodorodga qaraganda kamroq elektromanfiy bo'lmagan metall bo'lmaganlar bilan o'zaro ta'siri.
Si + 2H 2 = SiH 4
Vodorodning o'zi XVI asrning birinchi yarmida kashf etilgan. Paracelsus. 1776-yilda G.Kavendish birinchi marta uning xossalarini oʻrganib chiqdi, 1783-1787-yillarda A.Lavuazye vodorodning suv tarkibiga kirishini koʻrsatib, uni kimyoviy elementlar roʻyxatiga kiritdi va “vodorod” nomini taklif qildi.
Adabiyotlar ro'yxati
1. M.B. Volovich, O.F. Kabardin, R.A. Lidin, L.Yu. Alikberova, V.S. Roxlov, V.B. Pyatunin, Yu.A. Simagin, S.V. Simonovich / Maktab o'quvchilari uchun qo'llanma / Moskva "AST-PRESS BOOK" 2003 yil.
2. I.L. Knunyats / Kimyoviy entsiklopediya / Moskva "Sovet entsiklopediyasi" 1988 yil
3. I.E. Shimanovich / Kimyo 11 / Minsk "Xalq Asvetasi" 2008 yil
4. F. Cotton, J. Wilkinson / Zamonaviy noorganik kimyo / Moskva “Mir” 1969 y.
Vodorod H kimyoviy element bo'lib, koinotimizda eng keng tarqalgan elementlardan biridir. Moddalar tarkibidagi element sifatida vodorodning massasi boshqa turdagi atomlarning umumiy tarkibining 75% ni tashkil qiladi. Bu sayyoradagi eng muhim va hayotiy birikma - suvning bir qismidir. Vodorodning o'ziga xos xususiyati shundaki, u D.I.Mendeleyevning kimyoviy elementlarning davriy tizimidagi birinchi elementdir.
Kashfiyot va kashfiyot
Paracelsusning asarlarida vodorod haqida birinchi eslatma XVI asrga to'g'ri keladi. Ammo uni havoning gaz aralashmasidan ajratish va yonuvchan xususiyatlarini o'rganish XVII asrda olim Lemeri tomonidan amalga oshirilgan. Vodorod ingliz kimyogari, fizigi va tabiatshunosi tomonidan chuqur o'rganilib, vodorodning massasi boshqa gazlarga nisbatan eng kichik ekanligini eksperimental isbotladi. Ilm-fan rivojining keyingi bosqichlarida u bilan ko'plab olimlar ishladilar, xususan, uni "suvning tug'ilishi" deb atagan Lavuazye.
PSHE-dagi pozitsiya bo'yicha xususiyatlar
D.I.Mendeleyevning davriy sistemasini ochuvchi element vodoroddir. Atomning fizik va kimyoviy xossalari ma'lum ikkilikni ko'rsatadi, chunki vodorod bir vaqtning o'zida birinchi guruhga, asosiy kichik guruhga tegishli bo'lib tasniflanadi, agar u o'zini metall kabi tutsa va kimyoviy reaktsiya jarayonida bitta elektrondan voz kechsa va ettinchisiga - valentlik qobig'ini to'liq to'ldirishda, ya'ni uni galogenlarga o'xshash deb tavsiflovchi salbiy zarrachani qabul qilishda.

Elementning elektron tuzilishining xususiyatlari
U kiritilgan murakkab moddalarning va eng oddiy H2 moddasining xossalari birinchi navbatda vodorodning elektron konfiguratsiyasi bilan belgilanadi. Zarrachada Z= (-1) bo'lgan bitta elektron mavjud bo'lib, u o'z orbitasida birlik massali va musbat zaryadli (+1) bitta protonni o'z ichiga olgan yadro atrofida aylanadi. Uning elektron konfiguratsiyasi 1s 1 sifatida yozilgan, bu vodorod uchun eng birinchi va yagona s-orbitalda bitta manfiy zarracha mavjudligini bildiradi.
Elektron chiqarilganda yoki undan voz kechganda va bu elementning atomi metallar bilan bog'liq bo'lgan shunday xususiyatga ega bo'lsa, kation olinadi. Mohiyatan vodorod ioni musbat elementar zarradir. Shuning uchun elektrondan mahrum bo'lgan vodorod oddiygina proton deb ataladi.

Jismoniy xususiyatlar
Vodorodni qisqacha ta'riflab beradigan bo'lsak, u rangsiz, ozgina eriydigan gaz bo'lib, nisbiy atom massasi havodan 14,5 baravar engilroq, suyuqlanish harorati -252,8 daraja Selsiy bo'ladi.
Tajribadan siz H 2 eng engil ekanligini osongina tekshirishingiz mumkin. Buning uchun uchta to'pni turli xil moddalar - vodorod, karbonat angidrid, oddiy havo bilan to'ldirish va ularni bir vaqtning o'zida qo'lingizdan ozod qilish kifoya. CO 2 bilan to'ldirilgani erga tezroq etib boradi, undan keyin havo aralashmasi bilan to'ldirilgani tushadi va H 2 ni o'z ichiga olgani shiftga ko'tariladi.
Vodorod zarralarining kichik massasi va kattaligi uning turli moddalarga kirib borish qobiliyatini oqlaydi. Xuddi shu to'p misolidan foydalanib, buni tekshirish oson, bir necha kundan keyin u o'z-o'zidan o'chib ketadi, chunki gaz shunchaki kauchukdan o'tib ketadi. Vodorod ba'zi metallar (palladiy yoki platina) tarkibida ham to'planishi va harorat ko'tarilganda undan bug'lanishi mumkin.
Vodorodning past eruvchanlik xususiyati laboratoriya amaliyotida uni vodorodni siqib chiqarish yo'li bilan ajratib olish uchun qo'llaniladi (quyida ko'rsatilgan jadvalda asosiy parametrlar mavjud), uni qo'llash doirasi va ishlab chiqarish usullarini aniqlash.
| Oddiy moddaning atomi yoki molekulasi parametri | Ma'nosi |
| Atom massasi (molyar massa) | 1,008 g/mol |
| Elektron konfiguratsiya | 1s 1 |
| Kristal hujayra | Olti burchakli |
| Issiqlik o'tkazuvchanligi | (300 K) 0,1815 Vt/(m K) |
| n da zichlik. u. | 0,08987 g/l |
| Qaynatish harorati | -252,76 ° S |
| O'ziga xos yonish issiqligi | 120,9 10 6 J/kg |
| Erish harorati | -259,2 ° S |
| Suvda eruvchanligi | 18,8 ml/l |
Izotopik tarkibi
Kimyoviy elementlarning davriy tizimining boshqa ko'plab vakillari singari, vodorod ham bir nechta tabiiy izotoplarga ega, ya'ni yadrodagi protonlar soni bir xil bo'lgan atomlarga ega, ammo neytronlarning soni har xil - nol zaryad va birlik massasi bo'lgan zarralar. Xuddi shunday xususiyatga ega bo'lgan atomlarga kislorod, uglerod, xlor, brom va boshqalar, shu jumladan radioaktivlar misol bo'ladi.
Ushbu guruh vakillarining eng keng tarqalgani bo'lgan vodorod 1H ning jismoniy xususiyatlari uning hamkasblarining bir xil xususiyatlaridan sezilarli darajada farq qiladi. Xususan, ular tarkibidagi moddalarning xarakteristikalari farqlanadi. Shunday qilib, oddiy va deyterlangan suv mavjud bo'lib, unda bitta protonli vodorod atomi o'rniga deyteriy 2 H - ikkita elementar zarrachali izotopi mavjud: ijobiy va zaryadsiz. Bu izotop oddiy vodoroddan ikki baravar og'ir, bu esa ular tashkil etuvchi birikmalar xossalaridagi keskin farqni tushuntiradi. Tabiatda deyteriy vodorodga qaraganda 3200 marta kamroq uchraydi. Uchinchi vakil tritiy 3H bo'lib, uning yadrosida ikkita neytron va bitta proton mavjud.

Ishlab chiqarish va izolyatsiyalash usullari
Laboratoriya va sanoat usullari juda farq qiladi. Shunday qilib, gaz oz miqdorda, asosan, mineral moddalar ishtirokidagi reaktsiyalar natijasida hosil bo'ladi, yirik ishlab chiqarishda esa ko'proq organik sintez qo'llaniladi.
Laboratoriyada quyidagi kimyoviy o'zaro ta'sirlardan foydalaniladi:

Sanoat maqsadlarida gaz quyidagi usullar bilan ishlab chiqariladi:
- Metanning katalizator ishtirokida termal parchalanishi uning oddiy moddalariga (harorat kabi ko'rsatkichning qiymati 350 darajaga etadi) - vodorod H2 va uglerod C.
- Karbonat angidrid CO 2 va H 2 hosil qilish uchun 1000 daraja Selsiyda bug'li suvni koks orqali o'tkazish (eng keng tarqalgan usul).
- Metan gazining nikel katalizatorida 800 darajaga etgan haroratda konversiyasi.
- Vodorod kaliy yoki natriy xloridlarning suvli eritmalarini elektroliz qilish natijasida hosil bo'ladigan qo'shimcha mahsulotdir.
Kimyoviy o'zaro ta'sirlar: umumiy qoidalar
Vodorodning fizik xususiyatlari asosan ma'lum bir birikma bilan reaktsiya jarayonlarida uning harakatini tushuntiradi. Vodorodning valentligi 1 ga teng, chunki u davriy sistemada birinchi guruhda joylashgan va oksidlanish darajasi har xil. Barcha birikmalarda, gidridlardan tashqari, vodorod d.o.da = (1+), CN, CN 2, CN 3 tipidagi molekulalarda - (1-).
Umumlashtirilgan elektron juft hosil qilish natijasida hosil boʻlgan vodorod gazi molekulasi ikki atomdan iborat boʻlib, energetik jihatdan ancha barqaror, shuning uchun ham normal sharoitda u biroz inert boʻlib, normal sharoit oʻzgarganda reaksiyaga kirishadi. Vodorodning boshqa moddalar tarkibidagi oksidlanish darajasiga qarab, u ham oksidlovchi, ham qaytaruvchi vosita sifatida harakat qilishi mumkin.

Vodorod bilan reaksiyaga kirishadigan va hosil bo'ladigan moddalar
Murakkab moddalarni hosil qilish uchun elementlarning o'zaro ta'siri (ko'pincha yuqori haroratlarda):
- Ishqoriy va ishqoriy tuproq metall + vodorod = gidrid.
- Galogen + H 2 = vodorod galogenid.
- Oltingugurt + vodorod = vodorod sulfidi.
- Kislorod + H 2 = suv.
- Uglerod + vodorod = metan.
- Azot + H 2 = ammiak.
Murakkab moddalar bilan o'zaro ta'siri:
- Uglerod oksidi va vodoroddan sintez gazini ishlab chiqarish.
- H 2 yordamida metallarning oksidlaridan qaytarilishi.
- To'yinmagan alifatik uglevodorodlarning vodorod bilan to'yinganligi.
Vodorod aloqasi
Vodorodning fizik xossalari shundan iboratki, ular elektron manfiy element bilan qo'shilganda, qo'shni molekulalarning bir xil atomlari bilan bir xil elektron juftlari (masalan, kislorod, azot va ftor) bilan bog'lanishning maxsus turini yaratishga imkon beradi. Ushbu hodisani ko'rib chiqish yaxshiroq bo'lgan eng aniq misol suvdir. Uni kovalent yoki ionlarga qaraganda zaifroq bo'lgan vodorod aloqalari bilan tikilgan deb aytish mumkin, ammo ularning ko'pligi tufayli ular moddaning xususiyatlariga sezilarli ta'sir ko'rsatadi. Asosan, vodorod bog'lanishi suv molekulalarini dimer va polimerlarga bog'laydigan elektrostatik o'zaro ta'sir bo'lib, uning yuqori qaynash nuqtasiga olib keladi.
Mineral birikmalardagi vodorod
Ularning barchasida proton, vodorod kabi atomning kationi mavjud. Kislotali qoldig'i oksidlanish darajasi (-1) dan katta bo'lgan moddaga ko'p asosli birikma deyiladi. U bir nechta vodorod atomlarini o'z ichiga oladi, bu suvli eritmalarda dissotsiatsiyani ko'p bosqichli qiladi. Har bir keyingi protonni kislota qoldig'idan olib tashlash tobora qiyinlashadi. Muhitning kislotaliligi muhitdagi vodorodning miqdoriy miqdori bilan belgilanadi.

Inson faoliyatida qo'llanilishi
Moddasi bo'lgan tsilindrlar, shuningdek, kislorod kabi boshqa suyultirilgan gazlar bo'lgan idishlar o'ziga xos ko'rinishga ega. Ular yorqin qizil rangda yozilgan "Vodorod" so'zi bilan quyuq yashil rangga bo'yalgan. Gaz tsilindrga taxminan 150 atmosfera bosim ostida quyiladi. Vodorodning fizik xossalari, xususan, agregatning gazsimon holatining yengilligi, geliy bilan aralashtirilgan sharlar, sharlar va boshqalarni to'ldirish uchun ishlatiladi.
Ko'p yillar oldin odamlar foydalanishni o'rgangan fizik va kimyoviy xossalari bo'lgan vodorod hozirgi kunda ko'plab sanoat tarmoqlarida qo'llaniladi. Uning asosiy qismi ammiak ishlab chiqarishga ketadi. Vodorod shuningdek (gafniy, germaniy, galiy, kremniy, molibden, volfram, tsirkoniy va boshqalar) oksidlarida ham ishtirok etadi, reaktsiyada qaytaruvchi vosita, gidrosiyan va xlorid kislotalar, shuningdek sun'iy suyuq yoqilg'i sifatida ishlaydi. Oziq-ovqat sanoati uni o'simlik moylarini qattiq yog'larga aylantirish uchun ishlatadi.
Yog'lar, ko'mirlar, uglevodorodlar, moylar va mazutlarni gidrogenlash va gidrogenlashning turli jarayonlarida vodorodning kimyoviy xossalari va ishlatilishi aniqlandi. U kislorod-vodorod alangasi ta'sirida qimmatbaho toshlar, cho'g'lanma lampalar ishlab chiqarish, metall buyumlarni zarb qilish va payvandlash uchun ishlatiladi.
Oddiy moddalarni ishlab chiqarishning sanoat usullari tegishli elementning tabiatda mavjud bo'lgan shakliga, ya'ni uni ishlab chiqarish uchun qanday xom ashyo bo'lishi mumkinligiga bog'liq. Shunday qilib, erkin holatda mavjud bo'lgan kislorod jismoniy ravishda olinadi - suyuq havodan ajratish. Deyarli barcha vodorod birikmalar shaklida bo'ladi, shuning uchun uni olish uchun kimyoviy usullar qo'llaniladi. Xususan, parchalanish reaktsiyalaridan foydalanish mumkin. Vodorod ishlab chiqarishning bir usuli suvning elektr toki bilan parchalanishidir.
Vodorod ishlab chiqarishning asosiy sanoat usuli - bu tabiiy gazning bir qismi bo'lgan metanning suv bilan reaktsiyasi. U yuqori haroratda amalga oshiriladi (metan qaynoq suvdan o'tganda ham hech qanday reaktsiya bo'lmasligini tekshirish oson):
CH 4 + 2H 2 0 = CO 2 + 4H 2 - 165 kJ
Laboratoriyada oddiy moddalarni olish uchun ular tabiiy xom ashyolardan foydalanishlari shart emas, balki kerakli moddani ajratib olish osonroq bo'lgan boshlang'ich materiallarni tanlashadi. Masalan, laboratoriyada kislorod havodan olinmaydi. Xuddi shu narsa vodorod ishlab chiqarishga ham tegishli. Sanoatda ba'zan qo'llaniladigan vodorodni olishning laboratoriya usullaridan biri suvni elektr toki bilan parchalashdir.
Odatda, vodorod laboratoriyada sinkni xlorid kislotasi bilan reaksiyaga kiritish orqali ishlab chiqariladi.
Sanoatda
1.Suvli tuz eritmalarini elektroliz qilish:
2NaCl + 2H 2 O → H 2 + 2NaOH + Cl 2
2.Issiq koks ustidan suv bug'ini o'tkazish 1000 ° C atrofidagi haroratlarda:
H 2 O + C ⇄ H 2 + CO
3.Tabiiy gazdan.
Bug 'konversiyasi: CH 4 + H 2 O ⇄ CO + 3H 2 (1000 °C) Kislorod bilan katalitik oksidlanish: 2CH 4 + O 2 ⇄ 2CO + 4H 2
4. Neftni qayta ishlash jarayonida uglevodorodlarni kreking va isloh qilish.
Laboratoriyada
1.Suyultirilgan kislotalarning metallarga ta'siri. Ushbu reaktsiyani amalga oshirish uchun ko'pincha sink va xlorid kislota ishlatiladi:
Zn + 2HCl → ZnCl 2 + H 2
2.Kaltsiyning suv bilan o'zaro ta'siri:
Ca + 2H 2 O → Ca(OH) 2 + H 2
3.Gidridlarning gidrolizi:
NaH + H 2 O → NaOH + H 2
4.Ishqorlarning sink yoki alyuminiyga ta'siri:
2Al + 2NaOH + 6H 2 O → 2Na + 3H 2 Zn + 2KOH + 2H 2 O → K 2 + H 2
5.Elektrolizdan foydalanish. Ishqorlar yoki kislotalarning suvli eritmalarini elektroliz qilish jarayonida katodda vodorod ajralib chiqadi, masalan:
2H 3 O + + 2e - → H 2 + 2H 2 O
- Vodorod ishlab chiqarish uchun bioreaktor
Jismoniy xususiyatlar
Vodorod gazi ikki shaklda (modifikatsiya) mavjud bo'lishi mumkin - orto - va para-vodorod shaklida.
Ortovodorod molekulasida (mp. -259,10 °C, bp -252,56 °C) yadro spinlari bir xil (parallel) va paravodorodda (mp. -259,32 °C, qaynoq nuqtasi -252,89 °C) - yo'naltirilgan. bir-biriga qarama-qarshi (antiparallel).
Vodorodning allotropik shakllari suyuq azot haroratida faol uglerodga adsorbsiya yo'li bilan ajratilishi mumkin. Juda past haroratlarda ortovodorod va parahidrogen o'rtasidagi muvozanat deyarli butunlay ikkinchisiga siljiydi. 80 K da shakllarning nisbati taxminan 1: 1 ni tashkil qiladi. Qizdirilganda, desorbsiyalangan parahidrogen xona haroratida muvozanat hosil bo'lgunga qadar ortohidrogenga aylanadi (orto-para: 75:25). Katalizator bo'lmasa, transformatsiya asta-sekin sodir bo'ladi, bu alohida allotropik shakllarning xususiyatlarini o'rganish imkonini beradi. Vodorod molekulasi ikki atomli - H₂. Oddiy sharoitlarda bu rangsiz, hidsiz va ta'msiz gazdir. Vodorod eng engil gaz bo'lib, uning zichligi havo zichligidan bir necha baravar kam. Shubhasiz, molekulalarning massasi qanchalik kichik bo'lsa, ularning bir xil haroratda tezligi shunchalik yuqori bo'ladi. Eng engil molekulalar sifatida vodorod molekulalari boshqa gaz molekulalariga qaraganda tezroq harakat qiladi va shuning uchun issiqlikni bir tanadan boshqasiga tezroq o'tkazishi mumkin. Bundan kelib chiqadiki, vodorod gazsimon moddalar orasida eng yuqori issiqlik o'tkazuvchanligiga ega. Uning issiqlik o'tkazuvchanligi havoning issiqlik o'tkazuvchanligidan taxminan etti baravar yuqori.
Kimyoviy xossalari
Vodorod molekulalari H₂ ancha kuchli va vodorodning reaksiyaga kirishishi uchun ko'p energiya sarflanishi kerak: H 2 = 2H - 432 kJ Shuning uchun oddiy haroratlarda vodorod faqat juda faol metallar bilan reaksiyaga kirishadi, masalan, kaltsiy, kaltsiy hosil qiladi. gidrid: Ca + H 2 = CaH 2 va yagona metall bo'lmagan ftor bilan vodorod ftorid hosil qiladi: F 2 + H 2 = 2HF Ko'pgina metallar va metall bo'lmaganlar bilan vodorod yuqori haroratlarda yoki boshqa ta'sirlar ostida reaksiyaga kirishadi, masalan. , yoritish. U ba'zi oksidlardan kislorodni "olib tashlashi" mumkin, masalan: CuO + H 2 = Cu + H 2 0 Yozma tenglama qaytarilish reaktsiyasini aks ettiradi. Qaytarilish reaktsiyalari - kislorodni birikmadan olib tashlash jarayonlari; Kislorodni olib tashlaydigan moddalar qaytaruvchi moddalar deb ataladi (ular o'zlari oksidlanadi). Keyinchalik, "oksidlanish" va "qaytarilish" tushunchalarining yana bir ta'rifi beriladi. Va bu ta'rif, tarixan birinchi bo'lib, bugungi kunda, ayniqsa, organik kimyoda o'z ahamiyatini saqlab qoladi. Qaytarilish reaksiyasi oksidlanish reaksiyasiga qarama-qarshidir. Bu ikkala reaksiya har doim bir jarayon sifatida bir vaqtning o'zida sodir bo'ladi: bir modda oksidlanganda (qaytarilganda), boshqasining qaytarilishi (oksidlanishi) bir vaqtning o'zida sodir bo'ladi.
N 2 + 3H 2 → 2 NH 3
Galogenlar bilan hosil bo'ladi vodorod galogenidlari:
F 2 + H 2 → 2 HF, reaktsiya qorong'uda va har qanday haroratda portlovchi sodir bo'ladi, Cl 2 + H 2 → 2 HCl, reaktsiya portlovchi, faqat yorug'likda sodir bo'ladi.
Yuqori haroratda kuyikish bilan o'zaro ta'sir qiladi:
C + 2H 2 → CH 4
Ishqoriy va gidroksidi tuproq metallari bilan o'zaro ta'siri
Vodorod faol metallar bilan hosil bo'ladi gidridlar:
Na + H 2 → 2 NaH Ca + H 2 → CaH 2 Mg + H 2 → MgH 2
Gidridlar- tuzga o'xshash, oson gidrolizlanadigan qattiq moddalar:
CaH 2 + 2H 2 O → Ca(OH) 2 + 2H 2
Metall oksidlari bilan o'zaro ta'sir (odatda d-elementlar)
Oksidlar metallarga qaytariladi:
CuO + H 2 → Cu + H 2 O Fe 2 O 3 + 3H 2 → 2 Fe + 3H 2 O WO 3 + 3H 2 → W + 3H 2 O
Organik birikmalarni gidrogenlash
Vodorod to'yinmagan uglevodorodlarga nikel katalizatori ishtirokida va yuqori haroratda ta'sir qilganda, reaktsiya sodir bo'ladi. gidrogenlash:
CH 2 =CH 2 + H 2 → CH 3 -CH 3
Vodorod aldegidlarni spirtga aylantiradi:
CH 3 CHO + H 2 → C 2 H 5 OH.
Vodorodning geokimyosi
Vodorod koinotning asosiy qurilish materialidir. Bu eng keng tarqalgan element bo'lib, barcha elementlar termoyadroviy va yadroviy reaktsiyalar natijasida hosil bo'ladi.
Erkin vodorod H2 quruqlikdagi gazlarda nisbatan kam uchraydi, lekin suv shaklida u geokimyoviy jarayonlarda juda muhim rol o'ynaydi.
Vodorod minerallarda ammoniy ioni, gidroksil ioni va kristall suv shaklida bo'lishi mumkin.
Atmosferada vodorod doimiy ravishda quyosh nurlari ta'sirida suvning parchalanishi natijasida hosil bo'ladi. U atmosferaning yuqori qatlamlariga ko'chib o'tadi va kosmosga qochadi.
Ilova
- Vodorod energiyasi
Atom vodorod atomik vodorod payvandlash uchun ishlatiladi.
Oziq-ovqat sanoatida vodorod oziq-ovqat qo'shimchasi sifatida ro'yxatga olingan E949, qadoqlash gazi kabi.
Davolashning xususiyatlari
Vodorod havo bilan aralashtirilganda portlovchi aralashmani hosil qiladi - bu portlovchi gaz deb ataladi. Vodorod va kislorodning hajm nisbati 2:1 yoki vodorod va havo taxminan 2:5 bo'lsa, bu gaz eng portlovchi hisoblanadi, chunki havoda taxminan 21% kislorod mavjud. Vodorod ham yong'in xavfi hisoblanadi. Suyuq vodorod teriga tegsa, qattiq sovuqqa olib kelishi mumkin.
Vodorod va kislorodning portlovchi kontsentratsiyasi hajmi bo'yicha 4% dan 96% gacha. Havo bilan aralashganda 4% dan 75(74)% gacha.
Vodoroddan foydalanish
Kimyo sanoatida vodorod ammiak, sovun va plastmassa ishlab chiqarishda ishlatiladi. Oziq-ovqat sanoatida margarin suyuq o'simlik moylaridan vodorod yordamida tayyorlanadi. Vodorod juda engil va har doim havoda ko'tariladi. Bir paytlar dirijabllar va havo sharlari vodorod bilan to'ldirilgan edi. Ammo 30-yillarda. XX asr Havo kemalari portlab, yonib ketganda bir nechta dahshatli ofatlar yuz berdi. Hozirgi vaqtda havo kemalari geliy gazi bilan to'ldirilgan. Vodorod raketa yoqilg'isi sifatida ham ishlatiladi. Bir kun kelib, vodorod avtomobillar va yuk mashinalari uchun yoqilg'i sifatida keng qo'llanilishi mumkin. Vodorod dvigatellari atrof-muhitni ifloslantirmaydi va faqat suv bug'ini chiqaradi (garchi vodorod ishlab chiqarishning o'zi atrof-muhitning ma'lum darajada ifloslanishiga olib keladi). Quyoshimiz asosan vodoroddan iborat. Quyosh issiqligi va yorug'ligi vodorod yadrolarining sintezidan yadro energiyasining chiqishi natijasidir.
Yoqilg'i sifatida vodoroddan foydalanish (tejamkor)
Yoqilg'i sifatida ishlatiladigan moddalarning eng muhim xususiyati ularning yonish issiqligidir. Umumiy kimyo kursidan ma'lumki, vodorod va kislorod o'rtasidagi reaksiya issiqlik ajralib chiqishi bilan sodir bo'ladi. Agar standart sharoitda 1 mol H 2 (2 g) va 0,5 mol O 2 (16 g) olib, reaksiyani qo‘zg‘atsak, u holda tenglama bo‘yicha.
H 2 + 0,5 O 2 = H 2 O
reaksiya tugagandan so'ng 285,8 kJ/mol energiya chiqishi bilan 1 mol H 2 O (18 g) hosil bo'ladi (taqqoslash uchun: asetilenning yonish issiqligi 1300 kJ/mol, propan - 2200 kJ/mol) . 1 m³ vodorodning og'irligi 89,8 g (44,9 mol). Shuning uchun 1 m³ vodorod ishlab chiqarish uchun 12832,4 kJ energiya sarflanadi. 1 kVt = 3600 kJ ekanligini hisobga olsak, biz 3,56 kVt soat elektr energiyasini olamiz. 1 kVt soat elektr energiyasi va 1 m³ gaz narxini bilib, biz vodorod yoqilg'isiga o'tish tavsiya etiladi degan xulosaga kelishimiz mumkin.
Masalan, 156 litrli vodorod bakiga ega (25 MPa bosim ostida 3,12 kg vodorod mavjud) 3-avlod Honda FCX eksperimental modeli 355 km masofani bosib o'tadi. Shunga ko'ra, 3,12 kg H2 dan 123,8 kVt / soat olinadi. 100 km uchun energiya sarfi 36,97 kVt / soatni tashkil qiladi. Elektr narxini, gaz yoki benzin narxini va ularning 100 km ga avtomobil uchun sarflanishini bilib, avtomobillarni vodorod yoqilg'isiga o'tkazishning salbiy iqtisodiy samarasini hisoblash oson. Aytaylik (Rossiya 2008), kVt/soat elektr energiyasi uchun 10 tsent, 1 m³ vodorod 35,6 tsent narxga olib keladi va suvning parchalanish samaradorligini hisobga olgan holda 40-45 tsent, bir xil miqdorda kVt soat. benzinni yoqishdan chakana narxlarda 12832,4 kJ/42000 kJ/0,7 kg/l*80 tsent/l=34 tsent turadi, vodorod uchun esa transport, uskunaning eskirishi va hokazolarni hisobga olmagan holda ideal variantni hisobladik. Metan bilan metan uchun m³ uchun taxminan 39 MJ yonish energiyasi narxdagi farq tufayli natija ikki-to'rt baravar past bo'ladi (Ukraina uchun 1 m³ 179 dollar, Evropa uchun esa 350 dollar). Ya'ni, metanning ekvivalenti 10-20 sent turadi.
Ammo shuni unutmasligimiz kerakki, biz vodorodni yoqib yuborganimizda, biz undan olingan toza suvni olamiz. Ya'ni, bizda qayta tiklanadigan energiya mavjud jamg'armachi energiyaning asosiy manbalari bo'lgan gaz yoki benzindan farqli o'laroq, atrof-muhitga zarar etkazmasdan energiya.
Php on line 377 Ogohlantirish: talab (http://www..php): oqimni ochib boʻlmadi: 377-qatorda /hsphere/local/home/winexins/site/tab/vodorod.php da mos oʻram topilmadi. xato: talab (): Muvaffaqiyatsiz ochilmadi "http://www..php" (include_path="..php 377-qatorda"
29-ma'ruza
Vodorod. Suv
Ma'ruza mazmuni:
Suv. Kimyoviy va fizik xossalari
Vodorod va suvning tabiatdagi roli
Vodorod kimyoviy element sifatida
Vodorod D.I.Mendeleyev davriy sistemasining yagona elementi boʻlib, uning joylashuvi noaniq. Uning kimyoviy belgisi davriy tizimda ikki marta yoziladi: IA va VIIA guruhlarida. Bu vodorodning ham ishqoriy metallar, ham galogenlar bilan birlashtiruvchi qator xossalarga ega ekanligi bilan izohlanadi (14-jadval).
14-jadval
Vodorodning xossalarini ishqoriy metallar va galogenlarning xossalari bilan solishtirish
| Ishqoriy metallar bilan o'xshashliklar | Galogenlarga o'xshashlik |
| Tashqi energiya darajasida vodorod atomlari bitta elektronni o'z ichiga oladi. Vodorod s elementidir | Tashqi va yagona daraja tugagunga qadar vodorod atomlari, galogen atomlari kabi, bitta elektronga ega emas. |
| Vodorod kamaytiruvchi xususiyatga ega. Oksidlanish natijasida vodorod ko'pincha +1 birikmalarida topilgan oksidlanish holatini oladi | Vodorod, galogenlar kabi, gidroksidi va ishqoriy tuproq metallari bilan birikmalarda -1 oksidlanish darajasiga ega, bu uning oksidlanish xususiyatlarini tasdiqlaydi. |
| Kosmosda metall kristall panjarali qattiq vodorod mavjud deb taxmin qilinadi. | Ftor va xlor kabi vodorod ham normal sharoitda gazdir. Uning molekulalari, galogen molekulalari kabi, diatomik bo'lib, kovalent qutbsiz bog'lanish orqali hosil bo'ladi. |
Tabiatda vodorod massa raqamlari 1, 2 va 3 bo'lgan uchta izotop shaklida mavjud: protiy 1 1 H, deyteriy 2 1 D va tritiy 3 1 T. Birinchi ikkitasi barqaror izotoplar, uchinchisi esa radioaktivdir. Izotoplarning tabiiy aralashmasida protium ustunlik qiladi. H: D: T izotoplari orasidagi miqdoriy nisbatlar 1: 1,46 10 -5: 4,00 10 -15.
Vodorod izotoplarining birikmalari xossalari jihatidan bir-biridan farq qiladi. Masalan, engil protiumli suvning qaynash va muzlash nuqtalari (H 2 O) mos ravishda - 100 o C va 0 o C, deyteriy suvi (D 2 O) - 101,4 o C va 3,8 o S ga teng. Reaksiya tezligi engil suv og'ir suvdan yuqori.
Koinotda vodorod eng keng tarqalgan element hisoblanadi - u koinot massasining taxminan 75% yoki uning barcha atomlarining 90% dan ortig'ini tashkil qiladi. Vodorod Yerning eng muhim geologik qobig'i - gidrosferada suvning bir qismidir.
Vodorod uglerod bilan birga barcha organik moddalarni hosil qiladi, ya'ni u Yerning tirik qobig'i - biosferaning bir qismidir. Yer qobig'ida - litosferada - vodorodning massa miqdori atigi 0,88% ni tashkil qiladi, ya'ni u barcha elementlar orasida 9-o'rinni egallaydi. Yerning havo qobig'i - atmosferada molekulyar vodorodning ulushi bo'lgan umumiy hajmning milliondan biridan kamroq qismi mavjud. U faqat atmosferaning yuqori qismida joylashgan.
Vodorod ishlab chiqarish va undan foydalanish
Vodorodni birinchi marta 16-asrda oʻrta asr shifokori va alkimyogari Parasels temir plastinkani sulfat kislotaga botirish yoʻli bilan olgan boʻlsa, 1766 yilda ingliz kimyogari Genri Kavendish vodorod faqat temirning sulfat kislota bilan oʻzaro taʼsirida hosil boʻlishini isbotladi. balki boshqa kislotalar bilan boshqa metallar ham. Kavendish ham birinchi marta vodorodning xossalarini tasvirlab berdi.
IN laboratoriya sharoitda vodorod olinadi:
1. Metalllarning kislota bilan o‘zaro ta’siri:
Zn + 2HCl → ZnCl 2 + H 2
2. Ishqoriy va ishqoriy tuproq metallarning suv bilan o'zaro ta'siri
2Na + 2H 2 O → 2NaOH + H 2
Ca + 2H 2 O → Ca(OH) 2 + H 2
IN sanoat Vodorod quyidagi usullar bilan olinadi:
1. Tuzlar, kislotalar va ishqorlarning suvdagi eritmalarini elektroliz qilish. Eng ko'p ishlatiladigan eritma stol tuzidir:
2NaCl + 2H 2 O →el. joriy H 2 + Cl 2 + NaOH
2. Issiq koks bilan suv bug'ini kamaytirish:
C + H 2 O → t CO + H 2
Olingan uglerod oksidi va vodorod aralashmasi deyiladi suv gazi (sintez gazi), va turli xil kimyoviy mahsulotlarni (ammiak, metanol va boshqalar) sintez qilish uchun keng qo'llaniladi. Vodorodni suv gazidan ajratish uchun uglerod oksidi suv bug'i bilan qizdirilganda karbonat angidridga aylanadi:
CO + H 2 → t CO 2 + H 2
3. Metanni isitish suv bug'i va kislorod ishtirokida. Bu usul hozirda asosiy hisoblanadi:
2CH 4 + O 2 + 2H 2 O → t 2CO 2 + 6H 2
Vodorod quyidagilar uchun keng qo'llaniladi:
1. ammiak va vodorod xloridning sanoat sintezi;
2. sintez gazining bir qismi sifatida metanol va sintetik suyuq yoqilg'ini olish (2 hajm vodorod va 1 hajm CO);
3. neft fraksiyalarini gidrotozalash va gidrokrekinglash;
4. suyuq yog'larni gidrogenlash;
5. metallarni kesish va payvandlash;
6. ularning oksidlaridan volfram, molibden va reniy olish;
7. yoqilg'i sifatida kosmik dvigatellar.
8. Termoyadro reaktorlarida yoqilg'i sifatida vodorod izotoplari ishlatiladi.
Vodorodning fizik va kimyoviy xossalari
Vodorod rangsiz, ta'msiz va hidsiz gazdir. Zichlik no. 0,09 g/l (havodan 14 marta engil). Vodorod suvda yomon eriydi (100 hajm suvga atigi 2 hajm gaz), lekin d-metallar - nikel, platina, palladiy tomonidan yaxshi so'riladi (bir hajm palladiyda 900 hajmgacha vodorod eriydi).
Kimyoviy reaksiyalarda vodorod ham qaytaruvchi, ham oksidlovchi xususiyatga ega. Ko'pincha vodorod qaytaruvchi vosita sifatida ishlaydi.
1. Metall bo'lmaganlar bilan o'zaro ta'siri. Vodorod nometallar bilan uchuvchi vodorod birikmalarini hosil qiladi (25-ma'ruzaga qarang).
Galogenlar bilan reaksiya tezligi va sharoitlari ftordan yodgacha o'zgaradi: ftor bilan vodorod qorong'uda ham portlovchi reaksiyaga kirishadi, xlor bilan reaktsiya yorug'lik bilan ozgina nurlantirilganda juda xotirjam davom etadi, brom va yod bilan reaktsiyalar qaytariladi va faqat qizdirilganda sodir bo'ladi:
H 2 + F 2 → 2HF
H 2 + Cl 2 → hn 2HCl
H 2 + I 2 → t 2HI
Kislorod bilan va oltingugurt vodorod engil qizdirish bilan reaksiyaga kirishadi. 1:2 nisbatda kislorod va vodorod aralashmasi deyiladi portlovchi gaz:
H 2 + O 2 → t H 2 O
H 2 + S → t H 2 S
Azot, fosfor va uglerod bilan reaksiya issiqlik, yuqori bosim va katalizator ishtirokida sodir bo'ladi. Reaktsiyalar qaytarilmas:
3H 2 + N 2 → kat., p, t2NH 3
2H 2 + 3P → kat., p, t3PH 3
H 2 + C → kat., p, t CH 4
2. Murakkab moddalar bilan o'zaro ta'siri. Yuqori haroratlarda vodorod metallarni oksidlaridan kamaytiradi:
CuO + H 2 → t Cu + H 2 O
3. Da gidroksidi va ishqoriy tuproq metallari bilan o'zaro ta'siri Vodorod oksidlovchi xususiyatga ega:
2Na + H 2 → 2NaH
Ca + H 2 → CaH 2
4. Organik moddalar bilan o'zaro ta'siri. Vodorod ko'plab organik moddalar bilan faol o'zaro ta'sir qiladi, bunday reaktsiyalar gidrogenlanish reaktsiyalari deb ataladi. Bunday reaktsiyalar "Organik kimyo" to'plamining III qismida batafsilroq ko'rib chiqiladi.
Suyuqlik
Vodorod(lat. Vodorod; belgisi bilan ko'rsatilgan H) elementlar davriy sistemasining birinchi elementi. Tabiatda keng tarqalgan. Vodorodning eng keng tarqalgan izotopi 1 H ning kationi (va yadrosi) protondir. 1 H yadrosining xossalari organik moddalarni tahlil qilishda NMR spektroskopiyasidan keng foydalanish imkonini beradi.
Vodorodning uchta izotopi o'z nomlariga ega: 1 H - protiy (H), 2 H - deyteriy (D) va 3 H - tritiy (radioaktiv) (T).
Oddiy vodorod moddasi - H 2 - engil rangsiz gazdir. Havo yoki kislorod bilan aralashganda, u yonuvchan va portlovchi hisoblanadi. Toksik bo'lmagan. Etanol va bir qator metallarda eriydi: temir, nikel, palladiy, platina.
Hikoya
Kislotalar va metallarning oʻzaro taʼsirida yonuvchi gazning ajralib chiqishi 16-17-asrlarda kimyo fan sifatida shakllangan davrda kuzatilgan. Mixail Vasilyevich Lomonosov ham uning izolyatsiyasini to'g'ridan-to'g'ri ta'kidladi, lekin u flogiston emasligini allaqachon aniq bilgan. Ingliz fizigi va kimyogari Genri Kavendish 1766 yilda bu gazni o'rganib chiqdi va uni "yonuvchi havo" deb atadi. Yonayotganda "yonuvchi havo" suv hosil qildi, ammo Kavendishning flogiston nazariyasiga sodiqligi unga to'g'ri xulosalar chiqarishga to'sqinlik qildi. Fransuz kimyogari Antuan Lavuazye muhandis J. Meunye bilan birgalikda 1783 yilda maxsus gazometrlar yordamida suvning sintezini, so‘ngra uni tahlil qilib, issiq temir bilan suv bug‘ini parchalab tashlashni amalga oshirdi. Shunday qilib, u "yonuvchi havo" suvning bir qismi ekanligini va undan olinishi mumkinligini aniqladi.
ismning kelib chiqishi
Lavuazye vodorodga gidrogen nomini berdi - "suvni tug'diruvchi". Ruscha "vodorod" nomi 1824 yilda kimyogar M. F. Solovyov tomonidan taklif qilingan - Slomonosovning "kislorod" iga o'xshash.
Tarqalishi
Vodorod koinotdagi eng keng tarqalgan elementdir. U barcha atomlarning taxminan 92% ni tashkil qiladi (8% geliy atomlari, boshqa barcha elementlarning birlashtirilgan ulushi 0,1% dan kam). Shunday qilib, vodorod yulduzlar va yulduzlararo gazning asosiy tarkibiy qismidir. Yulduzli harorat sharoitida (masalan, Quyoshning sirt harorati ~ 6000 ° C) vodorod plazma shaklida mavjud; yulduzlararo bo'shliqda bu element alohida molekulalar, atomlar va ionlar shaklida mavjud va hosil bo'lishi mumkin. hajmi, zichligi va harorati jihatidan sezilarli darajada farq qiluvchi molekulyar bulutlar.
Yer qobig'i va tirik organizmlar
Er qobig'idagi vodorodning massa ulushi 1% ni tashkil qiladi - bu eng ko'p bo'lgan o'ninchi element. Biroq, uning tabiatdagi roli massa bilan emas, balki atomlar soni bilan belgilanadi, ularning ulushi boshqa elementlar orasida 17% (kisloroddan keyin ikkinchi o'rin, atomlarining ulushi ~ 52%). Shuning uchun Yerda sodir bo'ladigan kimyoviy jarayonlarda vodorodning ahamiyati deyarli kislorodniki kabi katta. Erda ham bog'langan, ham erkin holatda mavjud bo'lgan kisloroddan farqli o'laroq, Yerdagi deyarli barcha vodorod birikmalar shaklida bo'ladi; Atmosferada oddiy modda holidagi vodorodning juda oz miqdori mavjud (hajm bo'yicha 0,00005%).
Vodorod deyarli barcha organik moddalar tarkibiga kiradi va barcha tirik hujayralarda mavjud. Tirik hujayralarda vodorod atomlar sonining deyarli 50% ni tashkil qiladi.
Kvitansiya
Oddiy moddalarni ishlab chiqarishning sanoat usullari tegishli elementning tabiatda mavjud bo'lgan shakliga, ya'ni uni ishlab chiqarish uchun qanday xom ashyo bo'lishi mumkinligiga bog'liq. Shunday qilib, erkin holatda mavjud bo'lgan kislorod jismoniy ravishda olinadi - suyuq havodan ajratish. Deyarli barcha vodorod birikmalar shaklida bo'ladi, shuning uchun uni olish uchun kimyoviy usullar qo'llaniladi. Xususan, parchalanish reaktsiyalaridan foydalanish mumkin. Vodorod ishlab chiqarishning bir usuli suvning elektr toki bilan parchalanishidir.
Vodorod ishlab chiqarishning asosiy sanoat usuli - bu tabiiy gazning bir qismi bo'lgan metanning suv bilan reaktsiyasi. U yuqori haroratda amalga oshiriladi (metan qaynoq suvdan o'tganda ham hech qanday reaktsiya bo'lmasligini tekshirish oson):
CH 4 + 2H 2 O = CO 2 + 4H 2 -165 kJ
Laboratoriyada oddiy moddalarni olish uchun ular tabiiy xom ashyolardan foydalanishlari shart emas, balki kerakli moddani ajratib olish osonroq bo'lgan boshlang'ich materiallarni tanlashadi. Masalan, laboratoriyada kislorod havodan olinmaydi. Xuddi shu narsa vodorod ishlab chiqarishga ham tegishli. Sanoatda ba'zan qo'llaniladigan vodorodni olishning laboratoriya usullaridan biri suvni elektr toki bilan parchalashdir.
Odatda, vodorod laboratoriyada sinkni xlorid kislotasi bilan reaksiyaga kiritish orqali ishlab chiqariladi.
Sanoatda
1.Suvli tuz eritmalarini elektroliz qilish:
2NaCl + 2H 2 O → H 2 + 2NaOH + Cl 2
2. Taxminan 1000 °C haroratda issiq koks ustidan suv bug'ini o'tkazish:
H2O+C? H2+CO
3. Tabiiy gazdan.
Steam konvertatsiyasi:
CH 4 + H 2 O ? CO + 3H 2 (1000 °C)
Kislorod bilan katalitik oksidlanish:
2CH 4 + O 2 ? 2CO + 4H2
4. Neftni qayta ishlash jarayonida uglevodorodlarni kreking va isloh qilish.
Laboratoriyada
1.Suyultirilgan kislotalarning metallarga ta'siri. Ushbu reaktsiyani amalga oshirish uchun ko'pincha sink va suyultirilgan xlorid kislota ishlatiladi:
Zn + 2HCl → ZnCl 2 + H 2
2.Kaltsiyning suv bilan o'zaro ta'siri:
Ca + 2H 2 O → Ca(OH) 2 + H 2
3.Gidridlarning gidrolizi:
NaH + H 2 O → NaOH + H 2
4.Ishqorlarning sink yoki alyuminiyga ta'siri:
2Al + 2NaOH + 6H 2 O → 2Na + 3H 2
Zn + 2KOH + 2H 2 O → K 2 + H 2
5.Elektrolizdan foydalanish. Ishqorlar yoki kislotalarning suvli eritmalarini elektroliz qilish jarayonida katodda vodorod ajralib chiqadi, masalan:
2H 3 O + + 2e - → H 2 + 2H 2 O
Jismoniy xususiyatlar
Vodorod ikki shaklda (modifikatsiyada) bo'lishi mumkin - orto- va para-vodorod shaklida. Ortohidrogen molekulasida o-H 2 (mp -259,10 °C, bp -252,56 °C) yadro spinlari bir xil (parallel) va paravodorod uchun yo'naltirilgan. p-H 2 (erish nuqtasi -259,32 °C, qaynash nuqtasi -252,89 °C) - bir-biriga qarama-qarshi (antiparallel). Muvozanat aralashmasi o-H 2 va p-H 2 berilgan haroratda deyiladi muvozanatli vodorod e-H2.
Vodorod modifikatsiyalarini suyuq azot haroratida faol uglerodga adsorbsiyalash orqali ajratish mumkin. Juda past haroratlarda ortovodorod va parahidrogen o'rtasidagi muvozanat deyarli butunlay ikkinchisiga siljiydi. 80 K da shakllarning nisbati taxminan 1: 1 ni tashkil qiladi. Qizdirilganda, desorbsiyalangan parahidrogen xona haroratida muvozanat hosil bo'lgunga qadar ortohidrogenga aylanadi (orto-para: 75:25). Katalizatorsiz transformatsiya asta-sekin sodir bo'ladi (yulduzlararo muhit sharoitida - kosmologik vaqtgacha bo'lgan xarakterli vaqtlar bilan), bu individual modifikatsiyalarning xususiyatlarini o'rganishga imkon beradi.
Vodorod eng engil gaz bo'lib, u havodan 14,5 baravar engilroq. Shubhasiz, molekulalarning massasi qanchalik kichik bo'lsa, ularning bir xil haroratda tezligi shunchalik yuqori bo'ladi. Eng engil molekulalar sifatida vodorod molekulalari boshqa gaz molekulalariga qaraganda tezroq harakat qiladi va shuning uchun issiqlikni bir tanadan boshqasiga tezroq o'tkazishi mumkin. Bundan kelib chiqadiki, vodorod gazsimon moddalar orasida eng yuqori issiqlik o'tkazuvchanligiga ega. Uning issiqlik o'tkazuvchanligi havoning issiqlik o'tkazuvchanligidan taxminan etti baravar yuqori.
Vodorod molekulasi ikki atomli - H2. Oddiy sharoitlarda bu rangsiz, hidsiz va ta'msiz gazdir. Zichligi 0,08987 g/l (no.), qaynash temperaturasi -252,76 °C, solishtirma yonish issiqligi 120,9×10 6 J/kg, suvda ozgina eriydi - 18,8 ml/l. Vodorod ko'pgina metallarda (Ni, Pt, Pd va boshqalar), ayniqsa palladiyda (1 hajm Pd uchun 850 hajm) yaxshi eriydi. Vodorodning metallarda eruvchanligi ular orqali tarqalish qobiliyati bilan bog'liq; Uglerod qotishmasi (masalan, po'lat) orqali diffuziya ba'zan vodorodning uglerod bilan o'zaro ta'siri (dekarbonizatsiya deb ataladigan) tufayli qotishmaning yo'q qilinishi bilan birga keladi. Kumushda amalda erimaydi.
Suyuq vodorod-252,76 dan -259,2 °C gacha bo'lgan juda tor harorat oralig'ida mavjud. Bu rangsiz suyuqlik, juda engil (zichligi -253 ° C 0,0708 g / sm3) va suyuqlik (-253 ° C da yopishqoqlik 13,8 spuaz). Vodorodning kritik parametrlari juda past: harorat -240,2 °C va bosim 12,8 atm. Bu vodorodni suyultirishdagi qiyinchiliklarni tushuntiradi. Suyuq holatda muvozanatli vodorod 99,79% para-H2, 0,21% orto-H2 dan iborat.
Qattiq vodorod, erish nuqtasi -259,2 °C, zichligi 0,0807 g/sm 3 (-262 °C da) - qorga o'xshash massa, olti burchakli kristallar, kosmik guruh P6 / mmc, hujayra parametrlari a=3,75 c=6.12. Yuqori bosimda vodorod metall holatga aylanadi.
Izotoplar
Vodorod uchta izotop shaklida bo'lib, ularning alohida nomlari bor: 1 H - protiy (H), 2 H - deyteriy (D), 3 H - tritiy (radioaktiv) (T).
Protiy va deyteriy massa raqamlari 1 va 2 bo'lgan barqaror izotoplardir. Ularning tabiatdagi tarkibi mos ravishda 99,9885 ± 0,0070% va 0,0115 ± 0,0070% ni tashkil qiladi. Bu nisbat vodorod ishlab chiqarish manbasi va usuliga qarab biroz farq qilishi mumkin.
Vodorod izotopi 3H (tritiy) beqaror. Uning yarim yemirilish davri 12,32 yil. Tritiy tabiatda juda oz miqdorda uchraydi.
Adabiyotlarda massa soni 4 - 7 va yarim yemirilish davri 10 -22 - 10 -23 s bo'lgan vodorod izotoplari haqida ham ma'lumotlar keltirilgan.
Tabiiy vodorod 3200:1 nisbatda H 2 va HD (deyteriy vodorod) molekulalaridan iborat. Sof deyteriy vodorod D 2 ning tarkibi bundan ham kamroq. HD va D 2 kontsentratsiyasining nisbati taxminan 6400:1 ni tashkil qiladi.
Kimyoviy elementlarning barcha izotoplari ichida vodorod izotoplarining fizik va kimyoviy xossalari bir-biridan eng ko'p farq qiladi. Bu atom massalarining eng katta nisbiy o'zgarishi bilan bog'liq.
|
Harorat |
Harorat |
Uchlik |
Tanqidiy |
Zichlik |
|
Deyteriy va tritiy ham orto- va para-modifikatsiyaga ega: p-D 2, o-D 2, p-T 2, o-T 2. Geteroizotop vodorod (HD, HT, DT) orto- va para-modifikatsiyalarga ega emas.
Kimyoviy xossalari
Dissotsilangan vodorod molekulalarining ulushi
Vodorod molekulalari H2 juda kuchli va vodorod reaksiyaga kirishishi uchun ko'p energiya sarflanishi kerak:
H 2 = 2H - 432 kJ
Shuning uchun oddiy haroratlarda vodorod faqat kaltsiy kabi juda faol metallar bilan reaksiyaga kirishib, kaltsiy gidridini hosil qiladi:
Ca + H 2 = CaH 2
va yagona metall bo'lmagan ftor bilan vodorod ftorid hosil qiladi:
Vodorod ko'pchilik metallar va metall bo'lmaganlar bilan yuqori haroratlarda yoki boshqa ta'sirlar ostida reaksiyaga kirishadi, masalan, yorug'lik:
O 2 + 2H 2 = 2H 2 O
U ba'zi oksidlardan kislorodni "olib tashlashi" mumkin, masalan:
CuO + H 2 = Cu + H 2 O
Yozma tenglama vodorodning qaytaruvchi xossalarini aks ettiradi.
N 2 + 3H 2 → 2NH 3
Galogenlar bilan vodorod galogenidlarini hosil qiladi:
F 2 + H 2 → 2HF, reaktsiya qorong'uda va har qanday haroratda portlovchi tarzda sodir bo'ladi,
Cl 2 + H 2 → 2HCl, reaksiya faqat yorug'likda, portlovchi tarzda davom etadi.
Yuqori haroratda kuyikish bilan o'zaro ta'sir qiladi:
C + 2H 2 → CH 4
Ishqoriy va gidroksidi tuproq metallari bilan o'zaro ta'siri
Faol metallar bilan o'zaro ta'sirlashganda vodorod gidridlarni hosil qiladi:
2Na + H 2 → 2NaH
Ca + H 2 → CaH 2
Mg + H 2 → MgH 2
Gidridlar- tuzga o'xshash, oson gidrolizlanadigan qattiq moddalar:
CaH 2 + 2H 2 O → Ca(OH) 2 + 2H 2
Metall oksidlari bilan o'zaro ta'sir (odatda d-elementlar)
Oksidlar metallarga qaytariladi:
CuO + H 2 → Cu + H 2 O
Fe 2 O 3 + 3H 2 → 2Fe + 3H 2 O
WO 3 + 3H 2 → W + 3H 2 O
Organik birikmalarni gidrogenlash
Molekulyar vodorod organik birikmalarni kamaytirish uchun organik sintezda keng qo'llaniladi. Bu jarayonlar deyiladi gidrogenlash reaksiyalari. Bu reaksiyalar katalizator ishtirokida yuqori bosim va haroratda amalga oshiriladi. Katalizator bir jinsli (masalan, Uilkinson katalizatori) yoki geterogen (masalan, Raney nikel, uglerodda palladiy) bo'lishi mumkin.
Shunday qilib, xususan, alkenlar va alkinlar kabi to'yinmagan birikmalarni katalitik gidrogenlash jarayonida to'yingan birikmalar - alkanlar hosil bo'ladi.
Vodorodning geokimyosi
Erkin vodorod H2 quruqlikdagi gazlarda nisbatan kam uchraydi, lekin suv shaklida u geokimyoviy jarayonlarda juda muhim rol o'ynaydi.
Vodorod minerallarda ammoniy ioni, gidroksil ioni va kristall suv shaklida bo'lishi mumkin.
Atmosferada vodorod doimiy ravishda quyosh nurlari ta'sirida suvning parchalanishi natijasida hosil bo'ladi. Kam massaga ega bo'lgan vodorod molekulalari diffuziya harakatining yuqori tezligiga ega (u ikkinchi kosmik tezlikka yaqin) va ular atmosferaning yuqori qatlamlariga kirganlarida ular kosmosga ucha oladilar.
Davolashning xususiyatlari
Vodorod havo bilan aralashtirilganda portlovchi aralashmani hosil qiladi - bu portlovchi gaz deb ataladi. Vodorod va kislorodning hajm nisbati 2:1 yoki vodorod va havo taxminan 2:5 bo'lsa, bu gaz eng portlovchi hisoblanadi, chunki havoda taxminan 21% kislorod mavjud. Vodorod ham yong'in xavfi hisoblanadi. Suyuq vodorod teriga tegsa, qattiq sovuqqa olib kelishi mumkin.
Vodorod va kislorodning portlovchi kontsentratsiyasi hajmi bo'yicha 4% dan 96% gacha. Havo bilan aralashganda 4% dan 75(74)% gacha.
Iqtisodiyot
Katta ulgurji etkazib berish uchun vodorod narxi har bir kg uchun 2-5 dollarni tashkil qiladi.
Ilova
Atom vodorod atomik vodorod payvandlash uchun ishlatiladi.
Kimyo sanoati
- Ammiak, metanol, sovun va plastmassa ishlab chiqarishda
- Suyuq o'simlik moylaridan margarin ishlab chiqarishda
- Oziq-ovqat qo'shimchasi sifatida ro'yxatga olingan E949(qadoqlash gazi)
Oziq-ovqat sanoati
Aviatsiya sanoati
Vodorod juda engil va har doim havoda ko'tariladi. Bir paytlar dirijabllar va havo sharlari vodorod bilan to'ldirilgan edi. Ammo 30-yillarda. XX asr Bir nechta falokatlar sodir bo'ldi, ular davomida havo kemalari portladi va yondi. Hozirgi vaqtda havo kemalari ancha yuqori narxga qaramay, geliy bilan to'ldirilgan.
Yoqilg'i
Vodorod raketa yoqilg'isi sifatida ishlatiladi.
Vodoroddan yengil va yuk mashinalari uchun yoqilg‘i sifatida foydalanish bo‘yicha tadqiqotlar olib borilmoqda. Vodorod dvigatellari atrof-muhitni ifloslantirmaydi va faqat suv bug'ini chiqaradi.
Vodorod-kislorodli yonilg'i xujayralari kimyoviy reaktsiyaning energiyasini elektr energiyasiga to'g'ridan-to'g'ri aylantirish uchun vodoroddan foydalanadi.
"Suyuq vodorod"("LH") - vodorodning suyuq holati, past o'ziga xos zichligi 0,07 g / sm³ va muzlash nuqtasi 14,01 K (-259,14 ° C) va qaynash nuqtasi 20,28 K (-252,87 ° C) bo'lgan kriogen xususiyatlarga ega. ). Bu rangsiz, hidsiz suyuqlik bo'lib, havo bilan aralashtirilganda 4-75% alangalanish darajasi bilan portlovchi deb tasniflanadi. Suyuq vodoroddagi izomerlarning spin nisbati: 99,79% - parahidrogen; 0,21% - ortohidrogen. Vodorodning agregat holatini gaz holiga keltirganda kengayish koeffitsienti 20°C da 848:1 ni tashkil qiladi.
Boshqa har qanday gazda bo'lgani kabi, vodorodning suyultirilishi uning hajmining pasayishiga olib keladi. Suyultirilgandan so'ng, suyuq suyuqlik bosim ostida issiqlik izolyatsiya qilingan idishlarda saqlanadi. Suyuq vodorod Suyuq vodorod, LH2, LH 2) sanoatda gaz saqlash shakli sifatida va kosmik sanoatda raketa yoqilg'isi sifatida faol qo'llaniladi.
Hikoya
Sun'iy sovutishdan birinchi hujjatlashtirilgan foydalanish 1756 yilda ingliz olimi Uilyam Kallen tomonidan amalga oshirilgan, Gaspard Monge 1784 yilda birinchi bo'lib oltingugurt oksidining suyuq holatini olgan, Maykl Faraday suyultirilgan ammiakni birinchi bo'lib olgan, amerikalik ixtirochi Oliver Evans. 1805 yilda birinchi bo'lib sovutgich kompressorini ishlab chiqdi, 1834 yilda Jeykob Perkins birinchi bo'lib sovutish mashinasini patentladi va 1851 yilda AQShda Jon Gori birinchi bo'lib konditsionerni patentladi. Verner Siemens 1857 yilda regenerativ sovutish kontseptsiyasini taklif qildi, Karl Linde "Joule-Tomson kengayish effekti" kaskadi va 1876 yilda regenerativ sovutish yordamida suyuq havo ishlab chiqarish uchun uskunani patentladi. 1885 yilda polshalik fizik va kimyogari Zigmunt Wroblewski vodorodning kritik harorati 33 K, kritik bosim 13,3 atm ekanligini e'lon qildi. va qaynash nuqtasi 23 K. Vodorod birinchi marta 1898 yilda Jeyms Devar tomonidan regenerativ sovutish va uning ixtirosi Devar kolbasi yordamida suyultirilgan. Suyuq vodorodning barqaror izomeri parahidrogenning birinchi sintezi 1929 yilda Pol Xartek va Karl Bonxoeffer tomonidan amalga oshirilgan.
Vodorodning spin izomerlari
Xona haroratidagi vodorod asosan spin izomeri ortohidrogendan iborat. Ishlab chiqarilgandan so'ng suyuq vodorod metastabil holatda bo'ladi va past haroratlarda o'zgarganda yuzaga keladigan portlovchi ekzotermik reaktsiyani oldini olish uchun parahidrogen shakliga aylanishi kerak. Parahidrogen fazaga o'tish odatda temir oksidi, xrom oksidi, faollashtirilgan uglerod, platina bilan qoplangan asbest, noyob tuproq metallari kabi katalizatorlar yoki uran yoki nikel qo'shimchalaridan foydalanish orqali amalga oshiriladi.
Foydalanish
Suyuq vodorod ichki yonuv dvigatellari va yonilg'i xujayralari uchun yoqilg'i saqlash shakli sifatida ishlatilishi mumkin. Vodorodning ushbu agregat shakli yordamida turli xil suv osti kemalari ("212A" va "214" loyihalari, Germaniya) va vodorodni tashish tushunchalari yaratilgan (masalan, "DeepC" yoki "BMW H2R" ga qarang). Dizaynlarning yaqinligi tufayli LHV uskunasini yaratuvchilar suyultirilgan gaz (LNG) dan foydalangan holda tizimlardan foydalanishlari yoki faqat o'zgartirishlari mumkin. Biroq, past hajmli energiya zichligi tufayli, yonish tabiiy gazga qaraganda ko'proq vodorod hajmini talab qiladi. Agar pistonli dvigatellarda "CNG" o'rniga suyuq vodorod ishlatilsa, odatda ko'proq hajmli yonilg'i tizimi talab qilinadi. To'g'ridan-to'g'ri in'ektsiya bilan, qabul qilish traktidagi yo'qotishlarning ko'payishi silindrni to'ldirishni kamaytiradi.
Suyuq vodorod neytronlarni sochish tajribalarida neytronlarni sovutish uchun ham ishlatiladi. Neytron va vodorod yadrosining massalari deyarli teng, shuning uchun elastik to'qnashuv paytida energiya almashinuvi eng samarali hisoblanadi.
Afzalliklar
Vodoroddan foydalanishning afzalligi uni ishlatishning "nol emissiyasi" dir. Uning havo bilan o'zaro ta'sirining mahsuloti suvdir.
To'siqlar
Bir litr "ZhV" ning og'irligi atigi 0,07 kg. Ya'ni, uning solishtirma og'irligi 20 K da 70,99 g / l. Suyuq vodorod kriogenli saqlash texnologiyasini talab qiladi, masalan, maxsus issiqlik izolyatsiyalangan idishlar va barcha kriyojenik materiallar uchun xos bo'lgan maxsus ishlov berishni talab qiladi. Bu jihatdan suyuq kislorodga yaqin, ammo yong'in xavfi tufayli ko'proq ehtiyot bo'lishni talab qiladi. Izolyatsiya qilingan idishlarda ham, uni suyuqlikda ushlab turish uchun zarur bo'lgan past haroratlarda ushlab turish qiyin (odatda u kuniga 1% bug'lanadi). U bilan ishlashda, shuningdek, vodorod bilan ishlashda odatiy xavfsizlik choralariga rioya qilish kerak - u portlovchi bo'lgan havoni suyultirish uchun etarlicha sovuq.
Raketa yoqilg'isi
Suyuq vodorod raketa yoqilg'ilarining keng tarqalgan komponenti bo'lib, u raketalar va kosmik kemalarni harakatga keltirish uchun ishlatiladi. Ko'pgina suyuq vodorodli raketa dvigatellarida u oksidlovchi bilan aralashtirilishidan va tortishish hosil qilish uchun yoqishdan oldin birinchi bo'lib ko'krak va boshqa dvigatel qismlarini regenerativ sovutish uchun ishlatiladi. H 2 / O 2 komponentlarini ishlatadigan zamonaviy dvigatellar vodorod bilan ortiqcha boyitilgan yonilg'i aralashmasini iste'mol qiladi, bu esa chiqindi gazida ma'lum miqdorda yonmagan vodorodga olib keladi. Molekulyar og'irlikni kamaytirish orqali dvigatelning o'ziga xos impulsini oshirishdan tashqari, bu ko'krak va yonish kamerasining eroziyasini ham kamaytiradi.
Kriogen tabiat va past zichlik kabi boshqa sohalarda LH dan foydalanish uchun bunday to'siqlar ham bu holatda foydalanish uchun cheklovchi omil hisoblanadi. 2009 yil holatiga ko'ra, faqat bitta raketa (Delta-4) mavjud bo'lib, u butunlay vodorod raketasidir. Asosan, "JV" raketalarning yuqori bosqichlarida yoki foydali yukni vakuumda kosmosga uchirish ishining muhim qismini bajaradigan bloklarda qo'llaniladi. Ushbu turdagi yoqilg'ining zichligini oshirish chora-tadbirlaridan biri sifatida loyga o'xshash vodorodni, ya'ni "suyuq vodorod" ning yarim muzlatilgan shaklini qo'llash takliflari mavjud.