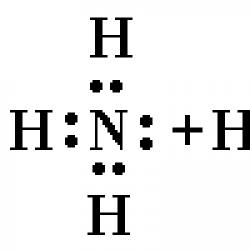Ammoniy xloriddagi kimyoviy bog'lanish. Kimyoviy bog'lanish turlari. Ammoniy xloridning kimyoviy xossalari
§5. Tuzlar uchun esa an'anaviy ion bog'lanishdir
Elektromanfiyligi jihatidan juda farq qiluvchi elementlarning atomlari - masalan, gidroksidi metalldan hosil bo'lsa, u qanday turdagi kimyoviy bog'lanishga ega bo'ladi. natriy va halogen xlor?
Atom elektron natriy Na, tashqi valentlik darajasida joylashgan, mahalla atrofida sayr qilishning katta muxlisi va ko'pincha hatto o'zining ona atom yadrosiga uyga qaytishni ham unutadi. Va keyin natriy atomi o'zining elektronsiz qoladi va aylanadi kation Na+:
Na 0 − 1 e− = Na +
Atomning yetti elektroni xlor Cl Aksincha, ular tuzatib bo'lmaydigan uy hayvonlari, ular tashrif buyurishni yoqtirmaydilar, lekin mehmonlarni mamnuniyat bilan qabul qilishadi. Agar ba'zi qo'shni elektronlar ular tomon burilsa, bu atomni anglatadi xlor ga aylanadi anion Cl¯, bu odatda deyiladi xlorid-ion:
Cl 0 + 1 e− = Cl −
Qarama-qarshi zaryadli ionlar bir-birini tortadi; shakllanadi Na+ ion aloqasi ~~~~ Cl -. Shunday qilib, shunday bo'ladi natriy xlorid NaCl, hamma biladi tuz.
Tabiiy osh tuzi mineral hisoblanadi.
Tabiatda bu mineral sho'r dengiz yoki ko'l suvidan hosil bo'ladi. Tuz eritmasi qatlami ostida sovutilganda uning kristallari - shaffof kublar topiladi natriy xlorid. Tarkibni tashkil etuvchi ionlar natriy xlorid, shakl ion kristalli, kationlardan iborat natriy Na+ Va xlorid anionlari Cl -.
Erigan ionlardan qattiq jism hosil bo'lganda, kationlar va anionlar kristalda tasodifiy emas, balki musbat va manfiy zaryadlar o'zaro almashinadigan tarzda joylashadilar. Shunda u kuchli bo'ladi kristalli hujayra tuz NaCl, ionlardan iborat.
Boshqa tuzlarning kristallari xuddi shunday tarzda qurilgan - natriy karbonat Na 2 CO 3 (soda), ammoniy xlorid NH4Cl (ammiak), kumush nitrat AgNO3 (lapis) va boshqalar.
Barcha tuzlar yakka o'zi mavjud bo'lgan alohida ionlardan tuzilganligi rostmi? To'g'ri, lekin kichik bir "lekin" bor ...
Tuz kationi elektron bulutining bir qismini saqlab qoladi, chunki hatto eng yaramas elektron ham vaqti-vaqti bilan uyga qaytadi. Ammo bu bulutning juda katta qismi tuz anioni tomon siljiydi. Shuning uchun ion bog'lanish ko'rib chiqiladi kovalent qutbli bog'lanishning cheklovchi holati.
TA’RIF
Ammoniy- musbat zaryadlangan ko'p atomli ion.
Kimyoviy formula NH4+
Ammoniy ioni NH 4+ oddiy tetraedr boʻlib, uning markazida atomlari, uchlarida joylashgan.
Ammiak NH 3 molekulasida uchta elektron juft uchta N - H bog'larini hosil qiladi, azot atomiga tegishli to'rtinchi elektron jufti yolg'izdir. Ushbu elektron jufti yordamida bo'sh orbitalga ega bo'lgan vodorod ioni bilan bog'lanish hosil bo'ladi:

Shunday qilib, ammoniy ionida uchta kovalent bog'lanish almashinuv mexanizmi, biri esa donor-akseptor mexanizmi orqali hosil bo'ladi. Tuzilish mexanizmi bog'lanish xususiyatlariga ta'sir qilmaydi, ammoniy kationidagi barcha bog'lanishlar ekvivalentdir.
Ammoniy birikmalari
Ammoniy kationi turli xil qarama-qarshi ionlar bilan ammoniy birikmalarini hosil qilishi mumkin, ularda musbat zaryadlangan azot atomi vodorod ionlari va (yoki) organik radikallar bilan kovalent bog'langan va ba'zi anionlar bilan ionli bog'langan.
Noorganik ammoniy birikmalari
Ammiak gidrati(ammiak gidroksidi, ammiakli suv, ammoniy gidroksidi, ammiak gidroksid). Formula: NH 3 H 2 O
Ammiak suv bilan reaksiyaga kirishganda hosil bo'ladi. Kuchsiz asos suvda ajraladi va ammoniy kationlari va gidroksid ionlarini hosil qiladi:
Reaksiya teskari, shuning uchun ammoniy gidroksidning suvli eritmalari har doim ammiakning o'ziga xos o'tkir hidiga ega.
Ammoniy tuzlari
Barcha ammoniy tuzlari xossalari bo'yicha tegishli natriy tuzlariga o'xshashdir. Ular suvda yaxshi eriydi, suvli eritmada butunlay ajraladi va qizdirilganda parchalanadi:
Eritmada ular kation bilan gidrolizlanadi:
Organik ammoniy birikmalari azot atomi bilan bogʻlangan organik radikallar soniga koʻra birlamchi (R 1 NH 3) + X –, ikkilamchi (R 1 R 2 NH 2) + X –, uchinchi (R 1 R 2 R 3 NH) + X – ga boʻlinadi. , va to'rtlamchi (R 1 R 2 R 3 R 4 N) + X – .
Birlamchi, ikkilamchi va uchinchi darajali ammoniy birikmalarini tegishli aminlarning tuzlari deb hisoblash mumkin, ular ushbu aminlarni kislotalar bilan reaksiyaga kiritish orqali tayyorlanishi mumkin:
bu erda R 1, R 2, R 3 organik radikallar yoki vodorod, X kislota qoldig'ining anionidir.
Sifatli reaktsiya ammoniy ionlari uchun - ammiakning chiqishi bilan ishqorlar bilan o'zaro ta'sir qilish:
Muammoni hal qilishga misollar
MISOL 1
| Mashq qilish | Ammoniy xloridning suvli eritmasi qanday pH qiymatiga ega (7 dan ko'p yoki kamroq)? Gidrolizning molekulyar va ion-molekulyar tenglamalarini yozing. |
| Yechim | NH 4 Cl kuchsiz asos va kuchli kislota tuzi, shuning uchun gidroliz kation orqali sodir bo'ladi. Molekulyar tenglama: To'liq ionli tenglama: Qisqa ionli tenglama: Gidroliz jarayonida vodorod (H +) hosil bo'ldi, shuning uchun eritma kislotali muhitga ega (pH) |
| Javob | Ammoniy xlorid eritmasining pH qiymati 7 dan kam. |
2-MISA
| Mashq qilish | 44,8 l ammiak va 33,6 l vodorod xlorid (normal sharoitda) oʻzaro taʼsirida tuzning qanday massasi hosil boʻladi? | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Yechim | Reaksiya tenglamasini yozamiz: Ammiak, vodorod xlorid va hosil bo'lgan tuz, ammoniy xloridning (NH 4 Cl) molyar massalari tengdir. Kimyoviy bog'lanish. Kristal hujayra Vazifalarga javoblar so'z, ibora, raqam yoki so'zlar ketma-ketligi, raqamlardir. Javobingizni bo'sh joy, vergul yoki boshqa qo'shimcha belgilarsiz yozing. Shaklning boshlanishi 1 Ammoniy xlorid tarkibida kimyoviy birikmalar mavjud: 1. ionli 2. kovalent qutbli 3. kovalent qutbsiz 4. vodorod 5. metall 2 Suyuq holatdagi molekulalararo vodorod aloqalari quyidagilarga xosdir: 1. vodorod 2. suv 3. ammiak 4. atsetaldegid 5. izobutan 3 Kovalent qutbsiz kimyoviy bog'lanishlar moddalarda uchraydi: 1. oq fosfor 2. fosfor kislotasi 3. ammiak 4. etil spirti 5. rombsimon oltingugurt 4 Taqdim etilgan ro'yxatdan ionli kimyoviy bog'langan ikkita birikmani tanlang. 1. Ca(ClO 2 ) 2 2. HClO 3 3. NH 4 Cl 4.HClO 4 5. C l2O 7 5 Taqdim etilgan ro'yxatdan ikkita birikmani tanlang kovalent qutbsiz kimyoviy bog'lanish. 1. Ca 2. N 2 3. AlCl 3 4. HClO 4 5. Cl 2 6 Kaliy sulfat kimyoviy birikmalarni o'z ichiga oladi: 1. ionli 2. kovalent qutbsiz 3. kovalent qutbli 4. vodorod 5. metall 7 Moddada ion va kovalent kimyoviy bog'lanishlar mavjud: 1. HCl 2. H 2 SO 4 3. NaOH 4. NH 4 Br 5. C 2 N 5 U 8 Taklif etilgan ro'yxatdan molekulalari orasidagi ikkita birikmani tanlang vodorod aloqasi. 1. fenol 2. dietil efir 3. etilsetat 4. chumoli aldegid 5. chumoli kislotasi. 9 Taqdim etilgan ro'yxatdan kovalentni o'z ichiga olgan ikkita birikmani tanlang qutbli kimyoviy bog'lanish. 1. CaCl 2 2. HCl 3. BaO 4. KSIO 4 5. Cl 2 10 Ular molekulyar bo'lmagan tuzilishga ega: 1. kaliy gidroksid 2. ammiak 3. sirka kislota 4. nitrat kislota 5. grafit 11 Ion aloqalari ikkita moddaning har birida amalga oshiriladi: 1. Al 2 O 3 VaFeCl 3 2.K 2 SVaNaNO 3 3. KNO 2 va YO'Q 2 4. HF va HCl 5. NaBr va NH 4 F 12 Qattiq holatda atom kristall panjarasi quyidagilarga ega: 1. kislorod 2. oq fosfor 3. qizil fosfor 4. olmos 5. natriy xlorid 13 Taqdim etilgan ro'yxatdan kimyoviy bog'lanish hosil bo'lgan ikkita birikmani tanlang elektronlarning umumiy juftligi tufayli. 1. Ca 2. H 2 O 3. NaCl 4. CaO 5. Cl 2 14 Molekulyar tuzilish: 1. propanol-2 2. kaliy asetat 3. karbonat angidrid 4. natriy metoksid 5. kaltsiy karbonat 15 Ion kristalli panjarali barcha moddalar 1. qattiq 2. plastmassa 3. nisbatan uchuvchan 4. suvda yaxshi eriydi 5. yuqori erish nuqtalariga ega 16 Taqdim etilgan ro'yxatdan molekulalari vodorod bog'ini hosil qiluvchi ikkita birikmani tanlang. 1. metan 2. silan 3. ammiak 4. fosfin 5. suv Shaklning oxiri Ammoniy xlorid (ammiak xlorid, ammiak) - turli sohalarda keng qo'llaniladigan noorganik birikma. Kimyoviy nuqtai nazardan, ammoniy tuzi; formulasi NH 4 Cl. Ammoniy xlorid Qadimgi Yunoniston va Qadimgi Misrda allaqachon ma'lum bo'lgan. Uning nomlaridan biri "ammiak" misrlik "nushadir" dan kelib chiqqan - ruhoniylar marosim oldidan bug'larini nafas olish va ilohiy kuchlar bilan aloqa qilish uchun g'orlar devorlariga yig'ishgan moddadir. "Ammiak" o'z nomini Misr quyosh xudosi Amun bilan bog'laydi. Qadimgi Yunonistonda modda yunonlar uchun yoqilg'i bo'lib xizmat qilgan tuya go'ngini yoqish natijasida mo'rilar devorlarida hosil bo'lgan kuyishdan olingan (ammiak xlorid hayvonlar va odamlarning ajralishidan olingan). Ammoniy xlorid tabiiy ravishda vulqon g'orlarida va er qobig'idagi yoriqlar yaqinida, blyashka yoki qobiq shaklida bo'ladi. XususiyatlariNH 4 Cl oq kristall kukun (texnik darajadagi reagent sarg'ish yoki pushti bo'lishi mumkin), ozgina gigroskopik, hidsiz va ta'mi sho'r. U suvda va suyuq ammiakda yaxshi eriydi, harorat oshishi bilan suvda eruvchanligi oshadi. Ishqorlar bilan reaksiyaga kirishib, tuz, suv va ammiak hosil qiladi. Reaktiv etil va metil spirtlarida ancha kam eriydi. Qalin oq tutun chiqishi bilan yonadi. 338 ° C dan yuqori haroratlarda, shuningdek, elektr tokining ta'siri ostida to'liq parchalanadi. Ammoniy xloridning yonishi nafas yo'llarini tirnash xususiyati beruvchi ammiakni chiqaradi. Reagentning suvli eritmasi ammiak bo'lib, asab tizimiga ogohlantiruvchi ta'sir ko'rsatadigan o'tkir hidli suyuqlikdir. Reagent dori sifatida ishlatiladi, ammo ammiak bilan davolash qat'iy ravishda shifokor tavsiyasiga binoan amalga oshirilishi kerak, chunki dozani oshirib yuborish nafas olishni to'xtatish va komaga olib kelishi mumkin (ishqoriy eritmalar, masalan, natriy bikarbonat, antidot sifatida qo'llaniladi). . Bundan tashqari, ushbu dori kontrendikatsiyaga ega.
Ammoniy xlorid o'rtacha xavfli moddaga kiradi (3-sinf), u bilan himoya vositalarini kiyib ishlash kerak: rezina qo'lqop, himoya ko'zoynak va respirator, ta'minot va chiqindi ventilyatsiyasi bo'lgan xonada. Reagent teri va shilliq pardalar bilan aloqa qilmasligi uchun ehtiyot bo'lish kerak. Kimyoviy saqlash Reagent germetik yopilgan ko'p qatlamli qoplarda, namlikka kirish imkoni bo'lmagan yopiq joylarda kerak. Ulanish atrof-muhit uchun xavflidir. IlovaRangli metallurgiyada metallarni tuzlash uchun. Prime Chemicals Group do'konida siz xarid qilishingiz mumkin 1. Molekuladagi eng qutbli bog‘lanishlar: a) HC1 b) AsH 3 c) PH 3 r) H 2 S 2. Molekula chiziqli shaklga ega: a)H 2 O b)H 2 S c)WeC1 2 d) OF 2 3. CH 4 metan molekulasining geometrik shakli: a) burchakli b) piramidal b) uchburchak d) tetraedral 4. Molekula piramidasimon shaklga ega: a) BC1 3 b) SiBr 4 c) A1Br 3 d) PC1 3 5. Qutbli molekula: a) CO 2 b) CH 4 b) NH 3 r) N 2 6. s-bog'lar soni molekuladagi p-bog'lar sonidan uch marta ko'p: a) xlor kislotasi b) ortofosfor kislotasi v) oltingugurt kislotasi d) perklorik kislota 7. Faqat kovalent bog'lanishga ega bo'lgan birikmalarning formulalari qaysi qatorda keltirilgan? a) BaCl 2, CdC1 2, LiF c) NaCl, CuSO 4, Fe(OH) 3 b) H 2 O, SiO 2, CH3COOH d) N 2, HNO 3, NaNO 3 8. Ammoniy xloridda qanday turdagi kimyoviy bog'lanishlar mavjud emas? a) kovalent qutbli b) kovalent qutbsiz v) donor-akseptor d) ionli 9. Atom raqamlari 3 va 9 bo'lgan elementlarning atomlari o'rtasida hosil bo'lgan kimyoviy bog'lanish: a) kovalent qutbli b) metall v) kovalent qutbsiz d) ionli 10. Etilen molekulasida nechta elektron bor? Yo'q kimyoviy bog'larning hosil bo'lishida ishtirok etadimi? a) 4 b) 8 c) 12 d) 16 11. Kimyoviy bog‘lanish hosil bo‘lishida ishtirok etuvchi elektronlar soni molekulada eng ko‘p bo‘ladi: a)H 2 O b)C1 2 b)H 2 S r)N 2 12. Atom kristall panjarasi quyidagilarga ega: a) natriy gidroksid c) temir b) olmos d) muz 13. Elektromanfiyligi yuqori bo'lgan p-elementlar bilan s-metalllarning birikmalariga kristall panjaraning qanday tipi xosdir? a) metall b) atomik b) ionli d) molekulyar 14. Qattiq holatda atom, molekulyar va ion kristall panjaralari bo'lgan moddalar mos ravishda qaysi qatorda keltirilgan? a) olmos, natriy xlorid, grafit b) oq fosfor, suv, bo'r v) kremniy (IV) oksidi, mis, azot d) olmos, karbonat angidrid, kaliy ftorid 15. Ammiak va vodorod xloriddan ammoniy xlorid hosil bo'lganda nima o'zgaradi? a) azot atomining oksidlanish darajasi b) azot atomining oksidlanish darajasi va valentligi v) azot atomining valentligi d) vodorod atomining oksidlanish darajasi 16. Quyidagi zarralardan qaysi biri donor-akseptor mexanizmi orqali hosil bo'lgan? a)F 2 b)HF c)BF 4 – d)BF 3 17. Qaysi moddada azotning oksidlanish darajasi va valentligi mutlaq qiymatga teng? a)N 2 b) NH 3 b) HNO 3 d) NH 4 C1 18. Qaysi molekula eng kam barqaror? a)H 2 O 6)H 2 S B)H 2 Se d) H 2 Te 19. Qaysi kimyoviy bog'lanish eng kam kuchli? a) metall b) vodorod b) ionli d) kovalent 20. Qaysi elementning atomi ion bog'lanishga eng ko'p moyillik ko'rsatadi? a) C b) Si c) F d) P 21. Bir qator molekulalarda qutblilik va bog‘lanish kuchi qanday o‘zgaradi HF → HC1 → HI? a) ham qutblilik, ham bog'lanish kuchi ortadi b) qutblanish kuchayadi, kuch kamayadi v) ham qutblilik, ham bog'lanish kuchi kamayadi d) qutblilik pasayadi, kuch kuchayadi 22. Vodorod xlorid molekulasini hosil qilganda vodorod va xlor atomlarining qaysi turdagi orbitallari mos ravishda ustma-ust tushadi? a) s Va s b) s Va R V) R Va R G) p Va s 23. Qaysi molekulada barcha bog‘lanishlar qutbli kovalent bo‘ladi? a) H 2 O 2 b) C 2 H 4 c) C 2 H 2 d) CO 2 24. Qaysi element eng yuqori oksidlanish darajasining eng yuqori algebraik qiymatiga ega? a) ftor b) xrom c) uglerod d) xlor 25. Qaysi element eng past oksidlanish darajasining eng kichik algebraik qiymatiga ega? a) azot b) oltingugurt c) vodorod d) brom 26. Vodorod qaysi birikmada manfiy oksidlanish darajasiga ega? a) NH 4 Cl b) CaH 2 c) H 2 O 2 d) HF 27. BC1 3, Be1 2 va SiBr 4 birikmalarida markaziy atomlarning valentlik orbitallari mos ravishda quyidagi gibrid holatda bo'ladi: a) sp, sp 2, sp 3 V) sp, sp 3, sp 2 b) sp 2, sp, sp 3 G) sp 3 , sp 2 , sp 28. Quyidagi birikmalardagi azotning valentligi: N 2, NH 3, NH 4 +, CH 3 NH 2, HNO 3 - mos ravishda teng: a) 0, III, IV, V, V c) III, III, IV, III, IV b) I, III, III, IV, IV r) III, III, III, IV, V 29.Ion bog'lanishning to'g'ri xarakteristikasi: b) yo'nalishli, to'yinmagan v) yo'naltirilgan, to'yingan d) yo'nalishsiz, to'yingan 30. Kovalent bog'lanishning to'g'ri xarakteristikasi: a) yo'nalishsiz, to'yinmagan b) yo'nalishli, to'yinmagan v) yo'naltirilgan, to'yingan d) yo'nalishsiz, to'yingan 31. Guruhga kiruvchi har bir birikmada atomlar orasidagi qo‘sh bog‘lanish mavjud: a) CO, CO 2 c) S 8, C 2 H 4 b) C 2 H 2, SO 2 d) CO 2, C 2 H 4 32. Guruhga kiruvchi har bir birikmada atomlar orasidagi uch bog`lanish mavjud: a) CO, N 2 b) N 2, SO 2 c) S 8, C 2 H 2 d) CO 2, C 2 H 4 33.Qaysi element uchun eng yuqori oksidlanish darajasi davriy sistemada joylashgan guruh sonidan katta? a) marganets b) oltin c) bor d) azot 34. Ushbu elementlarning atomlari orasidagi kimyoviy bog'lanish turini aniqlash imkonini beruvchi elementlarning miqdoriy xarakteristikasi: a) atom radiusi c) elektr manfiyligi b) yadro zaryadi d) atom massasi 35. Quyidagi moddalar molekulalarida mos ravishda bitta qutbli, ikki qutbsiz, bir qutbsiz, uch qutbli bog‘lanishlar mavjud: a) HF, C 2 H 4, Br 2, CO c) H 2, CO 2, HC1, N 2 b) HBr, SO 3, N 2, C 2 H 2 d) C1 2, O 2, C 2 H 6, CO 36. Ikkixrom kislota molekulasidagi umumiy s-son va p-bog'lar mos ravishda: a) 10 va 4 b) 4 va 10 c) 6 va 2 d) 2 va 6 37. Berilgan moddalar: seziy xlorid, mis, olmos, rombsimon oltingugurt, muz, natriy oksidi, yod, “quruq muz” (qattiq CO 2), grafit, platina, kaliy gidrid. Ular orasida atom kristalli panjarali moddalar soni quyidagilarga teng: a) 4 b)3 c) 2 d)1 38. Berilgan moddalar: seziy xlorid, mis, olmos, rombsimon oltingugurt, muz, natriy oksidi, yod, “quruq muz” (qattiq CO 2), grafit, platina, kaliy gidrid. Ular orasida molekulyar kristall panjarali moddalar soni quyidagilarga teng: a) 4 b) 3 c) 2 d) 1 39. Berilgan moddalar: seziy xlorid, mis, olmos, rombsimon oltingugurt, muz, natriy oksidi, yod, “quruq muz” (qattiq CO 2), grafit, platina, kaliy gidrid. Ular orasida ionli kristall panjarali moddalar soni quyidagilarga teng: a) 4 b) 3 c) 2 d) 1 40. Berilgan moddalar: seziy xlorid, mis, olmos, rombsimon oltingugurt, muz, natriy oksidi, yod, "quruq muz" (qattiq CO 2), grafit, platina, kaliy gidrid. Ular orasida metall kristall panjarali moddalar soni quyidagilarga teng: a) 4 b) 3 c) 2 d) 1
|

 Sanoatda ammoniy xlorid soda ishlab chiqarishda qo'shimcha mahsulot sifatida olinadi. Laboratoriyada aralashmani xlor va ammiakdan yoki ammiak va vodorod xloridni osh tuzi eritmasidan o'tkazish orqali sintez qilish mumkin.
Sanoatda ammoniy xlorid soda ishlab chiqarishda qo'shimcha mahsulot sifatida olinadi. Laboratoriyada aralashmani xlor va ammiakdan yoki ammiak va vodorod xloridni osh tuzi eritmasidan o'tkazish orqali sintez qilish mumkin.