Glavne klase anorganskih spojeva. Podjela i svojstva složenih anorganskih tvari. Odnos Klasifikacija i nomenklatura složenih anorganskih spojeva
Trenutno je poznato više od 500 tisuća anorganskih spojeva, gotovo je nemoguće znati njihove formule, imena, a još više svojstva. Kako bi se lakše snalazili u ogromnoj raznolikosti kemijskih tvari, sve su tvari podijeljene u zasebne klase, uključujući spojeve slične strukture i svojstava.
U početku se sve kemijske tvari dijele na jednostavne i složene.
Jednostavne tvari dijelimo na metale i nemetale.
Osim tipičnih metala i nemetala, postoji velika skupina tvari s srednjim svojstvima, nazivaju se metaloidi. .
Složene tvari dijele se u četiri klase kemijskih spojeva: oksidi, baze, kiseline i soli . Ovu klasifikaciju razvili su izvanredni kemičari 18.-19. stoljeća Antoine Laurent Lavoisier, Mikhail Vasilyevich Lomonosov, Jons Jacob Berzelius, John Dalton.
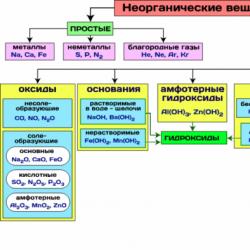
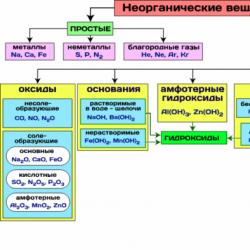
Na sl. Tablica 8 prikazuje najvažnije klase anorganskih spojeva.
Slika 8 - Najvažnije klase anorganskih spojeva
Hidroksidi su vrsta složenih tvari koje sadrže atome nekog elementa E (osim fluora i kisika) i hidroksilne skupine OH; opća formula hidroksida E(OH) n, Gdje n= 1÷6. Oblik hidroksida E(OH) n nazvao orto-oblik; na n> 2 hidroksid se također može naći u meta-oblik, koji uključuje, osim E atoma i OH skupina, atome kisika O, na primjer E(OH) 3 i EO(OH), E(OH) 4 i E(OH) 6 i EO 2 (OH) 2 .
Hidroksidi se dijele u dvije skupine suprotnih kemijskih svojstava: kiseli i bazični hidroksidi.
Kiseli hidroksidi sadrže atome vodika, koji se mogu zamijeniti atomima metala, prema stehiometrijskom pravilu valencije. Većina kiselih hidroksida nalazi se u meta-oblik, a atomi vodika u formulama kiselih hidroksida su na prvom mjestu, npr. H 2 SO 4, HNO 3 i H 2 CO 3, a ne SO 2 (OH) 2, NO 2 (OH) i CO ( OH) 2. Opća formula kiselinskih hidroksida je H x EO na, gdje je elektronegativna komponenta EO y x - naziva se kiselinski ostatak. Ako nisu svi atomi vodika zamijenjeni metalom, tada ostaju kao dio kiselinskog ostatka.
Imena uobičajenih kiselinskih hidroksida sastoje se od dvije riječi: vlastitog imena sa završetkom "aya" i skupne riječi "kiselina".
Nazivi kiselina i kiselinskih ostataka prikazani su u tablici. Dodatak A.
Imena kiselinskih ostataka koriste se za konstruiranje naziva soli.
Bazični hidroksidi sadrže hidroksidne ione, koji se mogu zamijeniti kiselim ostacima prema pravilu stehiometrijske valencije. Svi bazični hidroksidi nalaze se u orto-oblik; njihova opća formula je M(OH) n, Gdje n= 1,2 (rjeđe 3,4) i M n+ - metalni kation.
Primjeri formula i imena bazičnih hidroksida:
Najvažnije kemijsko svojstvo bazičnih i kiselih hidroksida je njihova međusobna interakcija pri čemu nastaju soli ( reakcija stvaranja soli), Na primjer:
Ca(OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O
Ca(OH) 2 + 2H 2 SO 4 = Ca(HSO 4) 2 + 2H 2 O
2Ca(OH)2 + H2SO4 = Ca2SO4(OH)2 + 2H2O
Soli- vrsta složenih tvari koje sadrže M katione n+ i kiseli ostaci.
Soli opće formule M x(EO na)n nazvao prosjek soli i soli s nesupstituiranim atomima vodika, - kiselo soli. Ponekad soli također sadrže hidroksidne i/ili oksidne ione; takve se soli nazivaju glavni soli.
Evo primjera i naziva soli:
Kisele i bazične soli mogu se pretvoriti u srednje soli reakcijom s odgovarajućim bazičnim i kiselim hidroksidom, na primjer:
Ca(HSO 4) 2 + Ca(OH) = CaSO 4 + 2H 2 O
Ca 2 SO 4 (OH) 2 + H 2 SO 4 = 2CaSO 4 + 2 H 2 O
Postoje i soli koje sadrže dva različita kationa: često se nazivaju dvostruke soli , Na primjer:
Kiseli i bazični oksidi
Oksidi E x OKO na- proizvodi potpune dehidracije hidroksida:
Kiselinski hidroksidi (H 2 SO 4, H 2 CO 3) odgovaraju kiseli oksidi (SO 3, CO 2) i bazični hidroksidi (NaOH, Ca(OH) 2) - bazični oksidi (Na 2 O, CaO), a oksidacijsko stanje elementa E se ne mijenja pri prelasku iz hidroksida u oksid.
Primjeri formula i imena oksida:
Kiseli i bazični oksidi zadržavaju svojstva tvorbe soli odgovarajućih hidroksida u interakciji s hidroksidima suprotnih svojstava ili međusobno:
N2O5 + 2NaOH = 2NaNO3 + H2O
3CaO + 2H 3 PO 4 = Ca 3 (PO 4) 2 + 3H 2 O
La 2 O 3 + 3SO 3 = La 2 (SO 4) 3
Amfoterni oksidi i hidroksidi
Amfoternost hidroksidi i oksidi - kemijsko svojstvo koje se sastoji u njihovom stvaranju dva reda soli, na primjer, za aluminijev hidroksid i aluminijev oksid:
(a) 2Al(OH) 3 + 3SO 3 = Al 2 (SO 4) 3 + 3H 2 O
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2 O
(b) 2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O
Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O
Dakle, aluminijev hidroksid i oksid u reakcijama (a) pokazuju svojstva glavni hidroksida i oksida, tj. reagiraju s kiselim hidroksidima i oksidima, tvoreći odgovarajuću sol - aluminijev sulfat Al 2 (SO 4) 3, dok u reakcijama (b) također pokazuju svojstva kiselo hidroksida i oksida, tj. reagiraju s bazičnim hidroksidom i oksidom, stvarajući sol - natrijev dioksoaluminat (III) NaAlO 2. U prvom slučaju, element aluminij pokazuje svojstvo metala i dio je elektropozitivne komponente (Al 3+), u drugom - svojstvo nemetala i dio je elektronegativne komponente formule soli ( AlO 2 -).
Ako se te reakcije dogode u vodenoj otopini, mijenja se sastav nastalih soli, ali ostaje prisutnost aluminija u kationu i anionu:
2Al(OH) 3 + 3H 2 SO 4 = 2 (SO 4) 3
Al(OH) 3 + NaOH = Na
Ovdje su kompleksni ioni 3+ - heksaakvaluminijev(III) kation, - - tetrahidroksoaluminatni(III) ion istaknuti u uglatim zagradama.
Elementi koji u spojevima pokazuju metalna i nemetalna svojstva nazivaju se amfoterni, a to uključuje elemente A-skupine periodnog sustava - Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po itd., kao kao i većina elemenata B- skupina - Cr, Mn, Fe, Zn, Cd, Au itd. Amfoterni oksidi nazivaju se isto kao i bazični, na primjer:
Amfoterni hidroksidi (ako oksidacijsko stanje elementa prelazi +II) mogu se naći u orto- ili (i) meta- obrazac.
Primjeri amfoternih hidroksida:
Amfoterni oksidi ne odgovaraju uvijek amfoternim hidroksidima, jer pri pokušaju dobivanja potonjih nastaju hidratizirani oksidi, na primjer:
Ako amfoterni element u spoju ima nekoliko oksidacijskih stanja, tada će amfoternost odgovarajućih oksida i hidroksida (a time i amfoternost samog elementa) biti različito izražena. Za niska oksidacijska stanja, hidroksidi i oksidi imaju prevlast bazičnih svojstava, a sam element ima metalna svojstva, pa je gotovo uvijek uključen u sastav kationa. Za visoka oksidacijska stanja, naprotiv, hidroksidi i oksidi imaju prevlast kiselih svojstava, a sam element ima nemetalna svojstva, pa je gotovo uvijek uključen u sastav aniona.
Oksidi koji stvaraju soli:
1). Bazični oksidi su oksidi kojima odgovaraju baze. Glavni oksidi uključuju okside metala skupine 1 i 2, kao i metale sekundarnih podskupina s valencijom I i II (osim ZnO - cinkov oksid i BeO - berilijev oksid): litijev oksid Li 2 O; natrijev oksid Na2O; kalijev oksid K2O; bakrov oksid CuO; srebrov oksid Ag2O; magnezijev oksid MgO; kalcijev oksid CaO; stroncijev oksid SrO; cezijev oksid Cs2O; živin oksid (2) HgO; rubidijev oksid Rb 2 O; željezov(2) oksid FeO; kromov oksid CrO; Nikalov oksid NiO.
2). Kiseli oksidi su oksidi koji odgovaraju kiselinama. Kiselinski oksidi uključuju okside nemetala (osim onih koji ne tvore sol - indiferentni), kao i okside metala sekundarnih podskupina s valencijom od V do VII:
ugljikov monoksid (IV) CO 2 ; sumporov(IV) oksid SO 2 ; sumpor(VI) oksid SO 3 ; silicij(IV) oksid SiO 2 ; fosfor(V) oksid P 2 O 5 ; krom(VI) dioksid CrO 3 ; mangan(VII) dioksid Mn 2 O 7 ; dušikov oksid NO 2; klorovi oksidi Cl 2 O 5 i Cl 2 O 3.
3). Amfoterni oksidi su oksidi, koji odgovaraju bazama i kiselinama. Tvore ga prijelazni metali. Metali u amfoternim oksidima obično pokazuju oksidacijsko stanje od +3 do +4, s izuzetkom ZnO, BeO, SnO, PbO: cinkov oksid ZnO; krom(III) oksid Cr 2 O 3 ; aluminijev oksid Al2O3; kositar(II) oksid SnO; kositar(IV) oksid SnO 2 ; olovo(II) oksid PbO; olovo(IV) oksid PbO 2 ; titan(IV) oksid TiO 2 ; manganov(IV) oksid MnO 2 ; željezov(III) oksid Fe 2 O 3 ; berilijev oksid BeO.
Oksidi koji ne stvaraju soli
1). Oksidi koji ne stvaraju soli– to su oksidi indiferentni prema kiselinama i bazama. To uključuje okside nemetala s valencijom I i II:
ugljikov monoksid CO; dušikov oksid (II) NO; dušikov oksid (I) N 2 O; silicij(II) oksid SiO, sumpor(I) oksid S 2 O; vodikov oksid H2O.
Temelji. Klasifikacija baza
Baze su hidroksidi koji disociraju (razbijaju se) na hidroksilnu skupinu i pozitivno nabijeni kation. Opća formula baza je E(OH)m, gdje je m oksidacijsko stanje metala.
Klasifikacija baza prema snazi:
1). Jaki razlozi.
Baze topive u vodi nazivaju se lužine:
NaOH - natrijev hidroksid (kaustična soda); KOH - kalijev hidroksid (kaustična potaša); LiOH - litijev hidroksid; Ba(OH) 2 - barijev hidroksid; Ca(OH) 2 - kalcijev hidroksid (gašeno vapno).
2). Slabi temelji:
Mg(OH) 2 - magnezijev hidroksid; Fe(OH) 2 - željezov (II) hidroksid; Zn(OH) 2 - cinkov hidroksid; NH 4 OH - amonijev hidroksid; A1 (OH) 3 - aluminijev hidroksid; Fe(OH) 3 - željezo (III) hidroksid itd. (većina metalnih hidroksida).
Podjela baza prema topljivosti
Prihvatljivija klasifikacija baza temelji se na njihovoj topljivosti u vodi.
1) Topljive baze. Alkalije- To su baze koje su topive u vodi. U alkalije spadaju hidroksidi alkalnih i zemnoalkalijskih metala: LiOH, NaOH, KOH, RbOH, CsOH, CaOH) 2, Sr(OH) 2, Ba(OH) 2.
2). Netopljive baze- to su takozvani amfoterni hidroksidi, koji u interakciji s kiselinama djeluju kao baze, a s alkalijama - kao kiseline.
Podjela baza prema broju hidroksilnih skupina (OH):
1). Pojedinačne kiselinske baze (n = 1)- ovo je baza koja sadrži jednu grupu - (OH): LiOH, KOH, NaOH, NH4OH.
2). Baze dvokiselina - (n = 2)- ovo je baza koja sadrži dvije skupine - (OH): Ba(OH) 2, Mg(OH) 2, Zn(OH) 2, Fe(OH) 2.
3). Trikiselinske baze - (n = 3)- ovo je baza koja uključuje tri skupine - (OH): Fe(OH) 3, A1(OH) 3 itd.
kiseline. Klasifikacija kiselina
Kiselina je složena tvar čija molekula sadrži jedan ili više atoma vodika i kiselinski ostatak. Kiseline se klasificiraju prema sljedećim kriterijima: a) prema prisutnosti ili odsutnosti kisika u molekuli i b) prema broju atoma vodika.
a) Podjela kiselina prema prisutnosti ili odsutnosti kisika u molekuli:
1). Kiseline koje sadrže kisik: H 2 SO 4 - sumporna kiselina; H 2 SO 3 - sumporna kiselina; HNO 3 - dušična kiselina; H3PO4 - fosforna kiselina; H2CO3 - ugljična kiselina; H 2 SiO 3 - silicijeva kiselina; HClO 4 - perklorna kiselina; HClO 3 - vodikov trioksoklorat (V) (klorna kiselina); HClO 2 - vodikov dioksoklorat(III) (kloričasta kiselina); HClO - hidrogen oksoklorat(I) (hipoklorna kiselina); H2Cr2O7 - heptaoksodikromat(VI) dihidrogen (dikromna kiselina); H 2 S 4 O 6 - dihidrogen heksaoksotetrasulfat (tetrationska kiselina); H2B4O6 - dihidrogen heksaoksotetraborat (tetrametaborna kiselina); H - vodikov heksahidroksostibat(V); H3PO3S - tiofosforna kiselina; HbSO 3 S - tiosumporna kiselina; H 3 PO 3 - fosforna (fosfonska) kiselina.
2). Anoksične kiseline: HF - fluorovodična kiselina; HCl - klorovodična kiselina (solna kiselina); HBr - bromovodična kiselina; HI - jodovodična kiselina; H2S - hidrosulfidna kiselina; HAuCl4 - vodikov tetrakloroaurat(III) (kloraurinska kiselina); HSCN - hidrotiocijanatna kiselina; HN3 - hidroazidna kiselina.
b) Podjela kiselina prema broju vodikovih atoma:
1). Jednobazične kiseline- to su kiseline koje sadrže jedan ion (H +): HNO 3 - dušična kiselina; HF - fluorovodična kiselina; HCl - klorovodična kiselina; HBr - bromovodična kiselina; HI - jodovodična kiselina; HClO 4 - perklorna kiselina; HClO 3 - vodikov trioksoklorat (V) (klorna kiselina); HClO 2 - vodikov dioksoklorat(III) (kloričasta kiselina); HClO - hidrogen oksoklorat(I) (hipoklorna kiselina); HAuCl 4 - vodikov tetrakloroaurat(III) (kloraurinska kiselina); H - vodikov heksahidroksostibat(V); HSCN - hidrotiocijanatna kiselina.
2). Dvobazične kiseline- to su kiseline koje sadrže dva iona (H+): H 2 SO 4 - sumporna kiselina; H 2 SO 3 - sumporna kiselina; H2S - hidrosulfidna kiselina; H2CO3 - ugljična kiselina; H 2 SiO 3 - silicijeva kiselina; H2Cr2O7 - heptaoksodikromat(VI) dihidrogen (dikromna kiselina); H 2 S 4 O 6 - dihidrogen heksaoksotetrasulfat (tetrationska kiselina); H2B4O6 - dihidrogen heksaoksotetraborat (tetrametaborna kiselina); H 2 SO 3 S - tiosumporna kiselina.
3). Trobazične kiseline- to su kiseline koje sadrže tri iona (H +): H 3 PO 4 - fosforna kiselina; H3BO3 - borna kiselina; H3AsO4 - arsenska kiselina; H3PO3S - tiofosforna kiselina; H3AlO3 - ortoaluminijeva kiselina; H 3 PO 3 - fosforna (fosfonska) kiselina.
4). Polibazične (višebazične) kiseline- to su kiseline koje sadrže četiri ili više iona (H+): H 4 SiO 4 - ortosilicijska kiselina; H4CO4 - ortokarbonska kiselina; H 4 P 2 O 7 - difosforna (pirofosforna) kiselina; H6P6O18 - heksafosforna kiselina; H 6 TeO 6 - telurska kiselina.
Ostale klasifikacije kiselina:
Prema jačini kiseline:
Jake kiseline - gotovo potpuno disociraju, konstante disocijacije su veće od 1 .
10-3 (HNO3); HCl; H2SO4);
Slabe kiseline - konstanta disocijacije manja od 1 .
10 -3 (octena kiselina Kd = 1,7 .
10 -5).
Što se tiče stabilnosti:
Stabilne kiseline (H 2 SO 4);
Nestabilne kiseline (H 2 CO 3).
Po pripadnosti klasama kemijskih spojeva:
Anorganske kiseline: (HBr); (H2SO4);
Organske kiseline: (HCOOH,CH3COOH).
Po volatilnosti:
Hlapljive kiseline: (HNO 3,H 2 S);
Nehlapljive kiseline: (H 2 SO 4).
Prema topljivosti u vodi:
Topljive kiseline (H 2 SO 4);
Netopljive kiseline (H 2 SiO 3).
Sol.
Soli su tvari u kojima su atomi metala vezani na kisele ostatke. Iznimka su amonijeve soli, u kojima nisu atomi metala, već čestice NH4+ povezane s kiselim ostacima, na primjer, (NH4) 2SO4 - amonijev sulfat.
Klasifikacija soli:
1). Srednje soli.
Srednje soli- to su složene tvari koje u vodenim otopinama disociraju na metalne katione i anione kiselinskih ostataka, tj. produkti su zamjene svih vodikovih kationa u molekulama kiselina metalnim kationima (Na 2 CO 3, K 3 PO 4).
2). Kisele soli.
Kisele soli- to su proizvodi djelomične zamjene vodikovih kationa u kiselinama metalnim kationima (NaHCO 3, KH 2 PO 4, K 2 HPO 4). Nastaju kada se baza neutralizira viškom kiseline (odnosno u uvjetima nedostatka baze ili suviška kiseline).
3). Bazične soli.
Bazične soli- to su proizvodi nepotpune supstitucije hidroksilnih skupina baze (OH -) s kiselim ostacima (CuOH) 2 CO 3, CoNO 3 (OH). Nastaju u uvjetima viška baze ili nedostatka kiseline.
4). Složene soli.
Složene soli- soli koje imaju složene katione ili anione u kojima je veza nastala donor-akceptorskim mehanizmom. Kompleksni ioni, kombinirajući se s drugim ionima, tvore kompleksne soli, na primjer, K 4, Cl, K 2, (Na 2) itd.
Podjela soli prema broju kationa i aniona prisutnih u strukturi
Razlikuju se sljedeće vrste soli:
1). Jednostavne soli.
Jednostavne soli- to su soli koje se sastoje od jedne vrste kationa i jedne vrste aniona (NaCl).
2). Dvostruke soli.
Dvostruke soli su soli koje sadrže dvije različite vrste kationa. primjeri dvostrukih soli su (KAl(SO 4) 2 .
12H 2 O) (kalijeva stipsa), KAl(SO4) 2 (aluminij-kalijev sulfat), MgK 2 (SO4) 2, AgK(CN) 2. Dvostruke soli postoje samo u čvrstom obliku.
3). Miješane soli.
Miješane soli- to su soli koje sadrže dva različita aniona (Ca(OCl)Cl), Fe(NH 4) 2 (SO 4) 2 [diamonijev željezo(II) sulfat], LiAl(SiO 3) 2 (aluminijev metasilikat-litij), Ca(ClO)Cl (kalcijev klorid-hipoklorit), Na 3 CO 3 (HCO 3) (natrijev bikarbonat-karbonat), Na 2 IO 3 (NO 3) (natrijev nitrat-jodat)
4). Hidratne soli (kristalni hidrati).
Hidratne soli ili kristalni hidrati- to su soli koje sadrže molekule kristalizacijske vode, na primjer, Na 2 SO 4 10 H 2 O, CaSO 4 ·
2H2O (gipps), MgCl2 ·
KCl ·
6H2O (karnalit), CuSO4 ·
5H2O (bakreni sulfat), FeSO4 ·
7H2O (željezni sulfat), Na2CO3 ·
10H20 (kristalna soda).
5). Unutarnje soli.
Unutarnje soli- to su soli koje tvore bipolarni ioni, odnosno molekule koje sadrže i pozitivno i negativno nabijen atom (+) NH 3 -CH 2 -COO (-) (bipolarni ion aminokiseline glicin), (+ ) NH3-C6H4-SO3 (-) (sulfanilna kiselina ili taurin). taurin- sulfonska kiselina koja nastaje u tijelu iz aminokiseline cisteina.
Klasifikacija anorganskih tvari temelji se na njihovoj sposobnosti razgradnje. Jednostavne tvari, koje se sastoje od atoma samo jednog kemijskog elementa (O 2, H 2, Mg), ne raspadaju se. Složene tvari koje se sastoje od atoma dvaju ili više elemenata (CO 2, H 2 SO 4, NaOH, KCl) lako se razlažu.
Jednostavan
Klasifikacija klasa anorganskih tvari uključuje:
- metali - elementi toplinske i električne vodljivosti, visoke duktilnosti, savitljivosti i metalnog sjaja;
- nemetali - elementi koji su lomljiviji od metala, nemaju električnu vodljivost i pokazuju oksidacijska svojstva.

Riža. 1. Shema klasifikacije anorganskih tvari.
Metali se nalaze u donjem lijevom kutu periodnog sustava, nemetali se nalaze u gornjem desnom kutu i uključuju plemenite plinove.

Riža. 2. Položaj metala i nemetala u periodnom sustavu.
Mnogi jednostavni kemijski elementi imaju alotropiju - svojstvo stvaranja nekoliko jednostavnih tvari. Na primjer, kada se kisiku doda još jedan atom, nastaje jednostavna tvar ozon (O 3), a ugljik, ovisno o broju atoma, tvori grafit, ugljen ili dijamant.
Kompleks
Složene tvari se razvrstavaju u sljedeće klase:
- oksidi - sastoje se od dva elementa od kojih je jedan kisik;
- kiseline - sastoje se od atoma vodika i kiselinskog ostatka;
- osnove - sastoji se od metala i jedne ili više hidroksilnih skupina;
- sol - sastoje se od metala i kiselinskog ostatka.
Zasebno su izolirani amfoterni hidroksidi koji pokazuju svojstva kiselina i baza. To su krutine koje su slabi elektroliti. Tu spadaju metalni hidroksidi s oksidacijskim stupnjem +3 i +4. Iznimke su Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2.
Detaljnija klasifikacija složenih tvari prikazana je u tablici s primjerima.
|
Pogled |
Nomenklatura |
Kemijska svojstva |
Primjer |
|
Oksidi - E x O y |
Element oksid (oksidacijsko stanje) |
Postoje bazični oksidi, koji u interakciji s kiselinama tvore soli, i kiseli oksidi, koji u interakciji s bazama tvore kiseline. Zasebno se izoliraju amfoterni oksidi koji stupaju u interakciju s kiselinama i bazama (nastaje sol) |
Na 2 O - natrijev oksid, Fe 2 O 3 - željezov (III) oksid, N 2 O 5 - dušikov oksid (V) |
|
Baze - Me(OH) x |
Metalni hidroksid (oksidacijsko stanje) |
Prema topljivosti razlikuju se lužine i baze netopljive u vodi. Lužine reagiraju s nemetalima i kiselim oksidima. Netopljive baze reagiraju s kiselinama i mogu se razgraditi na visokim temperaturama |
Fe(OH) 2 - željezo (II) hidroksid, Cu(OH) 2 - bakar (II) hidroksid, NaOH - natrijev hidroksid |
|
Kiseline - H n Ac |
Čitati ovisno o kiselinskom ostatku |
Oni stupaju u interakciju s metalima lijevo od vodika u seriji aktivnosti, s oksidima i solima. Sposoban raspadanja na visokim temperaturama |
H 2 SO 4 - sumporna kiselina, HCl - klorovodična kiselina, HNO 3 - dušična kiselina |
|
Soli - krzno x (Ac) y |
Kiselinski ostatak metala (oksidacijsko stanje) |
Reagira s kiselinama, alkalijama, metalima i solima |
Na 2 SO 4 - natrijev sulfat, CaCO 3 - kalcijev karbonat, KCl - kalijev klorid |

Riža. 3. Popis naziva kiselina.
Genetske veze među klasama temelje se na međusobnoj transformaciji tvari. Tijekom kemijskih reakcija atomi prelaze iz jedne tvari u drugu, tvoreći genetske nizove (nizove transformacija). Kada se metal doda kisiku, on tvori oksid, koji se u reakciji s vodom pretvara u bazu. Kiselinski oksid nastaje iz nemetala, koji reagira s vodom i stvara kiselinu. Svaki genetski niz završava sa soli.
Što smo naučili?
Anorganske tvari uključuju jednostavne i složene spojeve. Jednostavne tvari sastoje se od atoma istog elementa. Tu spadaju metali i nemetali. Složeni spojevi uključuju tvari koje se sastoje od nekoliko elemenata. To uključuje okside, kiseline, baze, soli i amfoterne hidrokside. Sve su tvari genetski povezane jedna s drugom. Od jednostavne tvari možete dobiti složeniju tvar. Soli se smatraju najsloženijim tvarima.
Test na temu
Ocjena izvješća
Prosječna ocjena: 4.6. Ukupno primljenih ocjena: 102.
Kemijske tvari možemo podijeliti u dvije nejednake skupine: jednostavne i složene.
Jednostavne tvari sastoje se od atoma jednog elementa (O 2, P 4).
Složene tvari sastoje se od atoma dva ili više elemenata (CaO, H 3 PO 4).
Jednostavne tvari možemo podijeliti na metali I nemetali.
Metali- to su jednostavne tvari u kojima su atomi međusobno povezani metalnom kemijskom vezom. Metali imaju tendenciju otpuštanja elektrona i karakteriziraju ih metalna svojstva (metalni sjaj, visoka električna i toplinska vodljivost, duktilnost itd.).
Nemetali – To su jednostavne tvari u kojima su atomi povezani kovalentnim (ili međumolekularnim) vezama. Nemetali imaju tendenciju prihvaćanja ili privlačenja elektrona. Nemetalna svojstva su sposobnost prihvaćanja ili privlačenja elektrona.
Svi elementi u periodnom sustavu kemijskih elemenata (PSCE) nalaze se ili u glavna podskupina, ili V strana. U različitim oblicima kratkotrajnog PSCE-a, glavna i sekundarna podskupina različito su locirane. Postoji jednostavan način koji će vam omogućiti da brzo i pouzdano odredite kojoj podskupini element pripada. Činjenica je da se svi elementi drugog razdoblja nalaze u glavnoj podskupini. Oni elementi koji se nalaze u ćeliji točno ispod elemenata druge periode (desno ili lijevo) pripadaju glavnoj podskupini. Ostatak ide na stranu.
Na primjer , u periodnom sustavu, koji se koristi na Jedinstvenom državnom ispitu iz kemije, element broj 32, galij, nalazi se u ćeliji s desne strane, točno ispod odgovarajućeg elementa druge periode, bora. Prema tome, galij pripada glavnoj podskupini. Ali skandij, element broj 21, nalazi se u ćeliji s lijeve strane. Prema tome, skandij pripada sekundarnoj podskupini.
Nemetali se nalaze u glavne podskupine, u gornjem desnom kutu PSHE. Svi metali uključuju elementi bočnih podskupina I elementi glavnih podskupina smješteni u donjem lijevom dijelu PSHE. Metali i nemetali obično se odvajaju povlačenjem konvencionalne linije od berilija do astatina. Na slici je prikazana precizna podjela na metale i nemetale. Nemetali su obojeni.
Glavne klase složenih tvari su oksidi, hidroksidi, sol.
Oksidi- to su složene tvari koje se sastoje od atoma dva elementa, od kojih je jedan kisik, koji ima oksidacijsko stanje -2.
Ovisno o drugom elementu, oksidi pokazuju različita kemijska svojstva. Neki oksidi odgovaraju hidroksidima (oksidi koji tvore soli), a neki ne (oksidi koji ne tvore soli).
Oksidi koji stvaraju soli dijele se na bazične, amfoterne i kisele.
Bazični oksidi su oksidi koji pokazuju karakteristična osnovna svojstva. To uključuje okside formirane od atoma metali s oksidacijsko stanje +1 i +2 . Na primjer, litijev oksid Li 2 O, željezni oksid (II) FeO.
Kiseli oksidi su oksidi koji pokazuju kisela svojstva. To uključuje okside formirane od atoma metali s oksidacijskim stupnjem +5, +6 i +7 , kao i atomi nemetala sa bilo koji stupanj oksidacije . Na primjer, klor oksid (I) Cl 2 O, kromov oksid (VI) CrO 3.
Amfoterni oksidi su oksidi koji pokazuju i bazična i kisela svojstva. To su oksidi metali sa stupnjem oksidacije +3 i +4 , kao i četiri oksida s oksidacijskim stupnjem +2: ZnO, PbO, SnO i BeO .
Oksidi koji ne stvaraju soli ne pokazuju karakteristična bazična ili kisela svojstva; hidroksidi im ne odgovaraju. Četiri oksida su klasificirana kao ne-tvoreća soli: CO, NO, N2O i SiO .
Postoje i oksidi slični solima, t.j. slani (dvostruki).
Dvostruko oksidi - To su neki oksidi koje stvara element s različitim oksidacijskim stanjima. Na primjer, magnetit (magnetska željezna ruda) FeO·Fe 2 O 3.

Algoritam za određivanje vrste oksida: isprva odrediti koji element tvori oksid – metal ili nemetalni. Ako se radi o metalu, tada određujemo oksidacijsko stanje, zatim određujemo vrstu oksida. Ako se radi o nemetalu, onda je oksid kiseo (osim ako je to iznimka).
Hidroksidi- to su složene tvari koje sadrže E-O-H skupinu. Hidroksidi uključuju baze, amfoterne hidrokside i kiseline koje sadrže kisik.
Svaki oksid koji stvara sol odgovara hidroksidu:
bazični oksid odgovara hidroksidu baza ,
kiseli oksid odgovara hidroksidu kiselina ,
amfoterni oksid odgovara amfoterni hidroksid .
Na primjer, krom (II) oksid CrO je bazičan; odgovara hidroksidnoj bazi. Hidroksidnu formulu lako je dobiti jednostavnim dodavanjem hidroksidne skupine OH metalu: Cr(OH) 2 .
Kromov (VI) oksid je kiseo, odgovara hidroksidnoj kiselini H 2 CrO 4, a kiseli ostatak je kromatni ion CrO 4 2-.
Ako su svi indeksi višekratnici broja 2, tada sve indekse dijelimo s 2.
Na primjer: N 2 O 5 + H 2 O → H 2 N 2 O 6, podijelimo s 2, dobivamo HNO 3. Tako dobivamo meta-formula kiseline. Ako dodamo još jednu molekulu vode, dobit ćemo orto formula kiseline.
Na primjer: oksid P 2 O 5 , meta-oblik: HPO 3 . Dodajte vodu, orto oblik: H 3 PO 4. Orto oblik je stabilan na fosfor i arsen.
Kromov (III) oksid - Cr 2 O 3 - je amfoteran, odgovara amfoternom hidroksidu, koji može djelovati i kao baza i kao kiselina: Cr(OH) 3 = HCrO 2, kiselinski ostatak kromit: CrO 2 -.
Odnos između oksida i hidroksida:
Razlozi(bazični hidroksidi) su složene tvari koje disocirajući u vodenim otopinama kao anioni (negativni ioni) tvore samo hidroksidne ione OH - .
Baze se mogu podijeliti na one koje su topive u vodi ( lužine ), netopljivu vodi i spontanorazlažući se .
DO raspada se u vodi (nestabilan) baze uključuju amonijev hidroksid, srebrov (I) hidroksid, bakar (I) hidroksid. U vodenoj otopini takvi se spojevi gotovo nepovratno razgrađuju:
NH 4 OH → NH 3 + H 2 O
2AgOH → Ag 2 O + H 2 O
2CuOH → Cu 2 O + H 2 O
Baze s jednom OH grupom – monokiselina(Na primjer, NaOH), sa dva - dvokiselina(Ca(OH)2) i sa tri - trikiselina(Fe(OH) 3).
kiseline- to su složene tvari koje, kada se disociraju u vodenim otopinama, tvore samo hidronijeve ione H 3 O + (H +) kao katione. Kiseline se sastoje od vodika H+ i kiselinskog ostatka.
Prema broju atoma vodika koji se mogu zamijeniti metalima, kiseline se dijele na jednobazni (HNO3), dvobazični(H2SO4), troosnovni (H 3 PO 4), itd.
Kiseline se također mogu podijeliti na jake i slabe.
Jake kiseline. To uključuje:
- Anoksične kiseline: HCl, HBr, HI. Preostale kiseline bez kisika obično su slabe.
- Neke kiseline s višim sadržajem kisika: H2SO4, HNO3, HClO4 i tako dalje.
Slabe kiseline . To uključuje:
- Slabe i topive kiseline : Ovo H3PO4, CH3COOH, HF i tako dalje.
- Hlapljive ili nestabilne kiseline : H2S— plin; H2CO3 H 2 CO 3 → H 2 O + CO 2; H2SO3- razlaže se na vodu i oksid: H 2 SO 3 → H 2 O+ SO 2.
- Kiseline netopljive u vodi : H2SiO3, H3BO3 i drugi.
Jednostavna tehnika omogućuje vam da odredite je li kiselina ispred vas jaka ili slaba. Od broja atoma O u kiselini oduzimamo broj atoma H. Ako dobijemo broj 2 ili 3, tada kiselina snažna. Ako je 1 ili 0 - onda kiselina slab.
Soli– složene tvari koje se sastoje od metalnog kationa (ili kationa sličnih metalu, na primjer, amonijevog iona NH 4 +) i aniona kiselinskog ostatka. Solima se nazivaju i tvari koje se mogu dobiti interakcijom kiselina i baza uz oslobađanje vode.
Ako smatramo soli kao produkti kiselinsko-bazne reakcije, zatim se soli dijele na prosjek , kiselo I Osnovni, temeljni .
Prosjek sol – produkti potpune zamjene vodikovih kationa u kiselini metalnim kationima ( Na primjer , Na2CO3, K3PO4).
kiselo sol – produkti nepotpune zamjene vodikovih kationa u kiselini s metalnim kationima ( Na primjer , NaHCO3, K2HPO4).
Osnovni, temeljni sol – produkti nepotpune supstitucije hidroksilnih skupina baze anionima kiselinskih ostataka ( Na primjer, malahit (CuOH)2CO3).
Prema broju kationa i aniona soli se dijele na:
Jednostavne soli – koji se sastoji od kationa jedne vrste i aniona jedne vrste ( Na primjer, kalcijev klorid CaCl2).
Dvostruke soli su soli koje se sastoje od dva ili više različitih kationa i aniona iste vrste ( Na primjer, kalijeva stipsa – KAl(SO 4) 2).
Miješane soli su soli koje se sastoje od kationa jedne vrste i dva ili više aniona različitih vrsta ( Na primjer, kalcijev klorid-hipoklorit Ca(OCl)Cl).
Na temelju strukturnih značajki, oni također razlikuju hidrat sol i kompleks sol.
Hidratne soli (kristalni hidrati) - to su soli koje sadrže molekule kristalizacijske vode ( Na primjer, natrijev sulfat dekahidrat Na 2 SO 4 10 H 2 O).
Složene soli su soli koje sadrže kompleksni kation ili kompleksni anion ( K3, (OH)2).
Uz glavne klase anorganskih spojeva, postoji veliki broj drugih. Na primjer, binarni spojevi elemenata s vodikom.
Vodikovi spojevi su složene tvari koje se sastoje od dva elementa od kojih je jedan vodik. Vodik tvori hidride slične soli i hlapljive vodikove spojeve.
Hidridi slični soli EN x su spojevi metala IA, IIA skupine i aluminija s vodikom. Oksidacijsko stanje vodika je -1. Na primjer, natrijev hidrid NaH.
Hlapljivi vodikovi spojevi H x E su spojevi nemetala s vodikom u kojima je oksidacijsko stanje vodika +1. Na primjer, amonijak NH 3, fosfin PH 3.
Kemija proučava pretvorbe kemijskih tvari, kojih je danas poznato više od 20 milijuna. Stoga je važna klasifikacija kemijskih spojeva, odnosno njihovo spajanje u skupine ili razrede koji imaju slična svojstva. Ova lekcija pomoći će vam u proučavanju suvremene klasifikacije anorganskih tvari i upoznati vas s pravilima za sastavljanje njihovih naziva pomoću kemijskih formula.
Tema: Glavne klase spojeva, njihova svojstva i tipične reakcije
Lekcija: Klasifikacija i nomenklatura anorganskih tvari
Anorganske tvari se prema sastavu obično dijele u dvije skupine: mala skupina jednostavnih tvari (ima ih oko 400) i vrlo velika skupina složenih tvari. Jednostavne tvari sastoje se od jednog kemijskog elementa, dok se složene tvari sastoje od više njih.
Sve jednostavne tvari mogu se podijeliti na metale i nemetale, jer se njihova svojstva značajno razlikuju. Metali imaju metalni sjaj, visoku toplinsku i električnu vodljivost, duktilni su i pokazuju svojstva obnavljanja. Nemetali imaju vrlo različita fizikalna i kemijska svojstva, ali su u pravilu u čvrstom stanju krti i slabo provode struju i toplinu.
Granica između metala i nemetala je proizvoljna. Postoje tvari koje imaju svojstva i metala i nemetala. Na primjer, sivi arsen ima metalni sjaj i električnu vodljivost (slika 1), dok druga alotropska modifikacija - žuti arsen - ima čisto nemetalna svojstva.
Riža. 1. Sivi arsen
Složene tvari obično se dijele na klase: oksidi, kiseline, baze, amfoterni hidroksidi i soli (slika 2). Ova klasifikacija je nesavršena, jer u njoj nema mjesta za amonijak, spojeve metala s fosforom, dušikom, ugljikom itd.

Riža. 2. Klasifikacija anorganskih tvari
Oksidi može biti solotvorno ili nesolotvorno. Oksidi koji tvore soli odgovaraju hidroksidima i solima s elementom u istom oksidacijskom stanju kao u oksidu. Oksidi koji ne tvore soli nemaju odgovarajuće hidrokside i soli. Malo je takvih oksida: N2O, NO, SiO, CO.
Solotvorne okside, ovisno o kiselo-baznom karakteru, dijelimo na kisele, amfoterne i bazične.
Bazične okside tvore metali s malim oksidacijskim stupnjem +1, +2. Amfoterne okside tvore prijelazni metali s oksidacijskim stupnjem +3, +4, kao i Be, Zn, Sn, Pb. Kisele okside tvore nemetali, kao i metali sa stupnjem oksidacije većim od +4. Riža. 3.

Riža. 3. Klasifikacija oksida
Kiseline su složene tvari koje se sastoje od atoma vodika koji se mogu zamijeniti metalima i kiselim ostacima. Kiseline se prema sadržaju kisika mogu podijeliti u skupine: one koje sadrže kisik (npr. HNO 3, H 2 SO 4, H 3 PO 4 ) i bez kisika (HI, H 2 S). Riža. 4.

Riža. 4. Podjela kiselina
Baze su složene tvari koje se sastoje od metalnih kationa i jednog ili više hidroksidnih aniona. Klasifikacija baza može se temeljiti na različitim karakteristikama. Na primjer, njihov odnos prema vodi. Na temelju ovog kriterija baze se dijele na topive u vodi (lužine) i netopljive u vodi. Riža. 5.

Riža. 5. Klasifikacija baza
Amfoterni hidroksidi su složene tvari koje imaju svojstva i kiselina i baza, pa se njihove formule mogu pisati u različitim oblicima:
Zn(OH) 2 = H 2 ZnO 2
baza oblik kiselina oblik
Postoji nekoliko vrsta soli (slika 6).

Riža. 6. Vrste soli
Srednje soli sastoje se od metalnih (ili amonijevih) kationa i aniona kiselinskih ostataka. Kisele soli, osim kationa metala, sadrže katione vodika i anion kiselinskog ostatka. Bazične soli sadrže hidroksidne anione.
Ako je sol sastavljena od dvije vrste metalnih kationa i jednog aniona, tada se naziva dvostrukom. Na primjer, aluminij-kalijev sulfat KAl(SO 4) 2.
Soli s dva različita aniona i jednim kationom nazivamo miješanim. Na primjer, Ca(OCl)Cl je kalcijev klorid-hipoklorit.
Kompleksne soli sadrže kompleksni ion, koji se obično nalazi u uglatim zagradama.
Bibliografija
- Kuznetsova N.E., Litvinova T.N., Levkin A.N. Kemija: 11. razred: udžbenik za učenike općeg. osnivanje (razina profila): u 2 dijela.2.dio. - M.: Ventana-Graf, 2008. (§55)
- Radetsky A.M. Kemija. Didaktički materijal. 10-11 razreda. - M.: Obrazovanje, 2011.
- Khomchenko I.D. Zbirka zadataka i vježbi iz kemije za srednju školu. - M.: RIA “Novi val”: Izdavač Umerenkov, 2008. (str. 27-30)
- Enciklopedija za djecu. Svezak 17. Kemija / Pogl. izd. V.A. Volodin, Ved. znanstveni izd. I. Leenson. - M.: Avanta+, 2003. (str. 156-159)